Verordening (EG) Nr. 726/2004 van het Europees Parlement en de Raad van 31 maart 2004 tot vaststelling van communautaire procedures voor het verlenen van vergunningen en het toezicht op geneesmiddelen voor menselijk en diergeneeskundig gebruik en tot oprichting van een Europees Geneesmiddelenbureau.
Rb. Den Haag, 19-06-2019, nr. C/09/541424 / HA ZA 17-1097
ECLI:NL:RBDHA:2019:6107, Hoger beroep: (Gedeeltelijke) vernietiging en zelf afgedaan
- Instantie
Rechtbank Den Haag
- Datum
19-06-2019
- Zaaknummer
C/09/541424 / HA ZA 17-1097
- Vakgebied(en)
Intellectuele-eigendomsrecht (V)
- Brondocumenten en formele relaties
ECLI:NL:RBDHA:2019:6107, Uitspraak, Rechtbank Den Haag, 19‑06‑2019; (Bodemzaak, Eerste aanleg - meervoudig)
Hoger beroep: ECLI:NL:GHDHA:2020:2052, (Gedeeltelijke) vernietiging en zelf afgedaan
- Vindplaatsen
BIE 2019/22 met annotatie van R.M. Kleemans en J.R. Drok
Uitspraak 19‑06‑2019
Inhoudsindicatie
Beschermingsomvang octrooi - artikelen 69 EOV en Protocol - de uitersten: letterlijke bewoordingen tegenover uitvindingsgedachte - vinden van het 'midden' - rol verleningsdossier - geen duidelijk onbedoelde beperking - redelijke mate van rechtszekerheid.
Partij(en)
vonnis
RECHTBANK DEN HAAG
Team handel
zaaknummer / rolnummer: C/09/541424 / HA ZA 17-1097
Vonnis van 19 juni 2019
in de zaak van
de rechtspersoon naar vreemd recht
ELI LILLY AND COMPANY,
te Indianapolis, Indiana, Verenigde Staten van Amerika,
eiseres,
advocaat: mr. J.A. Dullaart te Naaldwijk,
tegen
FRESENIUS KABI NEDERLAND B.V.,
te ‘s-Hertogenbosch,
gedaagde,
advocaat: mr. P.L. Reeskamp te Amsterdam.
Partijen zullen hierna Lilly en Fresenius worden genoemd. Voor Lilly is de zaak inhoudelijk behandeld door mrs. K.A.J. Bisschop en H.J. Ridderinkhof, advocaten te Amsterdam. Voor Fresenius zijn opgetreden de advocaat voornoemd en mr. A.M. van der Wal, advocaat te Amsterdam.
1. De procedure
1.1.
Het verloop van de procedure blijkt uit:
- -
de beschikking van de voorzieningenrechter van deze rechtbank van 9 mei 2017 waarbij aan Lilly verlof is verleend te procederen volgens het Versneld Regime in Octrooizaken;
- -
de dagvaarding van 23 mei 2017;
- -
de akte houdende overlegging (aanvullende) producties van 18 oktober 2017 met producties EP01 t/m EP35;
- -
de conclusie van antwoord van 27 december 2017 met producties GP01 t/m GP25;
- -
de akte houdende overlegging aanvullende producties van Lilly van 4 april 2018 met producties EP36 t/m EP40;
- -
de akte houdende nadere producties van Fresenius van 4 april 2018 met producties GP26 en GP27;
- -
de akte houdende overlegging reactieve producties van Lilly van 4 mei 2018 met productie EP41;
- -
de brief van mr. Ridderinkhof van 25 mei 2018 met daarbij gevoegd een akte houdende overlegging aanvullende productie, met productie EP42;
- -
de pleidooien van 1 juni 2018 en de ter gelegenheid daarvan overgelegde pleitnotities;
- -
de akte houdende uitlating Rosuvastatine-arrest van Lilly van 11 juli 2018;
- -
de akte houdende uitlating HR 8 juni 2018 ‘Rosuvastatine’ van Fresenius van 18 juli 2018.
1.2.
Vonnis is nader bepaald op heden.
2. De feiten
Pemetrexed, Lilly en Alimta®
2.1.
Pemetrexed is een antifolaat. Antifolaten zijn zogenoemde antineoplastische middelen. Dat wil zeggen dat zij de vorming van (kanker)gezwellen tegengaan. Antifolaten hebben niet alleen (een remmende) invloed op de groei van snel-groeiende kankercellen, maar ook op de groei van gezonde cellen. Hierdoor kan de behandeling met een antifolaat ernstige bijwerkingen (toxiciteit) meebrengen.
2.2.
De stof pemetrexed is (door de aanwezigheid van de twee -CO2H groepen) een vrij zuur (diacide of dizuur) (hierna: pemetrexed dizuur) dat de volgende moleculaire structuur heeft:
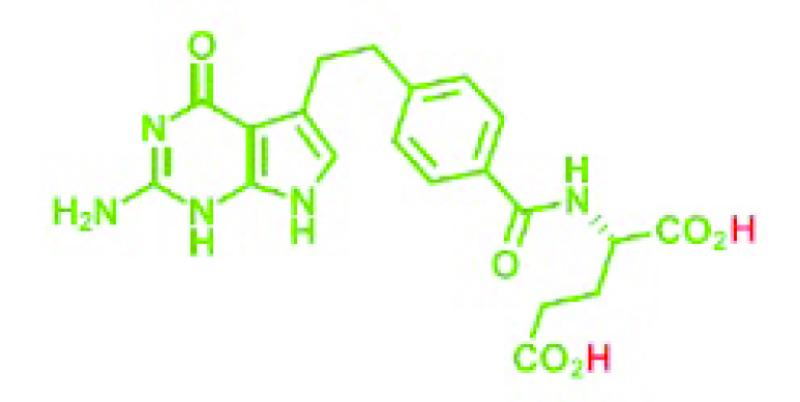
Het CAS (Chemical Abstract Service) nummer van pemetrexed dizuur is 137281-23-3.
2.3.
Wanneer pemetrexed dizuur in een waterige oplossing wordt gebracht, worden de met rood aangegeven waterstoffen als positief geladen ionen van de rest van het molecuul gescheiden, dat dan een negatief geladen ion is (ook wel: anion). Alleen het anion is verantwoordelijk voor de werkzaamheid (en toxiciteit) van het antifolaat.
2.4.
Lilly is onderdeel van het Eli Lilly concern dat actief is op het gebied van onderzoek, ontwikkeling en verhandeling van nieuwe geneesmiddelen.
2.5.
Lilly brengt het pemetrexed dinatrium (in het Engels: disodium; hierna worden beide termen gebruikt) bevattende geneesmiddel Alimta® op de markt, dat geïndiceerd is voor de behandeling van bepaalde longkankers (tumorgroei).
2.6.
Alimta® heeft de vorm van een gevriesdroogd poeder voor concentraat voor oplossing voor intraveneuze infusie. Voor de formulering zijn de hulpstoffen mannitol, zoutzuur en natriumhydroxide gebruikt. In de ‘Samenvatting van de Productkenmerken’ (hierna in de Engelse afkorting: SmPC) van Alimta® staat dat het middel verdund dient te worden in een fysiologische zoutoplossing ten behoeve van infusie. Alimta® dient te worden toegediend in combinatie met vitamine B12 en foliumzuur.
2.7.
De moleculaire structuur van Alimta® is gelijk aan die van pemetrexed dizuur, met dien verstande dat pemetrexed dinatrium in plaats van de twee -CO2H groepen (zie 2.2) twee -CO2Na groepen heeft. Door de natriumionen wordt een zoutvorm van pemetrexed gevormd. De structuur ziet er als volgt uit:
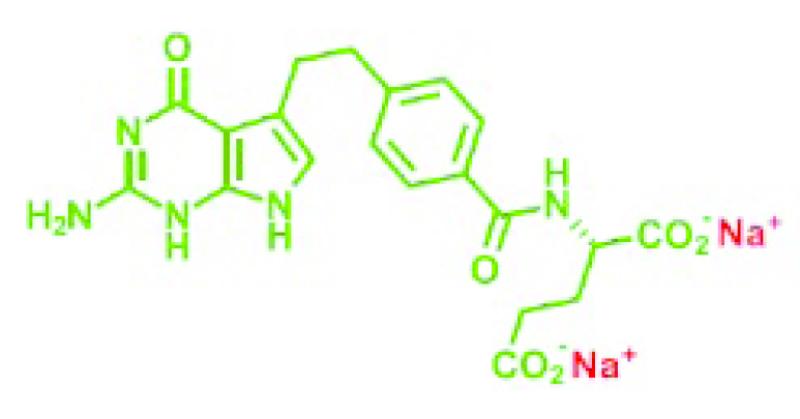
Het CAS nummer van pemetrexed dinatrium is 150399-23-8.
2.8.
Wanneer Alimta® ten behoeve van intraveneuze infusie in een waterige oplossing wordt gebracht, worden de met rood aangegeven natriumelementen als kationen van de rest van het molecuul gescheiden en resteert het (groen gekleurde) negatief geladen pemetrexed anion. Ook hier is alleen het anion verantwoordelijk voor de werkzaamheid (en toxiciteit) van het antifolaat.
2.9.
Het is niet mogelijk een toedieningsvorm van pemetrexed te vervaardigen die alleen bestaat uit het anion; er kan alleen een neutrale stof worden gehanteerd en dat impliceert de aanwezigheid van een kation (een positief geladen deeltje, waarmee een zout wordt gevormd) of waterstof (waarmee het dizuur wordt gevormd).
2.10.
Het antifolaat pemetrexed, dat wil zeggen zowel het dizuur als de farmaceutisch aanvaardbare zouten van pemetrexed zoals het dinatriumzout, werd aanvankelijk beschermd door EP 0 432 677 (hierna: EP 677) waarvan Lilly (mede)houdster was. EP 677 is het basisoctrooi voor Aanvullend Beschermingscertificaat 300181 voor ‘pemetrexed, desgewenst in de vorm van een farmaceutisch aanvaardbaar zout’. Het certificaat was van kracht tot en met 9 december 2015.
Het octrooi (EP 508)
2.11.
Lilly is houdster van Europees octrooi 1 313 508 B1 (hierna: EP 508), met de titel ‘Combination containing an antifolate and methylmalonic acid lowering agent’ (in de Nederlandse vertaling ‘Samenstelling welke een antifolaat en methylmallonzuur verlagend middel bevat’). EP 508 is verleend op 18 april 2007 op een internationale aanvrage van 15 juni 2001, met nummer PCT/US2001/014860 (hierna: de (oorspronkelijke) PCT-aanvrage) gepubliceerd als WO 02/02093 A2 (hierna: WO 093). Daarbij is een beroep op prioriteit gedaan van US 215310 P van 30 juni 2000, US 235859 P van 27 september 2000 en US 284448 P van 18 april 2001.
2.12.
EP 508 bevat twee onafhankelijke conclusies (1 en 12) en daarvan afhankelijke conclusies (2 t/m 11 en 13 t/m 14). In de oorspronkelijke Engelse taal luiden die als volgt:
1. Use of pemetrexed disodium in the manufacture of a medicament for use in combination therapy for inhibiting tumor growth in mammals wherein said medicament is to be administered in combination with vitamin B12 or a pharmaceutical derivative thereof, said pharmaceutical derivative of vitamin B12 being hydroxocobalamin, cyano-10-chlorocobalamin, aquocobalamin perchlorate, aquo-10-chlorocobalamin perchlorate, azidocobalamin, chlorocobalamin or cobalamin.
2. Use according to claim 1 wherein said medicament is to be administered in combination with vitamin B12 or a pharmaceutical derivative thereof, said pharmaceutical derivative of vitamin B12 being hydroxocobalamin, cyano-10-chlorocobalamin, aquocobalamin perchlorate, aquo-10-chlorocobalamin perchlorate, azidocobalamin, chlorocobalamin or cobalamin, and a folic binding protein binding agent selected from folic acid, (6R)-5-methyl-5,6,7,8-tetrahydrofolic acid and (6R)-5-forinyl-5,6,7,8-tetrahydrofohc acid or a physiologically available salt or ester thereof.
3. Use according to claim 2 wherein the folic binding protein binding agent is folic acid.
4. Use according to any one of claims 1 to 3 wherein the vitamin B12 or pharmaceutical derivative thereof is vitamin B12, cobalamin or chlorocobalamin.
5. Use according to any one of claims 1 to 3 wherein the vitamin B12 or pharmaceutical derivative thereof is selected from vitamin B12 or hydroxocobalamin.
6. Use according to any one of claims 1 to 5 wherein the medicament, the vitamin B12 or pharmaceutical derivative thereof and optionally the folic binding protein binding agent are to be administered simultaneously, separately or sequentially.
7. Use according to any one of claims 1 to 6 wherein the medicament is to be administered after administration of the vitamin B12 or pharmaceutical derivative thereof.
8. Use according to any one of claims 1 to 7 wherein the medicament is to be administered after the folic binding protein binding agent.
9. Use according to any one of claims 2 to 8 wherein the medicament is to be administered after pretreatment with the vitamin B12 or pharmaceutical derivative thereof followed by folic acid.
10. Use according to any one of claims 1 to 9 wherein vitamin B12 or pharmaceutical derivative thereof is to be administered as an intramuscular injection.
11. Use according to any one of claims 2 to 10 wherein the folic binding protein binding agent is to be administered orally as a tablet.
12. A product containing pemetrexed disodium, vitamin B12 or a pharmaceutical derivative thereof said pharmaceutical derivative of vitamin B12 being hydroxocobalamin, cyano-10-chlorocobalamin, aquocobalamin perchlorate, aquo-10-chlorocobalamin perchlorate, azidocobalamin, chlorocobalamin or cobalamin, and, optionally, a folic binding protein binding agent selected from the group consisting of folic acid, (6R)-5-methyl-5,6,7,8-tetrahydrofolic acid and (6R)-5-formyl-5,6,7,8-tetrahydrofolic acid, or a physiologically available salt or ester thereof, as a combined preparation for the simultaneous, separate or sequential use in inhibiting tumor growth.
13. A product according to claim 12 wherein the vitamin B12 or pharmaceutical derivative thereof is vitamin B12, co-balamin or chlorocobalamin and, if present, the folic binding protein binding agent is folic acid.
14. A product according to claim 12 wherein the vitamin B12 or pharmaceutical derivative thereof is vitamin B12 or hydroxocobalamin and, if present, the folic binding protein binding agent is folic acid.
2.13.
In de onbestreden Nederlandse vertaling luiden de conclusies van EP 508 als volgt:
1. Toepassing van pemetrexed dinatrium bij het bereiden van een geneesmiddel voor toepassing bij combinatietherapie voor het remmen van tumorgroei bij zoogdieren, waarbij het geneesmiddel dient te worden toegediend in combinatie met vitamine B12 of een farmaceutisch derivaat daarvan, waarbij het farmaceutisch derivaat van vitamine B12 hydroxocobalamine, cyaan-10-chloorcobalamine, aquocobalamine perchloraat, aquo-10-chloorcobalamine perchloraat, azidocobalamine, chloorcobalamine of cobalamine is.
2. Toepassing volgens conclusie 1, waarbij het geneesmiddel dient te worden toegediend in combinatie met vitamine B12 of een farmaceutisch derivaat daarvan, waarbij het farmaceutisch derivaat van vitamine B12 hydroxocobalamine, cyaan-10-chloorcobalamine, aquocobalamine perchloraat, aquo-10-chloorcobalamine perchloraat, azidocobalamine, chloorcobalamine of cobalamine is, en een foliumbindend eiwit bindend middel gekozen uit foliumzuur, (6R)-5-methyl-5,6,7,8-tetrahydrofoliumzuur en (6R)-5-formyl-5,6,7,8-tetrahydrofoliumzuur of een fysiologisch aanvaardbaar zout of ester daarvan.
3. Toepassing volgens conclusie 2, waarbij het foliumbindende eiwitbindende middel foliumzuur is.
4. Toepassing volgens een of meer van de conclusies 1-3, waarbij het vitamine B12 of het farmaceutische derivaat daarvan vitamine B12, cobalamine of chloorcobalamine is.
5. Toepassing volgens een of meer van de conclusies 1-3, waarbij het vitamine B12 of het farmaceutische derivaat daarvan is gekozen uit vitamine B12 of hydroxocobalamine.
6. Toepassing volgens een of meer van de conclusies 1-5, waarbij het geneesmiddel, het vitamine B12 of het farmaceutische derivaat daarvan en eventueel het foliumbindende eiwitbindende middel tegelijkertijd, afzonderlijk of achtereenvolgens dienen te worden toegediend.
7. Toepassing volgens een of meer van de conclusies 1-6, waarbij het geneesmiddel dient te worden toegediend na toediening van het vitamine B12 of het farmaceutische derivaat daarvan.
8. Toepassing volgens een of meer van de conclusies 1-7, waarbij het geneesmiddel na het foliumbindende eiwitbindende middel dient te worden toegediend.
9. Toepassing volgens een of meer van de conclusies 2-8, waarbij het geneesmiddel dient te worden toegediend na voorbehandeling met het vitamine B12 of het farmaceutische derivaat daarvan gevolgd door foliumzuur.
10. Toepassing volgens een of meer van de conclusies 1-9, waarbij het vitamine B12 of het farmaceutische derivaat daarvan als een intramusculaire inspuiting dient te worden toegediend.
11. Toepassing volgens een of meer van de conclusies 2-10, waarbij het foliumbindend eiwitbindend middel als een tablet oraal dient te worden toegediend.
12. Product dat pemetrexed dinatrium, vitamine B12 of een farmaceutisch derivaat daarvan, waarbij het farmaceutisch derivaat van vitamine B12 hydroxocobalamine, cyaan-10-chloorcobalamine, aquocobalamine perchloraat, aquo-10-chloorcobalamine perchloraat, azidocobalamine, chloorcobalamine of cobalamine is, en eventueel een foliumbindend eiwitbindend middel gekozen uit de groep bestaande uit foliumzuur, (6R)-5-methyl-5,6,7,8-tetrahydrofoliumzuur en (6R)-5-formyl-5,6,7,8-tetrahydrofoliumzuur, of een fysiologisch aanvaardbaar zout of ester daarvan, als een gecombineerd preparaat voor gelijktijdige, afzonderlijk of achtereenvolgend gebruik bij remmen van tumorgroei, bevat.
13. Product volgens conclusie 12, waarbij het vitamine B12 of het farmaceutische derivaat daarvan vitamine B12, cobalamine of chloorcobalamine is en, indien aanwezig, het foliumbindende eiwitbindende middel foliumzuur is.
14. Product volgens conclusie 12, waarbij het vitamine B12 of farmaceutisch derivaat daarvan vitamine B12 of hydroxocobalamine is en, indien aanwezig, het foliumbindend eiwitbindend middel foliumzuur is.
2.14.
In de beschrijving van het octrooi is - voor zover hier van belang - het volgende opgenomen:
[0001] Potentially, life-threatening toxicity remains a major limitation to the optimal administration of antifolates. (see, generally, Antifolate Drugs in Cancer Therapy, edited by Jackman, Ann L., Humana Press, Totowa, NJ, 1999.) In some cases, a supportive intervention is routinely used to permit safe, maximal dosing. For example, steroids, such as dexamethone, can be used to prevent the formation of skin rashes caused by the antifolate. (Antifolate, pg 197.)[0002] Antifolates represent one of the most thoroughly studied classes of antineoplastic agents, with aminopterin initially demonstrating clinical activity approximately 50 years ago. Methotrexate was developed shortly thereafter, and today is a standard component of effective chemotherapeutic regimens for malignancies such as lymphoma, breast cancer, and head and neck cancer. (…) Antifolates inhibit one or several key folate-requiring enzymes of the thymidine and purine biosynthetic pathways, in particular, thymidylate synthase (TS), dihydrofolate reductase (DHFR), and glycinamide ribonucleotide formyltransferase (GARFT), by competing with reduced folates for binding sites of these enzymes. (…) Several antifolate drugs are currently in development. Examples of antifolates that have thymidylate synthase inhibiting ("TSI") characteristics include 5-fluorouracil and Tomudex®. An example of an antifolate that has dihydrofolate reductase inhibiting ("DHFRI'') characteristic is Methotrexate®. An example of an antifolate that has glycinamide ribonucleotide formyltransferase inhibiting (''GARFTI") characteristics is Lometrexol. Many of these antifolate drugs inhibit more than one biosynthetic pathway. For example Lometrexol is also an inhibitor of dihydrofolate reductase and pemetrexed disodium (Alimta®, Eli Lilly and Company, Indianapolis, IN) has demonstrated thymidylate synthase, dihydrofolate reductase, and glycinamide ribonucleotide formyltransferase inhibition.[0003] A limitation to the development of these drugs is that the cytotoxic activity and subsequent effectiveness of antifolates may be associated with substantial toxicity for some patients. Additionally antifolates as a class are associated with sporadic severe mylosuppression with gastrointestinal toxicity which, though infrequent, carries a high risk of mortality. The inability to control these toxicities led to the abandonment of clinical development of some antifolates and has complicated the clinical development of others, such as Lometrexol and raltitrexed. (…)[0004] Initially, folic acid was used as a treatment for toxicities associated with GARFTI see, e.g. U.S. Pat. No. 5,217,974. Folic acid has been shown to lower homocysteine levels (…). The role of folic acid in modulating the toxicity and efficacy of the multitargeted antifolate LY 231514 (pemetrexed) was discussed in Worzalla et al. (Anticancer Research 18: 3235-3240 (1998) Worzalla JF, Chuan S and Schultz RM). EP-A-0546870 relates to nutrient compositions which are intended to prevent and cure infectious diseases and which are intended to be administered to patients being administered with anticancer drugs to prevent and treat infectious diseases due to immunosuppression induced by the anticancer drug therapy. The compositions of EP-A-0546870 are characterized in that they comprise a certain amount of retinoid compound(s) such as vitamin A which is indicated as being responsible for the immunoreactivity. Effects of vitamin B12, folate and vitamin B6 supplements in elderly people with normal serum vitamin concentrations (Lancet 1995; 346:85-89), and homocysteine levels have been shown to be a predictor of cytotoxic events related to the use of GARFT inhibitors, see e.g. U.S. Pat. No. 5,217,974. However, even with this treatment, cytotoxic activity of GARFT inhibitors and antifolates as a class remains a serious concern in the development of antifolates as pharmaceutical drugs. The ability to lower cytotoxic activity would represent an important advance in the use of these agents.[0005] Surprisingly and unexpectedly, we have now discovered that certain toxic effects such as mortality and nonhematologic events, such as skin rashes and fatigue, caused by antifolates, as a class, can be significantly reduced by the presence of a methylmalonic acid lowering agent as vitamin B12, without adverse [sic] adversely affecting therapeutic efficacy. The present invention thus generally relates to a use in the manufacture of a medicament for improving the therapeutic utility of antifolate drugs by administering to the host undergoing treatment with a methylmalonic acid lowering agent as vitamin B12. We have discovered that increased levels of methylmalonic acid is a predictor of toxic events in patients that receive an antifolate drug and that treatment for the increased methylmalonic acid, such as treatment with vitamin B12, reduces mortality and nonhematologic events, such as skin rashes and fatigue events previously associated with the antifolate drugs. Thus, the present invention generally relates to a use in the manufacture of a medicament for reducing the toxicity associated with the administration of an antifolate to a mammal by administering to said mammal an effective amount of said antifolate in combination with a methylmalonic acid lowering agent as vitamin B12.[0006] Additionally, we have discovered that the combination of a methylmalonic acid lowering agent as vitamin B12 and folic acid synergistically reduces the toxic events associated with the administration of antifolate drugs. Although, the treatment and prevention of cardiovascular disease with folic acid in combination with vitamin B12 is known, the use of the combination for the treatment of toxicity associated with the administration of antifolate drugs was unknown heretofore. (…)
[0010] The invention specifically provides the use of the antifolate pemetrexed disodium in the manufacture of a medicament for use in combination therapy for inhibiting tumor growth in mammals wherein said medicament is to be administered in combination with a methylmalonic acid lowering agent selected from vitamin B12 and pharmaceutical derivatives thereof.
[0011] The invention also specifically provides the use of the antifolate pemetrexed disodium in the manufacture of a medicament for use in combination therapy for inhibiting tumor growth in mammals wherein said medicament is to be administered in combination with a methylmalonic acid lowering agent selected from vitamin B12 and pharmaceutical derivatives thereof and a FBP binding agent selected from folic acid, (6R)-5-methyl-5,6,7,8-tetrahydrofolic acid and (6R)-
5-formyl-5,6,7,8-tetrahydrofolic acid or a physiologically available salt or ester thereof.
(…)
[0016] The current invention concerns the discovery that administration of a methylmalonic acid lowering agent such as vitamin B12 or a pharmaceutical derivative thereof, in combination with an antifolate drug such as pemetrexed disodium reduces the toxicity of the said antifolate drug.
(…)[0022] The terms "antifolate" and ''antifolate drug'' generally refer to a chemical compound which inhibits at least one key folate-requiring enzyme of the thymidine or purine biosynthetic pathways, preferably thymidylate synthase ("TS"), dihydrofolate reductase ("DHFR"), or glycinamide ribonucleotide formyltransferase ("GARFT"), by competing with reduced folates for binding sites of these enzymes. The "antifolate" or ''antifolate drug" for use in this invention is Pemetrexed Disodium (ALIMTA®), as manufactured by Eli Lilly & Co.
2.15.
Bij brief van 8 januari 2003 heeft de in-house octrooigemachtigde van Lilly, dr. [A] (hierna: [A] ) het Europees Octrooibureau (EOB) verzocht de PCT-aanvrage in behandeling te nemen op basis van de documentatie aan de hand waarvan de International Preliminary Examination is uitgevoerd. Daarbij heeft hij de oorspronkelijke conclusies uit de PCT-aanvrage vervangen door een nieuwe set conclusies (1 tot en met 17), waarvan nieuwe conclusie 1 luidde:
1. Use of a methylmalonic acid lowering agent in the preparation of a medicament useful in lowering the mammalian toxicity associated with an antifolate, and the medicament is administered in combination with an antifolate.
2.16.
Bij Communication van 9 maart 2004 heeft de examiner van het EOB onder meer aangegeven dat de materie van de nieuwe conclusies 1 t/m 9, 11 t/m 14 en 16 nieuwheid ontbeert in het licht van de documenten D1 (EP 0 546 870) en D2 (US 5 405 839) omdat - kort gezegd - het gebruik van een antifolaat, namelijk 5-fluorouracil en methotrexaat, in combinatie met vitamine B12 (een methylmalonic acid lowering agent) daarin al was geopenbaard.
2.17.
Bij fax van 23 december 2004 heeft [A] opnieuw een nieuwe set conclusies ingediend en daarbij het EOB als volgt bericht:
In reply to the Communication pursuant to Article 96(2) EPC dated 9 March 2004 I attach new claims 1-16 to replace claims 1-17 previously on file. I also attach amended description pages 2, 2a, 3, 4, 4a and 6 to replace description pages 2 to 4 and 6 presently on file.
Amendments
The Applicant, having reviewed the scope of the application and in order to expedite the application proceeding to grant, has elected to amend the claims so as to more closely reflect the specific examples provided. The present amendments are made without prejudice to the Applicant’s right to obtain protection for other patentable subject matter in one or more divisional applications.
Claims 1-12 have been refocused on the use of the antifolate compound pemetrexed. Basis can be found at page 2 line 6-7 and page 6 line 16 of the application as filed.
The term “methylmalonic acid lowering agent” has been replaced by “vitamin B12 or a pharmaceutical derivative thereof”. Basis for this can be found page 6 lines 19-21 and page 7 line 5 of the application as filed.
(…)
Novelty
There is no disclosure in any of documents D1-D3 of the invention as presently claimed. In particular D1 and D2 do not relate to pemetrexed. D3 does not disclose or relate in any way to the use of vitamin B12.
(…)
2.18.
Conclusies 1, 4, 13 en 16 van de door [A] ingediende gewijzigde conclusieset luidden voor zover hier van belang als volgt:
1. Use of pemetrexed in the manufacture of a medicament for use in combination therapy for inhibiting tumor growth in mammals wherein said medicament is to be administered in combination with vitamin B12 or a pharmaceutical derivative thereof.
4. Use according to any one of claims 1 to 3 wherein pemetrexed is pemetrexed disodium.
13. A product containing pemetrexed, vitamin B12 of a pharmaceutical derivative thereof and, optionally, a folic binding protein agent (…) as a combined preparation for the simultaneous, separate or sequential use in inhibiting tumor growth.
16. A product according to any one of claims 13 to 15 wherein pemetrexed is pemetrexed disodium.
2.19.
Bij Communication van 17 mei 2005 heeft het EOB hierop voor zover relevant als volgt gereageerd:
Amendments (Art. 123(2) EPC)
The amendments filed with letter 23.12.2004 do not comply with the requirements of Art. 123 (2) EPC in so far as they introduce subject matter beyond the content of the originally filed documents.
The amendments concerned are the following:
The subject matter of claims 1-16 and description pages 4, line 18- page 4a.
The subject matter of present claims 1 reading “use of pemetrexed…” and claim 13 “a product containing pemetrexed…” do not find base in the application documents as filed. The term “pemetrexed” in the wording of these claims and the corresponding passages on amended description is certainly a distinct compound (CAS Registry number 137281-23-3) of the “pemetrexed disodium” (CAS Registry number 150399-23-8) expressed on original document description page 2, line 6 and page 6, line 16. Said amendment beyond the content of the original document is therefore not allowable (Art. 123 (2) EPC).
Dependent claims 2-12, 14-16 in so far as related to “pemetrexed” are consequently not allowable according to Art. 123(2) EPC.
2.20.
Het door het EOB genoemde ‘original document’ is de oorspronkelijkePCT-aanvrage WO 093, waarvan regel 31 op pagina 1 en regels 1-9 op pagina 2 als volgt luiden:


Regels 6-16 op pagina 6 luiden als volgt:

2.21.
Bij brief van 8 maart 2006 heeft [A] de thans geldende conclusies ingediend en de examiner onder meer het volgende laten weten:
I refer to the Communication pursuant to Article 96(2) EPC dated 17 May 2005 and enclose new pages 3, 4, 4a, 5, 6, 7, 8, 10, 11, 11a, 13, 14, 15 and 16 and new Claims 1-14 to replace pages 3-8, 10, 11 and 13-16 and Claims 1-16 presently on file.
Amendments
The Claims have been amended to refer to the preferred embodiment, the use of pemetrexed disodium (ALIMTA®) as manufactured by Eli Lilly and Company, as the antifolate drug. The Claims have also been amended to incorporate the list of vitamin B12 derivatives set out on page 7 lines 6-7 of the application as filed.
(…)
The description has been amended in conformity with the new Claims. The passages on pages 3 and 4 have been edited. The Applicant seeks to draw a distinction between subject matter which is relevant to the invention which is indicated as being that to which “the present invention generally relates” and “the subject matter provided by the invention” which is the subject matter claimed. In particular it is highlighted that the reduction of toxicity of the anti-folate in the use of the combination therapy is relevant to the invention and should be retained.
(…)
For the Examiner’s ease of reference I enclose a copy of previous description pages 3-8, 10, 11 and 13-16 showing the changes in manuscript.
2.22.
De bijlage bij voornoemde brief bevat een kopie van de beschrijving uit de PCT-aanvrage met daarin door [A] handgeschreven onder meer de volgende wijzigingen doorgevoerd (nu: paragraaf [0022] van EP 508):

2.23.
De Communication van het EOB van 4 oktober 2006 luidt als volgt:
Communication under Rule 51(4) EPC
You are informed that the Examining Division intends to grant a European patent on the basis of the above application with the text and drawings as indicated below:
(…)
Comments
(…)
Page 5, lines 22, 28, 32; page 6, line 5; page 9, lines 4, 16, 30: introduction of “pemetrexed disodium” to adapt description to claims on file (Art. 84 EPC).
Page 4, lines 24 and 25, introduction of “disodium” after “pemetrexed” to adapt description to claims on file (Art. 84 EPC)
De examiner heeft de aanpassingen zelf handgeschreven in het zogenaamde ‘Druckexemplar’ aangebracht.
2.24.
Bij brief van 2 februari 2007 heeft [A] namens Lilly bericht deze aanpassingen in de beschrijving te accepteren:
I refer to the Communication under Rule 51(4) EPC dated 4 October 2006 and approve the text specified therein subject to a minor formal change to claim 11.
2.25.
Lilly is ook houdster van Europees octrooi EP 1 265 612 B1 (hierna: EP 612), dat op een aanvrage daartoe van 23 januari 2001 is verleend op 26 mei 2004 voor een ‘Pharmaceutical composition comprising pemetrexed together with monothioglycerol,
L-cystein or thioglycolic acid’. In paragraaf [0020] van de beschrijving van dit octrooi wordt vermeld:
As used herein, the term “pemetrexed” refers to the stable salts, acids and free base forms thereof. The term includes, for example, the free acid, the pharmaceutically acceptable alkali metal, alkaline earth metal, non-toxic metal, ammonium, and substituted ammonium salts, such as for example, the sodium, potassium, lithium, calcium, magnesium, aluminium, zinc, ammonium, trimethylammonium, triethylammonium, monoethanolammonium, triethanolammonium, pyridinium and substituted pyridinum salts. The substituted ammonium salts are one especially preferred group of salts.
[A] was ook bij de verlening van dit octrooi betrokken als de octrooigemachtigde van Lilly.
Fresenius en Pemetrexed Fresenius
2.26.
Fresenius maakt onderdeel uit van het Fresenius concern. Zij is actief op de geneesmiddelenmarkt en verhandelt wereldwijd diverse generieke geneesmiddelen voor intraveneuze toediening.
2.27.
Eén van de producten van het Fresenius concern is ‘Pemetrexed Fresenius Kabi’ (hierna: Pemetrexed Fresenius) dat geïndiceerd is voor maligne mesothelioom van de pleura en niet kleincellig longcarcinoom.
2.28.
De SmPC van dit generieke product vermeldt dat Fresenius de vertegenwoordiger van de marktvergunninghouder Fresenius Kabi Oncology Plc. in Nederland is. Deze laatste heeft de marktvergunning verkregen door toepassing van de gecentraliseerde procedure als bedoeld in artikel 3 lid 3 van Verordening EG 726/2004.1.Daarbij is als referentieproduct verwezen naar Lilly’s product Alimta®.
2.29.
Pemetrexed Fresenius heeft net als Alimta® de farmaceutische vorm van een (gevriesdroogd) poeder voor concentraat voor oplossing voor intraveneuze infusie. Voor de formulering zijn dezelfde hulpstoffen gebruikt als voor Alimta®, met dien verstande dat in plaats van natriumhydroxide de hulpstof tromethamine wordt gebruikt. In de SmPC van Pemetrexed Fresenius is onder rubriek 4.2 (dosering en wijze van toediening) het volgende opgenomen:
Om de toxiciteit te verminderen moeten patiënten die worden behandeld met pemetrexed tevens vitaminesupplementen krijgen (zie rubriek 4.4). Patiënten moeten dagelijks oraal foliumzuur of een multivitaminepreparaat met foliumzuur (350 tot 1000 microgram) innemen. Gedurende de zeven dagen voorafgaand aan de eerste dosis pemetrexed moeten ten minste vijf doses foliumzuur worden ingenomen en de inname ervan moet gedurende de gehele behandelingsperiode en gedurende 21 dagen na de laatste dosis pemetrexed worden voortgezet. Patiënten moeten tevens een intramusculaire injectie vitamine B12 (1000 microgram) krijgen toegediend in de week voorafgaand aan de eerste dosis pemetrexed en daarna eenmaal per drie cycli. Daaropvolgende vitamine-B12-injecties kunnen op dezelfde dag als pemetrexed worden toegediend.
In de SmPC is ook opgenomen dat het middel in poedervorm verdund dient te worden in een glucoseoplossing ten behoeve van infusie.
2.30.
In Pemetrexed Fresenius zijn de twee waterstofatomen zoals die voorkomen in pemetrexed dizuur (zie opnieuw 2.2) vervangen door tromethaminegroepen (hierna ook: het pemetrexed tromethamine). De moleculaire structuur van Pemetrexed Fresenius is onderstaand weergegeven, waarbij rood gemarkeerd zijn de tromethaminegroepen die als kationen van de rest van het molecuul worden gescheiden als dat ten behoeve van infusie in een waterige oplossing wordt gebracht, waarna het (groen gekleurde) pemetrexed anion resteert.
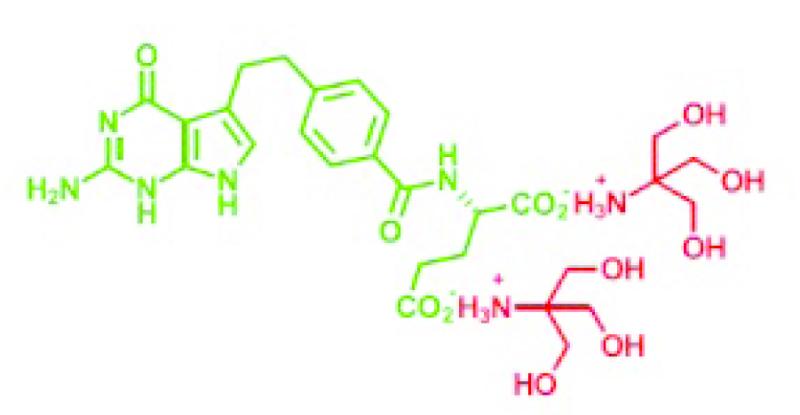
2.31.
In het European Public Assesment Report voor Pemetrexed Fresenius is onder meer het volgende opgenomen.
pagina 7:
The difference in active substance salt form between the applied product and the reference product is therefore not relevant for the clinical efficacy and safety of the ready to use infusion.
pagina 8:
The active substance in Fresenius Kabi’s Pemetrexed for Injection is pemetrexed diacid instead of pemetrexed disodium as in the originator product Alimta. Both products are intended for intravenous use and must be reconstituted and further diluted prior to use. When reconstituted and diluted for administration, the active moiety remains the same irrespective of the salt form.
pagina 11:
The excipients used in the formulation of Pemetrexed Fresenius Kabi are the same used in the reference product except sodium hydroxide, which is replaced by trometamol. Trometamol is a known buffering agent/pH adjuster and solubilizer.
pagina 12:
No bioequivalence study was deemed required as the finished product is to be administered as an aqueous solution containing the same active substance in the same concentration as the reference product.
pagina 16:
The active substance in Fresenius Kabi's Pemetrexed for Injection is Pemetrexed diacid instead of Pemetrexed disodium as in Alimta 100 mg/500 mg powder for concentrate for solution for infusion. When reconstituted and diluted for administration, the active moiety remains the same irrespective of the salt form. Accordingly, both medicinal products are considered to contain the same active substances.Trometamol is a known buffering agent/pH adjuster used in formulations available in Europe and US. It is agreed that the quantity used in Fresenius Kabi's formulation is less than the required quantity to produce pharmacological action and would not be expected to cause any adverse effects of its own. The other excipients are well known and commonly used in aqueous intravenous solution available on the European market. The existing differences in the excipients of the applied product as compared to the reference product are not expected to have any significant impact in properties with regards to bioavailability, pharmacokinetics, safety and efficacy between these products.
2.32.
Fresenius heeft haar generieke product in de doseringen 100mg en 500mg laten opnemen in de G-standaard van Z-index voor februari 2017, die op 17 januari 2017 is gepubliceerd.
Andere procedures
2.33.
Tussen Lilly enerzijds en Fresenius of andere aanbieders van generieke pemetrexed producten anderzijds zijn in Europa diverse procedures over (niet-)inbreuk op EP 508 gevoerd.
2.34.
In Nederland heeft de voorzieningenrechter van deze rechtbank bij vonnis van
1 maart 2017 aan Sandoz B.V. een verbod opgelegd om generiek pemetrexed dinatrium te verhandelen.2.Bij vonnis van 24 oktober 2017 heeft de voorzieningenrechter van deze rechtbank aan Teva Nederland B.V. en Fresenius een zelfde verbod opgelegd.3.Deze vonnissen in kort geding zijn bekrachtigd door het gerechtshof Den Haag (hierna: het hof) bij arresten van 8 mei 2018.4.
2.35.
Voor een overzicht van buitenlandse procedures waarin al over (niet-)inbreuk is beslist, wordt verwezen naar overweging 2.12 van genoemde arresten. In de in dat overzicht genoemde landen is uiteindelijk steeds geoordeeld dat de betreffende generieke producten inbreuk maken.5.Aan het overzicht kan worden toegevoegd de uitspraak van het Oberlandesgericht Wien, dat op 12 april 2018 het door het Handelsgericht Wien op 22 december 2017 aan Fresenius gegeven voorlopig inbreukverbod heeft bekrachtigd. Verder is inmiddels bekend dat het Tribunale di Milano bij uitspraak van 15 oktober 2018, anders dan het Tribunale Ordinario in eerste aanleg op 10 september 2017, heeft geoordeeld dat het generieke Pemetrexed Fresenius inbreuk maakt op het Italiaanse deel van EP 508.
3. Het geschil
3.1.
Lilly vordert samengevat - dat de rechtbank, voor zoveel mogelijk uitvoerbaar bij voorraad, zowel bij wijze van provisionele voorziening als bij wijze van maatregel in de hoofdzaak aan Fresenius een inbreukverbod voor Nederland oplegt en voor recht verklaart dat Fresenius inbreuk heeft gemaakt op EP 508 in Nederland, althans Fresenius beveelt iedere onrechtmatige handeling jegens Lilly te staken en gestaakt te houden, op straffe van een dwangsom, en met nevenvorderingen, waaronder het doen van opgave, het sturen van een rectificatiebrief naar haar afnemers en publicatie van een rectificatie op haar website, alsmede Fresenius veroordeelt tot vergoeding van de door Lilly geleden schade, met veroordeling van Fresenius in de volledige kosten van de procedure, te vermeerderen met wettelijke rente.
3.2.
Aan haar vorderingen legt Lilly primair ten grondslag dat Fresenius met het gebruiken en verhandelen van Pemetrexed Fresenius directe (letterlijke) inbreuk maakt op Swiss type conclusies 1 t/m 11 van EP 508 omdat zij weet, althans het voor haar voorzienbaar is, dat haar product in Nederland bewust gebruikt zal worden voor het geoctrooieerde gebruik van pemetrexed in combinatietherapie met vitamine B12 (en foliumzuur). Als van ‘letterlijke’ inbreuk geen sprake is, dan maakt Fresenius inbreuk bij wijze van equivalentie omdat Pemetrexed Fresenius in wezen dezelfde functie uitvoert op in wezen dezelfde wijze met in wezen hetzelfde resultaat als het geoctrooieerde pemetrexed dinatrium. Subsidiair stelt Lilly dat Fresenius met de levering van Pemetrexed Fresenius indirecte inbreuk maakt op conclusies 1 t/m 11 van EP 508 nu zij voor haar bedrijf wezenlijke bestanddelen voor de toepassing van de uitvinding levert aan andere personen dan de personen die bevoegd zijn de uitvinding in Nederland toe te passen terwijl zowel Fresenius als haar afnemers weten, of gezien de omstandigheden (i.e. de toedieningsinstructies) behoren te weten, dat die middelen geschikt en bestemd zijn voor toepassing van de geoctrooieerde uitvinding. Meer subsidiair stelt Lilly zich op het standpunt dat Fresenius met de verhandeling van Pemetrexed Fresenius ook direct of indirect inbreuk maakt op de purpose limited product claims 12 t/m 14. Nog meer subsidiair stelt Lilly dat het handelen van Fresenius een onrechtmatige daad oplevert als gevolg waarvan Lilly schade lijdt.
3.3.
Fresenius voert gemotiveerd verweer, dat er op neer komt dat de verhandeling van Pemetrexed Fresenius ten behoeve van het gebruik daarvan in combinatie met vitamine B12 en foliumzuur voor de behandeling van kanker, buiten de beschermingsomvang van EP 508 valt, zodat van (indirecte) inbreuk geen sprake is en evenmin van onrechtmatig handelen.
3.4.
Op de stellingen van partijen wordt hierna, voor zover van belang, nader ingegaan.
4. De beoordeling
Bevoegdheid
4.1.
De rechtbank is op grond van artikel 4 Brussel I bis-Vo6.internationaal en op grond van artikel 80 lid 2 onder a Rijksoctrooiwet 1995 ook relatief bevoegd om van de vorderingen kennis te nemen.
Beschermingsomvang EP 508
4.2.
Tussen partijen is in geschil hoe ver de beschermingsomvang van EP 508 strekt. Meer in het bijzonder verschillen zij van mening of het kenmerk ‘toepassing van pemetrexed dinatrium’ in onafhankelijke conclusie 1 (en evenzo het kenmerk ‘product dat pemetrexed dinatrium (…) bevat’ in onafhankelijke conclusie 12) tot de stof pemetrexed dinatrium is beperkt, zoals Fresenius aanvoert, of dat daaronder ook Pemetrexed Fresenius moet worden begrepen, hetgeen Lilly stelt.
Het kader
4.3.
De beschermingsomvang van een Europees octrooi wordt op grond van artikel 69 lid 1 van het Verdrag inzake de verlening van Europese octrooien (EOV) bepaald door de conclusies van het octrooischrift, waarbij de beschrijving en de tekeningen dienen tot uitleg van die conclusies. Daarbij dient, op grond van artikel 1 van het Protocol inzake de uitleg van artikel 69 EOV (hierna: het Protocol), het midden te worden gehouden tussen een uitleg die de beschermingsomvang strikt bepaalt aan de hand van de letterlijke tekst van de conclusies (en als zouden de beschrijving en de tekeningen slechts dienen om eventuele onduidelijkheden in de conclusies op te heffen) en een uitleg waarbij de conclusies alleen als richtlijn dienen en waarbij de bescherming zich uitstrekt tot datgene wat de octrooihouder volgens de gemiddelde vakman (hierna: de vakman), die de beschrijving en de tekeningen bestudeert, heeft willen beschermen. Artikel 1 van het Protocol vereist dat zowel een billijke bescherming van de aanvrager als een redelijke mate van rechtszekerheid aan derden wordt geboden. Daarbij dient verder op grond van artikel 2 van het Protocol op passende wijze rekening te worden gehouden met elk bij de vakman bekend element dat equivalent is aan een in de conclusies omschreven element.
4.4.
Bij het vaststellen van de beschermingsomvang vormen de beschrijving en de tekeningen van het octrooischrift een belangrijke bron. Van de beschrijving maakt onderdeel uit een weergave van de stand van de techniek die de aanvrager als nuttig beschouwt voor het begrijpen van de uitvinding. Ook niet in de beschrijving genoemde stand van de techniek kan van belang zijn. Leidend is het perspectief van de vakman vanuit zijn kennis van de stand van de techniek op de aanvraag- of prioriteitsdatum, nu het gaat om de vaststelling van hetgeen het octrooi toevoegt aan de stand van de techniek.
4.5.
Bij de na het op deze wijze vaststellen van de beschermingsomvang (ook wel ‘context-gebonden’ of ‘protocolaire’7.uitleg genoemd) te beantwoorden inbreukvraag kan mede betekenis worden gehecht aan de kennis van de vakman ten tijde van de beweerde inbreuk, in het bijzonder waar het erom gaat of er sprake is van equivalente elementen (voor zover die nog niet in aanmerking zijn genomen bij de vaststelling van de beschermings-omvang aan de hand van het perspectief van de vakman met zijn kennis van de stand van de techniek op de aanvraag- of prioriteitsdatum).8.
De ‘uitersten’
4.6.
Met het oog op de toepassing van de in 4.3 bedoelde uitlegregel van het Protocol heeft de Hoge Raad in zijn eerdere uitspraken gebruikte formuleringen, ‘hetgeen voor de uitvinding waarvan de bescherming wordt ingeroepen, wezenlijk is’, onderscheidenlijk ‘de achter de woorden van die conclusies liggende uitvindingsgedachte’ nadien bestempeld als gezichtspunt, tegenover de letterlijke tekst van de conclusies (de ‘uitersten’ in de woorden van het Protocol). Daarbij dient het achterhalen van de achter de woorden van de conclusies liggende uitvindingsgedachte ertoe een uitsluitend op de letterlijke betekenis van de bewoordingen gegronde en daarom voor een redelijke bescherming van de octrooihouder wellicht te beperkte of onnodig ruime uitleg te vermijden.9.
4.7.
In deze zaak zijn partijen het eens over de betekenis van de letterlijke bewoordingen van eerder genoemde conclusies (het - beperkte - ene uiterste) en eveneens over hetgeen de vakman (tussen partijen is in deze procedure niet meer in geschil dat de vakman kan worden aangemerkt als een team waarvan een oncoloog en een chemicus/ formuleringsdeskundige deel uitmaken, de rechtbank zal daar dan ook vanuit gaan) zal begrijpen dat de achter die conclusies liggende uitvindingsgedachte is (het - ruime - andere uiterste). Niet in geschil is immers dat de letterlijke bewoordingen van eerder genoemde conclusies, gelezen in het licht van de beschrijving van EP 508, specifiek en uitsluitend op de toepassing van de stof pemetrexed dinatrium zien, terwijl de vakman zal onderkennen dat de achter die woorden liggende uitvindingsgedachte - zoals (onder andere) ook door de Nederlandse voorzieningenrechter en het hof in kort geding is aangenomen - niet tot pemetrexed dinatrium is beperkt. EP 508 ontleent immers nieuwheid en inventiviteit niet aan de stof pemetrexed dinatrium, die al bekend was, maar aan de therapeutische toepassing ervan in combinatie met vitamine B12 en optioneel foliumzuur. Zoals Lilly heeft betoogd en Fresenius in deze procedure niet heeft weersproken zou de vakman op de prioriteitsdatum begrijpen dat deze combinatietherapie ervoor zorgt dat de ernstige bijwerkingen van de pemetrexed anionen (het actieve bestanddeel) verminderen zonder dat de werkzaamheid ervan bij het remmen van tumorgroei nadelig wordt beïnvloed. Gelet daarop zal de vakman inzien dat het voordeel van de combinatietherapie met vitamine B12 en optioneel foliumzuur niet specifiek is voor pemetrexed in de dinatriumvorm, maar ook behaald zou kunnen worden met toepassing van een andere toedieningsvorm van pemetrexed, een technische equivalent van pemetrexed dinatrium, in de combinatietherapie.
4.8.
De vakman is zich er aldus van bewust dat de letterlijke tekst een beperking is ten opzichte van de uitvindingsgedachte. De vraag die dan voorligt is hoe in deze zaak het in het Protocol bedoelde midden kan worden gevonden, meer in het bijzonder of de beschermingsomvang van EP 508, mede in aanmerking genomen de uitvindingsgedachte, verder strekt dan de bewoordingen van de conclusies, gelezen in het licht van de beschrijving, die specifiek en uitsluitend op pemetrexed dinatrium zien. Volgens Fresenius is dat niet het geval omdat er op grond van verschillende omstandigheden vanuit mag worden gegaan dat de beperking op een bewuste keuze van Lilly berust. Zij beroept zich in dit kader nadrukkelijk ook op gegevens uit het verleningsdossier.
Handvatten voor het te vinden ‘midden’
4.9.
In de rechtspraak van de Hoge Raad is neergelegd dat het gezichtspunt van ‘de achter de woorden van de conclusies liggende uitvindingsgedachte’ nog geen aanwijzingen geeft voor de wijze waarop het in artikel 1 van het Protocol bedoelde midden tussen een billijke bescherming van de octrooihouder en een redelijke mate van rechtszekerheid voor derden kan worden gevonden. De tot uitleg van de conclusies van het octrooischrift geroepen rechter zal dan ook tevens moeten beoordelen of het resultaat van zijn onderzoek de rechtszekerheid voor derden voldoende tot haar recht laat komen. Dit laatste gezichtspunt zal een restrictieve, meer bij de bewoordingen van de conclusies aansluitende uitleg kunnen rechtvaardigen in dier voege dat gebrek aan duidelijkheid voor de vakman die de grenzen van de door het octrooi geboden bescherming wil vaststellen, in beginsel ten nadele van de octrooihouder werkt. Bij dit alles moet echter rekening worden gehouden met de aard van het concrete geval, waaronder ook de mate waarin de geoctrooieerde uitvinding vernieuwing heeft gebracht.10.
4.10.
Ook kan een rol spelen in hoeverre volgens de vakman bewust voor een beperkte bescherming is gekozen. In het Bayer/Sandoz-arrest heeft de Hoge Raad immers overwogen dat het hof in die zaak terecht ten behoeve van de te maken weging had onderzocht of de vakman uit de conclusie van het daar besproken octrooi zou begrijpen dat de octrooihouder een bewuste keuze heeft gemaakt voor het gebruik van een bepaalde stof (rutheniumzout) als katalysator.11.In het Rosuvastatine-arrest heeft de Hoge Raad vervolgens bepaald dat bij de zoektocht naar het evenwicht de rechter, wanneer de vraag rijst of een in een conclusie opgenomen formulering moet worden opgevat als een beperking van de beschermingsomvang, betekenis kan toekennen aan het antwoord dat de vakman zal geven op de vraag naar het bestaan van een goede grond voor die beperking.12.
4.11.
In de onder 2.34 genoemde kort geding procedure heeft het hof in zijn arrest van 8 mei 2018 overwogen dat uit het Bayer/Sandoz arrest, gelezen in samenhang met de in cassatie bestreden overwegingen van het hof in die zaak, volgt dat ‘bewuste keuze’ als bedoeld in dat arrest, moet worden begrepen als ‘bewuste keuze die op een technische reden is gebaseerd’. Van een in de conclusie te lezen beperking (‘beperkende voorwaarde’) kan daarom volgens het hof sprake zijn als er voor de vakman (op grond van bijvoorbeeld zijn algemene vakkennis of op basis van de beschrijving), kenbaar technische overwegingen ten grondslag hebben gelegen aan de formulering van (een) conclusie(s) met een beperktere beschermingsomvang dan die waarop indachtig het gezichtspunt van de uitvindingsgedachte aanspraak had kunnen worden gemaakt’ (r.o. 4.14). Het hof concludeert vervolgens dat geen van de bij de uitleg van de conclusies relevante gezichtspunten erop wijst dat derden mochten veronderstellen dat Lilly vanwege een technische reden bewust voor pemetrexed dinatrium heeft gekozen (r.o. 4.23).
4.12.
De rechtbank kan dit voorlopig oordeel van het hof in zoverre onderschrijven, dat als voor een beperktere formulering van de conclusie dan waartoe de uitvindingsgedachte aanleiding geeft een kenbaar technisch bewuste keuze bestaat, het voor de hand ligt dat de vakman die keuze als een beperking van de beschermingsomvang zal opvatten. Dat betekent naar het oordeel van de rechtbank echter niet dat als er geen kenbaar technisch bewuste keuze voor een beperking (ten opzichte van de uitvindingsgedachte) in de formulering van een octrooi(conclusie) bestaat, de vakman steeds zou moeten aannemen dat die beperktere formulering (dus) niet als een beperking van de beschermingsomvang is op te vatten. Een dergelijke algemene regel is uit het Bayer/Sandoz-arrest niet af te leiden en evenmin uit het Rosuvastatine-arrest.
4.13.
Uit r.o. 3.4.3. van het Rosuvastatine-arrest is juist op te maken dat steeds ook andere omstandigheden/gezichtspunten een rol kunnen spelen. Lilly’s opmerking dat de Hoge Raad in het Rosuvastatine-arrest geen algemene regel heeft willen aannemen die erop ziet dat eventuele twijfel aan de zijde van de vakman voor rekening van de octrooihouder moet blijven, is hiermee in lijn. Zoals volgt uit dat arrest komt het in de door de Hoge Raad voorgeschreven wijze van uitleg immers aan op een - in cassatie beperkt te toetsen - weging van de betrokken gezichtspunten. Wel kan uit eerdere rechtspraak van de Hoge Raad worden afgeleid (zie hierover al 4.9 hierboven) dat een gebrek aan duidelijkheid ten aanzien van de inhoud c.q. reikwijdte van de conclusies in beginsel voor de octrooihouder moet blijven. Anderzijds zal er eerder aanleiding zijn uit te gaan van een ruimere beschermingsomvang als duidelijk is dat aan de beperking in de formulering geen bewuste keuze ten grondslag ligt, met andere woorden: als de beperking duidelijk onbedoeld is.13.
4.14.
Bij dit alles kan betekenis worden toegekend aan de inhoud van het verleningsdossier.14.Waar het gaat om het in het voordeel van de octrooihouder hanteren van aan het verleningsdossier ontleende argumenten, is terughoudendheid geboden. Slechts wanneer de rechter oordeelt dat het voor de vakman ook na bestudering van de beschrijving en de tekeningen nog voor redelijke twijfel vatbaar blijft hoe de inhoud van de conclusies moet worden begrepen, zal hij gebruik mogen maken van verhelderende gegevens uit het openbare deel van het verleningsdossier. Met deze restrictieve regel wordt de bij de uitleg van een octrooi in aanmerking te nemen eis van een redelijke mate van rechtszekerheid voor derden gediend. Anders dan in sommige andere Europese landen (en anders dan daar soms lijkt te worden gedacht15.), geldt echter dat in het geval een derde zich ter staving van de door hem verdedigde uitleg van een octrooi op het verleningsdossier beroept, zoals in het onderhavige geval, de rechtszekerheidseis niet tot enige beperking dwingt bij het bij de uitleg van de beschermingsomvang van het octrooi betrekken van openbare gegevens uit het verleningsdossier.16.Met andere woorden: Fresenius kan zich wat betreft de door haar bepleite uitleg van het octrooi zonder meer op het verleningsdossier beroepen.
Het ‘midden’ in de onderhavige zaak
4.15.
Omdat de letterlijke bewoordingen van het hier relevante conclusiekenmerk, gelezen in het licht van de beschrijving, niet stroken met de uitvindingsgedachte, zal de vakman zich afvragen hoe hij de beperking in de tekst op moet vatten. Hij zal onderkennen dat toepassing van pemetrexed dinatrium neerkomt op het gebruik van Alimta®, het eigen product van Lilly, en dat van dit product ook gebruik is gemaakt in de onderzoeken die hebben geleid tot het octrooi. In paragraaf [0022] van de beschrijving van het octrooi staat ook: “The "antifolate" or ''antifolate drug" for use in this invention is Pemetrexed Disodium (ALIMTA®), as manufactured by Eli Lilly & Co.” Dat zegt echter nog niets over wat is beoogd te beschermen. Aan Lilly kan worden toegegeven - Fresenius bestrijdt dat ook niet - dat een reden voor de beperking tot de specifieke dinatriumvorm van pemetrexed in de beschrijving van EP 508 niet wordt gegeven. Tegelijkertijd bevat de beschrijving ook geen duidelijke indicatie dat bescherming voor andere vormen dan dinatrium is beoogd, anders dan in het geval van vitamine B12 en het foliumbindende eiwit bindende middel, waarvoor zowel in de conclusies als in de beschrijving diverse varianten worden genoemd. De vakman zal bij het niet noemen van pemetrexedvarianten vraagtekens plaatsen, omdat hij - en naar hij begrijpt ook Lilly - weet dat het (kinderlijk) eenvoudig is om pemetrexed in andere vormen dan het dizuur of dinatriumzout als toedieningsvorm te vervaardigen: in deze procedure is immers niet in geschil dat op de prioriteitsdatum voorzienbaar was dat er (andere) farmaceutisch geschikte zoutvormen van pemetrexed waren en dat het binnen het bereik van de vakman lag om die routinematig te vinden (voor het pemetrexed tromethamine was dat evenzeer het geval, zo volgt uit de eigen stellingen van Lilly17.). Het octrooi zelf biedt dan ook geen duidelijkheid voor de vakman die de grenzen van de door het octrooi geboden bescherming wil vaststellen.
4.16.
Als daarnaast dan acht wordt geslagen op het verleningsdossier, is de rechtbank van oordeel dat vanwege de aard van de beperking en de wijze waarop die volgens het verleningsdossier heeft plaatsgevonden, de vakman, althans de derde18., de letterlijke bewoordingen van het octrooi niet zal aanmerken als een (duidelijk) onbedoelde beperking.
4.17.
Uit het verleningsdossier volgt dat de oorspronkelijke aanvrage van Lilly na bezwaren met betrekking tot onder meer nieuwheid (het gebruik van een antifolaat, namelijk 5-fluorouracil en methotrexaat, was in de stand van de techniek al in combinatie met vitamine B12 geopenbaard) door haar octrooigemachtigde is gewijzigd in die zin dat de term ‘an antifolate’ is vervangen door ‘pemetrexed’. De examiner van het EOB heeft vervolgens te kennen gegeven dat de oorspronkelijke aanvrage geen basis biedt voor het geclaimde ‘use of pemetrexed…’ (en ‘a product containing pemetrexed…’), aangezien volgens hem de term ‘pemetrexed’ in de bewoordingen van de conclusies en de aangepaste beschrijving “is certainly a distinct compound (CAS Registry number 137281-23-3) of the “pemetrexed disodium” (CAS Registry number 150399-23-8) expressed on original document description page 2, line 6 and page 6, line 16” (Communication van 17 mei 2005, zie 2.19).
4.18.
De vakman zou begrijpen dat Lilly met de term pemetrexed niet het specifieke dizuur op het oog had, maar het antifolaat als zodanig, oftewel het pemetrexed anion als werkzaam bestanddeel van de in PCT-aanvrage bedoelde chemical compound (pag. 6, regel 6 PCT-aanvrage) waarvan pemetrexed (di)sodium slechts een ‘preferred example’ vormt. Dat volgt immers uit de uit de oorspronkelijke beschrijving blijkende uitvindingsgedachte en is ook een logische gevolgtrekking uit de wijziging van ‘antifolate’ (vanwege het al bekend zijn van de combinatie vitamine B12 met antifolaten 5-fluorouracil en methotrexaat) naar ‘pemetrexed’ (als ander antifolaat dan 5-fluorouracil en methotrexaat). Verder volgt die bedoeling van Lilly uit de verhouding tussen de gewijzigde conclusie 1 en 4 respectievelijk 13 en 16 (zie 2.18), waar Lilly ter zitting ook op heeft gewezen.
4.19.
Als het gaat om de vraag of de PCT-aanvrage basis biedt voor conclusies met het antifolaat pemetrexed als zodanig, althans voor bescherming van andere toedieningsvormen dan pemetrexed dinatrium, heeft Lilly in deze procedure geen duidelijk standpunt ingenomen. Lilly heeft wel aangevoerd (zie dagvaarding onder 3.37 en 3.38), op dezelfde bladzijde als waarop zij uiteen heeft gezet dat het in het octrooi gaat om het werkzame pemetrexed anion en niet om de specifieke uitvoeringsvorm, dat de vakman de uitdrukkingen pemetrexed, pemetrexed dizuur en pemetrexed dinatrium als synoniemen zou beschouwen. Fresenius heeft onbestreden aangevoerd dat als die stelling van Lilly wordt gevolgd, Lilly (op basis van de PCT-aanvrage) met kans op succes bescherming voor elke toedieningsvorm van het antifolaat pemetrexed had kunnen krijgen. Gelet hierop gaat de rechtbank er vanuit dat Lilly meent dat de PCT-aanvrage voor een bredere conclusie basis biedt. Lilly heeft in deze procedure ook niet gesteld dat de vakman, althans voornoemde derde, op de prioriteitsdatum zou begrijpen dat er voor een bredere conclusie in de
PCT-aanvrage geen basis bestaat. Zij heeft enkel aangevoerd dat er volgens de examiner geen basis voor bescherming van andere toedieningsvormen van het antifolaat pemetrexed dan dinatrium bestond.
4.20.
Anders dan Lilly ingang wil doen vinden, zegt de examiner in de Communication over de wijziging naar ‘pemetrexed’ echter niet dat de PCT-aanvrage slechts basis biedt voor pemetrexed dinatrium. Hij wijst er op dat pemetrexed dinatrium en pemetrexed te onderscheiden verbindingen zijn. Vanwege de verwijzing naar de respectievelijke CAS nummers en de term ‘compound’ (zie ook pagina 6 regel 6 van de PCT-aanvrage onder 2.20) zou de vakman begrijpen dat de examiner daarbij met ‘pemetrexed’ op het dizuur doelde (en niet op het anion dat, zoals Fresenius ter zitting onweersproken heeft toegelicht, geen CAS-nummer heeft). Naar het oordeel van de rechtbank zou de vakman uit de Communication dus opmaken dat de examiner Lilly verkeerd heeft begrepen.
4.21.
Wat dan opvalt is dat Lilly hierover niet nader met de examiner heeft gecommuniceerd. Zij heeft niet aan de examiner duidelijk gemaakt dat zij met ‘pemetrexed’ niet specifiek op het dizuur doelde, maar op het antifolaat pemetrexed met het werkzame pemetrexed anion. Zij heeft ook niet geprobeerd om haar bedoeling te vertalen en een op meerdere toedieningsvormen van het antifolaat pemetrexed gerichte conclusie te verkrijgen. Lilly is de discussie met de examiner hierover niet eens aangegaan. In plaats daarvan heeft zij haar conclusies zonder enige slag of stoot tot toepassing van de stof pemetrexed dinatrium beperkt. Dit terwijl (zie eerder onder 4.15) op de prioriteitsdatum voorzienbaar was dat er andere farmaceutisch geschikte toedieningsvormen van pemetrexed waren en dat het binnen het bereik van de vakman lag om die routinematig te vinden. Desondanks heeft Lilly ook de beschrijving op pagina 6 van de aanvrage gewijzigd, waarbij pemetrexed disodium van een ‘preferred example’ de enige uitvoeringsvorm is geworden (zie 2.22), zonder daarbij een poging te doen om in de beschrijving een zin op te nemen als: ‘as the skilled person will understand the invention can also be practised with other farmaceutically acceptable salts’. Nadien heeft zij zonder bezwaar geaccepteerd dat de examiner de tekst van de beschrijving op andere plaatsen tot alleen de uitvoeringsvorm van pemetrexed disodium heeft teruggebracht. Verder is van belang dat [A] ten aanzien van de door hem namens Lilly aangebrachte beperkingen heeft verklaard: “The Applicant seeks to draw a distinction between subject matter which is relevant to the invention which is indicated as being that to which “the present invention generally relates” and “the subject matter provided by the invention” which is the subject matter claimed”. De vakman ziet aldus in het verleningsdossier dat Lilly van het door de examiner bedoelde pemetrexed dizuur heeft afgebakend. Als de vakman, althans de derde die zich op het octrooi oriënteert, dan de conclusies in het licht van paragraaf [0022] van de beschrijving beziet, kan hij daaruit bezwaarlijk anders opmaken dan dat wat wordt geclaimd en hetgeen waarvoor bescherming wordt gezocht, het gebruik van pemetrexed dinatrium (oftewel Alimta®) in combinatietherapie met vitamine B12 is.
4.22.
Bij het voorgaande komt mede betekenis toe aan de omstandigheid dat Lilly als farmaceutische grootmacht de nodige deskundigheid en ervaring mag worden toegedicht bij het doen van octrooi-aanvragen (ook met betrekking tot farmaceutische samenstellingen met pemetrexed, zoals blijkt uit EP 612, waarin zij in paragraaf [0021] van de beschrijving wél een zeer ruime definitie geeft van de term ‘pemetrexed’ (zie 2.25)). Daarnaast weegt mee dat Lilly in de onderhavige verleningsprocedure niet onder tijdsdruk stond. Zij heeft steeds ruim de gelegenheid gehad om zich op aanpassingen in haar aanvrage te beramen: er zijn maanden gelegen tussen de Communications van de examiner en reacties daarop van Lilly en niet in geschil is dat Lilly zich ondertussen vanwege EP 677 en aanvullende certificaat bescherming, nog jaren op de bescherming voor (zoutvormen van) pemetrexed kon beroepen. De derde die zich op het octrooi oriënteert zou daarom mogen veronderstellen dat Lilly de beperkingen in EP 508 tot pemetrexed dinatrium weloverwogen heeft aangebracht. Lilly heeft dat als zodanig ook niet weersproken.
4.23.
De rechtbank is van oordeel dat voornoemde omstandigheden in onderlinge samenhang bezien aan bescherming voor meer dan pemetrexed dinatrium, en dus voor bescherming van de uitvindingsgedachte, in de weg staan. Dat geen technische reden voor de beperking kan worden geduid, is gelet op de op het oog weloverwogen keuze van Lilly onvoldoende voor bescherming in haar voordeel. Nu voor mogelijk moet worden gehouden en ook voor de hand had gelegen dat Lilly op zijn minst zou hebben geprobeerd een bredere conclusie te verkrijgen, zal uit het niet opteren daarvoor en juist afbakenen van het dizuur kunnen worden afgeleid dat Lilly zich om haar moverende redenen heeft teruggetrokken op de toedieningsvorm van het door haar zelf ontwikkelde product Alimta®. Enige onduidelijkheid in dat opzicht dient in dit geval voor rekening van octrooihouder Lilly te blijven. De redelijke mate van rechtszekerheid voor derden, waarop de feitenrechter als ‘countercheck’ het oog moet houden19., zou hier onvoldoende tot haar recht komen indien de beschermingsomvang van EP 508, in weerwil van de specifieke bewoordingen ‘pemetrexed dinatrium’ in de conclusies en beschrijving, en in het licht van het verleningsdossier dat er op duidt dat die bewoordingen op een bewuste keuze berusten, zou worden uitgebreid, in die zin dat daaronder toch alle toedieningsvormen van het antifolaat pemetrexed zouden vallen.
4.24.
Pemetrexed Fresenius, het pemetrexed tromethamine, valt daarom niet binnen de beschermingsomvang van de conclusies van EP 508. De rechtbank heeft bij het vaststellen van de beschermingsomvang, zoals artikel 2 van het Protocol voorschrijft, op passende wijze rekening gehouden met equivalentie en bij de uitleg van de conclusies gezocht naar het midden tussen een billijke bescherming van de octrooihouder en een redelijke mate van rechtszekerheid voor derden: uit het voorgaande volgt immers dat voor equivalente bescherming, te weten bescherming voor (ook) andere toedieningsvormen van het antifolaat pemetrexed, in dit geval geen ruimte bestaat.
4.25.
De door Lilly ter zitting nog aangevoerde gezichtspunten kunnen het voorgaande niet anders maken. Aan de ‘aard van het octrooi’, ‘het beoogde doel van de uitvinding’ en ‘de voordelen van de geoctrooieerde combinatietherapie’, komt geen bijzonder gewicht toe nu deze elementen al deel uit maken van de in 4.7 weergegeven uitvindingsgedachte. Ook de door Lilly eerst ter zitting aangevoerde omstandigheid dat de uitvinding van EP 508 serieuze vernieuwing heeft gebracht, legt geen nader gewicht in de schaal, al niet omdat Lilly dat punt onvoldoende handen en voeten heeft gegeven: gesteld noch gebleken is dat sprake is van een ‘pioniersuitvinding’ waarvan het vernieuwende karakter in de weg heeft gestaan aan een afdoende beschrijving in het octrooischrift van wat Lilly onder bescherming wilde stellen en evenmin dat eventuele onduidelijkheden omtrent door Lilly gemaakte keuzes in dat octrooischrift niet in haar nadeel zouden mogen werken.20.
4.26.
Het hiervoor uiteengezette oordeel van de rechtbank is gebaseerd op de aanname dat er in de oorspronkelijke PCT-aanvrage basis bestond voor andere toedieningsvormen dan pemetrexed dinatrium. Aan een oordeel over hoe de situatie zou moeten worden bezien indien aangenomen zou moeten worden dat er geen basis bestond en de derde dat ook zo zou zien, komt de rechtbank niet toe nu Lilly noch Fresenius deze stelling heeft betrokken.
Ten overvloede
4.27.
Zou dat anders zijn geweest, dan had dit het oordeel van de rechtbank ook niet anders gemaakt. Zoals reeds overwogen, lagen aan pemetrexed dinatrium equivalente toedieningsvormen, waaronder het dizuur, op de prioriteitsdatum binnen het bereik van de vakman. Dat geldt ook voor het pemetrexed met tromethaminegroepen. In de hier bedoelde situatie geldt dan dat Lilly voor die andere vormen van pemetrexed in haar oorspronkelijke PCT-aanvrage geen basis heeft gelegd. Niet kan worden aangenomen dat dat duidelijk onbedoeld is geweest. Lilly heeft immers niet gesteld, ook niet nadat zij hier ter zitting op was bevraagd, dat de oorspronkelijke aanvrage een fout of omissie bevatte en dat de derde dat had moeten begrijpen. Uit de verleningsfase komt dat ook niet naar voren; Lilly heeft de beperking tot pemetrexed dinatrium zonder enige discussie aangebracht.
4.28.
Zoals Arnold J in zijn door Fresenius op dit punt aangehaalde vonnis in de parallelle Engelse zaak overwoog21., beroepen octrooihouders zich doorgaans in drie categorieën van situaties op equivalentie. De eerste is waar het achteraf bezien voor de vakman/derde duidelijk is dat het octrooischrift ongelukkig is opgesteld, bijvoorbeeld door slechte instructie van de uitvinder aan de octrooigemachtigde waar zijn uitvinding op ziet, door slecht redigeren van de octrooigemachtigde zelf of door samenloop van deze omstandigheden. De tweede categorie is die waarin door voortschrijding van de techniek uitvoeringsvarianten zijn ontstaan die op de prioriteitsdatum nog niet voorzienbaar waren en dus niet zijn geclaimd. De derde categorie is die waar de octrooihouder spijt heeft van een beslissing genomen tijdens de verleningsprocedure, door hemzelf of de examiner, en na verlening de gevolgen van die keuzes wenst te ontlopen.
4.29.
In de eerste twee situaties kan het billijk zijn dat equivalente bescherming een corrigerende werking heeft. Die situaties doen zich hier echter niet voor. Lilly stelt zoals gezegd immers niet dat er in de oorspronkelijke aanvrage van een duidelijk onbedoelde fout of omissie sprake is. Nu in deze procedure vaststaat dat andere toedieningsvormen, zoals het pemetrexed tromethamine, op de prioriteitsdatum voorzienbaar waren, wordt aan de tweede situatie evenmin toegekomen. Resteert de derde situatie. Niet valt in te zien, en Lilly heeft desgevraagd inhoudelijk ook niet steekhoudend onderbouwd waarom een in het octrooi tijdens de verleningsprocedure aangebrachte - duidelijk bedoelde en in de hier besproken situatie ook terechte - beperking in de conclusie op grond van toegevoegde materie22.nadien met een beroep op equivalentie toch weer onder de beschermingsomvang zou kunnen worden gebracht.23.Die corrigerende werking zou onder omstandigheden denkbaar zijn voor op de prioriteitsdatum niet voorzienbare varianten maar van die situatie is hier, als gezegd, geen sprake. Ook indien dus aangenomen zou moeten worden dat er geen basis in de oorspronkelijke PCT-aanvrage bestond voor andere toedieningsvormen dan het dinatriumzout van pemetrexed, zou het doek zijn gevallen voor de door Lilly voorgestane beschermingsomvang, omdat Fresenius naar het oordeel van de rechtbank terecht betoogt dat het beroep op bescherming binnen het equivalentiebereik niet bedoeld is om achteraf bezien onwelgevallige keuzes van Lilly in de formulering van haar octrooischrift ongedaan te maken ten koste van de redelijke rechtszekerheid van derden.
Conclusie
4.30.
Het voorgaande leidt ertoe dat de vorderingen van Lilly dienen te worden afgewezen.
4.31.
Lilly zal als de in het ongelijk te stellen partij worden veroordeeld in de kosten van de procedure, die aan de zijde van Fresenius - conform de door partijen gemaakte afspraak - worden begroot op € 400.000,-.
5. De beslissing
De rechtbank
5.1.
wijst de vorderingen af;
5.2.
veroordeelt Lilly in de kosten van de procedure, tot zover aan de zijde van Fresenius begroot op € 400.000,-;
5.3.
verklaart dit vonnis ten aanzien van de proceskostenveroordeling uitvoerbaar bij voorraad.
Dit vonnis is gewezen door mr. J.Th. van Walderveen, mr. M. Knijff en mr. C.T. Aalbers en in het openbaar uitgesproken op 19 juni 2019.
Voetnoten
Voetnoten Uitspraak 19‑06‑2019
Vzr. Rb. Den Haag 1 maart 2017, ECLI:NL:RBDHA:2017:1907 (Eli Lilly v. Sandoz B.V.). Opgemerkt wordt dat Sandoz B.V. een nietigheidsprocedure met betrekking tot EP 508 heeft ingesteld bij deze rechtbank. In die procedure is op 16 januari 2019 uitspraak gedaan (ECLI:NL:RBDHA:2019:321), waarbij de vorderingen zijn afgewezen.
Vzr. Rb. Den Haag 24 oktober 2017, ECLI:NL:RBDHA:2017:12045 (Eli Lilly v. Teva Nederland B.V.) en ECLI:NL:RBDHA:2017:12046 (Eli Lilly v. Fresenius Kabi Nederland B.V.)
Gerechtshof Den Haag 8 mei 2018, ECLI:NL:GHDH:2018:1106 (Teva Nederland B.V. v. Eli Lilly & Company) en ECLI:NL:GHDHA:2018:1105 (Fresenius Kabi Nederland B.V. v. Eli Lilly & Company)
Daarbij verdient opmerking dat het Duitse deel van EP 508 inmiddels door het Bundespatentgericht bij uitspraak van 17 juli 2018 is vernietigd.
Verordening (EU) 1215/2012 van het Europees Parlement en de Raad van 12 december 2012 betreffende de rechterlijke bevoegdheid, de erkenning en de tenuitvoerlegging van beslissingen in burgerlijke en handelszaken
Zie voetnoot 12 van de conclusie van A-G Van Peursem d.d. 24 november 2017 bij HR 8 juni 2018 (Resolution v. AstraZeneca), ECLI:NL:PHR:2017:1282
Vgl. Rechtbank Den Haag 18 juni 2014, IEF 13955, (MBI v. Shimano) en 23 juli 2014, ECLI:NL:RBDHA:2014:9417 (Bayer v. Sandoz) met in beide zaken verwijzing naar de conclusie van de A-G bij HR 25 mei 2012, ECLI:NL:PHR:2012:BV3680, alsook de conclusie van de A-G bij HR 5 februari 2016 (Bayer v. Sandoz), ECLI:NL:PHR:2015:2200, nrs. 2.37 en 2.38
Zie HR 8 juni 2018, ECLI:NL:HR:2018:854 (Resolution v. AstraZeneca, hierna ook wel aan te duiden als het Rosuvastatine arrest), r.o. 3.4.2. en de daarin genoemde rechtspraak.
Zie HR 13 januari 1995, ECLI:NL:HR:1995:ZC1609, NJ 1995, 391 (Ciba Geigy v. Oté Optics) , HR 7 september 2007, ECLI:NL:HR:2007:BA3522 (Lely v. Delaval) alsook HR 25 mei 2012, ECLI:NL:2012:BV3680 (Aga v. Occlutech)
HR 5 februari 2016, ECLI:NL:HR:2016:196 (Bayer v. Sandoz)
Zie eerdergenoemd Resolution/AstraZeneca-arrest
Vgl. nr. 2.22. van eerdergenoemde conclusie van de A-G bij HR 8 juni 2018 (Resolution v. AstraZeneca),waarmee, zo hebben zij ter zitting te kennen gegeven, zowel Fresenius als Lilly kunnen instemmen. Vgl ook nr. 2.27 van die conclusie.
Zie genoemd Ciba Geigy-arrest; HR 22 december 2006, ECLI:NL:HR:2006:AZ1081 (Dijkstra v. Saier), en genoemd Aga/Occlutech-arrest
Vgl. de beslissing van 12 juli 2017 van de Supreme Court van het Verenigd Koninkrijk onder nummer 84
Dijkstra/Saier-arrest, Aga/Occlutech-arrest.
Pleitnota Lilly 3.24 t/m 3.29 en 5.17
Lees: de derde die zich op het octrooi oriënteert en dat octrooi waar relevant met de ogen van de vakman en diens kennis van de stand van de techniek dient te bezien.
Zie eerdergenoemde conclusie van de A-G bij Resolution / AstraZeneca, nr. 2.28 en voetnoot 66 van die conclusie.
Vgl. eerdergenoemd arrest Aga/Occlutech, r.o. 4.2.6.
Actavis UK Limited c.s. v. Eli Lilly & Company, High Court (Arnold J) 15 mei 2014, [2014] EWHC 1511 (Pat), r.o. 104 t/m 107
die als ongeoorloofde uitbreidings- of nietigheidsgrond ook haar oorsprong vindt in de rechtszekerheid voor derden
Vgl. Hof Den Haag 31 december 2003, Bayer v. Sandoz, r.o. 5.7, ECLI:NL:GHDHA:2013:5403