Waar in het navolgende naar de prioriteitsdatum wordt verwezen, wordt steeds de eerste prioriteitsdatum van 30 juni 2000 bedoeld.
Rb. Den Haag, 16-01-2019, nr. C/09/533354 / HA ZA 17-581
ECLI:NL:RBDHA:2019:321
- Instantie
Rechtbank Den Haag
- Datum
16-01-2019
- Zaaknummer
C/09/533354 / HA ZA 17-581
- Vakgebied(en)
Intellectuele-eigendomsrecht (V)
- Brondocumenten en formele relaties
ECLI:NL:RBDHA:2019:321, Uitspraak, Rechtbank Den Haag, 16‑01‑2019; (Bodemzaak, Eerste aanleg - meervoudig)
Uitspraak 16‑01‑2019
Inhoudsindicatie
Intellectuele eigendom. Octrooirecht. EP 508. Gekozen vertrekpunt geeft niet weer wat op de (ca. 3 jaar later gelegen) prioriteitsdatum de stand van de techniek was m.b.t. combineren van pemetrexed en foliumzuur. Vervolgstudies leiden weg van uitvinding.
Partij(en)
vonnis
RECHTBANK DEN HAAG
Team handel
zaaknummer / rolnummer: C/09/533354 / HA ZA 17-581
Vonnis van 16 januari 2019
in de zaak van
de rechtspersoon naar vreemd recht
SANDOZ INTERNATIONAL GMBH,
te Holzkirchen, Duitsland,
eiseres,
advocaat: mr. D.F. de Lange te Amsterdam,
tegen
de rechtspersoon naar vreemd recht
ELI LILLY AND COMPANY,
te Indianapolis, Indiana, Verenigde Staten van Amerika,
gedaagde,
advocaat: mr. J.A. Dullaart te Naaldwijk.
Partijen zullen hierna Sandoz en Lilly genoemd worden.
De zaak is voor Sandoz inhoudelijk behandeld door de advocaat voornoemd, tezamen met mr. A.D. de Leeuw en mr. B.J.M. van der Maazen, advocaten te Amsterdam, en voor Lilly door mr. L. Oosting, mr. K.A.J. Bisschop en mr. ing. H.J. Ridderinkhof, advocaten te Amsterdam.
1. De procedure
1.1.
Het verloop van de procedure blijkt uit:
- -
de beschikking van de voorzieningenrechter van deze rechtbank van 15 december 2016 waarbij verlof is verleend te dagvaarden volgens de regeling voor de versnelde bodemprocedure in octrooizaken,
- -
de dagvaarding van 5 januari 2017,
- -
de akte houdende overlegging producties, tevens zienswijze kortgedingvonnis van Sandoz van 14 juni 2017, met producties EP01 tot en met EP50,
- -
de conclusie van antwoord van 23 augustus 2017, met producties GP01 tot en met GP14,
- -
de akte houdende overlegging nadere producties van Sandoz van 29 november 2017, met producties EP51 tot en met EP54,
- -
de akte houdende overlegging aanvullende producties van Lilly van 29 november 2017, met producties GP15 tot en met GP18,
- -
de akte houdende overlegging reactieve producties van Sandoz van 5 januari 2018, met productie EP55,
- -
de akte houdende overlegging reactieve producties van Lilly van 5 januari 2018, met producties GP19 tot en met GP29,
- -
de e-mail van 12 januari 2018 van de zijde van Lilly met een kostenopgave en specificatie;
- -
de e-mail van 25 januari 2018 van mr. De Leeuw waarin hij namens beide partijen meedeelt dat overeenstemming is bereikt over de redelijke en evenredige proceskosten waarin de verliezende partij zou moeten worden veroordeeld ter hoogte van een bedrag van € 300.000,-;
- -
het pleidooi van 26 januari 2018 en de daarbij door partijen gehanteerde pleitnotities, waarbij in de pleitnotities van Sandoz de randnummers 13, 15 (eerste bullet point vanaf “Aan de OD beslissing”), 36 onder 3., 72 (vanaf “N.B.”), 73, 75, 76 aanhef en onder 1. en 4. alsmede voetnoot 7 zijn doorgehaald omdat deze niet zijn gepleit. In de pleitnota van Lilly zijn om dezelfde reden de randnummers 2.6, tweede citaat, 3.1-3.3 en 4.25-4.30 doorgehaald.
1.2.
Ten slotte is vonnis nader bepaald op heden.
2. De feiten
2.1.
Sandoz is onderdeel van de Novartis-groep en is actief op het gebied van de ontwikkeling, productie en distributie van generieke geneesmiddelen.
2.2.
Lilly is onderdeel van het Eli Lilly concern dat actief is op het gebied van onderzoek, ontwikkeling en verhandeling van nieuwe geneesmiddelen.
2.3.
Lilly brengt het geneesmiddel Alimta® op de markt dat - kort samengevat - geïndiceerd is voor de behandeling van bepaalde longkankers. Alimta® bevat de werkzame stof pemetrexed dinatrium. Pemetrexed is een antifolaat dat in de stand van de techniek ook werd aangeduid als LY231514 of MTA.
2.4.
Lilly is houdster van Europees octrooi 1 313 508 B1 (hierna: EP 508), met de titel ‘Combination containing an antifolate and methylmalonic acid lowering agent’ (waarvan de Nederlandse vertaling luidt ‘Samenstelling welke een antifolaat en methylmallonzuur verlagend middel bevat’). De conclusies zien op het gebruik van respectievelijk een gecombineerd preparaat bevattende de werkzame stof pemetrexed dinatrium of in de Engelse tekst: pemetrexed disodium (hierna: pemetrexed). EP 508 is verleend op 18 april 2007 op een aanvrage van 15 juni 2001 met een beroep op prioriteit van US 215310 P van 30 juni 2000, US 235859 P van 27 september 2000 en US 284448 P van 18 april 20011.. Het antifolaat pemetrexed werd aanvankelijk beschermd door EP 0 432 677 (hierna: EP 677). EP 677 is het basisoctrooi voor Aanvullend Beschermingscertificaat 300181 voor ‘pemetrexed, desgewenst in de vorm van een farmaceutisch aanvaardbaar zout’ (hierna: het ABC). Het ABC was van kracht tot en met 9 december 2015.
2.5.
EP 508 bevat twee onafhankelijke conclusies (1 en 12) en de daarvan afhankelijke conclusies (2 tot en met 11 en 13 tot en met 14) die in de oorspronkelijke Engelse taal als volgt luiden:
1. Use of pemetrexed disodium in the manufacture of a medicament for use in combination therapy for inhibiting tumor growth in mammals wherein said medicament is to be administered in combination with vitamin B12 or a pharmaceutical derivative thereof, said pharmaceutical derivative of vitamin B12 being hydroxocobalamin, cyano-10-chlorocobalamin, aquocobalamin perchlorate, aquo-10-chlorocobalamin perchlorate, azidocobalamin, chlorocobalamin or cobalamin.
2. Use according to claim 1 wherein said medicament is to be administered in combination with vitamin B12 or a pharmaceutical derivative thereof, said pharmaceutical derivative of vitamin B12 being hydroxocobalamin, cyano-10-chlorocobalamin, aquocobalamin perchlorate, aquo-10-chlorocobalamin perchlorate, azidocobalamin, chlorocobalamin or cobalamin, and a folic binding protein binding agent selected from folic acid, (6R)-5-methyl-5,6,7,8-tetrahydrofolic acid and (6R)-5-forinyl-5,6,7,8-tetrahydrofohc acid or a physiologically available salt or ester thereof.
3. Use according to claim 2 wherein the folic binding protein binding agent is folic acid.
4. Use according to any one of claims 1 to 3 wherein the vitamin B12 or pharmaceutical derivative thereof is vitamin B12, cobalamin or chlorocobalamin.
5. Use according to any one of claims 1 to 3 wherein the vitamin B12 or pharmaceutical derivative thereof is selected from vitamin B12 or hydroxocobalamin.
6. Use according to any one of claims 1 to 5 wherein the medicament, the vitamin B12 or pharmaceutical derivative thereof and optionally the folic binding protein binding agent are to be administered simultaneously, separately or sequentially.
7. Use according to any one of claims 1 to 6 wherein the medicament is to be administered after administration of the vitamin B12 or pharmaceutical derivative thereof.
8. Use according to any one of claims 1 to 7 wherein the medicament is to be administered after the folic binding protein binding agent.
9. Use according to any one of claims 2 to 8 wherein the medicament is to be administered after pretreatment with the vitamin B12 or pharmaceutical derivative thereof followed by folic acid.
10. Use according to any one of claims 1 to 9 wherein vitamin B12 or pharmaceutical derivative thereof is to be administered as an intramuscular injection.
11. Use according to any one of claims 2 to 10 wherein the folic binding protein binding agent is to be administered orally as a tablet.
12. A product containing pemetrexed disodium, vitamin B12 or a pharmaceutical derivative thereof said pharmaceutical derivative of vitamin B12 being hydroxocobalamin, cyano-10-chlorocobalamin, aquocobalamin perchlorate, aquo-10-chlorocobalamin perchlorate, azidocobalamin, chlorocobalamin or cobalamin, and, optionally, a folic binding protein binding agent selected from the group consisting of folic acid, (6R)-5-methyl-5,6,7,8-tetrahydrofolic acid and (6R)-5-formyl-5,6,7,8-tetrahydrofolic acid, or a physiologically available salt or ester thereof, as a combined preparation for the simultaneous, separate or sequential use in inhibiting tumor growth.
13. A product according to claim 12 wherein the vitamin B12 or pharmaceutical derivative thereof is vitamin B12, co-balamin or chlorocobalamin and, if present, the folic binding protein binding agent is folic acid.
14. A product according to claim 12 wherein the vitamin B12 or pharmaceutical derivative thereof is vitamin B12 or hydroxocobalamin and, if present, the folic binding protein binding agent is folic acid.
2.6.
In de Nederlandse vertaling luiden de conclusies van EP 508 als volgt.
1. Toepassing van pemetrexed dinatrium bij het bereiden van een geneesmiddel voor toepassing bij combinatietherapie voor het remmen van tumorgroei bij zoogdieren, waarbij het geneesmiddel dient te worden toegediend in combinatie met vitamine B12 of een farmaceutisch derivaat daarvan, waarbij het farmaceutisch derivaat van vitamine B12 hydroxocobalamine, cyaan-10-chloorcobalamine, aquocobalamine perchloraat, aquo-10-chloorcobalamine perchloraat, azidocobalamine, chloorcobalamine of cobalamine is.
2. Toepassing volgens conclusie 1, waarbij het geneesmiddel dient te worden toegediend in combinatie met vitamine B12 of een farmaceutisch derivaat daarvan, waarbij het farmaceutisch derivaat van vitamine B12 hydroxocobalamine, cyaan-10-chloorcobalamine, aquocobalamine perchloraat, aquo-10-chloorcobalamine perchloraat, azidocobalamine, chloorcobalamine of cobalamine is, en een foliumbindend eiwit bindend middel gekozen uit foliumzuur, (6R)-5-methyl-5,6,7,8-tetrahydrofoliumzuur en (6R)-5-formyl-5,6,7,8-tetrahydrofoliumzuur of een fysiologisch aanvaardbaar zout of ester daarvan.
3. Toepassing volgens conclusie 2, waarbij het foliumbindende eiwitbindende middel foliumzuur is.
4. Toepassing volgens een of meer van de conclusies 1-3, waarbij het vitamine B12 of het farmaceutische derivaat daarvan vitamine B12, cobalamine of chloorcobalamine is.
5. Toepassing volgens een of meer van de conclusies 1-3, waarbij het vitamine B12 of het farmaceutische derivaat daarvan is gekozen uit vitamine B12 of hydroxocobalamine.
6. Toepassing volgens een of meer van de conclusies 1-5, waarbij het geneesmiddel, het vitamine B12 of het farmaceutische derivaat daarvan en eventueel het foliumbindende eiwitbindende middel tegelijkertijd, afzonderlijk of achtereenvolgens dienen te worden toegediend.
7. Toepassing volgens een of meer van de conclusies 1-6, waarbij het geneesmiddel dient te worden toegediend na toediening van het vitamine B12 of het farmaceutische derivaat daarvan.
8. Toepassing volgens een of meer van de conclusies 1-7, waarbij het geneesmiddel na het foliumbindende eiwitbindende middel dient te worden toegediend.
9. Toepassing volgens een of meer van de conclusies 2-8, waarbij het geneesmiddel dient te worden toegediend na voorbehandeling met het vitamine B12 of het farmaceutische derivaat daarvan gevolgd door foliumzuur.
10. Toepassing volgens een of meer van de conclusies 1-9, waarbij het vitamine B12 of het farmaceutische derivaat daarvan als een intramusculaire inspuiting dient te worden toegediend.
11. Toepassing volgens een of meer van de conclusies 2-10, waarbij het foliumbindend eiwitbindend middel als een tablet oraal dient te worden toegediend.
12. Product dat pemetrexed dinatrium, vitamine B12 of een farmaceutisch derivaat daarvan, waarbij het farmaceutisch derivaat van vitamine B12 hydroxocobalamine, cyaan-10-chloorcobalamine, aquocobalamine perchloraat, aquo-10-chloorcobalamine perchloraat, azidocobalamine, chloorcobalamine of cobalamine is, en eventueel een foliumbindend eiwitbindend middel gekozen uit de groep bestaande uit foliumzuur, (6R)-5-methyl-5,6,7,8-tetrahydrofoliumzuur en (6R)-5-formyl-5,6,7,8-tetrahydrofoliumzuur, of een fysiologisch aanvaardbaar zout of ester daarvan, als een gecombineerd preparaat voor gelijktijdige, afzonderlijk of achtereenvolgend gebruik bij remmen van tumorgroei, bevat.
13. Product volgens conclusie 12, waarbij het vitamine B12 of het farmaceutische derivaat daarvan vitamine B12, cobalamine of chloorcobalamine is en, indien aanwezig, het foliumbindende eiwitbindende middel foliumzuur is.
14. Product volgens conclusie 12, waarbij het vitamine B12 of farmaceutisch derivaat daarvan vitamine B12 of hydroxocobalamine is en, indien aanwezig, het foliumbindend eiwitbindend middel foliumzuur is.
2.7.
In de beschrijving van het octrooi is - voor zover hier van belang - het volgende opgenomen:
[0001] Potentially, life-threatening toxicity remains a major limitation to the optimal administration of antifolates. (see, generally, Antifolate Drugs in Cancer Therapy, edited by Jackman, Ann L., Humana Press, Totowa, NJ, 1999.) In some cases, a supportive intervention is routinely used to permit safe, maximal dosing. For example, steroids, such as dexamethone, can be used to prevent the formation of skin rashes caused by the antifolate. (Antifolate, pg 197.)[0002] Antifolates represent one of the most thoroughly studied classes of antineoplastic agents, with aminopterin initially demonstrating clinical activity approximately 50 years ago. Methotrexate was developed shortly thereafter, and today is a standard component of effective chemotherapeutic regimens for malignancies such as lymphoma, breast cancer, and head and neck cancer. (…) Antifolates inhibit one or several key folate-requiring enzymes of the thymidine and purine biosynthetic pathways, in particular, thymidylate synthase (TS), dihydrofolate reductase (DHFR), and glycinamide ribonucleotide formyltransferase (GARFT), by competing with reduced folates for binding sites of these enzymes. (…) Several antifolate drugs are currently in development. Examples of antifolates that have thymidylate synthase inhibiting ("TSI") characteristics include 5-fluorouracil and Tomudex®. An example of an antifolate that has dihydrofolate reductase inhibiting ("DHFRI'') characteristic is Methotrexate®. An example of an antifolate that has glycinamide ribonucleotide formyltransferase inhibiting (''GARFTI") characteristics is Lometrexol. Many of these antifolate drugs inhibit more than one biosynthetic pathway. For example Lometrexol is also an inhibitor of dihydrofolate reductase and pemetrexed disodium (Alimta®, Eli Lilly and Company, Indianapolis, IN) has demonstrated thymidylate synthase, dihydrofolate reductase, and glycinamide ribonucleotide formyltransferase inhibition.[0003] A limitation to the development of these drugs is that the cytotoxic activity and subsequent effectiveness of antifolates may be associated with substantial toxicity for some patients. Additionally antifolates as a class are associated with sporadic severe mylosuppression with gastrointestinal toxicity which, though infrequent, carries a high risk of mortality. The inability to control these toxicities led to the abandonment of clinical development of some antifolates and has complicated the clinical development of others, such as Lometrexol and raltitrexed. (…)[0004] Initially, folic acid was used as a treatment for toxicities associated with GARFTI see, e.g. U.S. Pat. No. 5,217,974. Folic acid has been shown to lower homocysteine levels (…). The role of folic acid in modulating the toxicity and efficacy of the multitargeted antifolate LY 231514 (pemetrexed) was discussed in Worzalla et al. (Anticancer Research 18: 3235-3240 (1998) Worzalla JF, Chuan S and Schultz RM). EP-A-0546870 relates to nutrient compositions which are intended to prevent and cure infectious diseases and which are intended to be administered to patients being administered with anticancer drugs to prevent and treat infectious diseases due to immunosuppression induced by the anticancer drug therapy. The compositions of EP-A-0546870 are characterized in that they comprise a certain amount of retinoid compound(s) such as vitamin A which is indicated as being responsible for the immunoreactivity. Effects of vitamin B12, folate and vitamin B6 supplements in elderly people with normal serum vitamin concentrations (Lancet 1995; 346:85-89), and homocysteine levels have been shown to be a predictor of cytotoxic events related to the use of GARFT inhibitors, see e.g. U.S. Pat. No. 5,217,974. However, even with this treatment, cytotoxic activity of GARFT inhibitors and antifolates as a class remains a serious concern in the development of antifolates as pharmaceutical drugs. The ability to lower cytotoxic activity would represent an important advance in the use of these agents.[0005] Surprisingly and unexpectedly, we have now discovered that certain toxic effects such as mortality and nonhematologic events, such as skin rashes and fatigue, caused by antifolates, as a class, can be significantly reduced by the presence of a methylmalonic acid lowering agent as vitamin B12, without adverse adversely affecting therapeutic efficacy. The present invention thus generally relates to a use in the manufacture of a medicament for improving the therapeutic utility of antifolate drugs by administering to the host undergoing treatment with a methylmalonic acid lowering agent as vitamin B12. We have discovered that increased levels of methylmalonic acid is a predictor of toxic events in patients that receive an antifolate drug and that treatment for the increased methylmalonic acid, such as treatment with vitamin B12, reduces mortality and nonhematologic events, such as skin rashes and fatigue events previously associated with the antifolate drugs. Thus, the present invention generally relates to a use in the manufacture of a medicament for reducing the toxicity associated with the administration of an antifolate to a mammal by administering to said mammal an effective amount of said antifolate in combination with a methylmalonic acid lowering agent as vitamin B12.[0006] Additionally, we have discovered that the combination of a methylmalonic acid lowering agent as vitamin B12 and folic acid synergistically reduces the toxic events associated with the administration of antifolate drugs. Although, the treatment and prevention of cardiovascular disease with folic acid in combination with vitamin B12 is known, the use of the combination for the treatment of toxicity associated with the administration of antifolate drugs was unknown heretofore.
2.8.
Met betrekking tot EP 508 en niet-Europese aan EP 508 gerelateerde octrooien zijn diverse procedures aanhangig gemaakt, waarvan een aantal hieronder wordt genoemd.
2.8.1.
Tegen de verlening van EP 508 is oppositie ingesteld door Teva Pharmaceuticals Industries Ltd., onder meer met een beroep op gebrek aan inventiviteit. De Oppositie Divisie van het Europees Octrooibureau heeft dat beroep verworpen en bij beslissing van 18 november 2010, uitgewerkt in de gronden van de beslissing van 27 december 2010, het octrooi ongewijzigd in stand gelaten. Het daartegen ingestelde beroep is ingetrokken.
2.8.2.
In Duitsland heeft het Landgericht München bij uitspraak van 20 mei 2016 een eerder gegeven ex parte beslissing, waarbij aan de onderneming Hexal AG (die evenals Sandoz behoort tot de Novartis-groep) een verbod was opgelegd met betrekking tot een combinatie van generiek pemetrexed, vitamine B12 en foliumzuur, bekrachtigd. EP 508 is daarbij voorshands geldig geacht. Hexal AG heeft bij het Duitse Bundespatentgericht een nietigheidsprocedure aanhangig gemaakt met betrekking tot het Duitse deel van EP 508, waarvan de mondelinge behandeling ten tijde van het pleidooi in deze zaak was voorzien in juli 2018. Ambtshalve is het de rechtbank bekend dat het Bundespatentgericht het Duitse deel van EP 508 bij beslissing van 17 juli 2018 heeft vernietigd.2.
2.8.3.
In de Verenigde Staten heeft Lilly een procedure aanhangig gemaakt tegen onder meer Teva Parenteral Medicines, Inc en Teva Pharmaceuticals USA, Inc. De District Court for the Southern District of Indiana heeft bij vonnis van 31 maart 2014 het aan EP 508 parallelle Amerikaanse octrooi 7,772,209 geldig bevonden en inbreuk aangenomen. Deze uitspraak is in hoger beroep door De United States Court of Appeals for the Federal Circuit bij uitspraak van 12 januari 2017 bekrachtigd. De United States Patent and Trademark Office heeft dit octrooi bij beslissing(en) van 5 oktober 2017, in onder meer een procedure tussen Sandoz en Lilly, ook geldig bevonden.
2.8.4.
In Nederland heeft Lilly bij deze rechtbank een kort geding aanhangig gemaakt tegen een zustermaatschappij van Sandoz, Sandoz B.V., nadat op haar naam in de
G-standaard van Z-index voor februari 2017, gepubliceerd op 17 januari 2017, een generieke versie van pemetrexed was opgenomen, waarvan de bijsluiter toediening in combinatie met foliumzuur en vitamine B12 voorschreef. Bij vonnis van 1 maart 2017 heeft de voorzieningenrechter Sandoz B.V. een inbreukverbod ter zake van EP 508 opgelegd.
2.8.5.
Voorts heeft Lilly Teva Nederland B.V. (hierna Teva) en Fresenius Kabi Nederland B.V. (hierna: Fresenius) in kort geding aangesproken op de verhandeling van een generiek geneesmiddel met als actieve stof pemetrexed diacid (in het Nederlands: pemetrexed dizuur), welk middel wordt voorgeschreven in combinatie met een vitaminesupplement dat bestaat uit foliumzuur, oraal toegediend, en vitamine B12, toegediend via intramusculaire injectie. Bij vonnissen van 24 oktober 2017 heeft de voorzieningenrechter van deze rechtbank aan Teva en Fresenius een verbod opgelegd. Bij arresten van 8 mei 2018 zijn voormelde vonnissen door het hof Den Haag bekrachtigd. Door Fresenius is cassatie ingesteld.
2.8.6.
Een bodemprocedure tussen Lilly en Fresenius aangaande inbreuk op EP 508 is aanhangig bij deze rechtbank. Pleidooi in die zaak vond plaats op 11 juli 2018. Het vonnis in die zaak wordt binnenkort verwacht.
2.9.
De hierna vermelde publicaties behoorden op de prioriteitsdatum van EP 508 tot de stand van de techniek.
2.9.1.
In de uitgave ‘Scientific Proceedings, 88th Annual Meeting of the American Association for Cancer Research’ (Volume 38, March 1997, p. 478) is het onderstaande abstract van J.F. Worzalla e.a gepubliceerd (hierna: het Worzalla-abstract):

2.9.2.
In het tijdschrift Anticancer Research (1998, 18: 3235-3240), is het artikel ‘Role of Folic Acid in Modulating the Toxicity and Efficacy of the Multitargeted Antifolate,
LY231514’, van J.F. Worzalla e.a. (hierna: Worzalla of de Worzalla-studie) verschenen. Hierin is onder meer opgenomen:
Abstract. We studied the effects of folic acid on modulating the toxicity and antitumor efficacy of LY231514. Using several human tumor cell lines adapted to growth in low folate medium, folic acid was shown to be 100- to 1000-fold less active than folinic acid at protecting cells from LY231514-induced cytotoxicity. The lethality of LY231514 was compared in mice maintained on standard diet or low folate diet. The LD50 occurred at 60- and 250-fold lower doses of LY231514 in DBA/2 and CDI nu/nu mice, respectively, maintained on low folate diet compared to standard diet. The L5178Y/TK-/HX-murine lymphoma was much more sensitive to the antitumor action of LY231514 compared to wild type L5178Y-S tumors. For mice on low folate diet, LY231514 at 0.3 and 1 mg/kg (qd x 10, i.p.) produced 100% inhibition of L5178Y/TK-/HX-lymphoma growth, and significant lethality occurred at ≥ 3 mg/kg. For mice on standard diet, LY231514 produced > 95% inhibition of tumor growth at 30 to 300 mg/kg, but all mice died at 800 mg/kg. Folic acid supplementation was demonstrated to preserve the antitumor activity of LY231514 while reducing toxicity. The combination of folic acid with LY231514 may provide a mechanism for enhanced clinical antitumor selectivity.
(…)
Several animal studies have indicated that folic acid supplementation in combination with antifolate cancer
therapy can prevent delayed toxicity and enhance the therapeutic potential of the GARFT inhibitor lometrexol and the TS inhibitor 1843U89. Unexpected delayed cumulative toxicity was observed in phase I studies with lometrexol, including thrombocytopenia, anemia, and mucositis. Additional clinical studies demonstrated the protective effects of folic acid against lometrexol toxicity in humans. Morgan and coworkers concluded that a daily supplement of 1 mg of folic acid during low-dose methotrexate therapy in patients with rheumatoid arthritis was useful in lessening toxicity without altering efficacy. In the present communication, we investigated the effects of folic acid on the antitumor activity and lethality of LY231514 in mice.
Materials and Methods
(…)
Cell lines. (…) The L5178Y/TK-/HX-murine lymphoma cell line was obtained from Eli Lilly Department of Genetic Toxicology (Greenfield, IN, USA).The tumor is a double mutant, deficient in thymidine kinase and hypoxanthine phosphoribosyl transferase.
(…)
Mice. Female CD I nu/nu mice were purchased from Charles River Laboratories (Wilmington, MA, USA). Female DBA/2 mice were purchased from Taconic (Germantown, NY, USA). Mice weighed 20 to 25 grams at the beginning of the studies. Mice were housed in temperature and humidity controlled rooms. Mice were fed either standard laboratory rodent chow (Purina Chow #5001) or folic acid-deficient diet containing 1% succinylsulfathiazole (Purina Chow #5831C-2); both diets were purchased from Ralston Purina Co. (St. Louis, MO, USA). The average content of folates from natural sources in both diets was found to be 0.03 ppm, whereas the standard diet was analyzed to contain 7.3 ppm of added folic acid. It was estimated that mice on a standard diet ingested 1 to 2 mg/kg/day of folates, while mice on a low folate diet ingested 0.001 to 0.008 mg/kg/day. In some studies, mice received solubilized folic acid once a day by oral gavage. Food and water were provided ad libitum.
(…)
Results
(…)
Role of folic acid in the antitumor activity of LY231514 against the L5178Y murine lymphoma. (…) The exquisite sensitivity of the L5178Y/TK-/HX- tumor model to LY231514 treatment allowed us to evaluate the effect of low folate diet on the therapeutic activity of this compound. For mice on LFD, LY231514 at 0.3 and 1.0 mg/kg/day (i.p. qd x10) produced 100% inhibition of tumor growth for tumors measured one day after the completion of a single course of drug treatment (Figure 2). As noted in Figure 1, higher drug levels yielded unacceptable toxicity. For mice on LFD that received a folate supplement of 15 mg/kg/day via oral gavage, significant inhibition of tumor growth was noted over a broad dose range (10- 1000 mg/kg/dose). Moreover, 100% inhibition of tumor growth was observed at 30 to 1000 mg/kg/dose without any lethality. This antitumor dose response (with folate supplementation) was virtually identical to that observed for mice receiving standard diet. However, the lethality was signicantly [sic] greater for the mice on standard diet (lethality at 400 and 800 mg/kg/day of 10% and 100%, respectively). Mice on standard diet received approximately one-tenth of the
amount of daily folic acid as the mice on LFD with 15 mg/kg/day supplemental folic acid.
Discussion
The poor predictive value of mouse models for antifolate toxicity may be partially due to the fact that standard laboratory mouse diets contain high levels of folic acid.
(…)
LY231514 produced potent antitumor activity against the L5178Y/TK-HX- lymphoma at l00-fold lower dose levels (0.3 and 1 mg/kg/day, Figure 2) in LFD mice relative to 30 and 100 mg/kg (Table II) in mice on standard diet. It is interesting to note that the LD50 was reduced 3000-fold for lometrexol in LFD animals, and antitumor activity could not be demonstrated even at low dose levels. In contrast, the shift in both LD50 and antitumor activity for mice on LFD compared to standard diet were of a similar magnitude (approximately 100-fold) for LY231514. However, LFD animals with high levels of folate supplementation demonstrated decreased lethality to LY231514 compared to conventional diet animals, suggesting that folate intake can be manipulated to achieve greater therapeutic effects. Oral folic acid dramatically decreased the toxicity of LY231514 and preserved antitumor activity (albeit at higher dose levels) in these mice (Figure 2).
Tabel II en figuren 1 en 2 waarnaar in vorenstaande passages wordt verwezen zijn hieronder weergegeven:
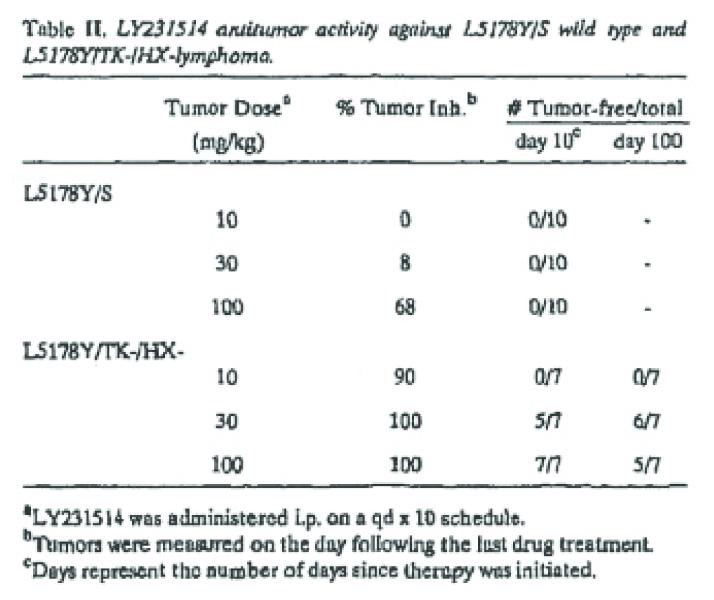
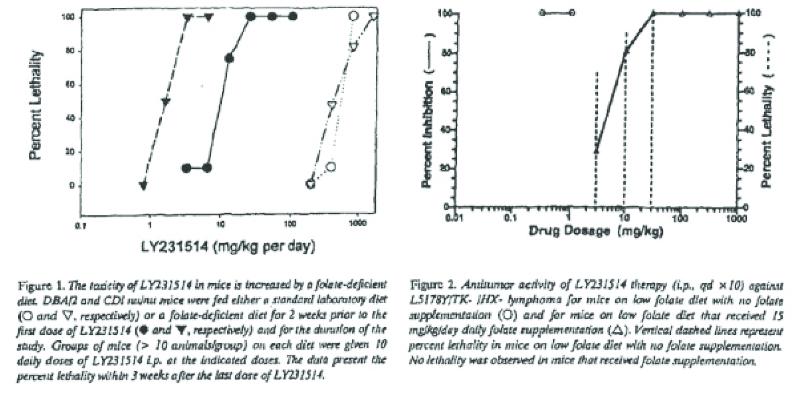
2.9.3.
Door de American Society of Clinical Oncology (ASCO) is in 1998 onderstaand abstract gepubliceerd van L. Hammond e.a. (hierna: Hammond I)3.:

2.9.4.
In het tijdschrift ‘Annals of Oncology’ (Supplement 4 to Volume 9, 1998, p. 129) is onderstaande publicatie van L. Hammond e.a. opgenomen (hierna: Hammond II):

2.9.5.
Het boek ‘Antifolate Drugs in Cancer Therapy’ (1999, Humana Press, Totowa, New Jersey) van A.L. Jackman (ed.) (hierna: Jackman), bevat in hoofdstuk 8 een bijdrage van C. Shih en D.E. Thornton, met de titel ‘Preclinical Pharmacology Studies and the Clinical Development of a Novel Multitargeted Antifolate, MTA (LY231514)’, waarin onder meer het volgende is opgenomen (pagina 190 en 191):
2.6.
The in Vivo Antitumor Effects and the Role of Folic Acid in Modulating the Efficacy and Toxicity of MTA
MTA was found to be highly active against the L5178Y/TK-/HX-lymphoma in mice (35). An excellent therapeutic index was seen, along with antitumor activity in this thymidine kinase-deficient murine model, a result that is consistent with TS inhibition being the primary mode of action of MTA. Good antitumor activity was also observed for MTA in other human tumor xenografts that expressed normal level of thymidine kinase, including VRC5 (colon, 80% growth inhibition) and GC3 (colon, 94% growth inhibition), BXPC3 (pancreas), LX-1 (lung), and MX-1 (breast) xenografts.
To evaluate the importance of dietary folate in modulating the toxicity of MTA, LD50 values were determined in mice maintained on standard diet (SD) or on a special low-folate diet (LFD) (35). MTA was administered ip daily for 10 d. It is estimated that mice on LFD consumed an average of approx 0.003 mg/kg/d of folic acid vs 0.75-1.5 mg/kg/d for mice on SD. Thus mice on SD had a daily intake of approx 250-500 times more folic acid than mice on LFD. MTA was more toxic to several different strains of mice maintained on LFD, with the LD50 values being 30- to 250-fold lower than mice maintained on SD. A similar effect had been observed for antipurine antifolates such as lometrexol. The MTD of lometrexol on LFD was 1000- to 5000-fold lower than in mice maintained on SD. DHFR inhibitors such as methotrexate had a similar effect but to a lesser extent (50- to 100-fold, J.F. Worzalla, unpublished observation). The therapeutic index of MTA against the L5178Y/TK-/HX-tumor was greatly diminished when the mice were put on a LFD (2 wk) with no folate supplementation. Good antitumor activity was observed at 0.3 mg/kg and 1.0 mg/kg (ip daily x 10) doses only, and significant toxicity was observed for MTA at higher doses. However, if daily folic acid supplementation (15 mg/d/mouse, po) was given in conjunction with MTA, excellent antitumor dose-response (10 mg/kg to 1000 mg/kg, with antitumor activity ranging from 80 to 100%) and no lethality were observed. This antitumor dose response (with folate supplementation) is identical to the dose response that was observed for MTA on mice fed with SD. These data suggest that folate supplementation not only modulates the toxicity but also slightly enhances the antitumor response of MTA.
(…)
REFERENCES
(…)
35. Worzalla JF, Self TD, Theoblad KS, Schultz RM, Mendelsohn LG, Shih C. Effects of folic acid on toxicity and antitumor activity of LY231514 multitargeted antifolate (MTA). Proc Am Assoc Cancer Res 1997; 38:478.
(…)
2.9.6.
In het tijdschrift ‘Seminars in Oncology’ (Vol. 26, No. 2, Suppl. 6 (April), 1999, p. 3-10) is een artikel met de titel ‘An Overview of Folate Metabolism: Features Relevant to the Action and Toxicities of Antifolate Anticancer Agents’ van H. Calvert gepubliceerd (hierna: Calvert), met daarin de volgende passages:
Pag. 7, rechter kolom, halverwege:
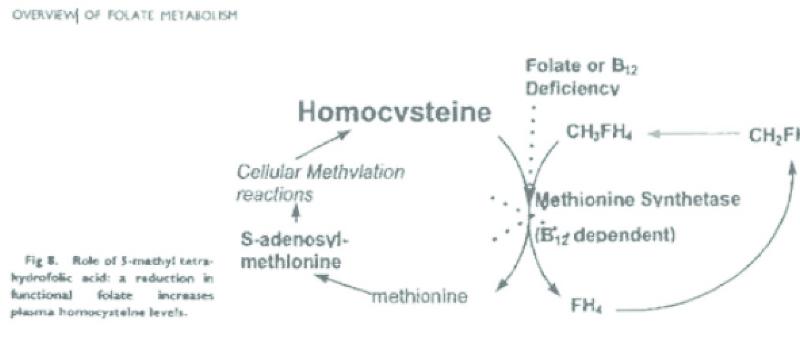
Pag. 8:

Pag. 9:


3. Het geschil
3.1.
Sandoz vordert vernietiging van het Nederlandse deel van EP 508 en veroordeling van Lilly in de op de voet van artikel 1019h Rv4.te begroten proceskosten vermeerderd met rente, met voor zover mogelijk uitvoerbaar bij voorraad verklaring van het vonnis.
3.2.
Sandoz legt hieraan samengevat het volgende ten grondslag. Conclusies 1 tot en met 9 en 12 tot en met 14 van EP 508 zijn nietig vanwege een gebrek aan nieuwheid in het licht van Worzalla, waaraan de conclusies 10 en 11 niets inventiefs toevoegen omdat de daarin geclaimde varianten (met een intramusculaire respectievelijk orale toediening) voor de gemiddelde vakman voor de hand liggen. Het octrooi is ook nietig vanwege een gebrek aan inventiviteit, primair uitgaande van Jackman in combinatie met algemene vakkennis over de methyl-folaat trap, maar ook uitgaande van Calvert in combinatie met algemene vakkennis over de methyl-folaat trap, althans de algemene vakkennis zoals blijkend uit Jackman, of uitgaande van Worzalla in combinatie met Jackman of Calvert. Deze documenten halen conclusie 2, en daarmee ook de bredere conclusie 1 (die niet tot pemetrexed en vitamine B12 is beperkt), onderuit en daaraan voegen de additionele kenmerken van de volgconclusies niets inventiefs toe.
3.3.
Lilly voert gemotiveerd verweer.
3.4.
Op de stellingen van partijen wordt hierna, voor zover van belang, nader ingegaan.
4. De beoordeling
Bevoegdheid
4.1.
De rechtbank is op grond van artikel 24 lid 4 Brussel I bis-Vo5.internationaal en op grond van artikel 80 lid 1 onder a Rijksoctrooiwet 1995 ook relatief bevoegd om van de vordering kennis te nemen.
Bezwaar tegen producties
4.2.
Lilly heeft bezwaar gemaakt tegen toelating van de niet al bij dagvaarding aangekondigde producties EP39 tot en met EP45, vanwege het ontbreken van een toelichting op (de relevantie van) die producties in de bijbehorende akte van 14 juni 2017. De rechtbank verwerpt dat bezwaar voor producties EP39 en EP42 tot en met EP45. Sandoz heeft deze producties bij akte van 29 november 2017 immers alsnog van een toelichting voorzien. Niet valt in te zien dat Lilly, die niet gesteld heeft dat zij hierop niet adequaat heeft kunnen reageren, hierdoor in haar verdediging is geschaad. Met betrekking tot producties EP40 en EP41 is het bezwaar gegrond. Dat deze producties al uit de Europese verlenings- respectievelijk Nederlandse kort geding procedure bekend waren, zoals Sandoz heeft aangevoerd, neemt niet weg dat zij met het oog op het verdedigingsbelang van Lilly en de voorlichting van de rechtbank minst genomen voor de zitting duidelijk had behoren te maken met welk doel zij die producties in deze procedure inbracht.6.Nu zij dat (zelfs na daarop te zijn gewezen) heeft nagelaten, worden EP40 en EP41 als producties van Sandoz wegens strijd met de goede procesorde geweigerd.
4.3.
Sandoz maakt in geval van honorering van Lilly’s bezwaar op haar beurt bezwaar tegen productie GP16, stellende dat GP16 uit de verleningsprocedure bekend was en daarom eerder had kunnen worden ingediend, zodat deze productie, overeenkomstig de door Lilly gehanteerde redenering met betrekking tot de in r.o. 4.2. genoemde producties, moet worden geweigerd. De vergelijking gaat echter mank. Zoals volgt uit r.o. 4.2., worden de door Lilly bestreden producties EP40 en EP41 niet geweigerd omdat deze eerder hadden kunnen worden ingediend, maar omdat is verzuimd het doel van indiening te vermelden. Dat is met betrekking tot GP16 niet aan de orde. Gelet daarop en bij afwezigheid van enig geschaad belang aan de zijde van Sandoz, wordt het bezwaar verworpen.
Technische achtergrond
4.4.
Voorafgaand aan de beoordeling van de door Sandoz gestelde nieuwheids- en inventiviteitsbezwaren tegen EP 508, volgt onderstaand een aan de stukken van partijen ontleende en onbestreden technische achtergrond met betrekking tot folaten, de zogenoemde methyl-folaat trap en antifolaten.
4.4.1.
Folaat is een essentiële vitamine uit het vitamine B-complex. De mens is voor de aanvoer van folaten afhankelijk van externe bronnen (voeding of voedingssupplementen). Natuurlijke folaat-varianten bevinden zich bijvoorbeeld in spinazie, spruitjes, broccoli en kool. Foliumzuur (folic acid) is een synthetische variant en de meest stabiele vorm van folaat, die veel aan voedingsmiddelen wordt toegevoegd. Foliumzuur wordt in het lichaam omgezet in andere folaatvormen. De folaatvariant die het meest in bloedplasma voorkomt, is 5-methyl-tetrahydrofolaat (MTHF).
4.4.2.
Folaat speelt een rol bij verschillende biochemische processen in de cellen in het lichaam, waaronder bij de DNA-cyclus die de basis voor de celdeling vormt. Binnen de DNA-cyclus fungeren verschillende folaat-varianten als zogenaamde ‘cofactoren’ van enzymen die (via een reeks reacties) nodig zijn voor de aanmaak van DNA (DNA-synthese). Een ‘cofactor’ is nodig om een enzym zijn biologische activiteit te geven (de cofactor fungeert als het ware als een aan/uit knop). Tot de belangrijkste folaat-behoevende enzymen betrokken in het metabolisme van een cel, behoren Thymidylate Synthase (TS), GlycinAmide Ribonucleotide FormylTransferase (GARFT) en DiHydroFolate Reductase (DHFR).
4.4.3.
Folaten spelen ook een rol binnen de methylatie-cyclus in het lichaam. In die cyclus is de folaatvariant MTHF nodig voor het omzetten van de stof homocysteïne in de stof methionine. Methionine is onder meer nodig voor de aanmaak van eiwitten.
4.4.4.
Bij de omzetting van homocysteïne naar methionine is het enzym methionine synthase betrokken. Dit enzym speelt tevens een rol in de DNA-cyclus, bij de omzetting van MTHF naar tetrahydrofolaat (THF), welke folaat nodig is voor verdere stappen bij DNA-synthese.
4.4.5.
Een cofactor voor methionine synthase is methylcobalamine. Methylcobalamine wordt gevormd door de methylgroep van MTHF en cobalamine, ofwel vitamine B12.
In het menselijk lichaam is vitamine B12 de enige acceptor van de methylgroep van MTHF, en MTHF is de enige donor van de methylgroep aan vitamine B12. Nadat vitamine B12 de methylgroep van MTHF heeft overgenomen ontstaat methylcobalamine. Door de vorming van methylcobalamine wordt MTHF ontdaan van de methylgroep en ontstaat THF, dat (zie r.o. 4.4.4.) weer nodig is in de DNA-cyclus. In de methylatie-cyclus is methylcobalamine in staat de methylgroep ‘door te geven’ aan homocysteïne met behulp van het enzym methionine synthase. Met deze methylgroep wordt homocysteïne omgezet in methionine.
4.4.6.
Bij een tekort aan vitamine B12 is er te weinig ‘methylacceptor’ en blijft de ‘methyldonor’ MTHF ‘met de methylgroep zitten’. Anders gezegd: een tekort aan vitamine B12 verhindert de reactie van MTHF naar THF en THF blijft als het ware ‘gevangen’ in de methylgroep in de vorm van MTHF. Doordat het folaat ‘gevangen’ is, kan het geen nuttige functie vervullen, zodat in een dergelijke situatie ook wel wordt gesproken van een pseudo-tekort aan folaat of een functioneel tekort aan folaat (het is er wel, maar in de verkeerde vorm). Dit wordt de methyl-folaat trap genoemd.
4.4.7.
Een antifolaat is een analoog van folaat. Antifolaten concurreren als het ware met folaten en binden zich - in plaats van folaten - aan enzymen als TS, GARFT en DHFR, waardoor de werking daarvan geremd wordt. Hierdoor wordt de DNA-vorming en daarmee de celdeling verstoord, onder meer van snel delende cellen zoals tumorcellen. Binnen het oncologisch vakgebied zijn daarom verschillende antifolaten als geneesmiddel ingezet c.q. op inzet als geneesmiddel tegen kanker onderzocht. Het antifolaat methotrexaat (dat eind jaren ’40 van de vorige eeuw is ontwikkeld en op enig moment goedgekeurd is voor medisch gebruik) bindt zich aan DHFR. Eind jaren ’90 van de vorige eeuw is het antifolaat raltitrexed (merknaam: Tomudex) goedgekeurd voor medisch gebruik voor de behandeling van dikke darmkanker. Raltitrexed bindt zich aan het enzym TS. Het antifolaat lometrexol bindt zich aan het enzym GARFT. Het door Lilly ontwikkelde antifolaat pemetrexed bindt zich zowel aan TS, GARFT als DHFR. Pemetrexed wordt daarom wel aangeduid als het Multi Target Antifolaat (MTA).
4.4.8.
Omdat antifolaten niet alleen de vorming van kankercellen, maar ook de vorming van normale cellen verstoren, met name snel delende cellen in het beenmerg en maagdarmkanaal, kan het gebruik ervan tot ernstige toxische effecten (bijwerkingen) leiden.
Nieuwheid - Worzalla
4.5.
Worzalla betreft een studie naar het effect van foliumzuur op de bijwerkingen (toxiciteit) en anti-tumor werkzaamheid van pemetrexed bij muizen met geïmplanteerde tumorcellen. In het kader van die studie is een groep muizen gehouden op een dieet met een laag foliumzuurgehalte (folid acid deficient diet of low folate diet) en een andere groep muizen op een standaarddieet. Sandoz heeft in de dagvaarding en in haar akte van 14 juni 2017 - net als in de eerdere kort geding procedure - de stelling betrokken dat Worzalla de conclusies 1 tot en met 9 en 12 tot en met 14 van EP 508 anticipeert omdat - kort gezegd -
in het onderzoek aan een deel van de muizen (namelijk die op het standaarddieet zijn gehouden) ‘Purina Chow #5001’ is gevoerd. In dit voer zou tweemaal zoveel vitamine B12 hebben gezeten als blijkens voedingsstandaarden voor laboratoriummuizen indertijd gebruikelijk werd geacht, kennelijk, aldus nog steeds Sandoz, vanuit de gedachte dat een adequate hoeveelheid vitamine B12 nodig was.
4.6.
Lilly heeft bij conclusie van antwoord gemotiveerd aangevoerd dat de tweede-medische-indicatie conclusies (en “mutatis mutandis” de conclusies 12 tot en met 14) van EP 508 hun nieuwheid ontlenen aan het voorgenomen nieuwe therapeutisch gecombineerde gebruik van pemetrexed dinatrium en vitamine B12 (en - kort gezegd7.- foliumzuur voor conclusie 2), welk therapeutisch gebruik in Worzalla hoe dan ook niet wordt geopenbaard. De door Sandoz gestelde (en door Lilly betwiste) samenstelling van het voer dat Worzalla aan de muizen heeft gegeven, is dan ook niet relevant, aldus Lilly. Sandoz heeft dit op haar beurt niet weersproken. Zij heeft ter zake geen aanvullende producties ingediend en is op de gemotiveerde betwisting van haar stellingen door Lilly bij pleidooi in het geheel niet meer teruggekomen. Zij heeft haar stelling dat ‘kennelijk de gedachte was dat toediening van een adequate hoeveelheid vitamine B12 nodig was’ ook anderszins niet nader onderbouwd. Sandoz heeft aldus op geen enkele wijze toegelicht waaruit de vakman afleidt dat enige hoeveelheid vitamine B12 - zo daar al sprake van zou zijn - door de onderzoekers van de Worzalla-studie bewust, dat wil zeggen, voor therapeutische doeleinden, is toegediend. Haar betoog wordt zodoende als onvoldoende onderbouwd verworpen.
4.7.
Conclusies 1 tot en met 9 en 12 tot en met 14 van EP 508 zijn derhalve nieuw te achten. Dientengevolge komt de rechtbank niet toe aan de stelling dat conclusies 10 en 11, bij gebreke van nieuwheid van de daaraan voorafgaande conclusies, niet inventief zijn.
Inventiviteit - Jackman
4.8.
De primaire inventiviteitsaanval van Sandoz neemt Jackman als vertrekpunt en is gericht op conclusie 2 van EP 508, met dien verstande dat - zo is door Lilly erkend - als conclusie 2 ongeldig is, dat ook geldt voor conclusie 1. Sandoz’ standpunt kan als volgt worden samengevat:
1) De combinatie van pemetrexed en folaat is stand van de techniek want die combinatie is geopenbaard in hoofdstuk 8, paragraaf 2.6 van het handboek Jackman. Jackman vermeldt daarbij dat foliumzuur de bijwerkingen van pemetrexed vermindert en dat geen afbreuk wordt gedaan aan de werkzaamheid:
However, if daily folic acid supplementation (15 mg/d/mouse, po) was given in conjunction with MTA, excellent antitumor dose-response (10 mg/kg to 1000 mg/kg, with antitumor activity ranging from 80 to 100%) and no lethality were observed. (…) These data suggest that folate supplementation not only modulates the toxicity but also slightly enhances the antitumor response of MTA.
De vakman weet dus dat de toediening van folaat bij pemetrexed nuttig is. Die leer is ook opgenomen in tal van andere publicaties.
2) Het is algemene vakkennis dat vitamine B12 nodig is om folaat functioneel beschikbaar te houden. Zonder vitamine B12 loopt het folaat vast in de methyl-trap en is het niet functioneel.
3) Daarom ligt het voor de hand te onderzoeken with a reasonable expectation of succes of naast het toedienen van folaat ook het toedienen van vitamine B12 bijdraagt aan het terugdringen van de bijwerkingen van pemetrexed. Conclusie 2 van EP 508 is daarmee gegeven.
4.9.
Een van de verweren van Lilly is dat de redenering van Sandoz op de onjuiste premisse berust dat de vakman op de prioriteitsdatum gemotiveerd zou zijn om kankerpatiënten foliumzuur in combinatietherapie met pemetrexed toe te dienen. Volgens Lilly is Jackman slechts een samenvoeging van artikelen en géén handboek, en ligt blijkens de referenties aan hoofdstuk 8 geen publicatie van na 1997 ten grondslag. Daarbij komt dat paragraaf 2.6 van hoofdstuk 8 verwijst naar de studie van Worzalla, waarvan in 1997 nog enkel het Worzalla-abstract was gepubliceerd. De vakman zou op de prioriteitsdatum dan ook verder kijken dan Jackman. Hij zou ook de aan paragraaf 2.6 van hoofdstuk 8 onderliggende publicaties en de vervolgstudies in ogenschouw nemen en alsdan weten dat het gebruik van foliumzuur ten koste ging van de werkzaamheid van pemetrexed, hetgeen de vakman van die combinatietherapie en van de uitvinding weg leidt.
4.10.
Dit verweer slaagt. De rechtbank overweegt daartoe het volgende. Daarbij zal zij er veronderstellenderwijs met Sandoz vanuit gaan dat de vakman een team is dat bestaat uit een oncoloog, die kankerpatiënten ziet in de kliniek, en een biochemisch farmacoloog met kennis van folaten en antifolaten dat onderzoek verricht.
4.11.
Hoofdstuk 8, paragraaf 2.6 van Jackman betreft een bespreking van (onderzoek naar) de invloed van (voorafgaande) toediening van foliumzuur op de toxiciteit van pemetrexed bij de bestrijding van tumoren. Op zichzelf is dus juist, zoals Sandoz stelt, dat Jackman de combinatie van foliumzuur met pemetrexed openbaart. Met Lilly is de rechtbank evenwel van oordeel dat Jackman vanwege de datering in combinatie met de aard en inhoud van het in paragraaf 2.6 van hoofdstuk 8 besproken onderzoek een te beperkt en daarmee geen realistisch uitgangspunt is voor de beoordeling van de inventiviteit van EP 508.
4.12.
Paragraaf 2.6 van hoofdstuk 8 is weliswaar onderdeel van de stand van de techniek maar de inhoud daarvan geeft niet weer wat op de prioriteitsdatum de stand van de techniek was als het gaat om het combineren van pemetrexed en foliumzuur, en de vakman wist dat. Niet bestreden is immers dat Jackman een samenvoeging van artikelen betreft en dat aan hoofdstuk 8 geen enkele publicatie van na 1997 ten grondslag ligt. Dat geldt dus ook voor paragraaf 2.6 die een bespreking van de studie van Worzalla inhoudt. Jackman verwijst daarvoor in eindnoot 35 naar het in maart 1997 gepubliceerde Worzalla-abstract. Ten tijde van de publicatie van Jackman (en dus ook op de prioriteitsdatum) was evenwel de volledige Worzalla-studie reeds gepubliceerd. De vakman zou bij de lezing van Jackman daarom niet slechts het abstract maar ook de Worzalla-studie betrekken. Hij zou voorts zien dat Worzalla slechts een preklinische studie naar de effecten van pemetrexed en foliumzuur op een specifiek muizenmodel behelst (zie ook r.o. 4.15.), terwijl op de (ca. drie jaar later gelegen) prioriteitsdatum ook publicaties van de klinische vervolgstudies van de behandeling met pemetrexed en foliumzuur op mensen beschikbaar waren in de vorm van Hammond I en II. De vakman zou deze publicaties (hierna tezamen ook: de Hammond-studie8.) evenzeer in ogenschouw nemen. Zou dit anders zijn, dan zou bij de inventiviteitsbeoordeling (een deel van) de de vakman aan te meten vakkennis ter zake van de in Jackman geopenbaarde combinatie van pemetrexed en foliumzuur op de prioriteitsdatum eenvoudigweg worden genegeerd.
4.13.
Het vertrekpunt bij de inventiviteitsbeoordeling is dus niet zo zeer Jackman, maar de voor de vakman bekende stand van de techniek in het onderzoek naar de combinatie van foliumzuur en pemetrexed op de prioriteitsdatum, zoals dat uit de in Jackman besproken studie van Worzalla (het Worzalla-abstract en de Worzalla-studie) en de daarop voortbordurende Hammond-studie blijkt. Die stand van de techniek is de volgende.
4.14.
Zoals al overwogen in r.o. 4.5. bespreekt de Worzalla-studie het resultaat van preklinisch onderzoek met muizen waarbij het effect van voorafgaande behandeling met foliumzuur is onderzocht. Het laat zien dat pemetrexed door voorafgaande toediening van foliumzuur minder toxisch is, in die zin dat zonder sterfte hogere doses pemetrexed mogelijk zijn. Tegelijkertijd leert deze studie dat de toediening van foliumzuur de werkzaamheid van pemetrexed vermindert als de dosis niet wordt verhoogd. Geconcludeerd wordt immers (onder ‘Discussion’, zie 2.9.2): “Oral folic acid dramatically decreased the toxicity of LY231514 and preserved antitumor activity (albeit at higher dose levels) in these mice” (onderstreping, rb). De Worzalla-studie verwijst daarbij naar figuur 2, waaruit af te lezen is dat bij muizen op een low folate dieet, die geen folaat supplement kregen, bij doseringen tussen 0,3 en 1 mg/kg/dag pemetrexed een antitumor werking van 100% werd gemeten. Om diezelfde werkzaamheid bij muizen op datzelfde low folate dieet mét folaat supplement te krijgen, waren blijkens deze figuur doseringen vanaf maar liefst 30 mg/kg/per dag nodig.
4.15.
Uit de Worzalla-studie kan verder worden afgeleid dat voor het onderzoek waarop de in figuur 2 neergelegde resultaten betrekking hebben, een voor pemetrexed zeer gevoelige kankercellijn (L5178Y/TK-/HX-) is gebruikt (zie tabel II van Worzalla waarin het verschil in werkzaamheid ten opzichte van de behandeling van muizen met een ‘wild type’ tumor is getoond). Lilly heeft bij monde van haar deskundige Calvert met betrekking tot het gebruik van deze speciale cellijn onweersproken aangevoerd dat deze niet geschikt is om de relatie tussen toxiciteit en werkzaamheid te voorspellen: “It is a good model to compare the efficacy between test compounds. It is a poor model to predict the relationship between toxicity and efficacy in a normal mouse and even less so in humans9..” Ook in de Worzalla-studie zelf is opgemerkt dat de muismodellen volgens de onderzoekers “poor predictive value for antifolate toxicity” hebben.
4.16.
De vakman weet op de prioriteitsdatum vanwege de Worzalla-studie dus dat de door Sandoz aangehaalde slotopmerking in Jackman dat “these data suggest that folate supplementation not only modulates the toxicity but also slightly enhances the antitumor response of MTA” genuanceerd moet worden, in die zin dat foliumzuur de toxiciteit van pemetrexed vermindert en aldus een hogere dosis pemetrexed mogelijk maakt, maar dat het toedienen van foliumzuur tegelijkertijd ook vraagt om een hogere dosis pemetrexed om een zelfde niveau van werkzaamheid daarvan te kunnen behouden. Daarbij is het maar de vraag of dat ook van toepassing is als pemetrexed in combinatie met foliumzuur aan mensen wordt toegediend.
4.17.
Wanneer daaraan de Hammond-studie wordt toegevoegd, vindt de vakman weliswaar een bevestiging voor de gedachte dat de toevoeging van foliumzuur de bijwerkingen van pemetrexed vermindert, maar niet voor het idee dat die toevoeging de werkzaamheid (anti tumor response) van pemetrexed positief zou kunnen beïnvloeden.
De Hammond-studie heeft blijkens de beschrijving betrekking op een fase I studie waarbij kankerpatiënten werden (voor)behandeld met foliumzuur bij doseringen van pemetrexed van 600, 700, 800 en 925 mg/m2, nadat een eerdere fase I-studie (door partijen de Rinaldi-studie genoemd, hierna: Rinaldi) met pemetrexed maar zonder toediening van foliumzuur had laten zien dat specifieke bijwerkingen geen hogere dosering dan 500-600 mg/m2 toelieten.
4.18.
Wat de werkzaamheid van pemetrexed betreft, vermeldt Hammond I dat slechts bij één patiënt een ‘partial response’ werd gezien (op 21 patiënten; dit aantal werd niet hoger toen in Hammond II het aantal patiënten was uitgebreid naar 33), terwijl in Rinaldi - blijkens Hammond I - nog ‘major antitumor response’ (bij 10 van de 37 patiënten) werd waargenomen. Sandoz heeft weliswaar aangevoerd dat bedoelde studies twee verschillende studies zijn met verschillende opzetten en dat die bij gebrek aan randomisatie van de patiëntenpopulatie niet met elkaar kunnen worden vergeleken, maar dan negeert zij dat die studies door Hammond zelf worden vergeleken en vanwege de dosering pemetrexed ook verband met elkaar houden. Daarmee maakt de vergelijking, onjuist of niet, onderdeel uit van de geopenbaarde uitkomst van de Hammond-studie. Bovendien heeft Sandoz niet, althans onvoldoende, de stelling van Lilly weersproken dat bij fase I-studies met kankerpatiënten altijd de respons wordt beoordeeld en dat de vermelding van slechts één gedeeltelijke respons tegenover ‘major anti-tumor response’ voor de vakman ten minste een signaal zou zijn dat de toediening van foliumzuur ten koste zou kunnen gaan van de werkzaamheid van pemetrexed, zoals de Worzalla-studie ook liet zien.
4.19.
Ook in de overige door Sandoz aangehaalde publicaties wordt niet geopenbaard dat de combinatie van pemetrexed en de (voor)behandeling met foliumzuur leidt tot verminderde toxiciteit zonder dat de werkzaamheid van pemetrexed daardoor wordt verminderd. Ter zitting heeft Sandoz desgevraagd erkend dat het overzichtsartikel van Calvert niets zegt over een effect van de voorbehandeling met folaat op de werkzaamheid van een antifolaat. Calvert beschrijft slechts de antitumorale werking van pemetrexed en dat de daaraan gerelateerde toxiciteit wellicht kan worden voorspeld door het meten van het homocysteïne-gehalte in het plasma voorafgaand aan de behandeling. De combinatie van foliumzuur en pemetrexed wordt in Calvert niet geopenbaard. De publicatie van Adjei10.grijpt door verwijzing in eindnoot 53 terug op de Hammond-studie en ziet de daar behaalde resultaten als een succes. Hiervoor is echter al overwogen dat op die resultaten bepaald het nodige valt af te dingen in die zin dat de (voor)behandeling met foliumzuur leidt tot een verminderde werkzaamheid van pemetrexed. Het artikel van Cripps11.baseert de stelling dat “A phase I study is underway investigating the combination of MTA and folic acid. High homocysteine levels [18] may be a predictor to toxicity of MTA and it is possible that when MTA is used in combination with folic acid, toxicity may be eliminated with no compromise in efficacy” in eindnoot 18 op ‘Unpublished data - Eli Lilly and Company’, hetgeen, gelet op de tijd, zoals Lilly onweersproken heeft aangevoerd, óf de Worzalla- óf de Hammond-studie moet zijn geweest. Er waren op dat moment immers geen andere publicaties beschikbaar. Op die studies is hiervoor al ingegaan.
4.20.
De stand van de techniek in het onderzoek naar de combinatie van foliumzuur en pemetrexed voor kankerpatiënten op de prioriteitsdatum is aldus dat foliumzuur goed functie kan doen als antigif, om de bijwerkingen van pemetrexed tegen te gaan, maar dat foliumzuur tegelijkertijd de werkzaamheid van pemetrexed vermindert. De vakman heeft er op de prioriteitsdatum kennis van dat verhoging van de dosis ter compensatie voor die verminderde werkzaamheid is onderzocht, maar dat gezien de lage respons in de Hammond-studie de meerwaarde daarvan niet is aangetoond.
4.21.
Bovendien is er als onweersproken van uit te gaan dat voor de vakman een punt van zorg zou zijn dat hogere doses pemetrexed een nadelige uitwerking op de nierfunctie zouden hebben. Zo volgt uit de Hammond-studie dat bij (ten minste) 7 van de 33 patiënten een afname in nierfunctie werd waargenomen in de vorm van een ‘decrease in creatinine clearance’, die in Hammond II significant wordt genoemd (significant decrease in CrCl). Lilly heeft met verwijzing naar de verklaringen van haar deskundige Jackman (en bevestiging daarvan door haar deskundige Calvert) aangevoerd dat de vakman zou begrijpen dat foliumzuur niet tegen deze niertoxiciteit zou beschermen. Sandoz heeft daar niets tegenover gezet.
4.22.
De rechtbank gaat daarom voorbij aan de stelling van Sandoz dat de toediening van foliumzuur in een combinatietherapie met pemetrexed op de prioriteitsdatum stand van de techniek was, laat staan dat de toepassing van die therapie - zoals Sandoz ook wel heeft betoogd - op die datum als behorend tot de algemene vakkennis kon worden aangemerkt. Daarbij neemt de rechtbank tevens in aanmerking dat de besproken documenten die gaan over de combinatie van pemetrexed en foliumzuur (Worzalla en Hammond) dateren uit 1998 en dat als deze (in potentie) een succesvolle combinatietherapie voor kanker zouden openbaren, verwacht zou worden dat die combinatie op de prioriteitsdatum bij de behandeling van kanker werd toegepast, althans dat verdere studies ten behoeve van die toepassing zouden hebben plaatsgevonden. Gesteld noch gebleken is dat dat het geval was. Integendeel, Lilly heeft onweersproken aangevoerd dat in het vervolg klinische fase II-onderzoek met pemetrexed geen foliumzuur werd toegediend (pleitnota, randnummer 2.19 onder (c)).
4.23.
Dat de vakman in (onder meer) Jackman leest dat de toediening van folaten ook de toxiciteit van een antifolaat als lometrexol verminderde (zie Jackman par. 2.6. ‘A similar effect has been observed for antipurine antifolates such as lometrexol’), zoals Sandoz heeft aangevoerd, maakt het voorgaande niet anders, nog daargelaten dat Sandoz niet, althans onvoldoende heeft weersproken het betoog van Lilly dat de op de prioriteitsdatum beschikbare studie van Laohavinij12., die experimenteerde met het toevoegen van foliumzuur aan het behandelingsschema van lometrexol (dat een ander werkingsmechanisme heeft dan pemetrexed) de vakman leerde dat die toevoeging leidde tot een verminderde werkzaamheid van lometrexol (‘only one objective partial response has been observed’ op een totaal van 43 patiënten), dat de vakman ermee bekend was dat lometrexol op de prioriteitsdatum van de markt was in verband met toxiciteitsproblemen (die niet konden worden opgelost, ook niet met foliumzuur) en dat voor de enige twee antifolaten die in Europa waren toegelaten, methotrexaat en raltitrexed, (voor)behandeling met foliumzuur (in de bijsluiter) werd afgeraden.
4.24.
Nu de combinatietherapie van pemetrexed en foliumzuur op de prioriteitsdatum niet als gegeven voor de vakman kan worden beschouwd, ontvalt de grond aan Sandoz’ betoog als weergeven in r.o. 4.8. en komt de rechtbank aan haar argumenten met betrekking tot vitamine B12 niet toe. Conclusie 2 en 1 moeten in het licht van de besproken documenten dus inventief worden geacht. Dat geldt dan ook voor de conclusies 3 tot en met 11. Waarom dit voor onafhankelijke conclusie 12 en de daarvan afhankelijke conclusies 13 en 14 anders zou zijn, heeft Sandoz niet gemotiveerd gesteld zodat ook die conclusies geldig worden geacht.
Inventiviteit - Worzalla
4.25.
Sandoz heeft een separate inventiviteitsaanval vanuit Worzalla (in combinatie met Jackman of Calvert) opgezet, stellende dat Worzalla de vakman leert dat foliumzuur in combinatietherapie met pemetrexed moet worden toegediend. Zoals hiervoor (onder r.o. 4.14. tot en met 4.16.) al is overwogen, is dat echter niet wat in Worzalla wordt geopenbaard. Daarmee ontvalt ook de grond aan deze inventiviteitsaanval.
Inventiviteit - Calvert
4.26.
De in de dagvaarding opgenomen inventiviteitsaanval vanuit Calvert is door Lilly bij conclusie van antwoord gemotiveerd bestreden. Gelet op wat in de voorgaande rechtsoverwegingen is overwogen, heeft Lilly terecht aangevoerd dat het daarbij door Sandoz gehanteerde uitgangspunt dat de combinatietherapie van pemetrexed en foliumzuur tot de stand van de techniek kon worden gerekend, onjuist is. Calvert zelf maakt dat niet anders (vgl. r.o. 4.19). Sandoz heeft de op Calvert gestoelde inventiviteitsaanval ook overigens niet nader onderbouwd, zodat haar stellingen terzake als onvoldoende onderbouwd worden verworpen.
Slotsom
4.27.
Nu het vorenstaande betekent dat geen van de inventiviteitsaanvallen van Sandoz slaagt, zal haar vordering tot vernietiging van het Nederlandse deel van EP 508 worden afgewezen.
4.28.
De rechtbank komt hiermee tot een andere uitkomst dan het Bundespatentgericht in zijn uitspraak van 17 juli 2018, waarbij het Duitse deel van EP 508 is vernietigd wegens gebrek aan inventiviteit. Het Bundespatentgericht heeft zich bij zijn beslissing gebaseerd op (deels) andere (gecombineerde) prior art dan in deze procedure voorlag.13.Het debat lijkt ook op andere punten anders te zijn geweest (zo volgt uit de uitspraak bijvoorbeeld niet dat ook daar de stelling is betrokken dat het verhogen van de dosis pemetrexed leidt tot niertoxiciteit alsmede dat in het vervolg klinische fase II-onderzoek van pemetrexed geen foliumzuur werd toegediend).
Proceskosten
4.29.
Sandoz zal als de in het ongelijk gestelde partij worden veroordeeld in de proceskosten, die aan de zijde van Lilly, in overeenstemming met de door partijen gemaakte afspraak, worden begroot op € 300.000,-. De gevorderde wettelijke rente en uitvoerbaar bij voorraadverklaring zullen als onweersproken worden toegewezen als na te melden.
5. Beslissing
De rechtbank
5.1.
wijst de vordering af;
5.2.
veroordeelt Sandoz in de proceskosten, aan de zijde van Lilly tot op heden begroot op € 300.000,-, te vermeerderen met de wettelijke rente met ingang van 14 dagen na betekening van dit vonnis tot de dag van volledige betaling;
5.3.
verklaart dit vonnis wat betreft de proceskostenveroordeling uitvoerbaar bij voorraad.
Dit vonnis is gewezen door mr. J.Th. van Walderveen, mr. M. Knijff en mr. C.T. Aalbers en in het openbaar uitgesproken op 16 januari 2019.
Voetnoten
Voetnoten Uitspraak 16‑01‑2019
ECLI:DE:BPatG:2018:170718U3Ni23.16EP.0
Onderstreping niet door rechtbank aangebracht
Wetboek van Burgerlijke Rechtsvordering
Verordening (EU) 1215/2012 van het Europees Parlement en de Raad van 12 december 2012 betreffende de rechterlijke bevoegdheid, de erkenning en de tenuitvoerlegging van beslissingen in burgerlijke en handelszaken
HR 10 maart 2017, ECLI:NL:HR:2017:404
In conclusie 2 worden naast foliumzuur ook andere folaat-vormen geclaimd maar in navolging van Lilly zal ook de rechtbank slechts spreken van foliumzuur.
De rechtbank begrijpt dat Hammond I en Hammond II zien op een verschillend stadium van dezelfde studie, waarbij het ten tijde van Hammond I nog ging om 21 patiënten en ten tijde van Hammond II om 33 patiënten.In de Hammond-studie wordt geconcludeerd dat toediening van foliumzuur hogere doseringen pemetrexed mogelijk lijkt te maken, waarbij Hammond II specifiek de relatie met verbetering van de toxiciteit legt: “FA supplementation appears to permit MTA dose escalation by ameliorating toxicity”.
Verklaring van Prof. H.J. Calvert van 5 januari 2018 (Calvert II, GP19) nr. 7
A.A. Adjei, ‘A review of the pharmacology and clinical activity of new chemotherapy agents for the treatment of colorectal cancer’, J. Clin Pharmacol, 1999, 48, pp. 265-277, overgelegd door Sandoz als productie EP19.
C. Cripps et al., ‘Phase II study of first-line LY231514 (multi-targeted antifolate) in patients with locally advanced or metastatic colorectal cancer: An NCIC Clinical Trials Group Study’, Annals of Oncology, 1999, 10, pp. 1175-1179, overgelegd door Sandoz als productie EP20.
Een publicatie van S. Laohavinij e.a. in ‘Investigational New Drugs’ (14: 325-335, 1996) met de titel ‘A Phase I clinical study of the antipurine antifolate lometrexol (DDATHF) given with oral folic acid’ (overgelegd door Lilly als GP07 - Annex 3).
Zo is het onder meer uitgegaan van Niyikiza, waar Sandoz in deze procedure juist van is weggebleven, zie pleitnota Eli Lilly, randnummer 4.2