Verordening (EG) Nr. 726/2004 van het Europees Parlement en de Raad van 31 maart 2004 tot vaststelling van communautaire procedures voor het verlenen van vergunningen en het toezicht op geneesmiddelen voor menselijk en diergeneeskundig gebruik en tot oprichting van een Europees Geneesmiddelenbureau.
Hof Den Haag, 27-10-2020, nr. 200.261.833/01
ECLI:NL:GHDHA:2020:2052, Hoger beroep: (Gedeeltelijke) vernietiging en zelf afgedaan
- Instantie
Hof Den Haag
- Datum
27-10-2020
- Zaaknummer
200.261.833/01
- Vakgebied(en)
Civiel recht algemeen (V)
- Brondocumenten en formele relaties
ECLI:NL:GHDHA:2020:2052, Uitspraak, Hof Den Haag, 27‑10‑2020; (Hoger beroep)
Eerste aanleg: ECLI:NL:RBDHA:2019:6107, (Gedeeltelijke) vernietiging en zelf afgedaan
- Vindplaatsen
BIE 2020-6, nr. 22 met annotatie van J.H.J. den Hartog
Uitspraak 27‑10‑2020
Inhoudsindicatie
Octrooirecht; equivalentie; inventiviteit
Partij(en)
GERECHTSHOF DEN HAAG
Afdeling Civiel recht
Zaaknummer : 200.261.833/01
Zaaknummer rechtbank : C/09/541424/ HA ZA 17-1097
arrest van 27 oktober 2020
inzake
Eli Lilly and Company,
gevestigd te Indianapolis, Indiana, Verenigde Staten van Amerika,
appellante in principaal beroep,
geïntimeerde in incidenteel beroep,
hierna te noemen: Lilly,
advocaat: mr. K.A.J. Bisschop te Amsterdam,
tegen
Fresenius Kabi Nederland B.V.,
gevestigd te 's-Hertogenbosch,
geïntimeerde in principaal beroep,
appellante in incidenteel beroep,
hierna te noemen: Fresenius,
advocaat: mr. P.L. Reeskamp te Amsterdam.
1. Het geding
1.1.
Het hof heeft kennisgenomen van de volgende processtukken:
- het dossier van de procedure in eerste aanleg;
- de dagvaarding in hoger beroep van 19 juni 2019;
- de memorie van grieven tevens houdende vermeerdering van eis (met producties);
- de memorie van antwoord tevens memorie van grieven in incidenteel appel (met producties);
- de memorie van antwoord in incidenteel appel (met producties);
- de akte houdende overlegging aanvullende producties tevens akte houdende wijziging van
eis van Lilly met producties 79 tot en met 89;
- de akte houdende aanvullende producties van Fresenius met producties 44 tot en met 52;
- de akte houdende aanvullende productie van Lilly met productie 90;
- het bericht van de advocaat van Lilly dat partijen overeenstemming hebben bereikt over de omvang van de proceskosten in hoger beroep; en
- de mondelinge behandeling van 20 januari 2020.
1.2.
Naar aanleiding van een verzoek van Fresenius heeft het hof beslist de voor partijen bij de mondelinge behandeling beschikbare pleittijd te verruimen van de voor octrooizaken gebruikelijke 45 minuten in eerste termijn voor elke zijde, tot 60 minuten in eerste termijn voor elke zijde. Verzoeken van Fresenius om verdere verlenging van de pleittijd heeft het hof afgewezen.
1.3.
Arrest is nader bepaald op heden.
2. De feiten
2.1.
De door de rechtbank in het vonnis van 19 juni 2019 vastgestelde feiten zijn niet in geschil. Ook het hof zal uitgaan van die feiten, waarbij het overzicht van de rechtspraak is aangevuld met recente uitspraken. Het gaat in deze zaak om het volgende.
Pemetrexed, Lilly en Alimta®
2.2.
Pemetrexed is een antifolaat. Antifolaten zijn zogenoemde antineoplastische middelen. Dat wil zeggen dat zij de vorming van (kanker)gezwellen tegengaan. Antifolaten hebben niet alleen (een remmende) invloed op de groei van snelgroeiende kankercellen, maar ook op de groei van gezonde cellen. Hierdoor kan de behandeling met een antifolaat ernstige bijwerkingen (toxiciteit) meebrengen.
2.3.
De stof pemetrexed is (door de aanwezigheid van twee -CO2H groepen) een vrij zuur (diacide of dizuur) (hierna: pemetrexed dizuur) dat de volgende moleculaire structuur heeft:
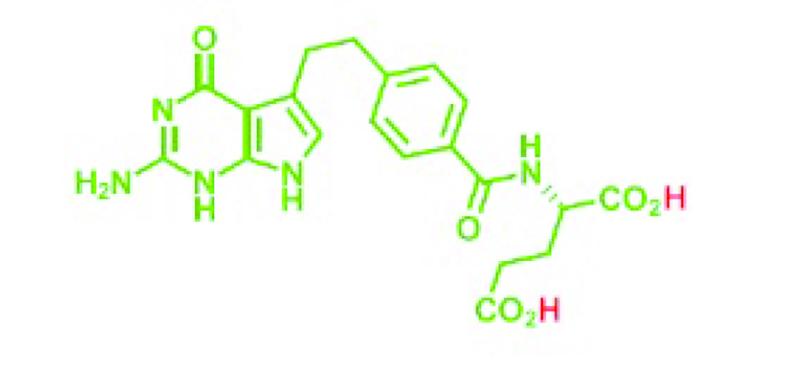
Het CAS (Chemical Abstract Service) nummer van pemetrexed dizuur is 137281-23-3.
2.4.
Wanneer pemetrexed dizuur in een waterige oplossing wordt gebracht, worden de met rood aangegeven waterstofatomen als positief geladen ionen van de rest van het molecuul gescheiden, dat dan een negatief geladen ion is (ook wel: anion). Alleen het anion is verantwoordelijk voor de werkzaamheid (en toxiciteit) van het antifolaat.
2.5.
Lilly is onderdeel van het Lilly-concern dat actief is op het gebied van onderzoek, ontwikkeling en verhandeling van nieuwe geneesmiddelen.
2.6.
Lilly brengt het pemetrexed dinatrium (in het Engels: disodium; hierna worden beide termen gebruikt) bevattende geneesmiddel Alimta® op de markt, dat geïndiceerd is voor de behandeling van bepaalde longkankers (tumorgroei).
2.7.
Alimta® heeft de vorm van een gevriesdroogd poeder voor concentraat voor oplossing voor intraveneuze infusie. Voor de formulering zijn de hulpstoffen mannitol, zoutzuur en natriumhydroxide gebruikt. In de ‘Samenvatting van de Productkenmerken’ (hierna in de Engelse afkorting: SmPC) van Alimta® staat dat het middel verdund dient te worden in een fysiologische zoutoplossing ten behoeve van infusie. Alimta® dient te worden toegediend in combinatie met vitamine B12 en foliumzuur.
2.8.
De moleculaire structuur van Alimta® is gelijk aan die van pemetrexed dizuur, met dien verstande dat pemetrexed dinatrium in plaats van de twee -CO2H groepen (zie 2.3) twee -CO2Na groepen heeft. Door de natriumionen wordt een zoutvorm van pemetrexed gevormd. De structuurformule ziet er als volgt uit:
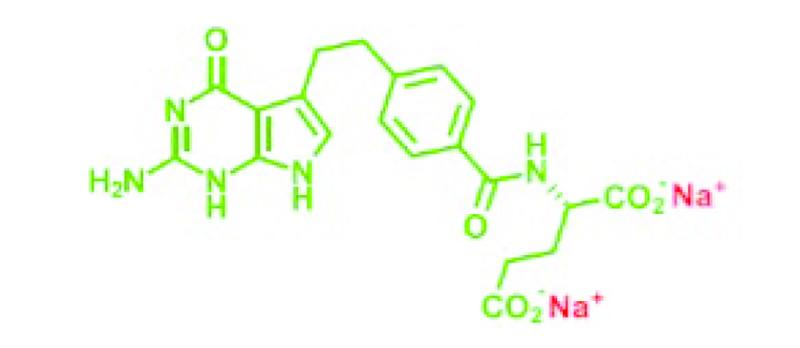
Het CAS nummer van pemetrexed dinatrium is 150399-23-8.
2.9.
Wanneer Alimta® ten behoeve van intraveneuze infusie in een waterige oplossing wordt gebracht, worden de met rood aangegeven natriumatomen als kationen van de rest van het molecuul gescheiden en resteert het (groen gekleurde) negatief geladen pemetrexed anion. Ook hier is alleen het anion verantwoordelijk voor de werkzaamheid (en toxiciteit) van het antifolaat.
2.10.
Het is niet mogelijk een toedieningsvorm van pemetrexed te vervaardigen die alleen bestaat uit het anion; er kan alleen een neutrale stof worden gehanteerd en dat impliceert de aanwezigheid van een kation (een positief geladen deeltje, waarmee een zout wordt gevormd) of waterstof (waarmee het dizuur wordt gevormd).
2.11.
Het antifolaat pemetrexed, dat wil zeggen zowel het dizuur als de farmaceutisch aanvaardbare zouten van pemetrexed zoals het dinatriumzout, werd aanvankelijk beschermd door EP 0 432 677 (hierna: EP 677) waarvan Lilly (mede)houdster was. EP 677 is het basisoctrooi voor Aanvullend Beschermingscertificaat 300181 voor ‘pemetrexed, desgewenst in de vorm van een farmaceutisch aanvaardbaar zout’. Het certificaat was van kracht tot en met 9 december 2015.
Het octrooi (EP 508)
2.12.
Lilly is houdster van Europees octrooi 1 313 508 B1 (hierna: EP 508), met de titel ‘Combination containing an antifolate and methylmalonic acid lowering agent’ (in de Nederlandse vertaling ‘Samenstelling welke een antifolaat en methylmallonzuur verlagend middel bevat’). EP 508 is verleend op 18 april 2007 op een internationale aanvrage van 15 juni 2001, met nummer PCT/US2001/014860 (hierna: de PCT-aanvrage of de oorspronkelijke aanvrage) gepubliceerd als WO 02/02093 A2 (hierna: WO 093). Daarbij is een beroep op prioriteit gedaan van US 215310 P van 30 juni 2000, US 235859 P van 27 september 2000 en US 284448 P van 18 april 2001.
2.13.
EP 508 bevat twee onafhankelijke conclusies (1 en 12) en daarvan afhankelijke conclusies (2 t/m 11 en 13 t/m 14). In de oorspronkelijke Engelse taal luiden die als volgt:
1. Use of pemetrexed disodium in the manufacture of a medicament for use in combination therapy for inhibiting tumor growth in mammals wherein said medicament is to be administered in combination with vitamin B12 or a pharmaceutical derivative thereof, said pharmaceutical derivative of vitamin B12 being hydroxocobalamin, cyano-10-chlorocobalamin, aquocobalamin perchlorate, aquo-10-chlorocobalamin perchlorate, azidocobalamin, chlorocobalamin or cobalamin.
2. Use according to claim 1 wherein said medicament is to be administered in combination with vitamin B12 or a pharmaceutical derivative thereof, said pharmaceutical derivative of vitamin B12 being hydroxocobalamin, cyano-10-chlorocobalamin, aquocobalamin perchlorate, aquo-10-chlorocobalamin perchlorate, azidocobalamin, chlorocobalamin or cobalamin, and a folic binding protein binding agent selected from folic acid, (6R)-5-methyl-5,6,7,8-tetrahydrofolic acid and (6R)-5-forinyl-5,6,7,8-tetrahydrofohc acid or a physiologically available salt or ester thereof.
3. Use according to claim 2 wherein the folic binding protein binding agent is folic acid.
4. Use according to any one of claims 1 to 3 wherein the vitamin B12 or pharmaceutical derivative thereof is vitamin B12, cobalamin or chlorocobalamin.
5. Use according to any one of claims 1 to 3 wherein the vitamin B12 or pharmaceutical derivative thereof is selected from vitamin B12 or hydroxocobalamin.
6. Use according to any one of claims 1 to 5 wherein the medicament, the vitamin B12 or pharmaceutical derivative thereof and optionally the folic binding protein binding agent are to be administered simultaneously, separately or sequentially.
7. Use according to any one of claims 1 to 6 wherein the medicament is to be administered after administration of the vitamin B12 or pharmaceutical derivative thereof.
8. Use according to any one of claims 1 to 7 wherein the medicament is to be administered after the folic binding protein binding agent.
9. Use according to any one of claims 2 to 8 wherein the medicament is to be administered after pretreatment with the vitamin B12 or pharmaceutical derivative thereof followed by folic acid.
10. Use according to any one of claims 1 to 9 wherein vitamin B12 or pharmaceutical derivative thereof is to be administered as an intramuscular injection.
11. Use according to any one of claims 2 to 10 wherein the folic binding protein binding agent is to be administered orally as a tablet.
12. A product containing pemetrexed disodium, vitamin B12 or a pharmaceutical derivative thereof said pharmaceutical derivative of vitamin B12 being hydroxocobalamin, cyano-10-chlorocobalamin, aquocobalamin perchlorate, aquo-10-chlorocobalamin perchlorate, azidocobalamin, chlorocobalamin or cobalamin, and, optionally, a folic binding protein binding agent selected from the group consisting of folic acid, (6R)-5-methyl-5,6,7,8-tetrahydrofolic acid and (6R)-5-formyl-5,6,7,8-tetrahydrofolic acid, or a physiologically available salt or ester thereof, as a combined preparation for the simultaneous, separate or sequential use in inhibiting tumor growth.
13. A product according to claim 12 wherein the vitamin B12 or pharmaceutical derivative thereof is vitamin B12, co-balamin or chlorocobalamin and, if present, the folic binding protein binding agent is folic acid.
14. A product according to claim 12 wherein the vitamin B12 or pharmaceutical derivative thereof is vitamin B12 or hydroxocobalamin and, if present, the folic binding protein binding agent is folic acid.
2.14.
In de onbestreden Nederlandse vertaling luiden de conclusies van EP 508 als volgt:
1. Toepassing van pemetrexed dinatrium bij het bereiden van een geneesmiddel voor toepassing bij combinatietherapie voor het remmen van tumorgroei bij zoogdieren, waarbij het geneesmiddel dient te worden toegediend in combinatie met vitamine B12 of een farmaceutisch derivaat daarvan, waarbij het farmaceutisch derivaat van vitamine B12 hydroxocobalamine, cyaan-10-chloorcobalamine, aquocobalamine perchloraat, aquo-10-chloorcobalamine perchloraat, azidocobalamine, chloorcobalamine of cobalamine is.
2. Toepassing volgens conclusie 1, waarbij het geneesmiddel dient te worden toegediend in combinatie met vitamine B12 of een farmaceutisch derivaat daarvan, waarbij het farmaceutisch derivaat van vitamine B12 hydroxocobalamine, cyaan-10-chloorcobalamine, aquocobalamine perchloraat, aquo-10-chloorcobalamine perchloraat, azidocobalamine, chloorcobalamine of cobalamine is, en een foliumbindend eiwit bindend middel gekozen uit foliumzuur, (6R)-5-methyl-5,6,7,8-tetrahydrofoliumzuur en (6R)-5-formyl-5,6,7,8-tetrahydrofoliumzuur of een fysiologisch aanvaardbaar zout of ester daarvan.
3. Toepassing volgens conclusie 2, waarbij het foliumbindende eiwitbindende middel foliumzuur is.
4. Toepassing volgens een of meer van de conclusies 1-3, waarbij het vitamine B12 of het farmaceutische derivaat daarvan vitamine B12, cobalamine of chloorcobalamine is.
5. Toepassing volgens een of meer van de conclusies 1-3, waarbij het vitamine B12 of het farmaceutische derivaat daarvan is gekozen uit vitamine B12 of hydroxocobalamine.
6. Toepassing volgens een of meer van de conclusies 1-5, waarbij het geneesmiddel, het vitamine B12 of het farmaceutische derivaat daarvan en eventueel het foliumbindende eiwitbindende middel tegelijkertijd, afzonderlijk of achtereenvolgens dienen te worden toegediend.
7. Toepassing volgens een of meer van de conclusies 1-6, waarbij het geneesmiddel dient te worden toegediend na toediening van het vitamine B12 of het farmaceutische derivaat daarvan.
8. Toepassing volgens een of meer van de conclusies 1-7, waarbij het geneesmiddel na het foliumbindende eiwitbindende middel dient te worden toegediend.
9. Toepassing volgens een of meer van de conclusies 2-8, waarbij het geneesmiddel dient te worden toegediend na voorbehandeling met het vitamine B12 of het farmaceutische derivaat daarvan gevolgd door foliumzuur.
10. Toepassing volgens een of meer van de conclusies 1-9, waarbij het vitamine B12 of het farmaceutische derivaat daarvan als een intramusculaire inspuiting dient te worden toegediend.
11. Toepassing volgens een of meer van de conclusies 2-10, waarbij het foliumbindend eiwitbindend middel als een tablet oraal dient te worden toegediend.
12. Product dat pemetrexed dinatrium, vitamine B12 of een farmaceutisch derivaat daarvan, waarbij het farmaceutisch derivaat van vitamine B12 hydroxocobalamine, cyaan-10-chloorcobalamine, aquocobalamine perchloraat, aquo-10-chloorcobalamine perchloraat, azidocobalamine, chloorcobalamine of cobalamine is, en eventueel een foliumbindend eiwitbindend middel gekozen uit de groep bestaande uit foliumzuur, (6R)-5-methyl-5,6,7,8-tetrahydrofoliumzuur en (6R)-5-formyl-5,6,7,8-tetrahydrofoliumzuur, of een fysiologisch aanvaardbaar zout of ester daarvan, als een gecombineerd preparaat voor gelijktijdige, afzonderlijk of achtereenvolgend gebruik bij remmen van tumorgroei, bevat.
13. Product volgens conclusie 12, waarbij het vitamine B12 of het farmaceutische derivaat daarvan vitamine B12, cobalamine of chloorcobalamine is en, indien aanwezig, het foliumbindende eiwitbindende middel foliumzuur is.
14. Product volgens conclusie 12, waarbij het vitamine B12 of farmaceutisch derivaat daarvan vitamine B12 of hydroxocobalamine is en, indien aanwezig, het foliumbindend eiwitbindend middel foliumzuur is.
2.15.
In de beschrijving van het octrooi is - voor zover hier van belang - het volgende opgenomen:
[0001] Potentially, life-threatening toxicity remains a major limitation to the optimal administration of antifolates. (see, generally, Antifolate Drugs in Cancer Therapy, edited by Jackman, Ann L., Humana Press, Totowa, NJ, 1999.) In some cases, a supportive intervention is routinely used to permit safe, maximal dosing. For example, steroids, such as dexamethone, can be used to prevent the formation of skin rashes caused by the antifolate. (Antifolate, pg 197.) [0002] Antifolates represent one of the most thoroughly studied classes of antineoplastic agents, with aminopterin initially demonstrating clinical activity approximately 50 years ago. Methotrexate was developed shortly thereafter, and today is a standard component of effective chemotherapeutic regimens for malignancies such as lymphoma, breast cancer, and head and neck cancer. (…) Antifolates inhibit one or several key folate-requiring enzymes of the thymidine and purine biosynthetic pathways, in particular, thymidylate synthase (TS), dihydrofolate reductase (DHFR), and glycinamide ribonucleotide formyltransferase (GARFT), by competing with reduced folates for binding sites of these enzymes. (…) Several antifolate drugs are currently in development. Examples of antifolates that have thymidylate synthase inhibiting ("TSI") characteristics include 5-fluorouracil and Tomudex®. An example of an antifolate that has dihydrofolate reductase inhibiting ("DHFRI'') characteristic is Methotrexate®. An example of an antifolate that has glycinamide ribonucleotide formyltransferase inhibiting (''GARFTI") characteristics is Lometrexol. Many of these antifolate drugs inhibit more than one biosynthetic pathway. For example Lometrexol is also an inhibitor of dihydrofolate reductase and pemetrexed disodium (Alimta®, Lilly and Company, Indianapolis, IN) has demonstrated thymidylate synthase, dihydrofolate reductase, and glycinamide ribonucleotide formyltransferase inhibition. [0003] A limitation to the development of these drugs is that the cytotoxic activity and subsequent effectiveness of antifolates may be associated with substantial toxicity for some patients. Additionally antifolates as a class are associated with sporadic severe mylosuppression with gastrointestinal toxicity which, though infrequent, carries a high risk of mortality. The inability to control these toxicities led to the abandonment of clinical development of some antifolates and has complicated the clinical development of others, such as Lometrexol and raltitrexed. (…) [0004] Initially, folic acid was used as a treatment for toxicities associated with GARFTI see, e.g. U.S. Pat. No. 5,217,974. Folic acid has been shown to lower homocysteine levels (…). The role of folic acid in modulating the toxicity and efficacy of the multitargeted antifolate LY 231514 (pemetrexed) was discussed in Worzalla et al. (Anticancer Research 18: 3235-3240 (1998) Worzalla JF, Chuan S and Schultz RM). EP-A-0546870 relates to nutrient compositions which are intended to prevent and cure infectious diseases and which are intended to be administered to patients being administered with anticancer drugs to prevent and treat infectious diseases due to immunosuppression induced by the anticancer drug therapy. The compositions of EP-A-0546870 are characterized in that they comprise a certain amount of retinoid compound(s) such as vitamin A which is indicated as being responsible for the immunoreactivity. Effects of vitamin B12, folate and vitamin B6 supplements in elderly people with normal serum vitamin concentrations (Lancet 1995; 346:85-89), and homocysteine levels have been shown to be a predictor of cytotoxic events related to the use of GARFT inhibitors, see e.g. U.S. Pat. No. 5,217,974. However, even with this treatment, cytotoxic activity of GARFT inhibitors and antifolates as a class remains a serious concern in the development of antifolates as pharmaceutical drugs. The ability to lower cytotoxic activity would represent an important advance in the use of these agents. [0005] Surprisingly and unexpectedly, we have now discovered that certain toxic effects such as mortality and nonhematologic events, such as skin rashes and fatigue, caused by antifolates, as a class, can be significantly reduced by the presence of a methylmalonic acid lowering agent as vitamin B12, without adverse [sic] adversely affecting therapeutic efficacy. The present invention thus generally relates to a use in the manufacture of a medicament for improving the therapeutic utility of antifolate drugs by administering to the host undergoing treatment with a methylmalonic acid lowering agent as vitamin B12. We have discovered that increased levels of methylmalonic acid is a predictor of toxic events in patients that receive an antifolate drug and that treatment for the increased methylmalonic acid, such as treatment with vitamin B12, reduces mortality and nonhematologic events, such as skin rashes and fatigue events previously associated with the antifolate drugs. Thus, the present invention generally relates to a use in the manufacture of a medicament for reducing the toxicity associated with the administration of an antifolate to a mammal by administering to said mammal an effective amount of said antifolate in combination with a methylmalonic acid lowering agent as vitamin B12. [0006] Additionally, we have discovered that the combination of a methylmalonic acid lowering agent as vitamin B12 and folic acid synergistically reduces the toxic events associated with the administration of antifolate drugs. Although, the treatment and prevention of cardiovascular disease with folic acid in combination with vitamin B12 is known, the use of the combination for the treatment of toxicity associated with the administration of antifolate drugs was unknown heretofore. (…)
[0010] The invention specifically provides the use of the antifolate pemetrexed disodium in the manufacture of a medicament for use in combination therapy for inhibiting tumor growth in mammals wherein said medicament is to be administered in combination with a methylmalonic acid lowering agent selected from vitamin B12 and pharmaceutical derivatives thereof.
[0011] The invention also specifically provides the use of the antifolate pemetrexed disodium in the manufacture of a medicament for use in combination therapy for inhibiting tumor growth in mammals wherein said medicament is to be administered in combination with a methylmalonic acid lowering agent selected from vitamin B12 and pharmaceutical derivatives thereof and a FBP binding agent selected from folic acid, (6R)-5-methyl-5,6,7,8-tetrahydrofolic acid and (6R)-5-formyl-5,6,7,8-tetrahydrofolic acid or a physiologically available salt or ester thereof.
(…)
[0016] The current invention concerns the discovery that administration of a methylmalonic acid lowering agent such as vitamin B12 or a pharmaceutical derivative thereof, in combination with an antifolate drug such as pemetrexed disodium reduces the toxicity of the said antifolate drug.
(…)[0022] The terms "antifolate" and ''antifolate drug'' generally refer to a chemical compound which inhibits at least one key folate-requiring enzyme of the thymidine or purine biosynthetic pathways, preferably thymidylate synthase ("TS"), dihydrofolate reductase ("DHFR"), or glycinamide ribonucleotide formyltransferase ("GARFT"), by competing with reduced folates for binding sites of these enzymes. The "antifolate" or ''antifolate drug" for use in this invention is Pemetrexed Disodium (ALIMTA®), as manufactured by Lilly & Co.
2.16.
Bij brief van 8 januari 2003 heeft de in-house octrooigemachtigde van Lilly, dr. I.J. Burnside (hierna: Burnside ) het Europees Octrooibureau (EOB) verzocht de PCT-aanvrage in behandeling te nemen op basis van de documentatie aan de hand waarvan de International Preliminary Examination is uitgevoerd. Daarbij heeft hij de oorspronkelijke conclusies uit de PCT-aanvrage vervangen door een nieuwe set conclusies (1 tot en met 17), waarvan nieuwe conclusie 1 luidde:
1. Use of a methylmalonic acid lowering agent in the preparation of a medicament useful in lowering the mammalian toxicity associated with an antifolate, and the medicament is administered in combination with an antifolate.
2.17.
Bij Communication van 9 maart 2004 heeft de examiner van het EOB onder meer aangegeven dat de materie van de nieuwe conclusies 1 t/m 9, 11 t/m 14 en 16 nieuwheid ontbeert in het licht van de documenten D1 (EP 0 546 870) en D2 (US 5 405 839) omdat - kort gezegd - het gebruik van een antifolaat, namelijk 5-fluorouracil en methotrexaat, in combinatie met vitamine B12 (een methylmalonic acid lowering agent) daarin al was geopenbaard.
2.18.
Bij fax van 23 december 2004 heeft Burnside opnieuw een nieuwe set conclusies ingediend en daarbij het EOB als volgt bericht:
In reply to the Communication pursuant to Article 96(2) EPC dated 9 March 2004 I attach new claims 1-16 to replace claims 1-17 previously on file. I also attach amended description pages 2, 2a, 3, 4, 4a and 6 to replace description pages 2 to 4 and 6 presently on file.
Amendments
The Applicant, having reviewed the scope of the application and in order to expedite the application proceeding to grant, has elected to amend the claims so as to more closely reflect the specific examples provided. The present amendments are made without prejudice to the Applicant’s right to obtain protection for other patentable subject matter in one or more divisional applications.
Claims 1-12 have been refocused on the use of the antifolate compound pemetrexed. Basis can be found at page 2 line 6-7 and page 6 line 16 of the application as filed.
The term “methylmalonic acid lowering agent” has been replaced by “vitamin B12 or a pharmaceutical derivative thereof”. Basis for this can be found page 6 lines 19-21 and page 7 line 5 of the application as filed.
(…)
Novelty
There is no disclosure in any of documents D1-D3 of the invention as presently claimed. In particular D1 and D2 do not relate to pemetrexed. D3 does not disclose or relate in any way to the use of vitamin B12.
(…)
2.19.
Conclusies 1, 4, 13 en 16 van de door Burnside ingediende gewijzigde conclusieset luidden voor zover hier van belang als volgt:
1. Use of pemetrexed in the manufacture of a medicament for use in combination therapy for inhibiting tumor growth in mammals wherein said medicament is to be administered in combination with vitamin B12 or a pharmaceutical derivative thereof.
4. Use according to any one of claims 1 to 3 wherein pemetrexed is pemetrexed disodium.
13. A product containing pemetrexed, vitamin B12 of a pharmaceutical derivative thereof and, optionally, a folic binding protein agent (…) as a combined preparation for the simultaneous, separate or sequential use in inhibiting tumor growth.
16. A product according to any one of claims 13 to 15 wherein pemetrexed is pemetrexed disodium.
2.20.
Bij Communication van 17 mei 2005 heeft het EOB hierop voor zover relevant als volgt gereageerd:
Amendments (Art. 123(2) EPC)
The amendments filed with letter 23.12.2004 do not comply with the requirements of Art. 123 (2) EPC in so far as they introduce subject matter beyond the content of the originally filed documents.
The amendments concerned are the following:
The subject matter of claims 1-16 and description pages 4, line 18- page 4a.
The subject matter of present claims 1 reading “use of pemetrexed…” and claim 13 “a product containing pemetrexed…” do not find base in the application documents as filed. The term “pemetrexed” in the wording of these claims and the corresponding passages on amended description is certainly a distinct compound (CAS Registry number 137281-23-3) of the “pemetrexed disodium” (CAS Registry number 150399-23-8) expressed on original document description page 2, line 6 and page 6, line 16. Said amendment beyond the content of the original document is therefore not allowable (Art. 123 (2) EPC).
Dependent claims 2-12, 14-16 in so far as related to “pemetrexed” are consequently not allowable according to Art. 123(2) EPC.
2.21.
Het door het EOB genoemde ‘original document’ is de oorspronkelijkePCT-aanvrage WO 093, waarvan regel 31 op pagina 1 en regels 1-9 op pagina 2 als volgt luiden:

Regels 6-16 op pagina 6 luiden als volgt:

2.22.
Bij brief van 8 maart 2006 heeft Burnside de thans geldende conclusies ingediend en de examiner onder meer het volgende laten weten:
I refer to the Communication pursuant to Article 96(2) EPC dated 17 May 2005 and enclose new pages 3, 4, 4a, 5, 6, 7, 8, 10, 11, 11a, 13, 14, 15 and 16 and new Claims 1-14 to replace pages 3-8, 10, 11 and 13-16 and Claims 1-16 presently on file.
Amendments
The Claims have been amended to refer to the preferred embodiment, the use of pemetrexed disodium (ALIMTA®) as manufactured by Lilly and Company, as the antifolate drug. The Claims have also been amended to incorporate the list of vitamin B12 derivatives set out on page 7 lines 6-7 of the application as filed.
(…)
The description has been amended in conformity with the new Claims. The passages on pages 3 and 4 have been edited. The Applicant seeks to draw a distinction between subject matter which is relevant to the invention which is indicated as being that to which “the present invention generally relates” and “the subject matter provided by the invention” which is the subject matter claimed. In particular it is highlighted that the reduction of toxicity of the anti-folate in the use of the combination therapy is relevant to the invention and should be retained.
(…)
For the Examiner’s ease of reference I enclose a copy of previous description pages 3-8, 10, 11 and 13-16 showing the changes in manuscript.
2.23.
De bijlage bij voornoemde brief bevat een kopie van de beschrijving uit de PCT-aanvrage met daarin door Burnside handgeschreven onder meer de volgende wijzigingen doorgevoerd (nu: paragraaf [0022] van EP 508):

2.24.
De Communication van het EOB van 4 oktober 2006 luidt als volgt:
Communication under Rule 51(4) EPC
You are informed that the Examining Division intends to grant a European patent on the basis of the above application with the text and drawings as indicated below:
(…)
Comments
(…)
Page 5, lines 22, 28, 32; page 6, line 5; page 9, lines 4, 16, 30: introduction of “pemetrexed disodium” to adapt description to claims on file (Art. 84 EPC).
Page 4, lines 24 and 25, introduction of “disodium” after “pemetrexed” to adapt description to claims on file (Art. 84 EPC)
De examiner heeft de aanpassingen zelf handgeschreven in het zogenaamde ‘Druckexemplar’ aangebracht.
2.25.
Bij brief van 2 februari 2007 heeft Burnside namens Lilly bericht deze aanpassingen in de beschrijving te accepteren:
I refer to the Communication under Rule 51(4) EPC dated 4 October 2006 and approve the text specified therein subject to a minor formal change to claim 11.
2.26.
Lilly is ook houdster van Europees octrooi EP 1 265 612 B1 (hierna: EP 612), dat op een aanvrage daartoe van 23 januari 2001 is verleend op 26 mei 2004 voor een ‘Pharmaceutical composition comprising pemetrexed together with monothioglycerol,
L-cystein or thioglycolic acid’. In paragraaf [0020] van de beschrijving van dit octrooi wordt vermeld:
As used herein, the term “pemetrexed” refers to the stable salts, acids and free base forms thereof. The term includes, for example, the free acid, the pharmaceutically acceptable alkali metal, alkaline earth metal, non-toxic metal, ammonium, and substituted ammonium salts, such as for example, the sodium, potassium, lithium, calcium, magnesium, aluminium, zinc, ammonium, trimethylammonium, triethylammonium, monoethanolammonium, triethanolammonium, pyridinium and substituted pyridinum salts. The substituted ammonium salts are one especially preferred group of salts.
Burnside was ook bij de verlening van dit octrooi betrokken als de octrooigemachtigde van Lilly.
Fresenius en Pemetrexed Fresenius
2.27.
Fresenius maakt onderdeel uit van het Fresenius concern. Zij is actief op de geneesmiddelenmarkt en verhandelt wereldwijd diverse generieke geneesmiddelen voor intraveneuze toediening.
2.28.
Eén van de producten van het Fresenius concern is ‘Pemetrexed Fresenius Kabi’ (hierna: Pemetrexed Fresenius) dat geïndiceerd is voor maligne mesothelioom van de pleura en niet kleincellig longcarcinoom.
2.29.
De SmPC van dit generieke product vermeldt dat Fresenius de vertegenwoordiger van de marktvergunninghouder Fresenius Kabi Oncology Plc. in Nederland is. Deze laatste heeft de marktvergunning verkregen door toepassing van de gecentraliseerde procedure als bedoeld in artikel 3 lid 3 van Verordening EG 726/2004.1.Daarbij is als referentieproduct verwezen naar Lilly’s product Alimta®.
2.30.
Pemetrexed Fresenius heeft net als Alimta® de farmaceutische vorm van een (gevriesdroogd) poeder voor concentraat voor oplossing voor intraveneuze infusie. Voor de formulering zijn dezelfde hulpstoffen gebruikt als voor Alimta®, met dien verstande dat in plaats van natriumhydroxide de hulpstof tromethamine wordt gebruikt. In de SmPC van Pemetrexed Fresenius is onder rubriek 4.2 (dosering en wijze van toediening) het volgende opgenomen:
Om de toxiciteit te verminderen moeten patiënten die worden behandeld met pemetrexed tevens vitaminesupplementen krijgen (zie rubriek 4.4). Patiënten moeten dagelijks oraal foliumzuur of een multivitaminepreparaat met foliumzuur (350 tot 1000 microgram) innemen. Gedurende de zeven dagen voorafgaand aan de eerste dosis pemetrexed moeten ten minste vijf doses foliumzuur worden ingenomen en de inname ervan moet gedurende de gehele behandelingsperiode en gedurende 21 dagen na de laatste dosis pemetrexed worden voortgezet. Patiënten moeten tevens een intramusculaire injectie vitamine B12 (1000 microgram) krijgen toegediend in de week voorafgaand aan de eerste dosis pemetrexed en daarna eenmaal per drie cycli. Daaropvolgende vitamine-B12-injecties kunnen op dezelfde dag als pemetrexed worden toegediend.
In de SmPC is ook opgenomen dat het middel in poedervorm verdund dient te worden in een glucoseoplossing ten behoeve van infusie.
2.31.
In Pemetrexed Fresenius zijn de twee waterstofatomen zoals die voorkomen in pemetrexed dizuur (zie opnieuw 2.3) vervangen door tromethaminegroepen (hierna ook: het pemetrexed tromethamine). De moleculaire structuur van Pemetrexed Fresenius is onderstaand weergegeven, waarbij rood gemarkeerd zijn de tromethaminegroepen die als kationen van de rest van het molecuul worden gescheiden als dat ten behoeve van infusie in een waterige oplossing wordt gebracht, waarna het (groen gekleurde) pemetrexed anion resteert.
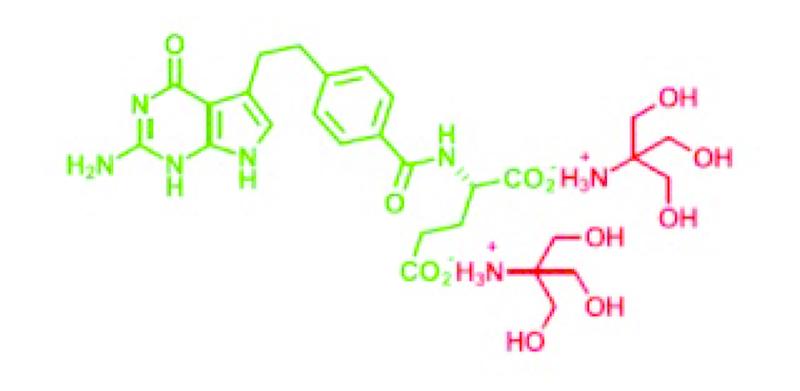
2.32.
In het European Public Assessment Report voor Pemetrexed Fresenius is onder meer het volgende opgenomen.
pagina 7:
The difference in active substance salt form between the applied product and the reference product is therefore not relevant for the clinical efficacy and safety of the ready to use infusion.
pagina 8:
The active substance in Fresenius Kabi’s Pemetrexed for Injection is pemetrexed diacid instead of pemetrexed disodium as in the originator product Alimta. Both products are intended for intravenous use and must be reconstituted and further diluted prior to use. When reconstituted and diluted for administration, the active moiety remains the same irrespective of the salt form.
pagina 11:
The excipients used in the formulation of Pemetrexed Fresenius Kabi are the same used in the reference product except sodium hydroxide, which is replaced by trometamol. Trometamol is a known buffering agent/pH adjuster and solubilizer.
pagina 12:
No bioequivalence study was deemed required as the finished product is to be administered as an aqueous solution containing the same active substance in the same concentration as the reference product.
pagina 16:
The active substance in Fresenius Kabi's Pemetrexed for Injection is Pemetrexed diacid instead of Pemetrexed disodium as in Alimta 100 mg/500 mg powder for concentrate for solution for infusion. When reconstituted and diluted for administration, the active moiety remains the same irrespective of the salt form. Accordingly, both medicinal products are considered to contain the same active substances.Trometamol is a known buffering agent/pH adjuster used in formulations available in Europe and US. It is agreed that the quantity used in Fresenius Kabi's formulation is less than the required quantity to produce pharmacological action and would not be expected to cause any adverse effects of its own. The other excipients are well known and commonly used in aqueous intravenous solution available on the European market. The existing differences in the excipients of the applied product as compared to the reference product are not expected to have any significant impact in properties with regards to bioavailability, pharmacokinetics, safety and efficacy between these products.
2.33.
Fresenius heeft haar generieke product in de doseringen 100 mg en 500 mg laten opnemen in de G-standaard van Z-index voor februari 2017, die op 17 januari 2017 is gepubliceerd.
Andere procedures
2.34.
Tussen Lilly enerzijds en Fresenius of andere aanbieders van generieke pemetrexed producten anderzijds zijn in Europa diverse procedures over (niet-)inbreuk op EP 508 gevoerd, waaronder de hierna beschreven procedures.
Nederland
2.35.
In Nederland heeft de voorzieningenrechter in de rechtbank Den Haag bij vonnis van 1 maart 2017 aan Sandoz B.V. een verbod opgelegd om generiek pemetrexed dinatrium te verhandelen (ECLI:NL:RBDHA:2017:1907). Bij vonnissen van 24 oktober 2017 heeft de voorzieningenrechter van diezelfde rechtbank ook verboden opgelegd aan Teva Nederland B.V. en Fresenius (ECLI:NL:RBDHA:2017:12045 en ECLI:NL:RBDHA:2017:12046). Deze vonnissen in kort geding zijn bekrachtigd door dit hof bij arresten van 8 mei 2018 (ECLI:NL:GHDHA:2018:1106 en ECLI:NL:GHDHA:2018:1105). Fresenius heeft cassatie ingesteld tegen het tegen haar gewezen arrest. Ambtshalve is het hof bekend dat de Hoge Raad bij arrest van 12 juni 2020 het cassatieberoep heeft verworpen (ECLI:NL:HR:2020:1036).
2.36.
Sandoz B.V. heeft een nietigheidsprocedure met betrekking tot EP 508 ingesteld bij de rechtbank Den Haag. In die procedure is op 16 januari 2019 uitspraak gedaan (ECLI:NL:RBDHA:2019:321), waarbij de vorderingen zijn afgewezen. Sandoz B.V. heeft hoger beroep ingesteld tegen die uitspraak. Op dat beroep was ten tijde van de mondelinge behandeling in deze zaak nog niet beslist.
Verenigd Koninkrijk
2.37.
Actavis UK Limited c.s. (thans Teva) heeft in 2012 een niet-inbreukprocedure aanhangig gemaakt jegens Lilly voor de High Court. Zij verzocht een verklaring voor recht dat commercialisering van bepaalde zoutvormen van pemetrexed (pemetrexed dikalium, pemetrexed dizuur en pemetrexed ditromethamine) geen inbreuk maakt op EP 508 in het Verenigd Koninkrijk, Frankrijk, Italië en Spanje. De High Court heeft zichzelf bevoegd verklaard met betrekking tot de Franse, Italiaanse en Spaanse octrooien. In zijn uitspraak van 15 mei 2014 heeft Justice Arnold (hierna: Arnold J) een verklaring van niet-inbreuk toegewezen, waarbij hij overwoog dat de door Actavis genoemde producten direct noch indirect inbreuk maken op EP 508.
2.38.
In hoger beroep heeft de Court of Appeal bij uitspraak van 25 juni 2015 (van Lord Justice Floyd met instemming van Kitchin LJ en Longmore LJ) de uitspraak van Arnold J onderschreven ten aanzien van het oordeel dat geen sprake is van directe inbreuk. De uitspraak van Arnold J is echter ten dele vernietigd met betrekking tot het oordeel over de indirecte inbreuk. Indien de door Actavis genoemde pemetrexed producten verdund worden in een saline-oplossing (met natriumchloride), is volgens de Court of Appeal sprake van indirecte inbreuk op EP 508. De vraag of ook sprake is van indirecte inbreuk wanneer wordt aangeraden dat het pemetrexed dizuur of het dikaliumzout verdund wordt in een dextroseoplossing, is terugverwezen naar de High Court.
2.39.
De UK Supreme Court (hierna: UKSC) heeft bij uitspraak van 12 juli 2017 (met leading speech van Lord Justice Neuberger) geoordeeld dat de beschermingsomvang van EP 508 zich ook uitstrekt tot andere zouten dan pemetrexed dinatrium, zodat de door Actavis genoemde pemetrexed producten directe inbreuk maken op EP 508.
Duitsland
2.40.
Lilly heeft een kort geding aanhangig gemaakt tegen Fresenius bij het Landgericht München. Bij vonnis van 29 november 2016 heeft het Landgericht inbreuk aangenomen.
2.41.
Lilly heeft ook jegens Actavis (thans: Teva) een inbreukprocedure gestart. In een uitspraak van 3 april 2014 heeft het Landgericht Düsseldorf geoordeeld dat pemetrexed dikalium (van Actavis) als equivalent directe inbreuk maakt op het Duitse deel van EP 508. In hoger beroep heeft het Oberlandesgericht Düsseldorf bij uitspraak van 5 maart 2015 geoordeeld dat de beschermingsomvang van EP 508 beperkt is tot pemetrexed dinatrium, zodat gebruik van pemetrexed dikalium geen directe inbreuk oplevert, ook niet op basis van equivalentie. In cassatie heeft het Bundesgerichtshof (hierna: BGH) bij arrest van 14 juni 2016 de zaak terugverwezen naar het Oberlandesgericht Düsseldorf omdat het BGH van oordeel was dat het Oberlandesgericht de Duitse equivalentieleer niet correct had toegepast. Vanwege een schikking tussen partijen zal er geen uitspraak komen in de terugverwezen zaak.
2.42.
Lilly heeft jegens Ratiopharm (ook onderdeel van de Teva groep) een ex parte verbod gevorderd, welk verbod op 6 april 2016 door het Landgericht München is toegewezen. Op 24 juni 2016 heeft het Landgericht München na een inter partes zitting het voorlopig verbod gehandhaafd oordelend dat Ratiopharms pemetrexed dizuur als equivalent directe inbreuk maakt op EP 508. Het Oberlandesgericht München heeft bij uitspraak van 18 mei 2017 in hoger beroep het besluit van het Landgericht München in stand gehouden.
2.43.
Bij vonnis van 18 juli 2018 heeft het Bundespatentgericht het Duitse deel van EP 508 op vordering van Hexal, Strada en Ratiopharm nietig verklaard. Lilly heeft hoger beroep ingesteld tegen het vonnis. Ten tijde van de mondelinge behandeling in deze zaak was nog niet beslist op dat beroep.
2.44.
Bij vonnis van 3 april 2019 heeft het Landgericht München het tegen Fresenius en een tegen Zentiva Pharma opgelegd inbreukverbod opgeheven. In hoger beroep heeft het Oberlandesgericht München deze beslissing in stand gelaten.
Zwitserland
2.45.
Het Bundespatentgericht heeft bij uitspraak van 9 maart 2017 een door Actavis gevorderde verklaring van niet-inbreuk voor pemetrexed producten (dikalium, ditromethamine of dizuur) toegewezen. Op 20 oktober 2017 heeft het Bundesgericht, de hoogste Zwitserse rechter, in hoger beroep de beslissing van het Bundespatentgericht vernietigd en geoordeeld dat het door Actavis op de markt gebrachte product Amtiris® (wat hetzelfde product is als Armisarte®) inbreuk maakt op EP 508. Het Bundesgericht heeft de zaak terugverwezen naar het Bundespatentgericht om te beoordelen of ook de twee producten die Actavis niet op de markt heeft gebracht, pemetrexed dikalium en pemetrexed ditromethamine als gevriesdroogd product (wat hetzelfde product is als dat van Fresenius), inbreuk maken op EP 508. Op 21 december 2017 heeft het Bundespatentgericht geoordeeld dat ook deze producten inbreuk maken op EP 508.
2.46.
Sandoz heeft een nietigheidsvordering ingesteld tegen het Zwitserse deel van EP 508. Het Bundespatentgericht heeft bij vonnis van 15 oktober 2019 geoordeeld dat EP 508 geldig is en de vordering afgewezen.
Denemarken
2.47.
Op 8 december 2017 heeft de Deense Maritieme en Commerciële rechtbank een door Lilly gevorderd voorlopig inbreukverbod tegen Fresenius Kabi toegewezen. Bij arrest van 20 december 2018 heeft de Ostre Landsret deze uitspraak bekrachtigd.
Oostenrijk
2.48.
Na eerdere afwijzing van een door Lilly verzocht ex parte verbod heeft het Handelsgericht Wien op 22 december 2017 in een inter partes kort geding een verbod aan Fresenius opgelegd. Bij uitspraak van het Oberlandesgericht Wien van 12 april 2018 is het inbreukverbod bekrachtigd. Er is een bodemzaak tussen partijen aanhangig bij het Handelsgericht Wien.
Finland
2.49.
Op 29 december 2017 heeft de Finse rechter op verzoek van Lilly een inbreukverbod tegen Actavis en Ratiopharm toegewezen.
Zweden
2.50.
Op 31 januari 2018 heeft de Tingsrät Stockholm het door Lilly gevorderde inbreukverbod tegen Actavis toegewezen.
2.51.
Lilly heeft in Zweden ook een kort geding aanhangig gemaakt tegen Fresenius. Bij vonnis van 23 maart 2018 heeft de Tingsrät Stockholm inbreuk aangenomen. Er is bij dezelfde rechtbank nog een bodemzaak tussen partijen aanhangig.
Italië
2.52.
In de door Fresenius bij de rechtbank Milaan tegen Lilly aanhangig gemaakte kort gedingprocedure tot verkrijging van een verklaring voor recht van niet-inbreuk heeft de rechtbank bij uitspraak van 10 september 2017 geoordeeld dat Fresenius met haar pemetrexed-product geen inbreuk maakt op EP 508. In hoger beroep heeft het Tribunale di Milano bij uitspraak van 15 oktober 2018 geoordeeld dat het generieke Pemetrexed Fresenius wel inbreuk maakt op het Italiaanse deel van EP 508. Er is tussen partijen nog een bodemzaak aanhangig voor hetzelfde tribunaal.
België
2.53.
Het Hof van Beroep in Brussel heeft bij arrest van 29 januari 2019 een vonnis van de Rechtbank van Koophandel van 15 juni 2018 waarbij een door Lilly tegen Fresenius gevorderd inbreukverbod is afgewezen, vernietigd. De procedure is nog aanhangig bij het Hof.
Portugal
2.54.
Het arbitrage tribunaal van Lissabon heeft bij vonnis van 22 april 2019 inbreuk aangenomen in een door Lilly tegen Fresenius ingestelde zaak. Fresenius heeft geen hoger beroep ingesteld tegen die beslissing.
3. Het geschil
3.1.
In eerste aanleg heeft Lilly gevorderd – samengevat – dat de rechtbank, voor zoveel mogelijk uitvoerbaar bij voorraad, zowel bij wijze van provisionele voorziening als bij wijze van maatregel in de hoofdzaak aan Fresenius een inbreukverbod voor Nederland oplegt en Fresenius beveelt iedere onrechtmatige handeling jegens Lilly te staken en gestaakt te houden, op straffe van een dwangsom, en voorts in de hoofdzaak voor recht verklaart dat Fresenius inbreuk heeft gemaakt op EP 508 in Nederland, met nevenvorderingen, waaronder het doen van opgave, het sturen van een rectificatiebrief naar haar afnemers en publicatie van een rectificatie op haar website, alsmede Fresenius veroordeelt tot vergoeding van de door Lilly geleden schade en afdracht van winst, met veroordeling van Fresenius in de volledige kosten van de procedure, te vermeerderen met wettelijke rente.
3.2.
Bij vonnis van 19 juni 2019 heeft de rechtbank de vorderingen van Lilly afgewezen op de grond dat Pemetrexed Fresenius niet binnen de beschermingsomvang van het octrooi valt. Naar het oordeel van de rechtbank zou de redelijke mate van rechtszekerheid onvoldoende tot haar recht komen indien het octrooi in weerwil van de specifieke bewoordingen ‘pemetrexed dinatrium’ in de conclusies en de beschrijving en in het licht van het verleningsdossier dat erop duidt dat die bewoordingen op een bewuste keuze berusten, zou worden uitgebreid in die zin dat daaronder toch alle vormen van het antifolaat pemetrexed zouden vallen. Daaruit volgt volgens de rechtbank ook dat voor equivalente bescherming in dit geval geen ruimte bestaat.
3.3.
In hoger beroep vordert Lilly, na vermeerdering van eis, dat het hof het vonnis van de rechtbank vernietigt en opnieuw rechtdoende de vorderingen van Lilly alsnog toewijst en Fresenius veroordeelt tot terugbetaling van hetgeen Lilly ter voldoening aan het vonnis heeft voldaan, vermeerderd met wettelijke rente, met veroordeling van Fresenius in de volledige kosten van het geding in beide instanties overeenkomstig artikel 1019h van het Wetboek van Burgerlijke Rechtsvordering (hierna: Rv) en met bepaling dat Fresenius over de proceskosten wettelijke rente moet betalen vanaf twee weken na de datum van het arrest. Daarnaast heeft Lilly in hoger beroep haar eis vermeerderd met een subsidiaire variant van de gevorderde accountsopgave. Lilly brengt elf grieven naar voren, waarmee zij beoogt het geschil in volle omvang voor te leggen aan het hof. Fresenius bestrijdt de grieven van Lilly en brengt zes incidentele grieven naar voren.
4. De beoordeling van het hoger beroep
4.1.
Partijen verschillen van mening over de beschermingsomvang van het octrooi.
De beschermingsomvang van het Europees octrooi wordt bepaald door de conclusies. Niettemin dienen de beschrijving en de tekeningen tot uitleg van de conclusies.
Het bij artikel 69 EOV horende Protocol inzake de uitleg van Artikel 69 van het Verdrag (hierna: het Protocol) luidt:
1. Artikel 69 mag niet worden uitgelegd als zou de beschermingsomvang van het Europees octrooi strikt worden bepaald door de letterlijke tekst van de conclusies en als zouden de beschrijving en de tekeningen slechts mogen dienen om de onduidelijkheden, die in de conclusies zouden kunnen voorkomen, op te heffen. Artikel 69 mag evenmin worden uitgelegd als zouden de conclusies alleen als richtlijn dienen en als zou de beschermingsomvang zich ook uitstrekken tot hetgeen de octrooihouder, naar het oordeel van de vakman die de beschrijving en de tekeningen bestudeert, heeft willen beschermen. De uitleg dient daarentegen tussen deze twee uitersten het midden te houden, waarbij zowel een billijke bescherming aan de octrooihouder als een redelijke mate van rechtszekerheid aan derden wordt geboden.
2. Bij het vaststellen van de beschermingsomvang van het Europees octrooi dient op passende wijze rekening te worden gehouden met elk element dat gelijkwaardig is aan een in de conclusies omschreven element.
4.2.
Op grond van artikel 31 lid 1 Verdrag van Wenen moet een verdrag te goeder trouw worden uitgelegd overeenkomstig de gewone betekenis van de termen van het verdrag in hun context en in het licht van voorwerp en doel van het verdrag. Uit artikel 31 lid 3, aanhef en onder b, Verdrag van Wenen volgt dat behalve met de context ook rekening moet worden gehouden met ieder later gebruik in de toepassing van het verdrag waardoor overeenstemming van de verdragspartijen inzake de uitleg van het verdrag is ontstaan, hetgeen meebrengt dat ook de heersende opvatting in de rechtspraak en literatuur van de verdragslanden een primair interpretatiemiddel bij de uitleg van dat verdrag vormt.
4.3.
In de rechtspraak en literatuur kunnen de volgende twee benaderingen worden onderscheiden in de wijze waarop artikel 69 EOV en het Protocol worden uitgelegd en, meer specifiek, de wijze waarop bij het vaststellen van de beschermingsomvang rekening kan worden gehouden met een element dat gelijkwaardig (hierna ook aangeduid als equivalent) is aan een in de conclusies omschreven element:
4.3.1.
In de eerste benadering wordt de beschermingsomvang in twee stappen vastgesteld. Bij de eerste stap wordt aan de hand van een uitleg van de octrooiconclusie bepaald of het product of de werkwijze van een derde voldoet aan alle kenmerken van die octrooiconclusie. Als de octrooiconclusie niet zo kan worden uitgelegd dat alle kenmerken daarvan terugkomen in het product of de werkwijze, wordt in een tweede stap bepaald of het element dat afwijkt van een in de conclusie opgenomen kenmerk wel equivalent is aan dat kenmerk en of het passend is om het product of de werkwijze om die reden toch onder de beschermingsomvang van het octrooi te laten vallen.
4.3.2.
In de tweede benadering wordt al bij de uitleg van de octrooiconclusies rekening gehouden met de equivalentie van elementen van een product of werkwijze aan in de octrooiconclusies omschreven kenmerken. In die benadering is daarom geen of nauwelijks ruimte voor een tweede stap waarin de equivalentie afzonderlijk wordt getoetst.
4.4.
In de Nederlandse rechtspraak zijn voorbeelden van beide hiervoor beschreven benaderingen te vinden. In andere EOV-lidstaten is de onder 4.3.1 beschreven twee-stappen-benadering momenteel de heersende opvatting. Een twee-stappen-benadering is vaste rechtspraak in onder meer Duitsland en Frankrijk. In het Verenigd Koninkrijk werd tot voor kort de onder 4.3.2 bedoelde één-staps-benadering gevolgd, maar in zijn arrest van 12 juli 2017 in de zaak Actavis – Lilly heeft het Britse UKSC uitdrukkelijk gekozen voor de twee-stappen-benadering (zie r.o. 2.39). Gelet daarop moet worden aangenomen dat de twee-stappen-benadering op dit moment ook in het Verenigd Koninkrijk de heersende opvatting is. Nu de twee-stappen-benadering in andere EOV-lidstaten overheerst en ook basis heeft in de Nederlandse rechtspraak, zal het hof die benadering hierna toepassen.
4.5.
De eerste stap van de twee-stappen-benadering wordt wel aangeduid als de beoordeling van ‘letterlijke inbreuk’. Daarmee wordt niet gedoeld op het in artikel 1 van het Protocol bedoelde uiterste waarbij de beschermingsomvang van het Europees octrooi strikt worden bepaald door de letterlijke tekst van de conclusie, maar op een uitleg van de octrooiconclusies in het licht van onder meer de beschrijving en tekeningen vanuit het perspectief van de gemiddelde vakman met zijn kennis van de stand van de techniek (artikel 69 lid 1 EOV en het midden van artikel 1 van het Protocol). In deze stap wordt alleen geen rekening gehouden met de eventuele equivalentie van elementen van het product of de werkwijze aan kenmerken van de octrooiconclusies overeenkomstig artikel 2 van het Protocol.
4.6.
Bij de tweede stap gaat het om de vraag of in de perceptie van de gemiddelde vakman de conclusies, gelezen in het licht van de beschrijving en de tekeningen, ruimte laten voor equivalenten, gelet op enerzijds een billijke bescherming van de octrooihouder en anderzijds een redelijke mate van rechtszekerheid voor derden.2.
4.7.
Om de hiervoor genoemde equivalentievraag positief te kunnen beantwoorden is ten eerste vereist dat het afwijkende element vanuit technisch oogpunt gelijkwaardig is aan het geclaimde kenmerk. Aan dat vereiste is voldaan als het product of de werkwijze met het afwijkende element het probleem dat het octrooi oplost, ook oplost en het afwijkende element in dat kader dezelfde functie vervult als het geclaimde kenmerk. Dit vereiste van ‘technische equivalentie’ vormt de basis voor het beroep op equivalentie.
4.8.
Ten tweede moet worden beoordeeld of het van uit het oogpunt van een billijke bescherming van de octrooihouder passend is om bij de vaststelling van de beschermingsomvang van het octrooi rekening te houden met equivalenten. Dat gezichtspunt vereist dat de beschermingsomvang van het octrooi in verhouding staat tot de bijdrage die de octrooihouder met het octrooi heeft geleverd aan de stand van techniek. Naast de hierna afzonderlijk als vierde eis te bespreken nieuwheid en inventiviteit van de variant, houdt dat in dat de uitvinding in het octrooischrift zodanig moet zijn geopenbaard dat het voor de gemiddelde vakman voor de hand ligt die uitvinding ook toe te passen met elementen die afwijken van het kenmerk van de octrooiconclusie. Met andere woorden, het octrooischrift moet voor de gemiddelde vakman met zijn algemene vakkennis een leer openbaren die de toepassing van equivalenten mede kan omvatten.
4.9.
Deze eis brengt niet mee dat iedere equivalent voor de gemiddelde vakman op de prioriteits- of aanvraagdatum nawerkbaar moet zijn. In het kader van de vraag of sprake is van een equivalent element kan namelijk mede betekenis worden gehecht aan de kennis van de gemiddelde vakman ten tijde van de inbreuk.3.Daarnaast moet bij de beoordeling van de verhouding tussen de beschermingsomvang en de bijdrage aan de stand van de techniek rekening worden gehouden met de mate van vernieuwing die het octrooi brengt, omdat een grote mate van vernieuwing de mogelijkheden van de aanvrager kan belemmeren alle uitvoeringsvormen adequaat te voorzien en te beschrijven.4.
4.10.
Ten derde moet worden beoordeeld of erkenning van het beroep op equivalentie in een concreet geval passend is gelet de vereiste redelijke mate van rechtszekerheid voor derden. Het feit dat in de octrooiconclusies bewoordingen zijn gebruikt die equivalenten niet letterlijk omvatten is in dat kader een belangrijke omstandigheid. Gelet op het feit dat artikel 69 EOV vooropstelt dat de beschermingsomvang van een Europees octrooi wordt bepaald door de conclusies, mogen derden in beginsel afgaan op de tekst van de conclusies, uitgelegd in het licht van de beschrijving en tekeningen, en werkt door de bewoordingen van de conclusies gecreëerde onduidelijkheid in beginsel ten nadele van de octrooihouder. Het feit dat in de octrooiconclusies bewoordingen zijn gebruikt die equivalenten niet letterlijk omvatten, kan echter niet volstaan voor het oordeel dat de rechtszekerheid voor derden onvoldoende is verzekerd. Als dat wel zo zou zijn, zou een beroep op equivalentie onmogelijk zijn. Die uitkomst zou niet in overeenstemming zijn met artikel 2 van het Protocol dat voorschrijft op passende wijze rekening te houden met equivalenten. Een beroep op equivalentie moet daarom mogelijk zijn als, ondanks de specifieke bewoordingen van de conclusies, een voldoende mate van rechtszekerheid is verzekerd. Er is een voldoende mate van rechtszekerheid als de gemiddelde vakman begrijpt dat de octrooiconclusies ruimte laten voor equivalenten, omdat de leer van het octrooi voor de gemiddelde vakman duidelijk breder is dan de bewoordingen van die conclusies en er in de ogen van de gemiddelde vakman geen goede grond bestaat voor een beperking van de beschermingsomvang tot toepassing van het in de conclusies vermelde kenmerk. Van een dergelijke goede grond is niet slechts sprake als de gemiddelde vakman mag aannemen dat afstand is gedaan van een gedeelte van de bescherming.
4.11.
Ten vierde moet, als het verweer daartoe aanleiding geeft, worden beoordeeld of de variant nieuw en inventief is ten opzichte van de stand van de techniek van het octrooi. Het verlenen van bescherming voor niet-nieuwe of niet-inventieve producten of werkwijzen zou verder gaan dan een billijke bescherming voor de octrooihouder rechtvaardigt (ook wel bekend uit het Gillette- of Formstein-verweer, genoemd naar twee gelijknamige zaken uit Engeland respectievelijk Duitsland). Deze aspecten moeten worden getoetst in het kader van de vaststelling van de beschermingsomvang van het octrooi omdat de nieuwheid en inventiviteit van equivalenten niet wordt beoordeeld in verlenings-, oppositie- en nietigheidsprocedures.
gemiddelde vakman
4.12.
Het hof zal bij de navolgende beoordeling van de beschermingsomvang van EP 508 ervan uitgaan dat de gemiddelde vakman een team is bestaande uit een oncoloog en een chemicus met expertise op het gebied van de formulering van farmaceutische preparaten. Lilly bestrijdt weliswaar dat een chemicus deel uitmaakt van het team, maar gaat er ook zelf vanuit dat de gemiddelde vakman beschikt over gespecialiseerde farmacologische kennis en dat die bekend is met het zoeken en selecteren van geschikte zouten voor een farmaceutisch preparaat. Een vakman met die kennis is niet goed te onderscheiden van de hiervoor door het hof omschreven gemiddelde vakman. Bovendien wordt in de eigen argumentatie van Lilly en in de door Lilly in het geding gebrachte deskundigenverklaringen ook uitgegaan van zowel oncologen als chemici.
geen letterlijke inbreuk
4.13.
Voor zover Lilly haar standpunt dat Fresenius letterlijk inbreuk maakt op het octrooi in hoger beroep heeft gehandhaafd, moet dat standpunt worden verworpen. Lilly heeft zelf aangevoerd dat de gemiddelde vakman begrijpt dat met de term ‘pemetrexed dinatrium’ wordt gedoeld op een specifieke zoutvorm van pemetrexed, te weten een afgeleide van pemetrexed dizuur waarin twee waterstofatomen zijn vervangen door twee natriumatomen (o.a. appeldagvaarding, paragraaf 4.70). Lilly heeft ook niet, althans onvoldoende bestreden dat de gemiddelde vakman de variant van pemetrexed die Fresenius gebruikt in haar product, te weten pemetrexed dizuur met tromethamine, zal opvatten als een andere zoutvorm dan pemetrexed dinatrium. Lilly heeft zelf benadrukt dat pemetrexed dinatrium en pemetrexed dizuur met tromethamine verschillende zoutvormen zijn (o.a. appeldagvaarding, paragraaf 4.73). Ook haar deskundigen Frøkjær en Østergaard verklaren dat het voor de gemiddelde vakman duidelijk is dat het product van Fresenius op dat punt afwijkt van de ‘literal wording’ van de octrooiconclusies (productie 27 van Lilly, paragraaf 6.9). Gelet daarop moet worden geconcludeerd dat de gemiddelde vakman pemetrexed dizuur met tromethamine niet gelijk zal stellen aan het geclaimde kenmerk ‘pemetrexed dinatrium’, ook niet als dat kenmerk wordt uitgelegd in het licht van de beschrijving van het octrooi.
4.14.
Het betoog van Lilly dat de gemiddelde vakman uit het octrooischrift leert dat de zoutvorm van pemetrexed – samengevat – niet relevant is voor de uitvindingsgedachte, kan niet leiden tot een andere conclusie met betrekking tot letterlijke inbreuk. Die stelling is van belang voor de beoordeling van het beroep op equivalentie, maar kan in dit geval niet meebrengen dat een term uit de octrooiconclusies die in het kader van zowel de algemene vakkennis als het octrooischrift een beperktere betekenis heeft, een bredere uitleg krijgt.
vraag 1: technische equivalentie
4.15.
Het probleem dat EP 508 beoogt op te lossen is, zoals het octrooischrift duidelijk maakt in onder meer de paragrafen [0003] tot en met [0005] en [0016] van de beschrijving: het verminderen van bepaalde bijwerkingen van antifolaten, zoals pemetrexed dinatrium, met behoud van de therapeutische werkzaamheid van het antifolaat. Het octrooi leert dat dit probleem kan worden opgelost door het antifolaat te combineren met vitamine B12 en optioneel foliumzuur.
4.16.
Mede gelet op de voorgaande beschrijving van het probleem en de oplossing daarvoor zal de gemiddelde vakman uit het feit dat de uitvinding is geclaimd als toepassing van pemetrexed dinatrium bij ‘de bereiding van een geneesmiddel’ niet afleiden dat de bijdrage van de geclaimde uitvinding is gelegen in een specifieke bereidingswijze. De gemiddelde vakman zal inzien dat die wijze van claimen louter een octrooirechtelijke achtergrond heeft, die samenhangt met het feit dat artikel 53 aanhef en onder c EOV medische behandelmethodes als zodanig uitsluit van octrooiering.
4.17.
Als onvoldoende bestreden staat vast dat zowel de therapeutische werking die het octrooi beoogt te behouden, als de bijwerkingen die het octrooi beoogt te verminderen, wordt veroorzaakt door de pemetrexed-anionen en dat de geclaimde zoutvorm geen invloed heeft op die therapeutische werking en bijwerkingen van de pemetrexed-anionen en evenmin op de toxiciteit verlagende eigenschappen van vitamine B12 wanneer het wordt toegediend in combinatie met pemetrexed dinatrium (en optioneel foliumzuur). Lilly heeft die stelling onderbouwd met een publicatie van Sierra en Goldman over het transport van folaten en antifolaten in de cel (productie 29 van Lilly) en deskundigenverklaringen van een oncoloog (verklaring van professor Smit, productie 26 van Lilly) en chemici (verklaring van professor Frøkjær en professor Østergaard, productie 27 van Lilly). Fresenius heeft daar slechts tegen ingebracht dat de eigenschappen van zouten verschillen en dat een zoutvorm van invloed kan zijn op de werkzaamheid en toxiciteit. Zij heeft echter niet bestreden dat bij pemetrexed dinatrium de zoutvorm geen invloed heeft op de werkzaamheid en toxiciteit.
4.18.
De functie van de zoutvorm pemetrexed dinatrium in het licht van de hiervoor beschreven uitvinding is gelet op het voorgaande, zoals Lilly heeft aangevoerd, uitsluitend het verschaffen van de pemetrexed-anionen. Meer specifiek heeft Lilly, als zodanig onweersproken, aangevoerd dat de zoutvorm in dit kader drie relevante eigenschappen heeft:
4.18.1.
Ten eerste heeft Lilly toegelicht dat de zoutvorm ervoor zorgt dat de negatief geladen pemetrexed-anionen beschikbaar zijn in een neutrale stof die voldoende stabiel is om te worden opgeslagen en verhandeld (zie ook hiervoor r.o. 2.10).
4.18.2.
Ten tweede heeft Lilly aangevoerd dat de zoutvorm ervoor zorgt dat in een waterige oplossing de pemetrexed-anionen dissociëren van de natriumionen en dus vrij beschikbaar komen.
4.18.3.
Ten derde heeft Lilly opgemerkt dat de zoutvorm (ook anderszins) farmaceutisch aanvaardbaar is, dat wil zeggen geschikt voor gebruik als geneesmiddel.
4.19.
Als niet, althans onvoldoende bestreden staat vast dat toepassing van Pemetrexed Fresenius in combinatie met vitamine B12 en optioneel foliumzuur bij de behandeling van longkanker de hiervoor beschreven effecten en voordelen van de in EP 508 geclaimde uitvinding realiseert, te weten minder bijwerkingen met behoud van de therapeutische werkzaamheid. Ook staat vast dat de vorm waarin Fresenius haar product op de markt brengt, te weten pemetrexed dizuur met tromethamine, in dat kader dezelfde functie vervult als pemetrexed dinatrium, te weten louter het verschaffen van pemetrexed-anionen. Niet in geschil is dat ook de tegenionen in Pemetrexed Fresenius, te weten de waterstofdeeltjes en de tromethaminegroepen, zich binden aan de pemetrexed-anionen en daarmee een stof vormen die voldoende stabiel is om te worden opgeslagen verhandeld. Ook staat buiten kijf dat in vloeistof de pemetrexed-anionen vrij beschikbaar worden gemaakt, doordat pemetrexed dizuur met tromethamine daarin oplost en de waterstofdeeltjes en tromethaminegroepen dissociëren van de pemetrexed-anionen (zie ook hiervoor r.o. 2.30). Evenmin in geschil is dat pemetrexed ook in deze vorm farmaceutisch aanvaardbaar is. Fresenius heeft niet weersproken dat het verschil in zoutvorm geen invloed heeft op de werkzaamheid en veiligheid van het geneesmiddel. Lilly heeft dat gesteld onder verwijzing naar de documenten die Fresenius heeft ingediend in het kader van de aanvraag van een marktvergunning, waarin de producten van Lilly en Fresenius worden vergeleken en onder meer uitdrukkelijk wordt verklaard dat ‘the difference in active substance salt form between applied product and the reference product is […] not relevant for the clinical efficacy and safety of the ready to use infusion’ (productie 8 van Lilly) (zie ook hiervoor r.o. 2.32). Fresenius erkent in deze procedure ook uitdrukkelijk dat sprake is van biologische equivalentie (memorie van antwoord tevens memorie van grieven in incidenteel appel, paragraaf 3 sub e).
4.20.
Het betoog van Fresenius dat de bio-equivalentie waar haar documentatie op doelt, niet gelijk kan worden gesteld aan technische equivalentie in octrooirechtelijke zin, moet worden gepasseerd. De eigenschappen van de zoutvorm pemetrexed dinatrium die bepalend zijn voor de bio-equivalentie van de pemetrexedverbindingen, in het bijzonder de therapeutische werkzaamheid en veiligheid, zijn in dit geval ook relevant in het kader van de beoordeling van technische equivalentie omdat die een functie hebben in het kader van de uitvinding. Er is, anders dan Fresenius meent, ook niet alleen sprake van equivalentie ‘op het niveau van het biologische effect na toediening in de patiënt’, maar ook ‘op het niveau van het farmaceutisch preparaat’. Zoals hiervoor is overwogen, is de functie van de natriumionen in het preparaat: het neutraliseren van de pemetrexed-anionen zodat die kunnen worden bewaard en verhandeld. Niet in geschil is dat de waterstofdeeltjes en tromethaminegroepen dezelfde functie vervullen in het product dat Fresenius verhandelt.
4.21.
Het betoog van Fresenius dat de eigenschappen van zouten sterk verschillen en dat niet alle zoutvormen een geschikt alternatief zijn voor pemetrexed dinatrium, kan worden gepasseerd. Voor de beoordeling van het beroep op equivalentie zijn niet alle eigenschappen van alle pemetrexedverbindingen relevant en hoeft ook niet vast te staan dat alle pemetrexedverbindingen een geschikt alternatief vormen voor pemetrexed dinatrium. Het volstaat dat Pemetrexed Fresenius in het kader van de geclaimde uitvinding dezelfde functie vervult als pemetrexed dinatrium. Fresenius heeft ook niet aangegeven dat pemetrexed dinatrium voor de uitvinding relevante eigenschappen heeft die Pemetrexed Fresenius niet bezit. Fresenius heeft wel gesteld dat natriumzouten een goede oplosbaarheid hebben en dat oplosbaarheid relevant is voor de werkzaamheid, maar Lilly heeft onweersproken gesteld dat ook tromethamine bekend staat als een zout met hoge oplosbaarheid. Gelet daarop moet worden geconcludeerd dat het product van Fresenius ook in dat opzicht niet verschilt van de in de octrooiconclusies genoemde zoutvorm.
vraag 2: billijke bescherming
4.22.
Het honoreren van het beroep op equivalentie is in dit geval passend in het licht van een billijke bescherming voor de octrooihouder en brengt niet mee dat de beschermingsomvang van EP 508 verder gaat dan de bijdrage van het octrooi aan de stand van de techniek. De uitvinding is in het octrooischrift zodanig geopenbaard dat de gemiddelde vakman die met zijn algemene vakkennis ook kon en zou toepassen met andere pemetrexedverbindingen dan het geclaimde pemetrexed dinatrium.
4.23.
Daarbij staat voorop dat de gemiddelde vakman al op grond van zijn algemene vakkennis tot de toepassing van andere pemetrexedverbindingen zou komen. Als niet, althans onvoldoende weersproken staat namelijk vast dat de gemiddelde vakman op grond van zijn algemene vakkennis zou inzien dat de functie van pemetrexed dinatrium in het kader van de geclaimde uitvinding louter is het verschaffen van een stof die in oplossing pemetrexed-anionen geeft en dat het probleem van het verminderen van bijwerkingen van de pemetrexed-anionen zonder afbreuk te doen aan de therapeutische werkzaamheid van de pemetrexed-anionen dus ook bij andere pemetrexedverbindingen kon worden opgelost door toediening van vitamine B12 en optioneel foliumzuur. Daarnaast heeft Lilly – onder verwijzing naar onder meer het stofoctrooi voor pemetrexed en als zodanig onbestreden – aangevoerd dat de gemiddelde vakman op basis van zijn algemene vakkennis wist dat andere zouten van pemetrexed konden worden vervaardigd met dezelfde functie van pemetrexed dinatrium. Ook is niet in geschil dat het selecteren van geschikte zoutvormen voor de gemiddelde vakman een routinewerkzaamheid is in het kader van de formulering van een geneesmiddel. Dat heeft Lilly aangevoerd onder verwijzing naar verklaringen van deskundigen in buitenlandse procedures en heeft Fresenius niet, althans onvoldoende gemotiveerd bestreden. Aangenomen moet dus worden dat de gemiddelde vakman routinematig kon vaststellen of een alternatieve pemetrexedverbinding de functie die pemetrexed dinatrium in het kader van de uitvinding heeft, ook vervult.
4.24.
Daar komt bij dat het octrooischrift naast de specifieke leer om pemetrexed dinatrium toe te passen een veel bredere leer openbaart die de toepassing van alternatieve pemetrexedverbindingen omvat. Zo leert het octrooischrift de vakman uitdrukkelijk dat de uitvinding betrekking heeft op ‘the discovery that administration of a methylmalonic acid lowering agent such as vitamin B 12 or a pharmaceutical derivative thereof, in combination with an antifolate drug such as pemetrexed disodium reduces the toxicity of the said antifolate drug’ (paragraaf [0016] van het octrooischrift). Onder meer deze paragraaf leert de gemiddelde vakman dat het beoogde effect van de vermindering van bijwerkingen met behoud van de werking niet beperkt is tot een specifiek antifolaat, laat staan tot een specifieke zoutvorm van een specifiek antifolaat. Ook de tekst van het octrooischrift zet de gemiddelde vakman dus op het spoor om op zoek te gaan naar alternatieven voor pemetrexed dinatrium. Zoals hiervoor overwogen, zou de gemiddelde vakman dat spoor volgend routinematig uitkomen op alternatieve pemetrexedverbindingen die op dezelfde wijze functioneren.
4.25.
Het betoog van Fresenius dat de gemiddelde vakman voorafgaand aan het routinematige experimentele onderzoek de eigenschappen van een zout of zuur niet kan voorspellen, leidt niet tot een andere uitkomst. Zoals beide partijen hebben opgemerkt onder verwijzing naar de uitspaak van de Britse High Court in de pemetrexed-zaak,5.laat die onvoorspelbaarheid onverlet dat de gemiddelde vakman een redelijke verwachting zou hebben om een alternatief zout te vinden dat geschikt is voor toepassing in het kader van de geoctrooieerde uitvinding. De onvoorspelbaarheid van de eigenschappen van zouten en zuren zou de gemiddelde vakman er daarom niet van weerhouden op zoek te gaan naar een alternatieve pemetrexedverbinding.
4.26.
In dit kader kan in het midden kan blijven of het vinden van een geschikt alternatief ‘kinderlijk eenvoudig’ is zoals de rechtbank heeft aangenomen, maar Fresenius bestrijdt. Dat het vinden van een alternatief binnen het bereik van de gemiddelde vakman ligt, draagt al bij aan het oordeel dat de beschermingsomvang van EP 508 niet verder gaat dan de bijdrage van het octrooi aan de stand van de techniek. Dat het vinden van een geschikte alternatieve pemetrexedverbinding binnen het bereik van de gemiddelde vakman lag en ligt, volgt genoegzaam uit de door Lilly overgelegde producties en heeft Fresenius niet bestreden.
4.27.
Het betoog van Fresenius dat zij een octrooi heeft gekregen voor de ontwikkeling van haar formulering, kan niet leiden tot een andere uitkomst. Het feit dat een product een maatregel bevat die inventief is ten opzichte van het octrooischrift, sluit niet uit dat in dat product ook de leer van het octrooi wordt toegepast en dat het dus billijk is ten opzichte van de octrooihouder het desbetreffende product onder de beschermingsomvang van het octrooi te brengen. De inventiviteit kan immers zijn gelegen in een aanvullende leer, in de vorm van de toevoeging van een maatregel aan het geoctrooieerde product of de selectie van een specifieke uitvoeringsvorm van de algemene leer van het octrooi. Die situatie doet zich ook voor in deze zaak. Lilly heeft onbestreden opgemerkt i) dat het octrooi van Fresenius niet pemextrexed dizuur met tromethamine als zodanig betreft, maar pemetrexed dizuur met tromethamine in een bijzondere gewichtsverhouding waarbij het oplosmiddel voor, tijdens of na het mengen met een inert gas wordt gespoeld, en ii) dat het EOB tijdens de verleningsprocedure heeft aangegeven dat pemetrexed dizuur met tromethamine als zodanig juist voor de hand lag. Dat oordeel van het EOB wordt ondersteund door het feit dat tromethamine, zoals Lilly heeft onderbouwd en onbetwist heeft gesteld, een algemeen bekend buffermiddel/pH-regelaar was dat in de top-10 van meest gebruikte hulpstoffen stond.
vraag 3: redelijke rechtszekerheid
4.28.
Naar het oordeel van het hof is in dit geval ook een redelijke mate van rechtszekerheid voor derden verzekerd. Het zal de gemiddelde vakman bij lezing van de conclusies in het licht van de beschrijving duidelijk zijn dat de conclusies op het punt van de zoutvorm ruimte laten voor equivalenten. Hij zal inzien dat de leer van het octrooi op dat punt duidelijk breder is dan de bewoordingen van die conclusies en dat er geen goede grond bestaat voor een beperking van de beschermingsomvang tot toepassing van het in de conclusies vermelde pemetrexed dinatrium.
4.29.
Zoals hiervoor al is overwogen, openbaart het octrooischrift uitdrukkelijk een leer die de toepassing van alternatieve pemetrexedverbindingen omvat, te weten dat de bijwerkingen van een antifolaat kunnen worden verminderd door toediening in combinatie met vitamine B12 (en optioneel foliumzuur). Die leer is bovendien in overeenstemming met de kennis waarmee de gemiddelde vakman het octrooischrift leest, waaronder de wetenschap dat de pemetrexed-anions verantwoordelijk zijn voor de therapeutische werkzaamheid en bijwerkingen en dat de functie van pemetrexed dinatrium in het kader van de uitvinding louter is het verschaffen van die pemetrexed-anions na oplossing. Voor de gemiddelde vakman die het octrooischrift met zijn algemene vakkennis leest is de leer van het octrooi dus duidelijk breder dan de bewoordingen ‘pemetrexed dinatrium’ van de conclusies. Met andere woorden, het is de gemiddelde vakman duidelijk dat hij ook met toepassing van alternatieve pemetrexedverbindingen gebruik maakt van de achter de woorden van de conclusie liggende uitvindingsgedachte.
4.30.
Ook is het de gemiddelde vakman duidelijk dat er geen goede grond bestaat voor beperking van de beschermingsomvang tot toepassing van het in de conclusies vermelde pemetrexed dinatrium. Zoals hierna zal worden toegelicht zal de gemiddelde vakman geen goede grond voor de beperking van de beschermingsomvang vinden in het octrooischrift, in de algemene vakkennis waarmee de gemiddelde vakman het octrooischrift leest of in de verleningsgeschiedenis van het octrooi, ook niet wanneer die bronnen in onderling verband worden beschouwd.
4.31.
Een goede grond voor beperking van de beschermingsomvang tot de toepassing van pemetrexed dinatrium staat niet in het octrooischrift. Het octrooischrift vermeldt geen enkel voordeel van de zoutvorm pemetrexed dinatrium ten opzichte van andere pemetrexedverbindingen en beschrijft ook geen enkel effect van die zoutvorm, zoals de stabiliteit, oplosbaarheid of absorptie. Het enige dat het octrooischrift over pemetrexed dinatrium leert, is dat Lilly pemetrexed in die zoutvorm produceert, dus dat pemetrexed dinatrium voorhanden is. In het feit dat pemetrexed dinatrium een bestaand product is, zal de gemiddelde vakman geen goede grond voor beperking van de beschermingsomvang van het octrooi tot pemetrexed dinatrium zien. De gemiddelde vakman weet op grond van zijn algemene vakkennis immers dat en hoe andere zouten van pemetrexed konden worden ontwikkeld die dezelfde werking zullen hebben.
4.32.
Het feit dat het octrooischrift in de conclusies en beschrijving uitsluitend pemetrexed dinatrium noemt, zonder toevoeging van een clausule zoals ‘or other pharmaceutically acceptable salts’, levert, anders dan Fresenius meent, geen goede grond op voor een beperking van de beschermingsomvang tot pemetrexed dinatrium. Een beroep op equivalentie zou onmogelijk worden als dat enkele feit een goede grond zou opleveren voor een beperking van de beschermingsomvang tot een product met dat kenmerk. Dat resultaat zou in strijd zijn met de regel dat op passende wijze rekening moet worden gehouden met equivalenten.
4.33.
Ook het feit dat het octrooischrift bij andere kenmerken wel uitdrukkelijk alternatieven noemt in de conclusies en de beschrijving, zoals bij vitamine B12 ‘pharmaceutical derivatives thereof’, levert geen goede grond op voor een beperking van de beschermingsomvang. Uit dat feit kan niet a contrario worden afgeleid dat bij pemetrexed dinatrium equivalenten zijn uitgesloten van de beschermingsomvang.
4.34.
Ten slotte heeft Fresenius gewezen op paragraaf [0016] van de beschrijving, waarin staat dat de uitvinding betrekking heeft op ‘the discovery that administration of a methylmalonic acid lowering agent such as vitamin B 12 or a pharmaceutical derivative thereof, in combination with an antifolate drug such as pemetrexed disodium reduces the toxicity of the said antifolate drug’. Ook die passage biedt geen goede grond voor een beperking van de beschermingsomvang. Integendeel, onder meer deze passage leert de vakman uitdrukkelijk dat de uitvinding niet is beperkt tot pemetrexed dinatrium (hiervoor, 4.24).
4.35.
Een goede grond voor de beperking van de beschermingsomvang van EP 508 tot de toepassing van pemetrexed dinatrium volgt ook niet uit de algemene vakkennis waarmee de gemiddelde vakman het octrooischrift leest. Integendeel, zoals hiervoor overwogen leert de algemene vakkennis dat de geclaimde uitvinding op het punt van de zoutvorm breder toepasbaar is.
4.36.
Op zich heeft Fresenius wel terecht opgemerkt, dat de gemiddelde vakman op basis van zijn vakkennis weet dat de zoutvorm ‘relevant’ is voor de uitvinding, in die zin dat niet ieder zout of zuur van pemetrexed de functies van pemetrexed dinatrium in het kader van uitvinding kan vervullen. Zo is denkbaar dat de oplosbaarheid van een bepaald zout zo laag is dat het zout niet of nauwelijks vrije pemetrexed-anions zal verschaffen in een vloeistof en dus niet de functies die pemetrexed dinatrium in het kader van de uitvinding heeft, kan vervullen. Dat impliceert echter niet dat er een goede grond is de toepassing van alternatieve pemetrexedverbindingen die wel dezelfde functies in het kader van de uitvinding vervullen, zoals pemetrexed dizuur met tromethamine, uit te sluiten van de beschermingsomvang van EP 508.
4.37.
Ook zal de gemiddelde vakman op basis van zijn algemene vakkennis weten dat de selectie van een alternatieve pemetrexedverbinding onderzoek vergt, waarvan de uitkomsten niet vooraf kunnen worden voorspeld. Die vakman weet echter ook hoe hij dat onderzoek moet doen en dat hij een redelijk kans op succes heeft dat hij met dat onderzoek een geschikt alternatief zal vinden. De noodzaak van dat onderzoek biedt daarom geen goede grond om de beschermingsomvang van de conclusies te beperken tot pemetrexed dinatrium.
4.38.
Het feit dat Lilly in het stofoctrooi voor pemetrexed (EP 0 432 677) een voorkeur uitspreekt voor pemetrexed dinatrium en in ander octrooi (EP 1 259 513 B1) voor een heptahydrate vorm van pemetrexed dinatrium, kan niet leiden tot een ander oordeel. Gesteld noch gebleken is dat de voordelige eigenschappen die Lilly in het kader van die octrooien toedicht aan (een specifieke vorm van) pemetrexed dinatrium, tot de algemene vakkennis behoorden. Daar komt bij Fresenius niet heeft gesteld dat de gemiddelde vakman zou menen dat pemetrexedverbindingen zonder die eigenschappen niet de functie zouden kunnen vervullen die pemetrexed dinatrium in het kader van de uitvinding heeft. Waarom de gemiddelde vakman in die eigenschappen van (een specifieke vorm van) pemetrexed dinatrium dan toch een goede grond zou zien voor een beperking van de beschermingsomvang tot pemetrexed dinatrium, heeft Fresenius onvoldoende toegelicht.
4.39.
Het feit dat Lilly in een ander octrooi (EP 1 265 612 B1) wel uitdrukkelijk andere zuren en zouten heeft geopenbaard en geclaimd, kan ook niet leiden tot een andere uitleg. Daaruit kan niet a contrario worden afgeleid dat de beschermingsomvang van EP 508 moet worden beperkt tot pemetrexed dinatrium.
4.40.
Op grond van het voorgaande moet worden geconcludeerd dat het de gemiddelde vakman op grond van lezing van de octrooiconclusies in het licht van de beschrijving duidelijk zal zijn dat de conclusies van EP 508 op het punt van de zoutvorm zich ook uitstrekken tot equivalenten. Bestudering van het verleningsdossier heeft hij daarvoor niet nodig. Als de gemiddelde vakman het verleningsdossier wel zou raadplegen, zou hij niet tot een ander oordeel komen omdat ook daarin geen goede grond voor een beperking van de beschermingsomvang tot de toepassing van pemetrexed dinatrium is te vinden. Integendeel, zoals hierna zal worden toegelicht, zal bestudering van het verleningsdossier de gemiddelde vakman sterken in zijn oordeel dat de beschermingsomvang niet is beperkt tot de toepassing van pemetrexed dinatrium.
4.41.
Zoals Fresenius ook zelf heeft opgemerkt, is het gebruik van het kenmerk pemetrexed dinatrium te herleiden tot de oorspronkelijke aanvraag, waarin pemetrexed dinatrium de enige beschreven vorm van pemetrexed was (zie hiervoor r.o. 2.21). Een goede grond om de beschermingsomvang te beperken tot die zoutvorm kan daaruit niet worden afgeleid. De conclusies van de oorspronkelijke aanvrage waren juist veel breder en omvatten – samengevat – de toepassing van ieder antifolaat in combinatie met een methylmalonic acid lowering agent (zoals vitamine B12). Die conclusies omvatten ook andere pemetrexedverbindingen dan pemetrexed dinatrium.
4.42.
Ook in de verdere gang van zaken tijdens de verleningsprocedure zal de gemiddelde vakman geen goede grond zien voor een beperking van de beschermingsomvang tot de toepassing van pemetrexed dinatrium. De verleningsgeschiedenis bevestigt juist dat Lilly een bredere beschermingsomvang beoogde die ook de toepassing van andere zouten en zuren van pemetrexed omvat. Nadat de onderzoeksafdeling van het EOB had aangevoerd dat de brede claim niet nieuw was in het licht van twee publicaties over het gebruik van vitamine B12 in combinatie met andere antifolaten dan pemetrexed, heeft Lilly namelijk een conclusie naar voren gebracht die betrekking had op – samengevat – de toepassing van ‘pemetrexed’ in combinatie met vitamine B12 (zie hiervoor r.o. 2.17, 2.18 en 2.19). Ook die conclusie omvat onmiskenbaar andere pemetrexedverbindingen dan pemetrexed dinatrium.
4.43.
Bestudering van het verleningsdossier leert de gemiddelde vakman dat het kenmerk ‘pemetrexed dinatrium’ vervolgens is geïntroduceerd naar aanleiding van een op artikel 123 lid 2 EOV gebaseerd bezwaar van de onderzoeksafdeling van het Europees Octrooibureau tegen het begrip ‘pemetrexed’ (zie hiervoor r.o. 2.20). Een beperking van de conclusies op die grond sluit een beroep op equivalentie niet uit. Uit die beperking kan slechts worden afgeleid dat Lilly heeft willen verzekeren dat het onderwerp van haar octrooi werd gedekt door de inhoud van de oorspronkelijke aanvrage. Een goede grond voor een beperking van de beschermingsomvang tot de toepassing van pemetrexed dinatrium en de uitsluiting van equivalenten, kan daarin niet worden gelezen. Voor het slagen van een beroep op equivalentie in het kader van het vaststellen van de beschermingsomvang is namelijk niet vereist dat de equivalenten worden gedekt door de inhoud van de oorspronkelijke aanvrage. De regel van artikel 123 lid 2 EOV is, zoals Fresenius ook onderkent (conclusie van antwoord, paragraaf 84 en memorie van antwoord, paragraaf 167), niet van toepassing bij de vaststelling van de beschermingsomvang van een octrooi. Toegevoegde materie en beschermingsomvang zijn te onderscheiden kwesties.
4.44.
Het beroep van Fresenius op de ratio van artikel 123 lid 2 EOV, kan niet leiden tot een ander oordeel. Fresenius betoogt dat die bepaling de rechtszekerheid van derden beschermt en waarborgt dat de omvang van het octrooi in redelijke verhouding staat tot de bijdrage van de octrooihouder aan de stand van de techniek. Uit het voorgaande volgt dat met die twee gezichtspunten ook rekening wordt gehouden bij de beoordeling van het beroep op equivalentie. Analoge toepassing van artikel 123 lid 2 EOV is daarvoor niet nodig.
4.45.
Er zijn ook gegronde redenen om de vereisten van artikel 123 lid 2 EOV niet toe te passen bij de beoordeling van een beroep op equivalentie in het kader van de vaststelling van de beschermingsomvang van een octrooi. Er bestaan namelijk wezenlijke verschillen tussen enerzijds het toevoegen van equivalenten aan de octrooiconclusies en de beschrijving, waar artikel 123 lid 2 EOV op betrekking heeft, en anderzijds het rekening houden met equivalenten in het kader van de vaststelling van de beschermingsomvang van het octrooi, waar artikel 69 EOV en het Protocol op zien.
4.45.1.
Ten eerste kan het toevoegen van equivalenten aan de octrooiconclusies en de beschrijving een groter effect hebben op de beschermingsomvang. De beschermingsomvang van het octrooi wordt immers bepaald door de conclusies in het licht van de beschrijving zoals die luiden na toevoeging van de equivalenten. Die beschermingsomvang kan onder omstandigheden na de wijziging ook equivalenten van de toegevoegde equivalenten omvatten. Die mogelijkheid doet zich niet voor bij een beroep op equivalentie. Met dat beroep kunnen onder omstandigheden equivalenten onder de beschermingsomvang worden gebracht, maar niet equivalenten van equivalenten.
4.45.2.
Ten tweede kan de toevoeging van een equivalent via een wijziging van het octrooischrift een effect hebben op de nieuwheid, inventiviteit en nawerkbaarheid van het octrooi, in die zin dat het octrooi nieuwheid, inventiviteit of nawerkbaarheid geheel of gedeeltelijk ontleent aan het toegevoegde equivalent. Daarmee zou de aanvrager zich een ongerechtvaardigd voordeel verschaffen, omdat nieuwheid, inventiviteit en nawerkbaarheid worden beoordeeld op de aanvraagdatum, terwijl het equivalent op die datum nog geen onderdeel uitmaakte van de in de oorspronkelijke aanvraag geopenbaarde uitvinding. Dat effect doet zich niet voor bij een beroep op equivalentie ter bepaling van de beschermingsomvang. Equivalenten worden namelijk niet meegewogen bij de beoordeling van nieuwheid en inventiviteit en kunnen ook een gebrek aan niet-nawerkbaarheid niet repareren.
Vanwege deze verschillen stelt artikel 123 lid 2 EOV relatief strenge eisen aan het toevoegen van materie aan het octrooischrift die niet (analoog) moeten worden toegepast bij de bepaling van de beschermingsomvang van een octrooi.
4.46.
De door Fresenius genoemde omstandigheden, zoals dat Lilly niet in discussie is gegaan met het EOB over het op artikel 123 lid 2 EOV gebaseerde bezwaar, dat Lilly een farmaceutische grootmacht is die weloverwogen heeft gekozen voor de beperking tot de toepassing van pemetrexed dinatrium, dat Lilly geen afgesplitste aanvrage heeft ingediend en dat Lilly de octrooiconclusies op andere manieren had kunnen formuleren, kunnen niet leiden tot een ander oordeel. Die omstandigheden laten onverlet dat de gemiddelde vakman uit het verleningsdossier zal opmaken dat Lilly de woorden pemetrexed dinatrium heeft ingevoerd naar aanleiding van het toegevoegde-materie-bezwaar en dat de gemiddelde vakman daaruit geen goede grond zal afleiden voor de beperking van beschermingsomvang tot de toepassing van pemetrexed dinatrium.
4.47.
Het voorgaande zou mogelijk anders zijn als de gemiddelde vakman zou aannemen dat toegevoegde materie geen reëel probleem was en dat er dus een andere reden moet zijn voor de introductie van de bewoordingen pemetrexed dinatrium in de conclusies. Dat heeft Fresenius – terecht – niet gesteld. Fresenius stelt niet dat er geen sprake zou zijn geweest van toegevoegde materie als Lilly een conclusie zou hebben voorgesteld die andere pemetrexedverbindingen omvat, laat staan dat de gemiddelde vakman dat zou hebben ingezien. Fresenius stelt slechts dat Lilly een redelijke kans van slagen had om het bezwaar van de onderzoeksafdeling te pareren. Dat is onvoldoende om te kunnen aannemen dat de gemiddelde vakman zou denken dat er een andere reden is geweest voor de introductie van de bewoordingen, laat staan dat er een andere reden is die een goede grond vormt voor een beperking van de beschermingsomvang.
4.48.
Het betoog van Fresenius dat de gemiddelde vakman uit het octrooischrift en het verleningsdossier zou afleiden dat het gebruik van de term ‘pemetrexed dinatrium’ in de conclusies en beschrijving een bewuste keuze of een niet duidelijk onbedoelde keuze van Lilly is geweest, kan niet leiden tot een andere conclusie. Voor zover Fresenius daarmee doelt op de subjectieve wil of bedoeling van Lilly, kan het betoog worden gepasseerd omdat de subjectieve wil of bedoeling van de aanvrager geen beslissende rol speelt bij de vaststelling van de beschermingsomvang van een octrooi. Voor zover Fresenius het oog heeft op hetgeen de gemiddelde vakman in objectieve zin uit het octrooischrift en het verleningsdossier opmaakt, valt het betoog samen met haar verweer tegen de stelling van Lilly dat er geen goede grond bestaat voor een beperking van de beschermingsomvang tot de toepassing van pemetrexed dinatrium. Dat verweer is hiervoor al verworpen.
4.49.
Daar komt bij dat de gemiddelde vakman op basis van het verleningsdossier zal vaststellen dat het gebruik van de term ‘pemetrexed dinatrium’ in de conclusies zijn oorsprong vindt in een ongelukkige formulering van de aanvrage, waarin Lilly geen, althans geen duidelijke basis heeft gelegd voor een conclusie die het midden houdt tussen enerzijds een (gelet op de stand van de techniek) te breed geformuleerde conclusie die alle antifolaten omvat en anderzijds een (gelet op de bijdrage van het octrooi aan de stand van de techniek) te beperkt geformuleerde conclusie die uitsluitend pemetrexed dinatrium vermeldt. Het gebruik van die formulering in de oorspronkelijke aanvrage kan niet worden aangemerkt als een bewuste of niet duidelijk onbedoelde keuze van Lilly om de beschermingsomvang van het octrooi te beperken tot de toepassing van pemetrexed dinatrium. Integendeel, het is voor de gemiddelde vakman evident dat met die bewoordingen geen beperking van de beschermingsomvang werd beoogd. Voor de gemiddelde vakman die uit het verleningsdossier leert dat dat de achtergrond is van het gebruik van de term pemetrexed dinatrium in de conclusies van het octrooi zoals verleend, is dan ook duidelijk dat Lilly nooit ervoor heeft gekozen de beschermingsomvang te beperken tot toepassing van pemetrexed dinatrium.
4.50.
Voor zover Fresenius heeft bedoeld te betogen dat de rechtszekerheid van derden altijd moet prevaleren als met een zorgvuldige formulering van de oorspronkelijke aanvrage en het octrooischrift een equivalent uitdrukkelijk had kunnen worden geclaimd, moet dat betoog worden verworpen. Een dergelijke opvatting gaat in zijn algemeenheid te ver en gaat eraan voorbij dat bij de vaststelling van de beschermingsomvang van een octrooi rekening moet worden gehouden met een redelijke rechtszekerheid voor derden en een billijke bescherming van de octrooihouder.
4.51.
Het oordeel van de rechtbank dat Lilly niet heeft gesteld dat er sprake is van een onbedoelde fout of omissie in de oorspronkelijke aanvrage, dat Lilly zelf meent dat de oorspronkelijke aanvrage wel basis biedt voor een bredere conclusie en dat Lilly niet heeft gesteld dat de gemiddelde vakman zou begrijpen dat er voor de bredere conclusie geen basis bestaat, moet worden verworpen. In ieder geval in hoger beroep heeft Lilly uitdrukkelijk het standpunt ingenomen dat de oorspronkelijke aanvraag geen basis biedt voor bredere conclusies, dat de gemiddelde vakman dat zal inzien en dat het (achteraf bezien) beter was geweest als de oorspronkelijke aanvraag ‘pemetrexed and pharmaceutically acceptable salts thereof’ had genoemd.
4.52.
Dat Lilly pemetrexed dinatrium in de octrooiaanvrage heeft aangeduid als ‘most preferred’ uitvoeringsvorm, is geen goede grond voor de beperking van de beschermingsomvang tot pemetrexed dinatrium. In die aanvrage stonden geen andere pemetrexedverbindingen dan pemetrexed dinatrium, maar uitsluitend andere antifolaten. Uit het feit dat de toepassing van pemetrexed dinatrium de voorkeur heeft boven andere antifolaten zoals methotrexate en lometrexol zal de gemiddelde vakman niet afleiden dat pemetrexed dinatrium ook voordelen heeft boven andere pemetrexedverbindingen.
4.53.
Ten slotte heeft Fresenius erop gewezen dat de octrooigemachtigde van Lilly in zijn brief van 8 maart 2006 aan de onderzoeksafdeling vermeldt dat Lilly ‘seeks to draw a distinction between subject matter which is relevant to the invention which is indicated as being that to which “the present invention generally relates” and “the subject matter provided by the invention” which is the subject matter claimed’. In die opmerking zal de gemiddelde vakman geen goede grond zien voor een beperking van de beschermingsomvang tot de toepassing van pemetrexed dinatrium met uitsluiting van andere pemetrexedverbindingen. De gemiddelde vakman die het verleningsdossier bestudeert, zal namelijk zien dat het onderscheid waar de octrooigemachtigde op doelt, niet is geïntroduceerd in het kader van de wijziging van de conclusies van pemetrexed naar pemetrexed dinatrium. Het onderscheid maakte al deel uit van de aangepaste beschrijving die Lilly bij brief van 23 december 2004 indiende in het kader van de wijziging van de conclusies van alle antifolaten naar pemetrexed. In het licht daarvan moet worden aangenomen dat het onderscheid betrekking heeft op de toepassing van antifolaten in het algemeen versus de toepassing van het antifolaat pemetrexed. De reden dat de gemachtigde het onderscheid naar voren haalt in zijn brief van 8 maart 2006 is, zoals hij toelicht in de brief, dat de passages over ‘subject matter to which the present invention generally relates’ behouden moeten blijven in de beschrijving omdat die duidelijk maken dat de vermindering van toxiciteit van het antifolaat bij het gebruik van de combinatietherapie relevant is voor de uitvinding. Daaruit zal de gemiddelde vakman niet afleiden dat de beschermingsomvang beperkt is tot pemetrexed dinatrium met uitsluiting van andere pemetrexedverbindingen.
vraag 4: nieuwheid en inventiviteit
4.54.
Fresenius heeft – afgezien van het hierna te bespreken geldigheidsverweer – niet bestreden dat haar product nieuw en inventief is ten opzichte van de stand van de techniek van het octrooi als bedoeld in rechtsoverweging 4.11 van dit arrest. Daarvan kan het hof dus uitgaan.
conclusie beschermingsomvang
4.55.
Op grond van het voorgaande moet worden geconcludeerd dat de grief van Lilly tegen het oordeel van de rechtbank dat zij op passende wijze rekening heeft gehouden met equivalenten, slaagt. Opnieuw rechtdoende moet worden geoordeeld dat het product van Fresenius onder de beschermingsomvang van onder meer conclusie 2 van EP 508 valt. De overige grieven die Lilly in principaal beroep en Fresenius in incidenteel beroep heeft aangevoerd tegen de beoordeling van de beschermingsomvang door de rechtbank, zijn meegewogen in de voorgaande beoordeling door het hof en kunnen verder onbesproken blijven.
4.56.
Het oordeel van het hof over de beschermingsomvang van EP 508 is in overeenstemming met de uitspraken van de hoogste buitenlandse rechters over de beschermingsomvang van de buitenlandse delen van EP 508. Het hof hoeft daarom niet nader toe te lichten hoe zijn oordeel zich verhoudt tot die uitspraken.
4.57.
Het hof komt daarom toe aan de beoordeling van de incidentele grief 6 van Fresenius over de geldigheid van onder meer conclusie 2 van EP 508, die Fresenius naar voren heeft gebracht onder de voorwaarde dat het hof tot het oordeel komt dat haar product binnen de beschermingsomvang van EP 508 valt.
geldigheid conclusie 2
4.58.
Het betoog van Fresenius dat de in conclusie 2 van EP 508 geclaimde uitvinding op voor de gemiddelde vakman voor de hand liggende wijze voortvloeit uit de stand van de techniek, moet om de volgende redenen worden verworpen.
4.59.
Fresenius betoogt dat de geclaimde uitvinding inventiviteit ontbeert omdat:
a. het algemene vakkennis was om antifolaten - waaronder pemetrexed dinatrium - te
gebruiken in combinatie met foliumzuur teneinde de toxiciteit van het antifolaat te reduceren
zonder afbreuk te doen aan de effectiviteit van het antifolaat;
b. het eveneens algemene vakkennis was dat er een samenhang bestond tussen folaat en
vitamine B12 in het metabolisme van een cel, meer in het bijzonder dat met behulp van
vitamine B12 het folaat dat zich in de zogenaamde ‘folaat-val’ bevindt vrij kan worden gemaakt en beschikbaar komt als functioneel folaat;
c. het dus voor de vakman alleen al hierom voor de hand lag om met een redelijke verwachting op succes uit te proberen of een tekort aan functioneel folaat opgelost kan worden door het toedienen van vitamine B12;
d. de stap naar vitamine B12 eens te meer voor de hand liggend was nu het bekend was dat
kankerpatiënten (die vaak al op leeftijd zijn) vaak een vitamine B12 tekort hadden;
e. er overigens geen enkel vooroordeel bestond tegen het gebruik van vitamine B12 bij de
behandeling van kanker.
Deze stellingen zullen hierna achtereenvolgens worden besproken. Mede gelet op hetgeen hiervoor is overwogen over het beperkte belang van de zoutvorm zal pemetrexed dinatrium daarbij kortweg worden aangeduid als pemetrexed.
gebruik antifolaten in combinatie met foliumzuur
4.60.
De stelling van Fresenius dat het algemene vakkennis was om antifolaten, waaronder pemetrexed, te gebruiken in combinatie met foliumzuur teneinde de toxiciteit van het antifolaat te reduceren zonder afbreuk te doen aan de effectiviteit van het antifolaat moet worden verworpen.
4.61.
Lilly heeft daartegen aangevoerd dat de gemiddelde vakman op basis van zijn algemene vakkennis antifolaten juist niet combineerde met foliumzuur, omdat hij verwachtte dat toediening van foliumzuur de werking van het antifolaat ondermijnt. Lilly heeft er daarbij op gewezen dat de gemiddelde vakman zich op basis van zijn algemene vakkennis zou realiseren dat antifolaten en foliumzuur (synthetisch folaat) elkaars werkzaamheid tegenwerken omdat zij in een competitieve relatie tot elkaar staan. Lilly heeft dat onderbouwd met verklaringen van deskundigen (verklaring O’Dwyer, productie 60 van Lilly, en verklaring Chabner, productie 71 van Lilly), een handboek voor clinici dat vermeldt dat foliumzuur de werking kan tegengaan van methotrexaat – een van de twee antifolaten die in Europa op de markt waren (producties 68-70 van Lilly) – en het SmPC van het antifolaat raltitrexed – het andere antifolaat dat in Europa op de markt was – dat expliciet vermeldt dat foliumzuur niet moet worden toegediend in combinatie met het antifolaat omdat het de werking ervan kan beïnvloeden (productie 58.4 van Lilly).
4.62.
Dat de gemiddelde vakman wist dat antifolaten en foliumzuur in een competitieve relatie tot elkaar staan, is als zodanig ook niet in geschil. Fresenius heeft zelf aangevoerd dat antifolaten en via foliumzuur toegediende folaten beiden kunnen binden aan enzymen die een rol spelen bij het delen van cellen en dat als het antifolaat aan het enzym bindt het de binding van het folaat blokkeert en zo voorkomt dat het enzym zijn werk bij het celdelingsproces afmaakt. Zij heeft niet weersproken dat dit behoort tot de algemene vakkennis van de gemiddelde vakman.
4.63.
Fresenius onderbouwt haar stelling ook niet met voorbeelden van combinatietherapieën van een antifolaat met foliumzuur die op de prioriteitsdatum in de klinische praktijk werden gebruikt ter behandeling van kanker. Integendeel, als niet, althans onvoldoende bestreden staat vast dat dergelijke combinatietherapieën niet werden toegepast op de prioriteitsdatum. Bij pleidooi heeft Fresenius wel gewezen op een octrooiaanvraag van Vesta (productie 52 van Fresenius) en een publicatie van Carrasco (productie 51 van Fresenius). Deze documenten openbaren echter geen combinatietherapie van een antifolaat met foliumzuur ter behandeling van kanker. De documenten beschrijven de toediening van onder meer foliumzuur ter behandeling van (de gevolgen van) een verhoogd homocycsteïnegehalte, respectievelijk acute megaloblastische anemie (een bijzondere vorm van bloedarmoede). Dat de publicaties ook vermelden dat die ziektebeelden het gevolg kunnen zijn eerdere toediening van het antifolaat methotrexaat, maakt niet dat zij een combinatiebehandeling in de zin van het octrooi openbaren, laat staan dat zij openbaren dat de combinatie met foliumzuur geen afbreuk doet aan de effectiviteit van het antifolaat.
4.64.
Fresenius onderbouwt haar stelling ook niet met publicaties over klinisch onderzoek naar de combinatie van antifolaten met foliumzuur. Fresenius wijst wel op publicaties over klinisch fase I onderzoek naar de combinatie van foliumzuur en antifolaten zoals pemetrexed (twee abstracts van Hammond, productie 39 en 40 van Fresenius). Fresenius heeft echter zelf benadrukt dat uit dat onderzoek ‘niets’ kan worden geconcludeerd over de effectiviteit van het antifolaat, omdat klinisch fase I onderzoek gericht is op vaststelling van de veiligheid, maximale dosering en farmacokinetiek van het middel, in plaats van de effectiviteit en omdat de kleine aantallen deelnemers aan het onderzoek al veel andere behandelingen hadden gehad. De resultaten van dat onderzoek kunnen dus niet dienen ter onderbouwing van de stelling van Fresenius dat het algemene vakkennis was dat toediening van foliumzuur geen afbreuk doet aan de effectiviteit van een antifolaat.
4.65.
Fresenius baseert haar stelling vooral op diverse publicaties waarin de resultaten van een preklinisch onderzoek naar de toediening van de combinatie van pemetrexed en foliumzuur in muizen worden beschreven (Jackman, productie 32 van Fresenius, en het abstract en het artikel van Worzalla, producties 37 en 38 van Fresenius, en Cripps, productie 35 van Fresenius). Resultaten van preklinisch onderzoek zijn echter onvoldoende om de stelling van Fresenius te dragen dat het algemene vakkennis was om antifolaten te gebruiken in combinatie met foliumzuur zonder afbreuk te doen aan de effectiviteit van het antifolaat, zeker in het licht van de hierboven genoemde kennis van de gemiddelde vakman over de competitieve relatie tussen antifolaten en foliumzuur. Het kan algemene vakkennis zijn dat de resultaten van een preklinisch onderzoek gunstige effecten van toediening van foliumzuur ‘suggereren’, zoals de door Fresenius aangehaalde Jackman het formuleert, maar dat is niet hetzelfde als dat het algemene vakkennis is dat die effecten er zijn.
4.66.
Daar komt bij dat de gepubliceerde preklinische onderzoeksresultaten duidelijk maken dat bij toediening van foliumzuur pemetrexed in veel hogere doses moest worden toegediend aan muizen om eenzelfde effect te bereiken. De publicaties leren dat bij muizen die geen foliumzuur kregen toegediend tumorgroei al volledig werd geremd met een dosis van 0,3 mg/kg. Bij muizen die wel foliumzuur kregen, werd dat effect pas bereikt bij een honderd keer hogere dosis, te weten 30 mg/kg. Mede gelet op de kennis van de gemiddelde vakman over de competitieve relatie tussen folaten en antifolaten, zou de gemiddelde vakman op basis van die resultaten niet zonder nader onderzoek aannemen dat bij toediening van foliumzuur de werking van pemetrexed behouden blijft.
4.67.
Het betoog van Fresenius dat de preklinische onderzoeksresultaten (en de resultaten van fase I klinisch onderzoek) er ook op wijzen dat foliumzuur bepaalde bijwerkingen van pemetrexed vermindert en dat daarom door toediening van foliumzuur pemetrexed in hogere doses kan worden toegediend, moet worden gepasseerd. Feit blijft dat de preklinische onderzoeksresultaten slechts suggereren dat de werking van pemetrexed wordt behouden bij die hoge doses en dat de resultaten van het fase I klinische onderzoek de gemiddelde vakman volgens Fresenius op dat punt niet verder helpen. Daar komt bij dat Lilly niet, althans onvoldoende bestreden heeft aangevoerd dat het gebruikte muizenexperiment, met kankercellen die specifiek zijn ontworpen om gevoelig te zijn voor pemetrexed, een slechte voorspellende waarde heeft voor de relatie tussen toxiciteit en werkzaamheid. Uit het feit dat de onderzoeksresultaten van het muizenexperiment suggereren dat bij hoge doses pemetrexed in combinatie met foliumzuur bepaalde bijwerkingen van pemetrexed zijn verminderd en de werking van pemetrexed op de specifieke kankercellen is behouden, volgt dus niet dat de gemiddelde vakman zonder nader onderzoek zou aannemen dat dit ook zo zal zijn bij gewone kankercellen.
4.68.
Het betoog van Fresenius dat het op basis van de bedoelde preklinische onderzoeksresultaten (en de resultaten van het fase I klinische onderzoek) voor de gemiddelde vakman wel voor de hand lag om nader te onderzoeken of de toediening van foliumzuur de bijwerkingen van pemetrexed zou reduceren zonder afbreuk te doen aan de werkzaamheid van pemetrexed, kan worden gepasseerd. De door Lilly in EP 508 geclaimde uitvinding betreft immers niet de combinatie van pemetrexed met enkel foliumzuur. Dat onder meer de Amerikaanse en Japanse rechter een octrooiconclusie die wel op die combinatie van pemetrexed met enkel foliumzuur was gericht, niet-inventief hebben gevonden, is, anders dan Fresenius meent, dus niet relevant voor de beoordeling van de geldigheid van EP 508.
4.69.
Fresenius baseert de kennis over het gebruik van de combinatie van antifolaten en foliumzuur daarnaast op de Amerikaanse octrooiaanvraag van Grindey (US 5 217 974, productie 78 van Lilly), waarin een mechanisme wordt voorgesteld voor het verminderen van toxiciteit van een specifiek soort antifolaat (waaronder lometrexol) door voorbehandeling met een bepaald soort eitwitbindend middel (zoals foliumzuur). Daargelaten dat één octrooiaanvraag onvoldoende is om de gestelde algemene vakkennis te onderbouwen, moet worden aangenomen dat de leer van deze octrooiaanvraag op de prioriteitsdatum achterhaald was. Lilly heeft gewezen op de latere publicatie van Laohavinij (bijlage 3 bij productie 58 van Lilly), die een veel uitgebreider klinisch onderzoek naar de combinatie van lometrexol en foliumzuur beschrijft (de studie van Laohavinij betreft een klinisch onderzoek met 43 patiënten terwijl Grindey gegevens van slechts één patiënt bevat). In overeenstemming met de door Lilly gestelde scepsis over het effect van foliumzuur vermeldt Laohavinij uitdrukkelijk de zorg dat de toediening van foliumzuur de werking van het antifolaat zal omzeilen of tumorgroei zelfs zal ondersteunen. De resultaten van haar onderzoek nemen die zorg niet weg. Laohavinij beschrijft dat de klinisch respons van lometrexol die werd waargenomen bij toediening van alleen lometrexol, in het algemeen niet werd geconstateerd bij de toediening van lometrexol in combinatie met foliumzuur. Bij toediening van foliumzuur bleek slechts één patiënt een gedeeltelijke respons te vertonen.
4.70.
Ten slotte lijkt Fresenius de gestelde kennis over de combinatie van antifolaten en foliumzuur te willen onderbouwen met haar stelling dat de gemiddelde vakman wist dat tumorcellen sneldelende cellen zijn die meer foliumzuur nodig hebben dan gezonde cellen. Die stelling moet worden verworpen. Lilly heeft de stelling gemotiveerd en onderbouwd met verklaringen van deskundigen betwist. Lilly heeft in dat verband er onder meer op gewezen dat er ook gezonde sneldelende cellen zijn, zoals die in het beenmerg en maagdarmkanaal, en dat antifolaten geen onderscheid maken tussen gezonde cellen en kankercellen. Fresenius heeft de stelling ook alleen onderbouwd met een citaat uit hoofdstuk 12 uit de bundel van Jackman, waarin de toediening van foliumzuur wordt geopperd als een maatregel die de respons zou kunnen (‘may’) normaliseren door folaat pools te herstellen in weefsel met een lage behoefte aan folaat. Die suggestie is in Jackman niet onderbouwd met onderzoeksresultaten. Bovendien wordt de suggestie gedaan in een hoofdstuk over de antifolaten lometrexol en LY309887. Zoals hiervoor al vastgesteld, wist de gemiddelde vakman op de prioriteitsdatum dat klinisch onderzoek naar de combinatie van lometrexol met foliumzuur de in Jackman gedane suggestie niet ondersteunde.
samenhang folaat en vitamine B12 en folaatval
4.71.
In het midden kan blijven of de door Fresenius beschreven kennis van de samenhang tussen folaat en vitamine B12 behoort tot de algemene vakkennis. Voor zover dat niet het geval is moet de inventiviteitsaanval al daarop stranden, want Fresenius niet heeft toegelicht waarom de gemiddelde vakman informatie zou raadplegen over de samenhang tussen folaat en vitamine B12 en de folaatval. Voor zover de bedoelde kennis wel behoort tot algemene vakkennis, kan dat niet leiden tot het oordeel dat de geclaimde uitvinding inventiviteit ontbeert. Het ligt op basis van die kennis voor de gemiddelde vakman niet voor de hand om met een redelijke verwachting van succes te onderzoeken of een tekort aan functioneel folaat kan worden opgelost door toediening van vitamine B12.
4.72.
Anders dan Fresenius suggereert, volgt uit de publicaties die Fresenius aanhaalt ter onderbouwing van de gestelde kennis over de samenhang tussen folaat en vitamine B12 (Baynes, productie 33 van Fresenius, en Scott, productie 34 van Fresenius) niet dat er bij de behandeling van kanker met pemetrexed sprake is van een problematisch tekort aan functioneel folaat en evenmin dat toediening van vitamine B12 er altijd toe leidt dat een tekort aan functioneel folaat wordt opgelost. De publicaties van Baynes en Scott beschrijven dat een tekort aan vitamine B12 tot gevolg heeft dat folaat (5-methyl-tetrahydrofolaat of 5-MTHF) niet wordt omgezet in functioneel folaat (tetrahydrofolaat of THF). Daaruit leert de gemiddelde vakman dat toediening van vitamine B12 een effect heeft op de hoeveelheid functioneel folaat als er sprake is van een tekort aan vitamine B12. De gemiddelde vakman zou op basis van deze kennis dus alleen een effect van toediening van vitamine B12 verwachten bij de patiënten met een tekort aan vitamine B12.
4.73.
Een aanwijzing dat patiënten die pemetrexed krijgen toegediend een tekort aan functioneel folaat of een tekort aan vitamine B12 hebben, haalt de gemiddelde vakman niet uit Baynes en Scott. Zij presenteren de informatie over de samenhang tussen folaat en vitamine B12 namelijk niet in het kader van de behandeling van kanker. Zij beschrijven de samenhang tussen folaten en vitamine B12 in de context van hematologische afwijkingen, zoals megaloblastische anemie en pernicieuze anemie (vormen van bloedarmoede), en neuropathie (zenuwbeschadiging). Dat betekent dat de gemiddelde vakman op basis van deze publicaties alleen bij het optreden van de beschreven hematologische afwijkingen en neuropathie reden heeft om te veronderstellen dat sprake is van een tekort aan functioneel folaat en om te onderzoeken of dat tekort aan functioneel folaat wordt veroorzaakt door een tekort aan vitamine B12. Bij de behandeling van kanker met pemetrexed heeft de gemiddelde vakman op basis van deze publicaties geen reden om te veronderstellen dat er sprake is van een tekort aan functioneel folaat dat verholpen moeten worden. Integendeel, de gemiddelde vakman wist dat therapeutische werking van antifolaten zoals pemetrexed is gebaseerd op de competitieve relatie tussen antifolaten en folaten en dat de behandeling met een antifolaat in die zin juist gericht is op het creëren van een tekort aan functioneel folaat (zie hiervoor 4.62). Daar komt bij dat de gemiddelde vakman op basis van deze publicaties geen reden heeft te onderzoeken of de bijwerkingen van pemetrexed worden veroorzaakt door een eventueel tekort aan vitamine B12. Uit het gegeven dat het gaat om bijwerkingen volgt immers dat die worden veroorzaakt door toediening van het antifolaat pemetrexed en Lilly heeft onweersproken aangevoerd dat de gemiddelde vakman wist dat pemetrexed ingrijpt in de DNA-cyclus in plaats van de cyclus waarin vitamine B12 een rol speelt.
4.74.
Als de gemiddelde vakman ondanks het voorgaande zou zijn nagegaan of patiënten die pemetrexed krijgen toegediend een tekort aan vitamine B12 hebben, zou hij zijn gestuit op de publicaties van Niyikiza (bijlage 11 bij productie 58 van Lilly) en Zervos (bijlage 12, bij productie 58 van Lilly). Beide publicaties leren de gemiddelde vakman dat geen correlatie is waargenomen tussen de specifieke biomarker voor de status van vitamine B12 (methylmalonzuur ofwel MMA) en de toxiciteit van pemetrexed. Gesteld noch gebleken is dat er andere publicaties zijn die wel een correlatie tussen de status van vitamine B12 en de toxiciteit van pemetrexed openbaren. In het licht daarvan kan niet als vaststaand worden aangenomen dat de gemiddelde vakman zou verwachten dat patiënten die pemetrexed kregen toegediend een tekort aan vitamine B12 hadden (zie ook hierna rechtsoverweging 4.84 over het gestelde tekort van vitamine B12 bij kankerpatiënten in het algemeen).
4.75.
Daar komt bij dat de hematologische context waarin de samenhang tussen folaat en vitamine B12 wordt gepresenteerd meebrengt dat de kennis over die samenhang de gemiddelde vakman niets leert over het effect van de toediening van vitamine B12 op de bijwerkingen en therapeutische werkzaamheid van pemetrexed. De opmerking van Fresenius dat Baynes op andere plekken in zijn boek wel de behandeling van kanker met antifolaten en DNA-synthese bespreekt, maakt dat niet anders. Die passages verwijzen niet naar de samenhang tussen folaten en vitamine B12 en andersom verwijst de passage die de samenhang tussen folaten en vitamine B12 beschrijft, niet naar de passages over de behandeling van kanker met antifolaten.
4.76.
Als de gemiddelde vakman toch zou aannemen dat toediening van vitamine B12 leidt tot meer functioneel folaat en hij een verband zou leggen tussen de toename van functioneel folaat en de bijwerkingen en therapeutische werkzaamheid van pemetrexed, leidt hem dat nog niet tot de oplossing van het objectieve probleem. Lilly heeft naar voren gebracht dat de gemiddelde vakman zou verwachten dat de gestelde toename van functioneel folaat de therapeutische werking van pemetrexed ondergraaft. Lilly heeft in dat kader verwezen naar de – hiervoor al beschreven en als zodanig niet ter discussie staande – kennis van de gemiddelde vakman over de competitieve relatie tussen folaten en antifolaten. Dat de gemiddelde vakman geen redelijke verwachting op behoud van de werkzaamheid van pemetrexed had, wordt verder ondersteund door de door Lilly overgelegde verklaringen van deskundigen (Chabner, productie 71, O’Dwyer, productie 64 en Calvert, productie 58), die allen verklaren dat zij op de prioriteitsdatum het tegendeel zouden hebben verwacht, en tot de stand van de techniek behorende publicaties die leren dat toediening van vitamine B12 de groei van tumoren stimuleert (Vidal, productie 5 van Lilly, en McLean, productie 76 van Lilly).
4.77.
Fresenius heeft niet gesteld dat de gemiddelde vakman zou menen dat toediening van vitamine B12 eenzelfde effect zou hebben op de bijwerkingen en therapeutische werking van pemetrexed als toediening van foliumzuur en dat de gemiddelde vakman daarom op basis van de hiervoor bedoelde resultaten van het preklinische onderzoek met de combinatie van foliumzuur en pemetrexed redelijkerwijs zou verwachten dat de toediening van vitamine B12 de bijwerkingen van pemetrexed vermindert met behoud van de therapeutische werking. Voor zover Fresenius heeft bedoeld te stellen dat de gemiddelde vakman dat wel zou verwachten op basis van de beschreven samenhang van folaat en vitamine B12, moet die stelling bij gebrek aan toelichting en onderbouwing worden verworpen, mede gelet op hetgeen Lilly heeft aangevoerd over de verschillen tussen foliumzuur en vitamine B12.
4.78.
Ten eerste heeft Lilly als zodanig onbestreden aangevoerd dat via foliumzuur toegediend folaat in het kader van het folaatmetabolisme een substraat is, dat wil zeggen een stof die wordt geconsumeerd, terwijl vitamine B12 in dat proces een cofactor is, dat wil zeggen een stof die niet wordt geconsumeerd en dus steeds opnieuw wordt gebruikt. Gelet daarop kan niet worden aangenomen dat de gemiddelde vakman zonder meer zal menen dat de toediening van vitamine B12 eenzelfde effect heeft op de aanmaak van functioneel folaat als de toediening van foliumzuur, laat staan eenzelfde effect op de bijwerkingen en therapeutische werking van pemetrexed.
4.79.
Ten tweede heeft Lilly naar voren gebracht dat foliumzuur de folaatval kan omzeilen. Bij toediening van foliumzuur in hoge concentraties zal volgens Lilly het folaat in inactieve vorm de cel binnendringen en de DNA-cyclus, die verantwoordelijk is voor de bijwerkingen en de therapeutische werking van pemetrexed, draaiende houden. Ook daarvan uitgaande kan niet worden aangenomen dat de gemiddelde vakman zonder meer zal menen dat de toediening van vitamine B12 eenzelfde effect heeft op de aanmaak van functioneel folaat als de toediening van foliumzuur, laat staan eenzelfde effect op de bijwerkingen en therapeutische werking van pemetrexed.
4.80.
Lilly heeft de gestelde omzeiling van de folaatval onderbouwd met diverse deskundigenverklaringen en een verwijzing naar het door Fresenius zelf overgelegde handboek van Scott, die dat proces expliciet beschrijft (productie 34 van Fresenius). Fresenius en de door haar ingeschakelde deskundige Molloy lijken ook niet te bestrijden dat de folaatval wordt omzeild als foliumzuur in hoge concentraties wordt toegediend. De verklaring van Molloy duidt de door Scott beschreven omzeiling aan als ‘a situation that could occur where large doses folic acid are ingested’ en noemt het ‘biologically plausible’ dat die omzeiling werkt doordat foliumzuur de cel binnendringt en deelneemt aan de DNA-cyclus (verklaring Molloy, productie 50 van Fresenius, pagina 5). Fresenius bestrijdt wel dat kankerpatiënten hoge doses foliumzuur zouden worden gegeven. Die tegenwerping kan alleen al niet slagen omdat in het klinische onderzoek naar de combinatie van pemetrexed en foliumzuur gebruik werd gemaakt van een dosis van 3 mg of meer, terwijl de omzeiling volgens Scott al optreedt bij doses van 1 mg.
4.81.
Daar komt bij dat, zoals hiervoor is vastgesteld, de resultaten van het preklinische onderzoek naar de combinatie van pemetrexed met foliumzuur de gemiddelde vakman ook niet zonder meer leren dat toediening van foliumzuur de bijwerkingen van pemetrexed vermindert en de therapeutische werkzaamheid daarvan behoudt. Die onzekerheid over het behoud van de werkzaamheid van pemetrexed bij de toediening van foliumzuur en de hiervoor beschreven onzekerheid over de effecten van toediening van vitamine B12 in vergelijking met de effecten van de toediening van foliumzuur brengen, in samenhang beschouwd, mee dat niet kan worden volgehouden dat het voor de gemiddelde vakman voor de hand lag om met een redelijke verwachting van succes te onderzoeken of toediening van vitamine B12 de bijwerkingen van pemetrexed vermindert zonder afbreuk te doen aan therapeutische werkzaamheid van pemetrexed.
4.82.
Op zich heeft Fresenius terecht aangevoerd dat bij de beantwoording van de vraag of de gemiddelde vakman de toediening van vitamine B12 zou onderzoeken, de omvang van de mogelijke ‘beloning’ moet meewegen. Anders dan Fresenius betoogt, pleit die factor in dit geval echter niet ondubbelzinnig voor het standpunt van Fresenius over de inventiviteit van de in conclusie 2 geclaimde uitvinding. Weliswaar is de beloning van een succesvolle behandeling van kanker groot, maar Lilly heeft onderbouwd en onbestreden opgemerkt dat op de prioriteitsdatum bekend was dat uit klinisch onderzoek was gebleken dat de toxiciteit van pemetrexed – zonder vitamine B12 en foliumzuur – verdraagbaar en beheersbaar was (pas na die datum is onderzoek gepubliceerd dat openbaarde dat pemetrexed wel degelijk zeer ernstige bijwerkingen had). Ervan uitgaande dat de gemiddelde vakman veronderstelde dat de bijwerkingen van pemetrexed redelijk onder controle waren, zou de gemiddelde vakman hebben gedacht dat hij relatief weinig te winnen had bij een middel dat de bijwerkingen verder verlaagt en moet worden aangenomen dat zijn zorgen over het behoud van de werking van pemetrexed relatief zwaar wogen.
4.83.
Dat het voor de gemiddelde vakman niet voor de hand lag om vitamine B12 toe te voegen aan een behandeling van kanker met de combinatie van een antifolaat en foliumzuur wordt bevestigd door het tussen partijen vaststaande feit dat in geen van de klinische studies die op de prioriteitsdatum waren uitgevoerd met de combinatie van een antifolaat en foliumzuur, vitamine B12 werd toegediend. De documenten Grindey (productie 78 van Lilly), Laohavinij (bijlage 3 bij productie 58 van Lilly), Rees (bijlage 5 bij productie 58 van Lilly), Hammond (producties 39 en 40 van Fresenius) die die studies beschrijven, opperen ook niet om vitamine B12 te gebruiken. Vesta (productie 52 van Fresenius) en Carrasco (productie 51 van Fresenius) beschrijven wel toediening van een combinatie van foliumzuur en vitamine B12, maar in de in die publicaties beschreven gevallen werden die vitamines niet toegediend in combinatie met het antifolaat (zie hiervoor 4.63).
vitamine B12 tekort
4.84.
De stelling van Fresenius dat het bekend was dat 15 tot 20% van de kankerpatiënten in het algemeen een tekort aan vitamine B12 hebben, kan niet leiden tot een ander oordeel. Zoals hiervoor al is vastgesteld, weet de gemiddelde vakman dat dat tekort niet de oorzaak is van de bijwerkingen van pemetrexed, daarin gesteund door publicaties die geen correlatie tussen de status van vitamine B12 en de toxiciteit van pemetrexed openbaren, en zou de gemiddelde vakman redelijkerwijs ook niet verwachten dat toediening van vitamine B12 de bijwerkingen van pemetrexed zou verminderen zonder afbreuk te doen aan de therapeutische werkzaamheid van pemetrexed. De gemiddelde vakman zou daarom niet kiezen voor een combinatie van pemetrexed met vitamine B12 in het kader van de behandeling van kanker.
4.85.
De stelling van Fresenius dat een tekort aan vitamine B12 op termijn kan leiden tot hematologische afwijkingen zoals neutropenie, maakt dat niet anders. Dat feit maakt het voor de gemiddelde vakman niet voor de hand liggend om bij constatering van een vitamine B12 tekort de toediening van vitamine B12 onderdeel te maken van de behandeling van kanker met pemetrexed. Integendeel, vanwege de mogelijke interactie met het antifolaat ligt het voor de hand om de behandeling van de bedoelde hematologische afwijkingen te scheiden van de behandeling met pemetrexed. Dat kan enerzijds door voorrang te geven aan de doorgaans dringende noodzaak van een behandeling van kanker met pemetrexed boven de behandeling van de gezondheidsproblemen ten gevolge van een tekort aan vitamine B12. Bij ernstige gezondheidsproblemen ten gevolge van een tekort aan vitamine B12 kan anderzijds worden geconcludeerd dat de patiënt niet gezond genoeg is om een behandeling met pemetrexed te ondergaan, in welk geval dus evenmin sprake zal zijn van toediening van een combinatie van foliumzuur en pemetrexed. De door Lilly overgelegde verklaringen van deskundigen ondersteunen dat die beide opties, en niet de combinatietherapie van pemetrexed en vitamine B12, voor de gemiddelde vakman voor de hand zouden liggen bij de veronderstelde constatering van een tekort aan vitamine B12.
geen vooroordeel
4.86.
Het betoog van Fresenius dat er geen vooroordeel bestond tegen het gebruik van vitamine B12 bij de behandeling van kanker, kan worden gepasseerd. De stelling dat er geen vooroordeel bestond tegen dat gebruik van vitamine B12 is onvoldoende om de inventiviteit van de geclaimde uitvinding te bestrijden.
4.87.
Het hiervoor gegeven oordeel over de inventiviteit van de in conclusie 2 van EP 508 geclaimde uitvinding is ook niet gebaseerd op het overwinnen van een vooroordeel. Wel is de door Lilly naar voren gebrachte scepsis over het behoud van de werkzaamheid van pemetrexed bij toediening van vitamine B12 en/of foliumzuur meegewogen bij de beoordeling van onder meer de stelling Fresenius dat de gemiddelde vakman bekend was om antifolaten toe te dienen in combinatie met foliumzuur teneinde de toxiciteit van het antifolaat te reduceren zonder afbreuk te doen aan de effectiviteit van het antifolaat en de stelling van Fresenius dat het voor de hand lag om met een redelijke verwachting van succes uit te proberen of een tekort aan functioneel folaat kon worden opgelost door het toedienen van vitamine B12. Die scepsis heeft Lilly ook goed onderbouwd met onder meer niet ter discussie staande kennis over de competitieve relatie tussen folaten en antifolaten, deskundigenverklaringen en documenten uit de stand van de techniek.
problem-solution approach
4.88.
Naast de hiervoor in 4.59 beschreven argumentatie heeft Fresenius een op de problem-solution approach gebaseerde aanval op de inventiviteit van de in conclusie 2 geclaimde uitvinding naar voren gebracht. Ook die redenering kan niet leiden tot het oordeel dat die uitvinding niet inventief is.
4.89.
In het midden kan blijven of hoofdstuk 8 van de bundel Antifolate Drugs in Cancer Therapy van Jackman (productie 32 van Fresenius, hierna Jackman), in het licht van de hiervoor besproken scepsis van gemiddelde vakman over het effect van toediening van foliumzuur, kan worden aangemerkt als de meest nabije stand van de techniek, dat wil zeggen een realistisch vertrekpunt voor de beoordeling van de inventiviteit. Als met Fresenius wordt aangenomen dat dit het geval is, kan dat om de volgende redenen niet leiden tot het oordeel van de in conclusie 2 geclaimde uitvinding niet inventief is.
4.90.
Hoofdstuk 8 van Jackman beschrijft onder meer het hiervoor al besproken preklinische onderzoek naar de combinatie van pemetrexed met foliumzuur in muizen. Het (belangrijkste) verschil met de in conclusie EP 508 geclaimde uitvinding is het gebruik van vitamine B12 of een farmaceutisch aanvaardbaar derivaat daarvan. Niet in geschil is dat het effect van die aanvullende maatregel is: een vermindering van de toxische bijwerkingen van pemetrexed met behoud van therapeutische werkzaamheid van pemetrexed. Daarvan uitgaande moet het objectieve probleem dat de in conclusie 2 geclaimde uitvinding oplost worden geformuleerd als het verminderen van de toxische bijwerkingen van pemetrexed, met behoud van de therapeutische werkzaamheid ervan. Ook Fresenius gaat daarvan uit.
4.91.
Fresenius heeft betoogd dat de gemiddelde vakman ter oplossing van het objectieve probleem zou kijken naar verbeteringen die worden gesuggereerd voor vergelijkbare antifolaten. Fresenius wijst in dit verband op hoofdstuk 12 van diezelfde bundel van Jackman (productie 32 van Fresenius). Daarin wordt bij de beschrijving van de antifolaten lometrexol en LY309887 onder meer wordt gesproken over ‘modulating antifolate toxicities through vitamin supplementation’ en wordt vermeld dat ‘the biochemical pathways that utilize folate cofactors also require adequate amounts of vitamins B12 and B6’. Op basis van deze informatie ligt de in conclusie 2 geclaimde uitvinding niet voor de hand om dezelfde redenen als dat hiervoor is geoordeeld op basis van de kennis over de samenhang tussen foliumzuur en vitamine B12 (zie hiervoor 4.72 en verder). Ook op basis van deze informatie heeft de gemiddelde vakman geen redelijke verwachting dat toediening van vitamine B12 de bijwerkingen van pemetrexed zal vermindering zonder afbreuk te doen aan de werking van pemetrexed, mede gelet op de scepsis die bestond over het effect van toediening van vitamine B12.
4.92.
Daar komt bij dat Lilly terecht heeft aangevoerd dat de gemiddelde vakman zal inzien dat de bedoelde citaten uit Jackman suggesties zijn die niet worden onderbouwd door onderzoek. Jackman vermeldt in het bedoelde hoofdstuk zelfs expliciet dat de folaatstatus van kankerpatiënten niet systematisch is geëvalueerd. Mede gelet op de scepsis die bestond over het effect van de toediening van vitamine B12, zou de gemiddelde vakman op basis van enkel een dergelijke, niet-onderbouwde suggestie redelijkerwijs niet verwachten dat hij het objectieve probleem zou oplossen met toevoeging van vitamine B12 aan de combinatie van pemetrexed en foliumzuur.
4.93.
Bovendien zou de gemiddelde vakman voordat hij toevoeging van vitamine B12 aan een behandeling met pemetrexed overweegt, nagaan of meer bekend is over de in Jackman beschreven andere antifolaten. Hij zal dan stuitten op de hiervoor als besproken publicatie van Laohavinij, die een klinisch onderzoek beschrijft naar de combinatie van lometrexol en foliumzuur (bijlage 3 bij productie 58 van Lilly). Zoals hiervoor overwogen, uit Laohavinij in die publicatie uitdrukkelijk de zorg dat de toediening van foliumzuur de werking van het antifolaat zal omzeilen of tumorgroei zelfs zal ondersteunen en nemen de resultaten van haar onderzoek die zorg niet weg. Bovendien is niet in geschil dat de gemiddelde vakman op de prioriteitsdatum wist dat de ontwikkeling van lometrexol was stopgezet. De gestelde pointer van Jackman leidt de gemiddelde vakman dus op een dood spoor.
conclusie inventiviteit
4.94.
Op grond van het voorgaande moet worden geoordeeld dat de aanval van Fresenius op de inventiviteit van conclusie 2 van EP 508 niet slaagt. Dat brengt mee dat die conclusie geldig moet worden geacht. Bij die stand van zaken kan de geldigheid van de overige conclusies van EP 508 onbesproken blijven, want inbreuk op conclusie 2 van EP 508 volstaat voor toewijzing van de vorderingen van Lilly en een vordering van Fresenius tot nietigverklaring van het octrooi ligt niet voor.
4.95.
Deze uitkomst is in overeenstemming met het door Lilly aangehaalde beslissing van de oppositieafdeling van het Europees Octrooibureau over EP 508 (productie 7 van Lilly) en het oordeel van de Zwitserse rechter over het Zwitserse deel van EP 508 (productie 48 van Lilly)(en het oordeel van de Amerikaanse en Japanse rechter over respectievelijke een parallel Amerikaans en Japans octrooi). Het hof is zich ervan bewust dat de uitkomst wel afwijkt van het oordeel van het Duitse Bundespatentgericht over het Duitse deel van EP 508. Op basis van de stellingen en bewijsmiddelen die partijen in deze procedure hebben ingebracht kan het hof echter niet de conclusie van de Duitse rechter onderschrijven dat de in conclusie 2 geclaimde uitvinding voor de gemiddelde vakman voor de hand lag.
vorderingen
4.96.
Ervan uitgaande dat het product van Fresenius onder de beschermingsomvang van conclusie 2 van EP 508 valt en dat die conclusie geldig is, moet worden geconcludeerd dat Fresenius door de verhandeling van dat product inbreuk heeft gemaakt op het octrooi. Fresenius heeft namelijk uitdrukkelijk erkend dat zij weet dat haar product in combinatie met vitamine B12 en foliumzuur wordt gebruikt voor de behandeling van kanker (conclusie van antwoord, paragraaf 21 sub b). Gelet daarop heeft Fresenius direct inbreuk gemaakt, omdat Fresenius heeft voorzien dat het door haar vervaardigde geneesmiddel welbewust zou worden aangewend voor de behandeling waarop het octrooi ziet (het remmen van tumorgroei), en/of indirect inbreuk gemaakt, omdat Fresenius het product heeft aangeboden en geleverd aan personen die niet tot toepassing van de uitvinding gerechtigd waren terwijl zij wist dat het product geschikt en bestemd was voor de geoctrooieerde indicatie.
4.97.
Gegeven het voorgaande oordeel over de inbreuk is het door Lilly gevorderde verbod op inbreuk toewijsbaar. Dat Fresenius zich anderszins schuldig zou maken aan onrechtmatige handelingen volgt niet uit de stellingen van Lilly. Het verbod op onrechtmatig handelen zal daarom worden afgewezen.
4.98.
Lilly heeft niet toegelicht welk belang zij heeft bij de gevorderde verklaring voor recht naast het toe te wijzen verbod en de toe te wijzen veroordeling tot schadevergoeding, ook niet nadat Fresenius had aangevoerd dat Lilly daar geen belang bij heeft. Die vordering zal daarom bij gebrek aan belang worden afgewezen.
4.99.
Fresenius heeft terecht naar voren gebracht dat een accountant de opgave van Fresenius op grond van zijn beroepsregels niet kan certificeren. De primaire vordering moet daarom worden afgewezen. Subsidiair heeft Lilly gevorderd dat een accountant een rapport van bevindingen opstelt. Fresenius heeft niet aangevoerd dat ook die vordering onuitvoerbaar is of dat Lilly daarbij geen belang heeft. Daarom zal de vordering in die subsidiaire variant worden toegewezen.
4.100. Wat betreft de inhoud van de opgave heeft Fresenius terecht aangevoerd dat Lilly geen belang heeft bij hernieuwde opgave van de gegevens die Fresenius Lilly al heeft verstrekt ter uitvoering van het kortgedingvonnis (de onder a, b en c gevorderde gegevens). Na die datum gold aanvankelijk het bij dat vonnis opgelegde verbod. Dat is weliswaar tijdelijk vervallen met het afwijzende vonnis van de rechtbank in deze zaak, maar Fresenius heeft onweersproken aangevoerd dat zij vanaf het kortgedingvonnis geen voorbehouden handelingen meer heeft verricht in Nederland. Daarom moet worden aangenomen dat Lilly geen belang heeft bij deze opgave en zal uitsluitend de opgave over de genoten winst worden toegewezen (de sub d gevorderde gegevens).
4.101. Gelet op het hiervoor vastgestelde feit dat Fresenius vanaf het kortgedingvonnis geen voorbehouden handelingen meer heeft verricht in Nederland en de tijd die is verstreken sinds dat vonnis, bestaat er geen aanleiding voor de gevorderde recall van producten. Ook kan niet worden aangenomen dat Lilly belang heeft bij de gevorderde rectificatie in het licht van hetgeen Fresenius daarover onweersproken heeft aangevoerd.
4.102. De toe te wijzen verboden en bevelen zullen worden versterkt met dwangsommen. Ter voorkoming van executiegeschillen zullen de dwangsommen voor het verbod worden gemaximeerd op € 10.000.000,- en die voor de overige veroordelingen op € 1.000.000,-.
4.103. De gevorderde schadevergoeding en winstafdracht zullen ook worden toegewezen, met dien verstande dat de winstafdracht niet kan cumuleren met de vergoeding van schade bestaande uit gederfde winst. In de schadestaatprocedure zal Lilly dus een keuze moeten maken tussen winstafdracht en vergoeding van schade bestaande uit gederfde winst, naast een vergoeding van eventuele andere schade. Het betoog van Fresenius dat zij niet wist en redelijkerwijs niet kon weten dat zij inbreuk maakte, moet worden verworpen. Fresenius heeft niet bestreden dat Lilly haar meermaals erop heeft gewezen dat zij inbreuk maakte. Dat Fresenius op basis van – later vernietigde – uitspraken van buitenlandse rechters heeft gedwaald over de beschermingsomvang van EP 508 moet voor haar rekening komen.
4.104. Als grotendeels in het ongelijk gestelde partij moet Fresenius worden veroordeeld in de kosten van de procedure in eerste aanleg en in principaal en incidenteel beroep. Partijen zijn overeengekomen dat de redelijke en evenredige kosten van de procedure in eerste aanleg en het tussen partijen in twee instanties gevoerde kort geding samen kunnen worden begroot op € 400.000,-. Omdat Lilly al betaling van € 150.000,- heeft gevorderd in het kort geding, maakt zij voor de eerste aanleg van deze bodemprocedure aanspraak op € 250.000,-. Wat betreft het hoger beroep van deze bodemprocedure zijn partijen overeengekomen dat de kosten moeten worden begroot op € 300.000,- voor het principaal en incidenteel beroep gezamenlijk. Het hof ziet geen aanleiding om af te wijken van die begroting.
4.105. Ten slotte staat als onbestreden vast dat Lilly ter uitvoering van de bij het bestreden vonnis opgelegde proceskostenveroordeling € 400.000,- heeft voldaan aan Fresenius. De vordering tot terugbetaling van dat bedrag is dus ook toewijsbaar.
5. De beslissing
Het hof
5.1.
vernietigt het tussen partijen gewezen vonnis van de rechtbank Den Haag van 19 juli 2019 en opnieuw rechtdoende:
5.1.1.
beveelt Fresenius met onmiddellijke ingang na betekening van dit arrest iedere directe dan wel indirecte inbreuk op EP 508 in Nederland te staken en gestaakte te houden, zulks op straffe van verbeurte van een dwangsom van € 100.000,- voor iedere dag of gedeelte van een dag dat Fresenius het bevel geheel of gedeeltelijk niet nakomt of – ter vrije keuze van Lilly – van € 100.000,- voor ieder inbreukmakend product waarmee Fresenius het bevel geheel of gedeeltelijk niet nakomt met een maximum van € 10.000.000,-;
5.1.2.
beveelt Fresenius binnen 21 dagen na betekening van dit arrest aan het adres van de advocaat van Lilly een volledige, correcte en verifieerbare opgave te doen van de door Fresenius genoten winst ten gevolge van de inbreukmakende handelingen in Nederland, gespecificeerd per inbreukmakend product dat is verkocht en/of is geleverd, een en ander gestaafd door middel van goed leesbare orders, orderbevestigingen, facturen en afschriften van andere in- en verkoopbescheiden en documentatie ter onderbouwing van eventuele aftrekposten van de op te geven omzet en winst;
5.1.3.
beveelt Fresenius binnen 21 dagen na betekening van dit arrest aan het adres van de advocaat van Lilly een rapport met feitelijke bevindingen te verschaffen, opgesteld door een onafhankelijke registeraccountant, met wie en met wiens kantoor Fresenius geen voorafgaande relatie heeft, met bevindingen omtrent de (geschatte) hoogte van de als gevolg van de inbreukmakende activiteiten in Nederland behaalde winsten van Fresenius, welk rapport feitelijke bevindingen dient te bevatten omtrent de hierboven in 5.1.2 genoemde gegevens en bescheiden;
5.1.4.
veroordeelt Fresenius tot betaling van een onmiddellijk opeisbare dwangsom van € 25.000,- voor iedere overtreding door Fresenius van de onder 5.1.2 en 5.1.3 opgelegde bevelen, dan wel, zulks ter vrije keuze van Lilly, voor iedere dag dat Fresenius in strijd handelt met deze bevelen, met een maximum van € 1.000.000,-;
5.1.5.
veroordeelt Fresenius tot vergoeding aan Lilly van de door Lilly geleden en nog te lijden schade ten gevolge van de door Fresenius gepleegde inbreuk op EP 508 in Nederland of – ter keuze van Lilly – de door Fresenius gemaakte en nog te maken winst ten gevolge van de inbreuk op EP 508 in Nederland, een en ander op te maken bij staat en te vereffenen volgens de wet, vermeerderd met de wettelijke rente vanaf de dag van dagvaarding tot aan de dag van algehele voldoening;
5.1.6.
veroordeelt Fresenius in de kosten van de procedure in eerste aanleg, begroot op € 250.000,-, met bepaling dat indien deze kosten niet binnen twee weken na betekening van dit arrest zullen zijn voldaan, Fresenius daarover zonder nadere sommatie wettelijke rente zal zijn verschuldigd;
5.1.7.
wijst af wat Lilly meer of anders heeft gevorderd;
5.2.
veroordeelt Fresenius ter terugbetaling van hetgeen Lilly ter voldoening aan bedoeld vonnis aan Fresenius heeft voldaan, tot betaling van een bedrag van € 400.000,- aan Lilly, vermeerderd met de wettelijke rente daarover vanaf 11 juli 2019;
5.3.
veroordeelt Fresenius in de kosten van het principaal en incidenteel beroep, tot op heden begroot op € 300.000,- met bepaling dat Fresenius over deze proceskosten wettelijke rente moet betalen te rekenen vanaf twee weken na de datum van dit arrest;
5.4.
verklaart dit arrest uitvoerbaar bij voorraad.
Dit arrest is gewezen door mr. P.H. Blok, mr. J.W. Frieling en mr. M.W.D. van der Burg en is ondertekend en in het openbaar uitgesproken door mr. J.E.H.M. Pinckaers, rolraadsheer, op 27 oktober 2020 in aanwezigheid van de griffier.
Voetnoten
Voetnoten Uitspraak 27‑10‑2020
HR 5 februari 2016, ECLI:NL:HR:2016:196, Bayer-Sandoz, r.o. 3.3.7.
HR 4 april 2014, ECLI:NL:HR:2014:816, Medinol-Abbott, r.o. 3.5.2.
HR 25 mei 2012, ECLI:NL:HR:2012:BV3680, Aga-Occlutech, r.o. 4.2.6.
High Court 15 mei 2014, [2014] EWHC 1511 (Pat) (Actavis/Lilly).