Opmerking voorzieningenrechter: de zin breekt hier onverwachts af. Bedoeld is, getuige de oorspronkelijke aanvrage waar de zin wel in zijn geheel staat, “e.g. in US patent 5,922,682”
Rb. Den Haag, 19-07-2022, nr. C/09/625801 / KG ZA 22-201
ECLI:NL:RBDHA:2022:7186, Hoger beroep: (Gedeeltelijke) vernietiging en zelf afgedaan
- Instantie
Rechtbank Den Haag
- Datum
19-07-2022
- Zaaknummer
C/09/625801 / KG ZA 22-201
- Vakgebied(en)
Intellectuele-eigendomsrecht (V)
- Brondocumenten en formele relaties
ECLI:NL:RBDHA:2022:7186, Uitspraak, Rechtbank Den Haag, 19‑07‑2022; (Kort geding)
Hoger beroep: ECLI:NL:GHDHA:2022:2327, (Gedeeltelijke) vernietiging en zelf afgedaan
Uitspraak 19‑07‑2022
Inhoudsindicatie
Intellectuele eigendom. Kort geding. Octrooi werkwijze produceren octreotide LAR-producten door middel van "verpakken" van octreotide acetaat in PLGA-polymeren. Vordering staken inbreukmakend handelen. Geen strijd met waarheidsplicht. Spoedeisend belang aanwezig: voldoende voortvarend gehandeld. Uitleg werkwijze stap a van onafhankelijke conclusies 1 en 2: de methanol/dichloormethaan moet een substantiële hoeveelheid lineair PLG-polymeer bevatten. De gemiddelde vakpersoon zal niet alleen 1-armig polymeer als lineair beschouwen, maar ook 2-armige polymeren. Griekse dochtermaatschappij van Pharmathen maakt inbreuk op het octrooi bij productie van haar octreotide LAR-producten. Pharmathen handelt als feitelijk leidinggevende moedervennootschap onrechtmatig en tevens dreiging directe inbreuk.
Partij(en)
vonnis
RECHTBANK DEN HAAG
Team handel
zaaknummer / rolnummer: C/09/625801 / KG ZA 22-201
Vonnis in kort geding van 19 juli 2022
in de zaak van
de rechtspersoon naar vreemd recht
NOVARTIS AG,
te Bazel, Zwitserland,
eiseres,
advocaat mr. R.M. Kleemans te Amsterdam,
tegen
PHARMATHEN GLOBAL B.V.,
te Amstelveen,
gedaagde,
advocaat mr. O.P. Swens te Amsterdam.
Partijen zullen hierna Novartis en Pharmathen genoemd worden.
1. De procedure
1.1.
Het verloop van de procedure blijkt uit:
- -
de dagvaarding van 11 maart 2022, met productie EP01 tot en met EP18;
- -
de akte houdende overlegging productie van Novartis, ingekomen ter griffie op 18 maart 2022, met productie EP19;
- -
de conclusie van antwoord, ingekomen ter griffie op 19 mei 2022, met productie GP01 tot en met GP27;
- -
de akte houdende overlegging producties van Novartis, ingekomen ter griffie op 2 juni 2022, met productie EP20 tot en met EP28;
- -
de akte houdende overlegging reactieve producties van Pharmathen, ingekomen ter griffie op 9 juni 2022, met productie GP28 tot en met GP31;
- -
de pleitaantekeningen van Novartis, ingekomen ter griffie op 20 juni 2022;
- -
de pleitnotities van Pharmathen, ingekomen ter griffie op 20 juni 2022;
- -
de reactieve pleitnotities van Pharmathen, ingekomen ter griffie op 21 juni 2022;
- -
de mondelinge behandeling van 28 juni 2022.
1.2.
Vonnis is bepaald op heden.
2. De feiten
2.1.
De Novartis-groep is een wereldwijd opererend farmaceutisch concern dat geneesmiddelen ontwikkelt, produceert en verhandelt. De Novartis-groep wordt geleid door Novartis.
2.2.
Novartis brengt een injecteerbaar LAR (Long Acting Release) product met octreotide op de markt onder de naam Sandostatine LAR. Octreotide lijkt op het lichaamseigen hormoon somatostatine en het blokkeert de aanmaak van veel soorten
hormonen. Octreotide wordt voorgeschreven in de behandeling van verschillende kankertumoren van organen die hormonen produceren, zoals bij acromegalie en gastro-enteropancreatische neuro-endocriene tumoren. Microdeeltjes bestaande uit een biologisch afbreekbaar polymeer in de vorm van glucose met D-L-lactid-co-glycolid-acid en octreotide acetaat worden door middel van een injectie in de spier ingespoten. De microdeeltjes geven de octreotide langzaam af aan de bloedbaan.
2.3.
Novartis is houdster van – onder andere – Europees octrooi EP 2 377 519 B1 (hierna: EP 519 of het Octrooi) getiteld “Pharmaceutical Composition Comprising Octreotide Microparticles”. EP 519 is verleend op 23 maart 2016 op een aanvraag van 18 november 2003 en doet een beroep op de prioriteitsdocumenten GB 0226993, gedateerd 19 november 2002, en GB 0227883, gedateerd 29 november 2002. Het Octrooi is tot en met 19 november 2023 van kracht en is gedesigneerd voor Nederland, Oostenrijk, België, Frankrijk, Duitsland, Griekenland, Italië, Liechtenstein, Portugal, Spanje, Zwitserland, Turkije en het Verenigd Koninkrijk.
2.4.
De onafhankelijke conclusies 1 en 2 van EP 519 luiden in de authentieke Engelse versie als volgt:
1. A process for the production of octreotide acetate microparticles comprising the steps of:
a) mixing octreotide acetate in methanol with methylene chloride containing a dissolved linear poly (lactide-co-glycolide) to form a solution; and
b) emulsifying said solution with the extraction medium, wherein said extraction medium is water or an aqueous buffered solution with a stabilizer;
c) immediately after the formation of emulsion, adding all at once said emulsion to an effective amount of an extraction medium to extract methylene to form said microparticles, wherein said extraction medium is water or an aqueous phase; and
d) collecting and drying the microparticles, e.g. freeze-drying or drying under vacuum.
2. A process for the production of octreotide acetate microparticles comprising the steps of:
a) mixing octreotide acetate in methanol with methylene chloride containing a dissolved linear poly (lactide-co-glycolide) to form a solution; and
b) mixing said solution with high shear stress with a suitable quantity of process medium in the ratio of 1 volume of said solution of step a) with 10 to up to 50 volumes of process medium, wherein said process medium is an aqueous phase;
c) hardening the microparticles by solvent evaporation under stirring; and
d) washing, collecting and drying the microparticles.
2.5.
Deze conclusies luiden in de onbestreden Nederlandse vertaling als volgt:
1. Werkwijze voor de vervaardiging van octreotideacetaatmicrodeeltjes, omvattende de stappen van:
a) mengen van octreotideacetaat in methanol met dichloormethaan dat een opgelost lineair poly(lactide-co-glycolide) bevat om een oplossing te vormen; en
b) emulgeren van de oplossing met het extractiemedium, waarbij het extractiemedium water of een waterige gebufferde oplossing met een stabilisator is;
c) direct na de vorming van de emulsie in één keer toevoegen van de emulsie aan een effectieve hoeveelheid van een extractiemedium om dichloormethaan te extraheren om de microdeeltjes te vormen, waarbij het extractiemedium water of een waterige fase is; en
d) verzamelen en drogen van de microdeeltjes, bijv. vriesdrogen of drogen onder vacuüm.
2. Werkwijze voor de vervaardiging van octreotideacetaatmicrodeeltjes, omvattende de stappen van:
a) mengen van octreotideacetaat in methanol met dichloormethaan dat een opgelost lineair poly(lactide-co-glycolide) bevat om een oplossing te vormen; en
b) mengen van de oplossing met hoge afschuifspanning met een geschikte hoeveelheid procesmedium in de verhouding van 1 volume van de oplossing van stap a) tot 10 tot ten hoogste 50 volumes procesmedium, waarbij het procesmedium een waterige fase is;
c) harden van de microdeeltjes door oplosmiddelverdamping onder roeren; en
d) wassen, verzamelen en drogen van de microdeeltjes.
2.6.
In de authentieke Engelse versie van de beschrijving van EP 519 is voorts - voor zover hier van belang - het volgende opgenomen:
[0004] Until now, no octreotide composition based on linear poly (lactide-co-glycolide) in sustained release form for parenteral administration has reached the market. The present invention provides a sustained release formulation of octreotide which is less expensive than the one available on the market and which is more easy to manufacture.
[0005] The present invention provides processes for manufacturing commercially acceptable octreotide acetate microparticles produced from linear poly (lactide-co-glycolide), hereinafter referred to as PLG, which have similar pharmacokinetic characteristics to SANDOSTATIN LAR with acceptable drug loading whilst also of high purity and which may be free from silicone oil and heptane.
(…)
[0022] Preferably the polymer used is poly (DL-lactide-glycolide), herein after referred as PLG.
The ratio of lactide to glycolide units in the PLG may vary between wide limits. It is however preferred to have a molar ratio of from 90 to 10 to 40:60 lactide to glycolide units, e.g. (i) 50:50 poly(lactide-glycolide) or (ii) 75:25 poly(lactide-glycolide) or (iii) 65:35 poly(lactide-glycolide).
The polymers may be pure poly(lactide-glycolide) polymers or copolymers with other units. Preferably they are pure poly(lactide-glycolide) polymers.
Typically, the average molecular weight of the PLG is from about 5,000 to about 70,000 daltons, e.g. 13,000, preferably it is from about 30,000 to about 70,000 daltons, especially from about 40,000 to about 60,000 daltons, more especially about 50,000 daltons.
The inherent viscosity of the PLG may vary between wide limits. It is however preferred to be in the range from about 0.1 to about 0.8 dL/g, e.g. from about 0.2 to about 0.8 dL/g in hexafluoroiso-propanol or preferably chloroform when measured under standard conditions, e.g. 20°C. A preferred example has a viscosity of from 0.45-0.55 dL/g in chloroform. Preferably, the polymer is amorphous. The linear polymer of the invention is not a star polymer and contains less than 5%, or preferably is free from, star polymers, e.g. a reaction product of a polyol containing at least 3 hydroxyl groups and having a molecular weight of up to 20,000 or a reactive derivative thereof and lactic acid or a reactive derivative thereof and glycolic acid or a functional derivative thereof. These star polymer products are disclosed, e.g.1.
The linear polymers of the invention may be produced in conventional manner, e.g. using conventional techniques such as polycondensation and ring-opening of dimers. The production may be, e.g. according to the teachings of US patent 3 773,919. The polymer may be a reaction product of lactic acid or a reactive derivative thereof, e.g. D,L-lactide, and glycolic acid or a functional derivative thereof, e.g. glycolide. There may be present a suitable catalyst for the production of linear polymers for example zinc oxide, zinc carbonate, basic zinc carbonate, diethyl zinc, organotin compounds, for example stannous octoate (stannous 2-ethylhexanoate), tributylaluminium, titanium, magnesium or barium compounds or litharge. Stannous octoate (stannous 2-ethylhexanoate) is preferred.
2.7.
De Griekse vennootschap Pharmathen SA is in 1969 opgericht. De Pharmathen- groep bestaat inmiddels uit Europese farmaceutische ondernemingen op het gebied van – onder meer – generieke geneesmiddelen. In september 2015 heeft de Britse investeerder BC Partners de Pharmathen-groep overgenomen, waarna op 13 oktober 2016 Pharmathen is opgericht. Op 20 januari 2022 is de Pharmathen-groep overgenomen door de Zwitserse investeerder Partners Group.
2.8.
In de gedeponeerde jaarrekening over 2020 van Pharmathen is – onder meer – het volgende opgenomen:
Directors’ Report
PHARMATHEN GLOBAL BV: Report of the Management Board
1. Company Overview
(…)
Following the acquisition of Pharmathen in 2015 by funds advised by BC Partners, the strategy of the Group focused on expanding further its international Business to Business (B2B) operations. With this target the Group in 2017 divested its Business to Consumer (B2C) operations and applied a Netherlands based B2B operating model and structure based on strong relationships with its marketing partners.
As a result, Pharmathen Global B.V. became the leading operating company of the Group, being responsible for setting the strategic targets, deciding on the allocation of the R&D resources of the Group and its commercial policy. It also exploits commercially in the international markets the products developed by the Group by forming long lasting business relationships with leading marketing partners that distribute the products of the Group worldwide. The development of the international business is supported by experienced staff, which is employed by Pharmathen Global B.V. and its subsidiary Pharmathen UK Ltd (based in Hertfordshire, UK).
(…)
1. General information
Activities:
Pharmathen Globa1 B.V. (hereafter "the Company") is a private limited liability company (B.V.) incorporated on 13 October 2016 in the Netherlands. The Company was set up to become the B2B sales and marketing and business development hub of Pharmathen Group for international B2B customers. The Company is also leading all the strategic decision making of the Group with respect to Research and Development of new products, commercial terms and policies and Group investing and financing.
2.9.
Binnen de Pharmathen-groep produceert Pharmathen SA in Griekenland injecteerbare octreotide LAR-producten. Bij de vervaardiging van deze producten maakt Pharmathen SA gebruik van PLGA polymeren die zij van Corbion betrekt, genaamd Purasorb® PDLG 5505G (hierna: Purasorb® PDLG5505G (Corbion)).
2.10.
Op 13 maart 2019 heeft Pharmathen SA Novartis in rechte betrokken voor de rechtbank Athene, Griekenland. In deze bodemprocedure heeft Pharmathen SA een verklaring voor recht van niet-inbreuk op EP 519 gevorderd.
2.11.
Novartis heeft op 16 april 2019 tegen Pharmathen SA twee procedures aanhangig gemaakt voor de voorzieningenrechter van de rechtbank Athene, Griekenland. De eerste procedure is een “Preliminary Injunction application" waarin Novartis – onder meer – een inbreukverbod heeft gevorderd. De tweede procedure is een “Temporary Restraint Order application”, waarin Novartis voor de duur tot aan de mondelinge behandeling in de Preliminary Injunction application een inbreukverbod heeft gevorderd.
2.12.
De verbodsvordering in de Temporary Restraint Order application is afgewezen op 18 april 2019.
2.13.
Bij vonnis in de Preliminary Injunction application van 10 oktober 2019 heeft de Griekse voorzieningenrechter geoordeeld dat Pharmathen geen inbreuk maakt op EP 519 en heeft de vorderingen van Novartis afgewezen.
2.14.
In de door Pharmathen geëntameerde bodemprocedure (zie onder 2.10) heeft Novartis vervolgens verzocht om de afwijzende beslissing van de voorzieningenrechter in de Preliminary Injunction application te herroepen. Bij vonnis van 26 november 2021 heeft de Griekse rechter zowel de vorderingen van Pharmathen als Novartis afgewezen op procedurele gronden.
2.15.
Pharmathen SA heeft op 18 november 2021 in Tsjechië en Duitsland marktvergunningen gekregen om injecteerbare octreotide LAR-producten onder de merknaam Okrodin (hierna: Okrodin) op de markt te brengen. Daarnaast heeft Pharmathen SA aanvragen voor marktvergunningen ingediend in Frankrijk en het Verenigd Koninkrijk.
2.16.
In de Global Product Catalogue 2021 van de Pharmathen-groep is – onder meer – het volgende opgenomen (gele markering toegevoegd):

(…)
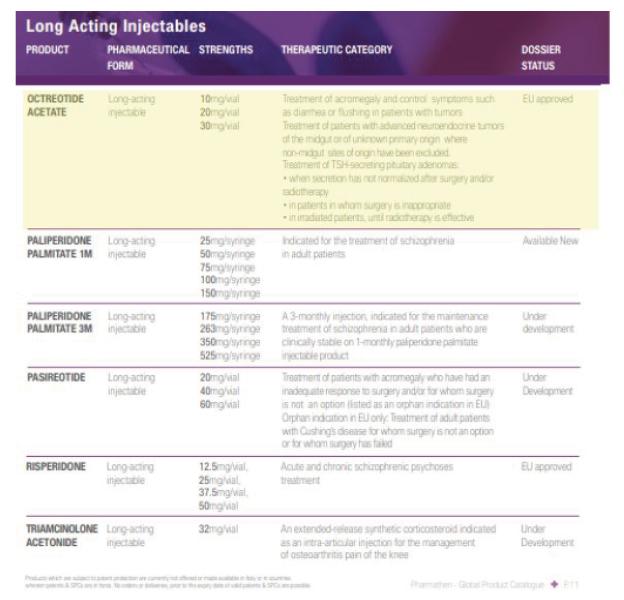
(…)

2.17.
Bij brief van 22 februari 2022 heeft Novartis Pharmathen gesommeerd inbreuk op EP 519 dan wel onrechtmatig handelen te staken. In deze brief is onder meer het volgende opgenomen:
“It has come to our attention that the Pharmathen group of companies was very recently
acquired by Swiss investor Partners Group Holding AG with the intention of expanding the
markets in which the Pharmathen group of companies sells its products.
In that context we understand that Pharmathen Global B.V. (Pharmathen Global is the
leading operating company of the Pharmathen group of companies and is responsible for
setting its strategic targets, allocation of R&D resources and commercial policy. Also,
Pharmathen Global holds all shares in Pharmathen SA (Pharmathen Greece) and instructs
Pharmathen Greece for the R&D, production and supply of medicinal products. We
understand that Pharmathen Greece has further recently acquired several marketing
authorisations (MAs) for generic octreotide acetate products (the Pharmathen Product or
Okrodin).
Novartis has reason to believe that Pharmathen Global facilitates and makes possible (i) the
development of Okrodin, (ii) the production of Okrodin, and (iii) the filing and acquiring of
applications for MAs within the EEA for said products, which Pharmathen Global intends to
make available in jurisdictions wherein Novartis holds proprietary rights. Furthermore, we
understand that Pharmathen Global facilitates the production of generic octreotide acetate
products by Pharmathen Greece and the subsequent distribution and/or commercialisation of
generic octreotide acetate products, either directly or through one or more third parties.
Novartis is convinced that Okrodin and its manufacturing process infringes EP 519. I may
refer to the claim chart that is attached as Annex 3 and that is based on the statements by
Pharmathen Greece in the Greek proceedings based on EP 519, with which we presume you
are familiar. As you will know, pursuant to Article 53(1) under b of the Dutch Patent Act 1995,
also products that are directly obtained by using the process claimed in EP 519, infringe.
Cease and desist of infringement and unlawful acts
As a result, Pharmathen Global is committing unlawful acts vis-à-vis Novartis, including as
listed under (i)-(iii) above. Accordingly, in order to put this to a halt, Novartis needs your
immediate confirmation that:
a. a) Pharmathen Global and/or any of its affiliates, third-party licensees, or collaborators
will not commit any infringing acts, including but not limited to the acts listed under
(i)-(iii) above, by making available (including importing, storing, selling, or
distributing) products infringing EP 519; and
b) Pharmathen Global will not commit unlawful acts against Novartis by instructing
Pharmathen Greece or other members of the Pharmathen Group or its distributors to
commit any infringing acts, allowing or approving such infringing acts, facilitating
such infringing acts, inducing such infringing acts, provoking such infringing acts, or
knowingly and willingly profiting of such acts; and
c) Pharmathen Global will refrain, and will cause its affiliates to refrain, from committing
such infringing or unlawful acts under (a) and (b).
If it is your position that the production process used for the Pharmathen Product does not
infringe EP 519 or that Pharmathen Global is not acting unlawfully in any way in facilitating
patent infringement in the Netherlands or any other jurisdictions where the patent is in force,
please provide us with a detailed explanation for the reasons on which this understanding is
based.
We request a substantive response within 7 days of the date of this letter, i.e. before 1 March
2022 (23:59h CET). We strongly request you will approach this matter seriously and advise
you to engage outside counsel as Novartis will have to start legal proceedings if we do not
receive the confirmation requested above within this timeframe. Requests for extensions will
not be granted. On behalf of our clients, we reserve all rights.”
2.18.
Pharmathen heeft daarop niet (inhoudelijk) gereageerd binnen de gestelde termijn noch voordat de dagvaarding in dit kort geding werd uitgebracht.
3. Het geschil
3.1.
Novartis vordert dat de voorzieningenrechter bij vonnis, voor zover
mogelijk uitvoerbaar te verklaren bij voorraad:
( i) Pharmathen zal verbieden om met onmiddellijke ingang na betekening van dit vonnis, in de landen genoemd in punt 40 van de dagvaarding, onrechtmatig te handelen, door haar dochtervennootschappen (de houder van marktvergunningen en hun lokale vertegenwoordigers), of derden distributeurs, aan te zetten tot het maken van inbreuk, die inbreuk toe te staan, goed te keuren, te faciliteren, te bevorderen, of uit te lokken, of het willens en wetens te profiteren van die inbreuk, in het bijzonder door het geven van goedkeuring om inbreukmakende producten te produceren, vermarkten en exporteren, dan wel anderszins onrechtmatig handelen vis-à-vis Novartis;
( ii) Pharmathen zal verbieden om met onmiddellijke ingang na betekening van dit vonnis, in Nederland en de andere landen waar EP 519 van kracht is, direct of indirect inbreuk te maken op EP 519;
( iii) Pharmathen zal gebieden dat zij derden, waaronder haar dochtervennootschap Pharmathen SA, hun lokale vertegenwoordigers, of derden distributeurs zal instrueren de inbreuk op EP 519 te staken en gestaakt te houden;
( iv) Pharmathen zal veroordelen tot betaling van een onmiddellijk opeisbare dwangsom voor elke gehele of gedeeltelijke overtreding van één of meer van de in dit vonnis (op te leggen, toevoeging voorzieningenrechter) ge- of verboden van € 1.000.000,- per dag of deel daarvan dat de overtreding voortduurt, of ter vrije keuze van Novartis € 250.000,- per overtreding;
( v) de termijn voor het instellen van een eis in de hoofdzaak op grond van artikel 1019i Rv2.zal bepalen op zes maanden na dit vonnis; en
( vi) Pharmathen zal veroordelen in de volledige kosten van deze procedure conform artikel 1019h Rv, te voldoen binnen veertien (14) dagen na de datum van dit vonnis, bij gebreke waarvan voormeld bedrag wordt vermeerderd met de wettelijke rente als bedoeld in artikel 6:119 BW3.vanaf de vijftiende dag na de datum van het vonnis tot de dag van algehele voldoening.
3.2.
Ter onderbouwing van de vordering in 3.1 onder (i) en (iii) stelt Novartis dat Pharmathen SA met het produceren van haar octreotide LAR-producten directe inbreuk maakt op EP 519. Volgens Novartis geeft Pharmathen feitelijk rechtstreeks leiding aan de Pharmathen-groep. Uit de jaarstukken van Pharmathen volgt dat zij verantwoordelijk is voor de strategische beslissingen rondom research en development van nieuwe producten, waaronder de generieke octreotide producten. Daarnaast levert Pharmathen de door Pharmathen SA geproduceerde generieke octreotide LAR-producten aan derde partijen, waaronder Teva en Casi Pharmaceuticals. Voorts zet Pharmathen Pharmathen SA aan tot het aanvragen van marktvergunningen voor haar generieke octreotide LAR-producten, waarmee zij op korte termijn op de markt dreigt te komen. Met deze activiteiten faciliteert Pharmathen Pharmathen SA en stelt zij Pharmathen SA in staat in Griekenland en de andere landen waar het Octrooi van kracht is inbreuk te maken, wat jegens Novartis onrechtmatig is.
3.3.
Aan de vordering in 3.1 onder (ii) legt Novartis ten grondslag dat Pharmathen Okrodin in Nederland aanbiedt, welk product door Pharmathen SA wordt geproduceerd. Het aanbieden van Okrodin kwalificeert als inbreuk op EP 519, nu dit een rechtstreeks verkregen voortbrengsel is dat voortkomt uit het productieproces van Pharmathen SA waarmee Pharmathen SA inbreuk maakt op de werkwijze zoals geclaimd in EP 519.
3.4.
Pharmathen voert verweer.
3.5.
Op de stellingen van partijen wordt hierna, voor zover van belang, nader ingegaan.
4. De beoordeling
Bevoegdheid
4.1.
De voorzieningenrechter van deze rechtbank is internationaal (en relatief) bevoegd van de (grensoverschrijdende) vorderingen kennis te nemen op grond van artikel 4 lid 1 Brussel I bis-Vo4.en artikel 80 lid 2 onder a ROW 19955., aangezien Pharmathen in Nederland is gevestigd. De bevoegdheid is overigens niet bestreden zodat er tevens bevoegdheid is op basis van artikel 26 lid 1 Brussel I bis-Vo. Artikel 24 Brussel I bis-Vo is niet toepasselijk, al niet omdat geen geldigheidsverweer is gevoerd.
Strijd met waarheidsplicht
4.2.
Pharmathen heeft aangevoerd dat de vorderingen van Novartis moeten worden afgewezen, alleen al omdat Novartis de voorzieningenrechter niet volledig heeft voorgelicht (artikel 21 Rv). Pharmathen wijst erop dat Novartis de afwijzing van de Temporary Injunction Order application (zie onder 2.12) en de op inhoudelijke gronden afgewezen Preliminary Injunction application bij vonnis van 10 oktober 2019 (vergelijk onder 2.13) onbesproken heeft gelaten in haar dagvaarding, waarbij zij dit laatste vonnis ook niet heeft overgelegd.
4.3.
Naar voorlopig oordeel voert Novartis evenwel terecht aan dat uit het door haar wel overgelegde vonnis van 26 november 2021 in de bodemprocedure (zie onder 2.14), blijkt van het vonnis van 10 oktober 2019, en de negatieve uitkomst daarvan voor Novartis. Bovendien is er voorshands geen sprake van dat Novartis bewust (bijvoorbeeld door een zodanige selectie van stukken over te leggen waardoor zij) een verkeerd beeld schetst met de bedoeling de voorzieningenrechter op het verkeerde been te zetten.6.Uit de dagvaarding volgt (i) dat er tussen partijen in Griekenland eerdere procedures aanhangig zijn geweest, en (ii) dat deze voor geen van beide partijen tot een toewijzing van de vorderingen (enerzijds een provisioneel inbreukverbod, anderzijds een verklaring voor recht van niet-inbreuk) hebben geleid. Het was zonder meer beter geweest als Novartis ook het inhoudelijke oordeel van 10 oktober 2019 van de Griekse voorzieningenrechter had overgelegd. Maar dat aan dit nalaten in dit inter partes kort geding de zeer vergaande sanctie zou moeten worden verbonden dat Novartis niet ontvankelijk moet worden verklaard, kan niet worden aanvaard, zeker niet nu het bewuste vonnis wel tot de stukken behoort (toegegeven: dankzij Pharmathen).
Spoedeisend belang
4.4.
De vraag of een eisende partij in kort geding voldoende spoedeisend belang heeft bij de gevraagde voorziening dient beantwoord te worden aan de hand van een afweging van de belangen van partijen, beoordeeld naar de toestand ten tijde van de uitspraak. Daarbij is het uitgangspunt dat het spoedeisend belang is gegeven zolang de gestelde inbreuk of het gestelde onrechtmatig handelen voortduurt.7.Indien daartegen echter onvoldoende voortvarend is opgetreden, kan dit een aanwijzing zijn dat het belang van de eisende partij kennelijk geen voorlopige maatregel vergt. Een en ander hangt af van de omstandigheden van het geval.8.
4.5.
Pharmathen stelt dat Novartis onvoldoende voortvarend is opgetreden, met name omdat Pharmathen op 30 januari 2019 al volledige openheid van zaken zou hebben gegeven, op grond waarvan Novartis toen al op de hoogte zou zijn van de (beweerdelijke) inbreuk die door Pharmathen/Pharmathen SA (met productie in Griekenland en vervolgens verkoop aan Teva en Casi Pharmaceuticals) wordt gepleegd. De voorzieningenrechter wijst dit betoog van de hand om de navolgende redenen, in onderlinge samenhang bezien.
Ten eerste heeft Novartis al op 16 april 2019 aan de Griekse rechter een voorlopig verbod gevraagd jegens Pharmathen SA (zie onder 2.11). Omdat de productie in Griekenland plaatsvindt bij Pharmathens dochteronderneming Pharmathen SA had Novartis met een verbod in Griekenland de productie van het beweerdelijk inbreukmakende octreotide LAR-product volgens de beweerdelijk inbreukmakende werkwijze op effectieve wijze kunnen stilleggen. Daarmee zou ook de verkoop aan Teva en Casi Pharmaceuticals rechtstreeks zijn geraakt. Het kan in zijn algemeenheid niet worden aanvaard dat Novartis dan (zekerheidshalve) ook hier in Nederland in kort geding had moeten optreden om in wezen hetzelfde te bereiken, ter voorkoming van verlies van spoedeisend belang.
Ten tweede, toen daarop door de Griekse rechter afwijzend werd beslist (vergelijk onder 2.13), heeft Novartis in de door Pharmathen gestarte bodemprocedure herziening van de voorlopige voorziening gevraagd. Hoger beroep van de afwijzing van de voorlopige voorziening was kennelijk niet mogelijk naar Grieks recht. De beslissing op het verzoek tot herziening is 26 november 2021 genomen (zie onder 2.14), derhalve kort voor het aanhangig maken van dit kort geding.
Ten derde wijst Novartis op het persbericht van 19 juli 2021 aangaande de overname door Zwitserse private equity investeerder Partner Group, die op 20 januari 2022 is afgerond (zie onder 2.7). Uit dat persbericht (overgelegd als productie EP01) kan – met Novartis – worden afgeleid dat een expansie in Europa (en de Verenigde Staten) op stapel staat: “Partners Group will work closely with Pharmathen's management team, led by Chief Executive Officer [A] , on initiatives to scale the business in Europe and globally.”. Daaraan leek door Pharmathen ook vervolg te worden gegeven door verkrijging van marktvergunningen in Duitsland en Tsjechië en aanvragen elders (zie onder 2.15) op naam van Pharmathen SA alsmede door de bouw van een nieuwe fabriek in Griekenland. Het is dan ook niet onbegrijpelijk dat Novartis zich concrete en relatief urgente zorgen maakte over (aanzienlijke) uitbreiding van de in haar ogen inbreukmakende activiteiten (tot dan toe: productie en levering aan afnemers Teva en Casi Pharmaceuticals) en de onrechtmatige aansturing daarvan door Pharmathen, die op zichzelf in beginsel een nieuw spoedeisend karakter aan de vorderingen kunnen verlenen.
Ten vierde wreekt zich daarbij dat Pharmathen geen reactie heeft gegeven op de sommatie van Novartis van 22 februari 2022 (zie onder 2.17) waarin deze zorgen werden benoemd. Zij heeft immers de in de sommatiebrief gestelde termijn (tot 1 maart 2022) ongebruikt laten verstrijken. Pas bij conclusie van antwoord in dit kort geding (van 19 mei 2022) heeft Pharmathen aangegeven dat zij niet met een eigen product op de markt wilde komen (ondanks de aan Pharmathen SA verleende marktvergunningen voor in elk geval Duitsland en Tsjechië: vergelijk onder 2.15). De door Novartis benoemde expansie is in de conclusie van antwoord overigens niet verder weersproken. Voor zover Pharmathen zich erop beroept dat door haar advocaten uitstel is gevraagd om de zaak inhoudelijk te kunnen bestuderen, is niet goed te volgen waarom het bestuderen en ontzenuwen van die zorg – die volgens de sommatiebrief de aanleiding was voor het schrijven – lang moest duren. Op het moment van toekennen van de kort geding datum (8 maart 2022) en dagvaarden (11 maart 2022) was er nog meer tijd verlopen en was die concrete en tamelijk urgente zorg derhalve nog altijd niet weersproken.
Ten vijfde wijst Novartis er op dat naast het verweten onrechtmatige uitlokken/aansturen van de beweerdelijke inbreuk, Pharmathen met de “Global Product Catalogue” (vergelijk onder 2.16) een verwijt van rechtstreekse inbreuk kan worden gemaakt omdat daarin de “Long-acting injectable” van octreotide acetaat wordt aangeboden met aanduiding “EU approved”. Voor zover Pharmathen daarover opmerkt dat de producten in de catalogus worden aangeboden door Pharmathen SA en niet Pharmathen, wijst Novartis er terecht op dat op de laatste pagina van de catalogus Pharmathen (in Nederland) als contact staat. Die Catalogue ziet blijkens het opschrift op 2021 en is daardoor een tamelijk recent aanbod. Pharmathen wijst nog op de voetnoot in de catalogus waarin staat staat dat octrooirechten gerespecteerd zullen worden. Die verwijzing gaat evenwel mank erop dat uit de stellingname van Pharmathen in dit geding duidelijk is dat zij van mening is dat haar octreotide product met vertraagde afgifte geen inbreuk op het octrooi maakt.
4.6.
Naar voorlopig oordeel is wat Pharmathen hiertegenover stelt om te betogen dat van een (spoedeisend) belang geen sprake is, onvoldoende. Dat als gezegd Teva en Casi Pharmaceuticals al op de markt zijn met een beweerdelijk inbreukmakend product dat door Pharmathen SA onder (beweerdelijke leiding van Pharmathen) wordt geproduceerd en geleverd, is in de vorige rechtsoverweging reeds besproken. De omstandigheid waar Pharmathen voorts op wijst, namelijk dat er een herstructurering aan de gang is waarbij al het octrooirechtelijk relevant handelen en de leiding daarvan naar Griekenland wordt verplaatst, maakt het voorgaande ook niet anders. Op dit moment is dat nog niet het geval en volgens vaste rechtspraak is bij gebleken recente inbreuk / onrechtmatig handelen een onthoudingsverklaring met boetebeding benodigd om het (spoedeisende) belang weg te nemen. Een herstructurering zou bovendien weer gestopt kunnen worden of ongedaan kunnen worden gemaakt. De door Pharmathen opgeworpen problematiek van executieproblemen zal bij de bespreking van de vorderingen aan de orde komen.
Res iudicata
4.7.
Pharmathen heeft zich erop beroepen dat het vonnis van 10 oktober 2019 in het Griekse kort geding (vergelijk onder 2.13) in de onderhavige zaak moet worden erkend op basis van Grieks recht en op basis van artikel 36 Brussel I bis-Vo. Dat betoog gaat al mank op de omstandigheid dat geen sprake is van dezelfde partijen. In de Griekse zaak was Pharmathen SA (in Griekenland) immers gedaagd, terwijl de onderhavige zaak is gericht tegen Pharmathen (in Nederland). De omstandigheid dat deze voorzieningenrechter wel gevraagd wordt om te oordelen over inbreuk in Griekenland, maakt dat hij in dat opzicht acht moet slaan op het afwijzende Griekse vonnis, maar niet dat hij eraan gebonden is.
Technische inleiding9.
Polymeren
4.8.
Volgens de geoctrooieerde werkwijze in EP 519 wordt de werkzame stof octreotide acetaat “verpakt” in PLGA-polymeren die ervoor zorgen dat de werkzame stof vertraagd in het lichaam kan worden afgegeven. Het is voor een goed begrip van deze zaak van belang om de verschillende verschijningsvormen van deze PLGA-polymeren (en de totstandkoming daarvan) te begrijpen.
4.8.1.
Een polymeer is een molecuul dat bestaat uit een keten van opeenvolgende sub- eenheden, genaamd monomeren. De monomeren kunnen identieke moleculen zijn. Het polymeer bestaat dan uit een regelmatige keten van dezelfde eenheden.
4.8.2.
In deze zaak gaat het om polymeren bestaande uit zogeheten lactide- en glycolide-monomeren. Een polymeer dat bestaat uit twee verschillende monomeren wordt een copolymeer genoemd. Het polymeer van deze zaak betreft een copolymeer van lactide en glycolide, oftewel een Poly(Lactide-co-Glycolide), afgekort als PLG. PLG wordt ook vaak PLGA genoemd, dat staat voor Poly(Lactic-co-Glycolic Acid).
4.8.3.
De monomeren lactide en glycolide zijn (cyclische) dimeren (i.e. een verbinding die uit twee monomeren bestaat) van de moleculen melkzuur en glycolzuur (“lactic acid” en “glycolic acid”) zoals hieronder geïllustreerd:
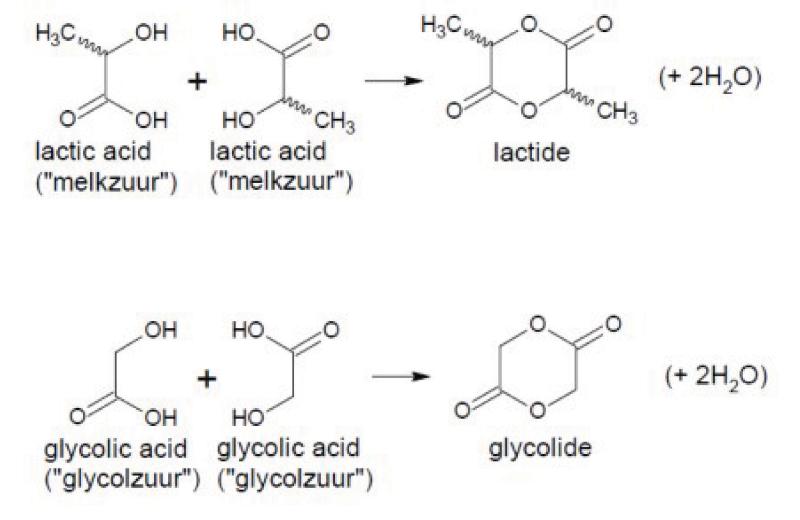
4.8.4.
Tijdens de polymerisatie waarbij PLGA gevormd wordt uit lactide en glycolide wordt de lactide-, dan wel glycolide-ring geopend, zodat een sequentie van twee eenheden melkzuur, dan wel glycolzuur ontstaat.
4.8.5.
De polymerisatie-reactie van lactide en glycolide vindt als volgt plaats. Om de reactie te initiëren, is de aanwezigheid van een vrije OH-groep (“hydroxylgroep”) nodig. In deze zaak is dat een vrije OH-groep op een glucosemolecuul, al kunnen ook andere moleculen met een vrije OH-groep gebruikt worden. De vrije OH-groep reageert met een lactide- of glycolide-monomeer, waardoor het molecuul met de vrije OH-groep, in dit geval glucose, door middel van de OH-groep aan het lactide- of glycolide-molecuul gekoppeld wordt. Door deze reactie opent tevens de ring, waardoor weer een vrije OH-groep ontstaat. De nieuw ontstane vrije OH-groep gaat vervolgens een reactie aan met een volgend lactide- of glycolide-monomeer, wat weer resulteert in een nieuwe vrije OH-groep.
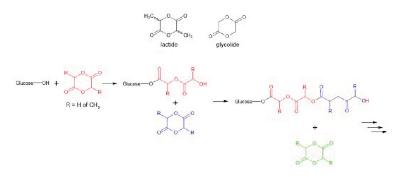
4.8.6.
Op deze wijze kan een lange keten gevormd worden, bestaande uit repeterende eenheden melkzuur en glycolzuur. Een PLGA-molecuul omvat over het algemeen honderden of duizenden melkzuur- en glycolzuur-eenheden.
4.8.7.
Wanneer verder geen maatregelen getroffen worden, is het min of meer willekeurig of het volgende monomeer dat gekoppeld wordt een lactide- of een glycolide-monomeer is. De volgorde van lactide en glycolide eenheden in de polymeerketen ligt dus niet vast. De keten wordt in zulke gevallen gekenmerkt door een gemiddelde verhouding tussen lactide en glycolide, in het octrooi gespecificeerd met een molaire verhouding van lactide:glycolide tussen 90:10 en 40:60. Het door Pharmathen gebruikte Purasorb® PDLG 5505G (Corbion) heeft volgens specificatie een molaire verhouding lactide:glycolide van 55:45.
4.8.8.
Het polymeer van melkzuur en glycolzuur dat door één vrije OH-groep wordt geïnitieerd, bestaat per definitie uit één keten en wordt aldus aangeduid als lineair. Aan de kant waar de polymeervorming begon, zit de groep die de reactie initieerde, in dit geval glucose (maar dat kan ook een ander molecuul zijn). Aan het andere uiteinde van de polymeerketen zit na de polymerisatie een vrije OH groep.
Polymeerstructuren
4.9.
Er bestaat een grote verscheidenheid aan verschillende polymeerstructuren. De eenvoudigste structuur is de lineaire structuur zoals hierboven beschreven: een keten zonder vertakkingen. Een lineaire keten omvat over het algemeen de resten van de initiator aan één uiteinde van de keten, en omvat verder de lineaire sequentie aan monomeren, zonder vertakkingen. Er zijn verder vele structuren denkbaar die bestaan uit verschillend verknoopte polymeerketens. De polymeerketens kunnen op verschillende manieren zijn vertakt. Zo kan er bijvoorbeeld sprake zijn van een stervorm, waarbij meerdere lineaire ketens op een enkel centraal punt samenkomen.10.
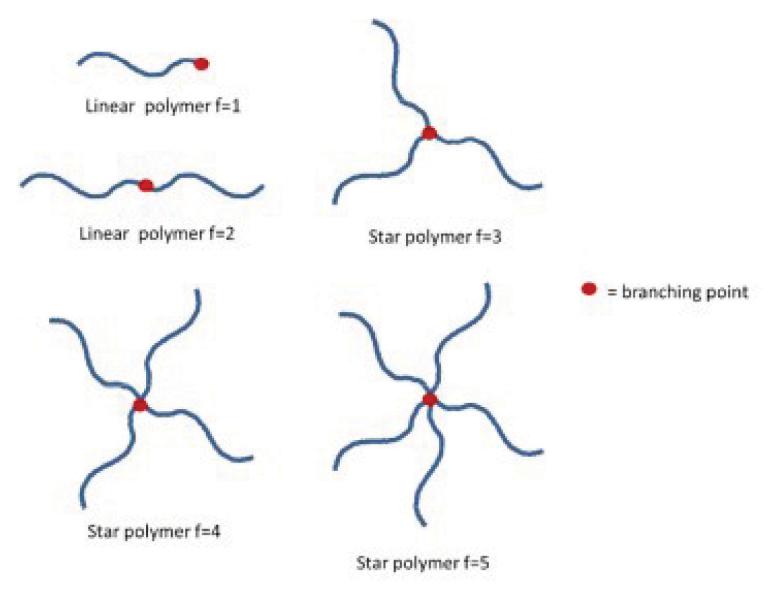
4.9.1.
Een copolymeer van lactide en glycolide is, wanneer verder geen maatregelen worden getroffen, lineair of stervormig. Een lineaire PLGA-keten ontstaat volgens beide partijen in elk geval wanneer er sprake is van polymerisatie vanuit één OH-groep van een initiator. In die gevallen is immers sprake van een keten zonder vertakkingen. Tussen partijen is in geschil of de “polymer f=2” die is ontstaan vanuit twee OH-groepen ook als lineair (volgens Novartis) of als ster-vormig (volgens Pharmathen) kan worden gezien. Partijen zijn het voorts eens dat wanneer de initiator drie of meer vrije OH-groepen heeft, een stervorm kan ontstaan, zoals wordt getoond door de andere drie voorbeelden in de figuur hierboven.
4.9.2.
De individuele polymeerketens die in een polymerisatiereactie gevormd worden, zijn niet allemaal even lang, en hebben dus ook niet allemaal hetzelfde molecuulgewicht. In elk polymeermengsel is er dus sprake van een verdeling van verschillende moleculen. Het gemiddeld molecuulgewicht is een belangrijke parameter in de polymeerchemie om een polymeer te karakteriseren.
4.9.3.
Er zijn verschillende manieren om dit gemiddelde te berekenen. De belangrijkste manieren zijn het bepalen van de zogeheten gewichtsgemiddelde molecuulmassa en de aantalsgemiddelde molecuulmassa:
- -
De aantalsgemiddelde molecuulmassa is het gewone rekenkundige gemiddelde en wordt berekend door de totale massa van het polymeer te delen door het aantal polymeermoleculen dat zich in die massa bevindt. Zo bereken je de gemiddelde massa van de individuele polymeermoleculen, oftewel de aantalsgemiddelde molecuulmassa.
- -
De gewichtsgemiddelde molecuulmassa wordt berekend door het gemiddelde te nemen van de massabijdragen van elk molecuul aan de totale massa. Sommige eigenschappen zijn afhankelijk van de molecuulgrootte, dus een groter molecuul zal een grotere bijdrage leveren dan een kleiner molecuul.
Anders gezegd is het aantalsgemiddeld molecuulgewicht de massa van een gemiddeld molecuul in het polymeer, en het gewichtsgemiddeld molecuulgewicht is het gemiddelde van de massa van elk molecuul in het polymeer.
4.9.4.
In het theoretische geval dat alle polymeermoleculen precies even lang zijn, is het gewichtsgemiddelde molecuulgewicht gelijk aan het aantalsgemiddelde molecuulgewicht. Echter, in de praktijk zijn niet alle moleculen even lang, en is het gewichtsgemiddelde molecuulgewicht altijd hoger dan het aantalsgemiddelde molecuulgewicht. Dit komt omdat in de berekening van het gewichtsgemiddelde molecuulgewicht de zwaardere moleculen meer bijdragen.
4.9.5.
Een ander belangrijk kenmerk van een polymeer is de mate van variatie tussen de verschillende polymeermoleculen, oftewel de polydispersiteit. De polydispersiteit kan worden berekend door de gewichtsgemiddelde molecuulmassa te delen door de aantalsgemiddelde molecuulmassa.
4.9.6.
Als alle ketens precies even lang zijn, is er geen variatie in ketenlengte, en is het gewichtsgemiddelde molecuulgewicht als gezegd gelijk aan het aantalsgemiddelde molecuulgewicht. De polydispersiteit is dan 1. Zodra er substantiële variatie in ketenlengte is, is het gewichtsgemiddelde molecuulgewicht groter dan het aantalsgemiddelde molecuulgewicht, en is de polydispersiteit duidelijk groter dan 1. Als alle moleculen ongeveer maar niet precies even lang zijn, is er sprake van een lage polydispersiteit, nèt iets hoger dan 1. Er is dan sprake van een smalle verdeling en een hoge uniformiteit tussen de verschillende moleculen.
4.9.7.
Als er grote variatie is tussen de verschillende polymeermoleculen is er sprake van een hoge polydispersiteit, en daarmee van een mengsel waarin de verschillende moleculen grote variatie in ketenlengte hebben.
4.9.8.
Hieruit volgt dat wanneer een PLGA-polymeer is gemaakt door initiatie met moleculen met één vrije OH-groep er sprake is van een veelheid aan PLGA-moleculen met verschillende lengte, die alleen als gemiddelde gekarakteriseerd kunnen worden. Alleen al de definitie van dit gemiddelde, voor lineaire moleculen, is complex.
4.9.9.
Dit geldt temeer wanneer er sprake is van een PLGA-polymeer dat verkregen is door initiatie met moleculen met meerdere vrije OH-groepen, zoals glucose. In zo’n geval varieert niet alleen de ketenlengte op elke OH-groep waar polymeer gevormd is, maar varieert ook de hoeveelheid ketens die per glucosemolecuul aanwezig zijn. Zo’n polymeer dient dus niet alleen gekenmerkt te worden op basis van een gemiddelde molecuulmassa, maar wordt ook gekenmerkt door het gemiddeld aantal armen per glucosemolecuul.
4.9.10.
Voor glucose geldt dat er vijf vrije OH-groepen beschikbaar zijn waarop een PLGA- keten gevormd kan worden:
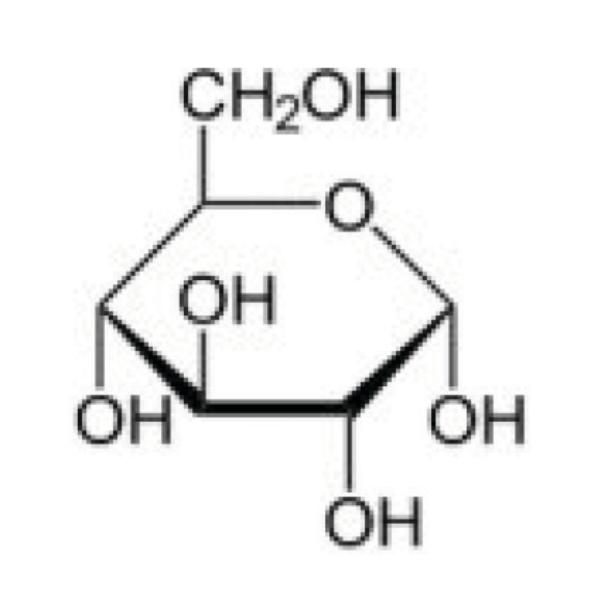
4.9.11.
Hoeveel ketens er daadwerkelijk gevormd worden op het glucosemolecuul hangt af van de reactiecondities. De reactiecondities bepalen of er gemiddeld genomen sprake is van één, twee, drie of meer PLGA-ketens per glucosemolecuul.
Inbreuk
Juridisch kader
4.10. 4.11.
Uit art. 69 EOV11.volgt dat de beschermingsomvang wordt bepaald door de conclusies van het octrooischrift, waarbij beschrijvingen en tekeningen dienen tot uitleg van die conclusies. Op grond van het bij art. 69 EOV behorende uitlegprotocol kan de beschermingsomvang door middel van uitleg niet worden beperkt tot de letterlijke tekst van de conclusies, maar volgt uit art. 69 EOV evenmin dat de conclusies alleen als richtlijn zouden dienen en dat de bescherming zich ook dient uit te strekken tot datgene wat de octrooihouder, naar het oordeel van de deskundige die de beschrijvingen en tekeningen bestudeert, heeft willen beschermen. De uitleg moet leiden zowel tot een redelijke bescherming van de aanvrager als tot een redelijke rechtszekerheid voor derden.
4.11.1.
Aangaande de te hanteren peildatum voor de beoordeling van inbreuk geldt het volgende.12.Onderscheiden dient te worden tussen enerzijds de vraag naar de uitleg van het octrooi met het oog op de vaststelling van de beschermingsomvang daarvan en anderzijds de daarop volgende vraag of een voortbrengsel (of in voorkomend geval: werkwijze) onder de aldus vastgestelde beschermingsomvang valt.
4.11.2.
In het kader van eerstgenoemde vraag kunnen diverse gezichtspunten een rol spelen. Een daarvan is de achter de woorden van de conclusies liggende uitvindingsgedachte. Bij het achterhalen daarvan moet het perspectief van de gemiddelde vakpersoon13.en diens kennis van de stand van de techniek op de aanvraag- of prioriteitsdatum richtinggevend worden geacht. Het gaat dan immers om de vaststelling van hetgeen het octrooi toevoegt aan de stand van de techniek. Dat, zoals uit de rechtspraak van de Hoge Raad blijkt, bij de beantwoording van deze vraag onder omstandigheden ook betekenis kan worden gehecht aan gegevens uit het – van na de aanvraag- of prioriteitsdatum daterende – verleningsdossier, doet aan dit uitgangspunt niet af.
4.11.3.
In het kader van de daarop volgende inbreukvraag kan daarentegen mede betekenis worden gehecht aan de kennis van de gemiddelde vakpersoon ten tijde van de beweerde inbreuk, in het bijzonder waar het erom gaat of sprake is van equivalente elementen (vgl. art. 2 van het Protocol).
Vakpersoon
4.12.
Bij de uitleg van het Octrooi is leidend het perspectief van de gemiddelde vakpersoon met kennis van de stand van de techniek. Partijen hebben zich in deze procedure niet uitgelaten over de gemiddelde vakpersoon. De voorzieningenrechter ziet geen noodzaak dat wel te doen.
Uitleg conclusiekenmerk werkwijze stap a) van conclusie 1 en 2
4.13.
Pharmathen betwist wat de inbreuk betreft enkel de toepassing van werkwijze stap a). Voor de leesbaarheid is hieronder deze werkwijze stap van conclusie 1 en 2 nogmaals opgenomen (vergelijk onder 2.4 en 2.5):
a) mengen van octreotideacetaat in methanol met dichloormethaan dat een opgelost lineair poly(lactide-co-glycolide) bevat om een oplossing te vormen
(mixing octreotide acetate in methanol with methylene chloride containing a dissolved linear poly (lactide-co-glycolide) to form a solution;)
4.14.
Met toepassing van de hiervoor gegeven regels van uitleg, overweegt de voorzieningenrechter voorshands als volgt.
4.14.1.
Een gemiddelde vakpersoon zal voor alles opmerken dat volgens dit conclusiekenmerk de methanol/dichloormethaan een lineair PLG-polymeer moet bevatten (“containing”). Een logische lezing van het kenmerk is daarom dat er bij stap a) ook andere stoffen in de oplossing mogen zitten, zelfs andere (niet-lineaire) PLG-polymeren. Vervolgens komt de gemiddelde vakpersoon toe aan de vraag hoeveel ander polymeer of stof in de oplossing mag zitten en hoeveel minimaal aan het (vereiste) lineair PLG-polymeer.
4.14.2.
Novartis stelt dat slechts als er geen lineair polymeer in de oplossing zit, geen sprake is van inbreuk. Naar voorlopig oordeel is dat standpunt onjuist. Wanneer, zoals Novartis wil, kennelijk slechts zou worden vrijgelopen met zuiver stervormig polymeer zou het kenmerk ook in wezen zinledig worden.
4.14.3.
Pharmathen wijst op paragraaf [0022] van het Octrooi (vergelijk onder 2.6) en gaat op basis daarvan uit van minimaal 95% lineair PLG-polymeer en 5% sterpolymeer. Het gaat daarbij om de volgende passage uit paragraaf [0022]:
(…) The linear polymer of the invention is not a star polymer and contains less than 5%, or preferably is free from, star polymers, e.g. a reaction product of a polyol containing at least 3 hydroxyyl groups and having a molecular weight of up to 20,00014. or a reactive derivative thereof and lactic acid or a reactive derivative thereof and glycolic acid or a functional derivative thereof. (…)”
De gemiddelde vakpersoon vindt naar voorlopig oordeel in deze passage onvoldoende aanleiding om een harde grens bij 95% lineair en 5% stervormig polymeer te leggen.
Ten eerste zal die vakpersoon onderkennen dat als dergelijke harde grenzen bedoeld waren, dit duidelijk en ondubbelzinnig in de conclusie had gestaan. De gemiddelde vakpersoon zal geen duidelijk aanwijsbare reden hebben om aan te nemen dat de octrooihouder kennelijk afstand heeft willen nemen van werkwijzen waarbij minder lineair polymeer wordt opgelost, maar niettemin de voordelen van de geoctrooieerde werkwijze worden behaald.15.
Ten tweede is duidelijk dat de rest van paragraaf [0022] ziet op (voorkeurs)uitvoeringsvormen van het octrooi. Dat zal de gemiddelde vakpersoon terughoudend maken om het betreffende percentage als harde beperking te zien.
4.14.4.
Voorshands interpreteert de voorzieningenrechter het kenmerk aldus dat er sprake dient te zijn van een substantiële hoeveelheid lineair polymeer, zodanig dat de gemiddelde vakpersoon zal verwachten dat de voordelen van de werkwijze kunnen worden behaald.
Die voordelen zijn benoemd in paragraaf [0004] van het octrooi, kort gezegd een goedkopere en eenvoudiger werkwijze om octreotide met vertraagde afgifte te produceren. Hierbij wordt uitgegaan van de uitleg van Novartis in haar pleitnota (nr. 57), waarin zij (onbestreden) aanvoert dat die voordelen worden behaald door gebruik van een lineair polymeer. De voorzieningenrechter weegt het betoog niet mee dat Novartis eerst bij repliek heeft opgeworpen, waartegen Pharmathen bezwaar heeft gemaakt, dat het juist niet zozeer zou gaan om lineaire polymeren maar om de werkwijze als geheel (en met name het oplossen in methanol en niet in water, zoals daarvoor gebruikelijk was). Hoewel het goed mogelijk is dat Novartis hier het gelijk aan haar zijde heeft, is dit een te grote wijziging ten opzichte haar eerder ingenomen standpunt. Van Pharmathen kan niet worden gevergd daarop eerst bij dupliek behoorlijk te reageren. Het is ook niet nodig voor de beslissing in dit kort geding.
4.14.5.
Voorshands oordelend is het met dat voordeel in gedachten bepaald niet nodig dat alle in de methanol-oplossing aanwezige polymeren lineair zijn en stervormige polymeren daarin afwezig moeten zijn of nagenoeg afwezig (maximaal de door Pharmathen bedoelde 5%). De gemiddelde vakpersoon realiseert zich immers dat de aanwezigheid van stervormig polymeer geen obstakel in de werkwijze vormt. Er zal immers nog steeds vertraagd afgevend polymeer worden gevormd, ook als het stervormig is. Nu het octrooi zich evenwel richt op gebruik van lineaire polymeren (zie ook paragrafen [0004] en [0005]) en daarin volgens Novartis de kern van de uitvinding is gelegen (met als gezegd voorbijgaan aan de andere kern die zij bij repliek bezigde), komt de voorzieningenrechter ertoe dat ten minste een substantieel (of aanzienlijk) deel van het gebruikte polymeer lineair van vorm moet zijn.
4.14.6.
Vervolgens komt de voorzieningenrechter toe aan de vraag wat een gemiddelde vakpersoon precies onder een lineair polymeer zal verstaan. Pharmathen stelt dat dit slechts enkelarmige polymeren betreft. Novartis noemt ook 2-armige polymeren lineair. Voorshands is de voorzieningenrechter van oordeel dat Novartis voldoende aannemelijk heeft gemaakt dat de gemiddelde vakpersoon ook 2-armige polymeren als lineair zal beschouwen.
Ten eerste is dit een logische gedachte. Net als bij een 1-armig polymeer kan men ook bij een 2-armig polymeer als gedachte-experiment immers van het ene uiteinde naar het andere “lopen” zonder dat er op enig punt sprake is van een splitsing of vertakking. Er is bij een 2-armig polymeer ook geen sprake van enige stervorm. Ten tweede blijkt ook in de praktijk de term sterpolymeer te worden gedefinieerd en gebruikt als sprake is van 3 of meer armen (en dus niet voor 2-armige polymeren). Zie wikipediahttps://en.wikipedia.org/wiki/Star-shaped_polymer maar ook de Encyclopedia of Polymeric Nanomaterials https://link.springer.com/referenceworkentry/10.1007/978-3-642-36199-9_38-1 en andere voorbeelden in paragrafen 16 en 17 van de verklaring van 1 juni 2022 van prof. dr. ir. R. Hoogenboom, de door Novartis ingeschakelde deskundige (hierna: Hoogenboom).
Ten derde komt tevens in het Octrooi de gedachte terug dat een stervormig polymeer tot stand komt bij een polyol met ten minste drie OH-groepen. Zie paragraaf [0022]: “star polymers, e.g. a reaction product of a polyol containing at least 3 hydroxyyl groups”. Wanneer de gemiddelde vakpersoon al zou twijfelen, leest diegene in het Octrooi in elk geval niets waaruit ondubbelzinnig kan worden afgeleid dat 2-armige polymeren niet als lineair moeten worden beschouwd, eerder een aanwijzing van het tegendeel. Hierbij speelt ook dat Novartis onweersproken heeft aangevoerd dat 1- of 2-armige polymeren zich grotendeels hetzelfde gedragen (nr. 3-5 pleitnota), vooral qua viscositeit.
4.14.7.
Pharmathen heeft tegen het voorgaande ingebracht dat de IUPAC-regels tot de conclusie zouden moeten leiden dat 2-armige polymeren als stervormig worden beschouwd. De verwijzing naar de IUPAC nomenclatuur helpt Pharmathen voorshands echter niet, al niet omdat de 2-armige variant daarin niet als zodanig wordt gekwalificeerd. Bovendien komt de uitleg die Hoogenboom daaraan geeft in paragraaf 14 van zijn verklaring van 1 juni 2022 de voorzieningenrechter niet onlogisch voor. Daarbij wijzen Novartis en Hoogenboom er terecht op dat daar waar IUPAC een “branch point” definieert en een “f-functional branch point” wordt uitgelegd, enkel voorbeelden van “trifunctional” en meer worden genoemd. Een “difunctional branch point” wordt niet benoemd, terwijl dat vanzelfsprekend voor de hand lag als dit type evenzeer een voorbeeld van een “branch point” zou zijn. Deze lezing komt voorshands logischer voor dan de beperkte lezing van de IUPAC regels die Pharmathen en haar deskundige, prof. D.R. Spring (hierna: Spring), in zijn verklaring van 18 mei 2022 voorstaan. Ook het handboek van Yamamoto / Tezuka (Cyclic and Multicyclic Topological Polymers), helpt Pharmathen naar voorlopig oordeel niet verder omdat een 2-armig polymeer daarin niet wordt besproken, niet als lineair noch als stervormig. De verklaring van Hoogenboom dat 2-armige polymeren in het vakgebied als lineair worden beschouwd, wordt voorts ondersteund door verklaringen van respectievelijk 30 mei 2020 en 25 oktober 2019 van de door Novartis ingeschakelde deskundigen prof. dr. ir. P.J. Schoenmakers en (emeritus) prof. J. Mays (met verwijzing naar handboeken).
4.14.8.
Pharmathen wijst voorts op de omstandigheid dat in Hadar 201916., op welke publicatie Novartis leunt bij haar bewijs van inbreuk, in tabel 2 “2-arm U-shaped PLGA” wordt geschaard onder “Branched (or Star-shaped) PLGA”. Aan Pharmathen kan worden toegegeven dat die vermelding lijkt te suggereren dat Hadar 2019 2-armige polymeren als stervormig beschouwde. Elders in hetzelfde artikel beschrijft Hadar echter 2-armige polymeren als lineair (3.10, p. 83): “branch standard with 2 arms, i.e. linear PLGA”. Hadar 2019, welk artikel overigens ook van ver na de prioriteitsindiening van het Octrooi dateert, beschouwt zodoende een 2-armig polymeer bepaald niet eenduidig als stervormig, integendeel.
4.14.9.
Gelet op het voorgaande vat de voorzieningenrechter het kenmerk aldus op dat in stap a van de geoctrooieerde werkwijze sprake moet zijn van ten minste een substantiële hoeveelheid lineair PLGA en dat dit 1- of 2-armig polymeer kan zijn. De redelijke rechtszekerheid voor derden komt daarbij niet in het gedrang, terwijl een aan de octrooihouder te bieden billijke bescherming geen verdere beperking meebrengt. De hiervoor in r.o. 4.11.2 bedoelde gezichtspunten leiden niet tot een ander oordeel. Nu 2-armige polymeren zich in oplossing hetzelfde gedragen als 1-armige polymeren, lijkt het voor de werkwijze geen duidelijk verschil te maken welk van die twee wordt toegepast.
Inbreuk
4.15.
Vervolgens staat de voorzieningenrechter voor de vraag of bij de productie door Pharmathen SA van haar octreotide LAR-producten sprake is van inbreuk op conclusie 1 en 2 van het Octrooi. Hierbij is van belang dat Pharmathen als gezegd enkel toepassing van werkwijze stap a) heeft betwist. Novartis heeft met Hoogenboom – aan de hand van onder meer de publicatie van Hadar 2019 – voldoende duidelijk gemaakt dat in het door Pharmathen SA gebruikte PLGA Purasorb® PDLG 5505G (Corbion) sprake is van een substantiële hoeveelheid lineair (1- of 2-armig) PLGA. In paragraaf 19 en 20 van zijn verklaring schat Hoogenboom het aandeel 1- of 2-armig PLGA in Purasorb® PDLG 5505G (Corbion) op 45-72% (mol-%), gebaseerd op de bevindingen van Hadar 2019, de Universitat Politècnica de València en Akina17.. Naar het oordeel van de voorzieningenrechter komt Hoogenboom – op wellicht iets meer omstreden wijze – aan de hand van het zuurgetal in paragraaf 23 van zijn verklaring uit op een aantal lineaire polymeerketens van 50 mol-%. Hoewel zij het nodige afdingt op de methodiek van Hoogenboom, heeft Pharmathen hiertegenover geen eigen onderzoek gelegd waar een ander (niet substantieel) aantal lineaire polymeren blijkt. Het moet er daarom voor gehouden worden dat Novartis aannemelijk heeft gemaakt dat wordt voldaan aan dit kenmerk. Voor zover Pharmathen aanvoert dat het door haar ingebrachte onderzoek van Akina door het gebruik van 4 in plaats van 1 Corbin monster (zoals bij Hadar 2019) nauwkeuriger resultaten oplevert, die wijzen op polymeren met meer dan drie armen in Purasorb® PDLG 5505G (Corbion), plaatst Novartis met Hoogenboom voorshands terecht daarbij de nodige kanttekeningen (die niet of onvoldoende door Pharmathen of haar deskundigen zijn weersproken). Zie de verklaring van Hoogenboom (paragraaf 19):
The provided Akina analyses (GP24) only list the final results and do not show any molar mass size distribution of branching units as function of molar mass, or other raw analytical data, making it very difficult to interpret and verify those results based on this document. It is surprising to see that the molecular weight values are reported up to single digits, as it is commonly accepted that such GPC analyses do not have that level of accuracy and values are usually reported in kg/mol, rounded up to 100’s, rather than single digit Da.
The standard deviation on the measurements reported in Hadar 2019 and the Akina report (GP24) are very similar and, hence, the argument that multiple injections lead to more accurate results appears not to be true. Furthermore, higher accuracy measurements would lead to a smaller standard deviation, but would not lead to large change in the average determined value.
In de schatting van het aantal armen die Hoogenboom vervolgens maakt, zijn voorts als gezegd de resultaten van Akina meegenomen. De resultaten van Akina leiden in die schatting tot de hiervoor genoemde ondergrens van 45 mol% lineair polymeer. Dat is naar voorlopig oordeel nog steeds substantieel.
4.16.
Pharmathen heeft nog gesteld dat Purasorb® PDLG 5505G (Corbion) in wezen hetzelfde is als Sandostatine LAR dat al bekend was. Zij wil daarmee stellen dat zij de stand van de techniek zou toepassen. Dat betoog gaat niet op, al niet omdat zij tegenover de stellingen van Novartis niet aannemelijk heeft gemaakt dat de overige werkwijze stappen van conclusie 1 ook tot de stand van de techniek behoorden, terwijl zij als gezegd niet betwist die te volgen. Voor zover zij stelt dat EP 519 zich afzet tegen gebruik van het polymeer in Sandostatine LAR, en dus ook van het gebruik van het daarop lijkende polymeer Purasorb® PDLG 5505G (Corbion), vermag de voorzieningenrechter dit niet zo duidelijk uit het Octrooi af te leiden. Het Octrooi beschrijft in [0004] en [0005] (zie onder 2.6) waar Pharmathen ter onderbouwing op wijst, enkel dat nog niet eerder een lineair PLGA van octreotide op de markt was en dat met de werkwijze een product wordt verkregen dat pharmacokinetisch gezien eigenschappen heeft gelijkwaardig aan Sandostatine LAR. Dat betekent niet dat gebruik van (het polymere uitgangsproduct voor) de Sandostatine LAR PLGA zonder meer wordt afgeraden. Dat geldt te minder nu Novartis erop heeft gewezen dat destijds de gedachte was dat een glu-PLGA inderdaad geen lineair polymeer zou bevatten omdat het 5 hydroxylgroepen bevat. Inmiddels is (na vooral Hadar 2019) bekend dat ook Sandostatine LAR lineair polymeer zal bevatten. Uit Hadar 2019 kan voorts worden afgeleid dat Purasorb® PDLG 5505G (Corbion) gemiddeld genomen een lager aantal “branch units”18.heeft en zodoende meer lineair polymeer lijkt te bevatten dan Sandostatine LAR. Sandostatine LAR heeft een gemiddeld aantal “branch units” van 3.10-3.25, tegenover een gemiddeld aantal “branch units” van 2.85 voor Purasorb® PDLG5505G (Corbion). Zie voorts Hadar 2019, pagina 83, begin van de tweede alinea onder 3.9 (gele markering toegevoegd):

Griekse vonnis
4.17.
Zoals hiervoor in r.o. 4.7 is overwogen, dient de voorzieningenrechter acht te slaan op de Griekse vonnissen, waarbij het met name gaat om de (octrooi)technisch inhoudelijke beslissing van 10 oktober 2019 (zie onder 2.13). De overige beslissingen, waaronder die van 26 november 2021 (vergelijk onder 2.14) zijn om – zo begrijpt de voorzieningenrechter – procesrechtelijke redenen in het nadeel van Novartis uitgevallen. In de beslissing van 10 oktober 2019 oordeelt de Griekse rechter kennelijk dat Purasorb® PDLG 5505G (Corbion) en u-vormige 2-armige polymeren als “star-branched” worden aangeduid in Hadar 2019 (en door de Universitat Valencia in haar onderzoeksrapport). Zoals hiervoor uitgelegd, oordeelt deze voorzieningenrechter hierover anders, waarbij in dit geschil ook nader bewijs voorhanden is in de vorm van verdere deskundigenverklaringen, zoals die van Hoogenboom.
Onrechtmatig handelen / inbreuk door Pharmathen
4.18.
Novartis heeft gesteld dat uit de jaarstukken van Pharmathen (zie onder 2.8) volgt dat Pharmathen haar dochtervennootschap Pharmathen SA in staat stelt inbreuk te maken in Griekenland en andere landen waar EP 519 van kracht is, daar Pharmathen verantwoordelijk is voor de strategische beslissingen rondom research en development van nieuwe producten, waaronder de generieke octreotide-producten. Volgens de jaarstukken behoort het tot de bedrijfsstrategie van Pharmathen om zich toe te leggen op de Long Acting Injectables, waartoe de octreotide LAR-producten behoren. Uit de Global Product Catalogue van Pharmathen volgt dat zij althans Pharmathen SA “EU-approval” heeft voor octreotide acetaat (vergelijk onder 2.16) en op de website van de Pharmathen-groep staat octreotide acetaat opgenomen in de portfolio. Uit dit alles volgt dat Pharmathen feitelijk leiding geeft aan haar dochtervennootschappen (waaronder Pharmathen SA), althans haar dochtervennootschappen opzettelijk faciliteert en aanzet tot octrooi-inbreuk, hetgeen – ook naar Grieks recht – onrechtmatig is, aldus Novartis.
4.19.
Pharmathen betwist dat zij feitelijk leiding geeft aan, dan wel invloed uitoefent op beleid van – onder andere – Pharmathen SA, waarbij zij verwijst naar de verklaring van CFO [B] . De voorzieningenrechter constateert echter dat in die verklaring vooral wordt gewezen op de herstructurering van de Pharmathen-groep, waarbij de organisatie zo wordt ingericht dat – verkort weergegeven – de handelsactiviteiten terug worden gehaald naar Griekenland en Pharmathen onder Pharmathen SA komt te vallen. Deze herstructurering is echter nog geen feit (vergelijk r.o. 4.6) en Pharmathen heeft niet – onderbouwd – betwist dat zij thans opereert zoals is beschreven in de gedeponeerde jaarrekening 2020 (zie onder 2.8). Uit die beschrijving blijkt dat Pharmathen leiding geeft en alle strategische beslissingen neemt over het merendeel van de activiteiten van de Pharmathen-groep en zij voorts de maketing en sales doet van B2B activiteiten van de Pharmathen-groep. Daarmee is naar voorlopig oordeel voldoende aannemelijk dat er een serieuze dreiging is dat Pharmathen dergelijke zeggenschap uitoefent dan wel de lokale dochtervennootschappen – waaronder Pharmathen SA – opdracht zal geven, zal faciliteren of hen tot inbreuk zal aanzetten of uitlokken. De voorzieningenrechter acht de dreiging aannemelijk dat Pharmathen ten minste op enigerlei wijze bij inbreuk in de Europese landen waarvoor EP 519 is gedesigneerd (opzettelijk) betrokken zou kunnen zijn. Naar Nederlands recht is dit (dreigend) onrechtmatig handelen.
4.20.
Novartis heeft terecht onderkend dat voor de vraag of een verbod op het – kort gezegd – faciliteren van of aanzetten tot octrooi-inbreuk in alle landen kan worden opgelegd waar het Octrooi is gedesigneerd, afhankelijk is van de vraag of naar het toepasselijk recht dit handelen als onrechtmatig kan worden gekwalificeerd. Op grond van artikel 4 lid 1 Rome II19.is het recht van het land van toepassing waar de schade zich voordoet. Omdat dat volgens Novartis voornamelijk Griekenland is, daar de inbreukmakende geneesmiddelen in Griekenland door Pharmathen SA worden geproduceerd (en aldaar de producten worden verkocht aan Teva en Casi Pharmaceuticals), heeft zij een deskundigenverklaring overgelegd van C. Kilimiris, advocaat te Athene. Daarin is uitgelegd dat naar Grieks recht – in tegenstelling tot Nederlands recht – wel is geregeld dat faciliterende handelingen zoals verricht door Pharmathen kwalificeren als indirecte octrooi-inbreuk (artikel 10.1 Griekse Octrooiwet). De voorzieningenrechter acht met deze verklaring voldoende aannemelijk dat naar Grieks recht faciliterende handelingen onrechtmatig zijn als indirecte octrooi-inbreuk. Daarbij wordt voorbijgegaan aan de betwisting van Pharmathen, die zich beroept op de deskundigenverklaring van G.A. Ballas, advocaat te Athene. In deze verklaring komt – samengevat – enkel aan de orde dat naar Grieks recht iedere rechtspersoon juridisch autonoom is en dat moedermaatschappijen niet verantwoordelijk gehouden kunnen worden voor onrechtmatig handelen van dochtermaatschappijen (ook niet wanneer het gaat om handelingen waarover de moedermaatschappijen controle uitoefenen). Het door Kilimiris besproken artikel 10.1 Griekse Octrooiwet, waaraan Novartis in haar pleitnota nogmaals refereert, laat Ballas echter onvermeld en ook in haar reactieve pleitnota komt Pharmathen niet terug op haar betwisting. Het voorgaande betekent dat het door Novartis gevorderde verbod in 3.1 onder (i) ten aanzien van Nederland en Griekenland voor toewijzing in aanmerking komt. Pharmathen heeft de onrechtmatigheid van leiding geven aan en faciliteren van octrooi inbreuk voor de overige gedesigneerde landen niet (gemotiveerd) betwist, zodat een verbod ertoe ook voor de overige gedesigneerde landen zal worden toegewezen. Het in de verbodsvordering onder (i) nog genoemde “anderszins onrechtmatig handelen vis-à-vis Novartis” zal als onvoldoende bepaald worden afgewezen. Voor zover het gevraagde verbod ook zou zien op aanzetting tot inbreuk van derden, wordt het afgewezen omdat die derden te onbepaald zijn en voorts gesteld noch gebleken is dat Pharmathen over die derden enige zeggenschap heeft. Aan het verbod zal een termijn tot nakoming van twee weken worden verbonden om executieproblemen te voorkomen.
4.21.
De onder (iii) gevraagde instructie aan Pharmathen SA de inbreuk te staken is voorshands een passende remedie om de eerdere instructies die onrechtmatig waren te redresseren. Voor zover die instructie ook aan derden zou moeten worden gegeven, wordt het afgewezen omdat als gezegd gesteld noch gebleken is dat Pharmathen tot instructies aan die derden bevoegd is of over hen enige zeggenschap heeft en bovendien onvoldoende bepaald is welke derden bedoeld zouden zijn. Aan de vordering onder (iii) is door Novartis geen voldoeningstermijn verbonden. In lijn met het verbod onder (i) zal een termijn van twee weken aan voldoening worden verbonden.
4.22.
Met verwijzing naar r.o. 4.5 onder ten vijfde overweegt de voorzieningenrechter dat naar voorshands oordeel eveneens sprake is van (dreigende) directe inbreuk door Pharmathen, nu zij in de Global Product Catalogue (zie onder 2.16) als contact is opgenomen. Dat betekent dat het gevorderde verbod in 3.1 onder (ii) zal worden toegewezen voor alle landen waar EP 519 van kracht is (waarbij de voorzieningenrechter voor de volledigheid opmerkt dat Pharmathen niet heeft betwist dat indirecte octrooi-inbreuk onrechtmatig is in alle gedesigneerde landen). Ook hier zal een nakomingstermijn van twee weken in acht worden genomen.
4.23.
De in 3.1 onder (iv) gevorderde dwangsom zal ten aanzien van de toe te wijzen verboden, gematigd en gemaximeerd, worden toegewezen. Mocht die prikkel onvoldoende blijken, dan staat het Novartis vrij om in kort geding verhoging te vorderen.
Proceskosten en artikel 1019i Rv
4.24.
Pharmathen zal als de overwegend in het ongelijk gestelde partij worden veroordeeld in de proceskosten. Deze zijn te begroten volgens artikel 1019h Rv. Partijen hebben afgesproken dat de proceskosten € 80.000,- bedragen, zodat daarvan wordt uitgegaan. De kosten aan de zijde van Novartis worden daarom begroot op € 80.676,- (€ 80.000,- + € 676,- griffierecht), te vermeerderen met de gevorderde wettelijke rente.
4.25.
De voorzieningenrechter zal de termijn in de zin van artikel 1019i Rv zoals gevorderd bepalen op zes maanden na heden.
5. De beslissing
De voorzieningenrechter
5.1.
verbiedt Pharmathen om binnen twee weken na betekening van dit vonnis, in de landen genoemd in punt 40 van de dagvaarding, onrechtmatig te handelen, door haar dochtervennootschappen in die landen (en Pharmathen SA als houdster van marktvergunningen), aan te zetten tot het maken van inbreuk, die inbreuk toe te staan, goed te keuren, te faciliteren, te bevorderen, of uit te lokken, of het willens en wetens te profiteren van die inbreuk, in het bijzonder door het geven van goedkeuring om producten volgens de geoctrooieerde werkwijze te produceren, vermarkten en exporteren;
5.2.
verbiedt Pharmathen om binnen twee weken na betekening van dit vonnis, in Nederland en de andere landen waar EP 519 van kracht is, direct of indirect inbreuk te maken op EP 519;
5.3.
gebiedt Pharmathen dat zij binnen twee weken na betekening van dit vonnis haar dochtervennootschap Pharmathen SA zal instrueren de inbreuk op EP 519 te staken en gestaakt te houden;
5.4.
veroordeelt Pharmathen tot betaling van een onmiddellijk opeisbare dwangsom voor elke gehele of gedeeltelijke overtreding van de onder 5.1-5.3 opgelegde verboden en geboden van € 100.000,- per dag of deel daarvan dat de overtreding voortduurt, of – ter vrije keuze van Novartis – € 100.000,- per overtreding, met een maximum van € 25.000.000,-;
5.5.
veroordeelt Pharmathen in de proceskosten, tot dusver aan de zijde van Novartis begroot op € 80.676,-, één en ander te voldoen binnen veertien dagen na de datum van dit vonnis en - voor het geval voldoening van de kosten niet binnen de gestelde termijn plaatsvindt - te vermeerderen met de wettelijke rente over de kosten te rekenen vanaf de 15e dag na de datum van dit vonnis tot aan de dag van volledige betaling;
5.6.
verklaart dit vonnis tot zover uitvoerbaar bij voorraad;
5.7.
bepaalt de termijn voor het instellen van een eis in de hoofdzaak in de zin van
artikel 1019i Rv op zes maanden na heden;
5.8.
wijst af het meer anders gevorderde.
Dit vonnis is gewezen door mr. E.F. Brinkman en in het openbaar uitgesproken door mr. J.Th. van Walderveen op 19 juli 2022.
Voetnoten
Voetnoten Uitspraak 19‑07‑2022
Wetboek van Burgerlijke Rechtsvordering
Burgerlijk Wetboek
Verordening (EU) 1215/2012 van het Europees Parlement en de Raad van 12 december 2012 betreffende de rechterlijke bevoegdheid, de erkenning en de tenuitvoerlegging van beslissingen in burgerlijke en handelszaken
Rijksoctrooiwet 1995
Gerechtshof Den Haag 2 februari 2022, ECLI:NL:GHDHA:2022:862, r.o. 9.3
HR 23 januari 1998, ECLI:NL:HR:1998:ZC2553, r.o. 3.3 (Kruidvat/Lancôme).
HR 29 juni 2001, ECLI:NL:HR:2001:AB2391, r.o. 3.2.3 (Impag/Milton Bradley).
Deze inleiding is ontleend aan de toelichting door Novartis.
In de figuur hierna is het polymeer met f=2 als lineair aangeduid maar dit is in geschil tussen partijen.
Verdrag inzake de verlening van Europese octrooien (Europees Octrooiverdrag)
Vergelijk HR 4 april 2014, ECLI:NL:HR:2014:816 (Medinol v. Abbott), zie met name r.o. 3.4.1-3.5.2; HR 5 februari 2016, ECLI:NL:HR:2016:196 (Bayer v. Sandoz); HR 8 juni 2018, ECLI:NL:HR:2018:854 (Resolution v. AstraZeneca c.s.)
Onbedoeld zou uit de veelgebruikte aanduiding “vakman” mogelijk kunnen worden afgeleid dat het om een mannelijke persoon gaat. Het spreekt echter voor zich dat het even goed kan gaan om een vrouw of een persoon die zich niet met een van beide geslachten identificeert. De rechtbank zal zich daarom in dit vonnis bedienen van de neutralere term “vakpersoon”.
Vzr: daltons
HR 8 juni 2018, ECLI:NL:HR:208:854 (Resolution / Shionogi), r.o. 3.4.3 en het arrest van het gerechtshof Den Haag in die zaak, ECLI:NL:GHDHA:2016:339, r.o. 5.11
Hadar et al, “Characterization of branched poly(lactide-co-glycolide) polymers used in injectable, long-acting formulations”, Journal of Controlled Release, 2019
Akina Inc., analysis report, Pharmathen Monthly Update, 5 december 2019 (GP24) en 14 februari 2020 (GP25)
Opmerking voorzieningenrechter: in Hadar 2019 heeft zowel 1-armig als 2-armig polymeer een berekend aantal “branch units” van 2.
Verordening (EG) nr. 864/2007 van het Europees Parlement en de Raad van 11 juli 2007 betreffende het recht dat van toepassing is op niet-contractuele verbintenissen