Hof Den Haag, 16-02-2016, nr. 200.174.337/01
ECLI:NL:GHDHA:2016:339
- Instantie
Hof Den Haag
- Datum
16-02-2016
- Zaaknummer
200.174.337/01
- Vakgebied(en)
Civiel recht algemeen (V)
Intellectuele-eigendomsrecht (V)
- Brondocumenten en formele relaties
ECLI:NL:GHDHA:2016:339, Uitspraak, Hof Den Haag, 16‑02‑2016
Cassatie: ECLI:NL:HR:2018:854, Bekrachtiging/bevestiging
Uitspraak 16‑02‑2016
Inhoudsindicatie
Octrooi; uitleg octrooiconclusie en toegevoegde materie
Partij(en)
GERECHTSHOF DEN HAAG
Afdeling Civiel recht
Zaaknummer : 200.174.337/01
Zaaknummer rechtbank : C/09/468395 / HA ZA 14-738
arrest van 16 februari 2016
inzake
1. de besloten vennootschap met beperkte aansprakelijkheid
ASTRAZENECA B.V.,
gevestigd te Zoetermeer,
2. de rechtspersoon naar vreemd recht
SHIONOGI SEIYAKU KABUSHIKI KAISHA,
gevestigd te Osaka, Japan,
appellanten in principaal appel,
geïntimeerden in incidenteel appel,
hierna afzonderlijk te noemen respectievelijk Astrazeneca B.V. en Shionogi en gezamenlijk Astrazeneca (in enkelvoud),
advocaat: mr. L.Ph.J. baron van Utenhove te Den Haag,
tegen
de rechtspersoon naar vreemd recht
RESOLUTION CHEMICALS LIMITED,
gevestigd te Stevenage, Verenigd Koninkrijk,
geïntimeerde in principaal appel,
appellante in incidenteel appel,
hierna te noemen: Resolution,
advocaat: mr. D. Knottenbelt te Rotterdam.
1. Het geding
Bij exploot van 27 juli 2015 met producties, tevens houdende 8 grieven, is Astrazeneca in hoger beroep gekomen van een door de rechtbank Den Haag tussen partijen gewezen vonnis van 15 juli 2015 (hierna ook: het vonnis). Op 4 augustus 2015 heeft Astrazeneca een incidentele conclusie tot het treffen van een voorlopige voorziening ex art. 223 RV tevens houdende overlegging van producties genomen. Astrazeneca heeft haar vordering in het incident vervolgens ingetrokken. Bij memorie van antwoord in principaal appel, tevens memorie van grieven in incidenteel appel met producties, heeft Resolution de grieven van Astrazeneca bestreden en twee incidentele grieven aangevoerd. Vervolgens heeft Astrazeneca bij memorie van antwoord in het incidenteel appel de incidentele grieven van Resolution bestreden. Nadien hebben beide partijen bij akte nog nadere producties overgelegd. Vervolgens hebben partijen op 12 november 2015 de zaak doen bepleiten door hun advocaten, Astrazeneca door mrs. W.A. Hoyng en J.M.J.A. Krens, advocaten te Amsterdam, bijgestaan door de octrooigemachtigde dr. […], Resolution door mrs. M.G.R. van Gardingen en H.J. Pot, advocaten te Amsterdam, bijgestaan door de octrooigemachtigde drs. […], aan beide zijden aan de hand van overgelegde pleitnotities. Ten slotte hebben partijen arrest gevraagd.
2. Feiten
De in het bestreden vonnis vastgestelde feiten zijn niet in geschil. Ook het hof zal daarvan uitgaan.
Het gaat in deze zaak om het volgende:
2.1
Resolution maakt haar bedrijf van het ontwikkelen en produceren van actieve farmaceutische bestanddelen.
2.2
Shionogi is een Japanse farmaceutische onderneming die houdster is van het aanvullende beschermingscertificaat 300125 (hierna ook: ABC) voor Nederland, verleend voor het product ‘Rosuvastatinum, desgewenst in de vorm van een niet-toxisch farmaceutisch aanvaardbaar zout, in het bijzonder het calciumzout’. Het ABC, dat is gebaseerd op Europees octrooi 0 521 471 (hierna: EP 471 of het (basis)octrooi), is in exclusieve licentie gegeven aan Astrazeneca B.V. Zij verhandelt in Nederland rosuvastatine calcium onder de merknaam Crestor®. Astrazeneca B.V. is ook houdster van de marktvergunning voor Crestor® in Nederland. Het ABC expireert op 29 juni 2017, tenzij de aanvraag voor pediatrische verlenging van het ABC wordt verleend. In dat geval zal de duur van het ABC worden verlengd tot 29 december 2017.
2.3
Shionogi was houdster van EP 471 dat betrekking heeft op ‘Pyrimidine derivatives as HMG-CoA reductase inhibitors’ (in de niet-bestreden Nederlandse vertaling: ‘Pyrimidinederivaten als HMG-CoA-reductase-inhibitoren’). Het octrooi is verleend op 25 oktober 2000 op een aanvrage daartoe van 30 juni 1992, onder inroeping van prioriteit van 1 juli 1991 op basis van JP 18801591. Het octrooi, dat op 29 juni 2012 expireerde, was gedesigneerd voor onder meer Nederland. Tegen de verlening van het octrooi is geen oppositie ingesteld.
2.4
Het octrooi kent 16 conclusies. Conclusie 1 ziet op de verbinding rosuvastatinezuur of een niet-toxisch farmaceutisch zout daarvan.
2.5
De (oorspronkelijke) Engelse tekst van conclusie 1 luidt als volgt:
1. The compound (+)-7-[4-(4-fluorophenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino)pyrimidin-5-yl]-(3R,5S)-dihydroxy-(E)-6-heptenoic acid or a non-toxic pharmaceutically acceptable salt thereof.
2.6
In de onbestreden Nederlandse vertaling luidt conclusie 1 van EP 471 als volgt:
1. Verbinding (+)-7-[4-(4-fluorfenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino)pyrimidin-5-yl]-(3R,5S)-dihydroxi-(E)-6-hepteenzuur of een niet-toxisch farmaceutisch aanvaardbaar zout daarvan.
2.7
De beschrijving van EP 471 bevat onder meer de volgende passages:
[0001] The present invention relates to 3-hydroxy-3-methylglutaryl coenzyme A (HMG-CoA) reductase inhibitors.
[0002] The first generation of drags [bedoeld zal zijn: drugs, hof] for the treatment of atherosclerosis by inhibiting the activity of HMG-CoA reductase, are mevinolin (…), pravastatin sodium (…), and simvastatin (…), which are fungal metabolites or chemical derivatives thereof. Recently, synthetic inhibitors of HMG-CoA reductase such as fluvastatin (…) were developed as the second generation drags [idem, hof].
[0003] The compounds of the present invention inhibit the HMG-CoA reductase, which plays a major role in the synthesis of cholesterol, and thus they suppress the biosynthesis of cholesterol. Therefore, they are useful in the treatment of hypercholesterolemia, hyperlipoproteinemia and atherosclerosis.
(…)
[0006] In the specification, the term “lower alkyl” refers to a straight, branched, or cyclic C1 to C6 alkyl, including methyl, ethyl, n-propyl, isopropyl, cyclopropyl, n-butyl, isobutyl, sec-butyl, tert-butyl, cyclobutyl, n-pentyl, isopentyl, neopentyl, tert-pentyl, cyclopentyl, n-hexyl, and isohexyl and the like. Further, the lower alkyl may be substituted by 1 to 3 substituents independently selected from the group consisting of halogen, amino, and cyano. Halogen means fluorine, chlorine, bromine and iodine.
[0007] The term “a non-toxic pharmaceutically acceptable salt” refers to a salt in which the cation is an alkali metal ion, an alkaline earth metal ion, or an ammonium ion. Examples of alkali metals are lithium, sodium, potassium, and cesium, and examples of alkaline earth metals are beryllium, magnesium, and calcium. Sodium and calcium are preferred.
(…)
[0029] The present invention is illustrated by the following examples and reference examples, which are not to be considered as limiting.
(…)
2.8
Conclusie 1 zoals neergelegd in de oorspronkelijke aanvrage van EP 471 luidt als volgt:
1. A compound represented by the formula (I):
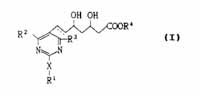
wherein R1 is lower alkyl, aryl of aralkyl, each of which may have one or more substituents; R2 and R3 each is independently hydrogen, lower alkyl or aryl, and each of said lower alkyl and aryl may have one or more substituents; R4 is hydrogen, lower alkyl, or a cation capable of forming a non-toxic pharmaceutically acceptable salt; X is sulfur, oxygen, or sulfonyl, or imino which may have a substituent; the dotted line represents the presence or absence of a double bond, or the corresponding ring-closed lactone.
2.9
In de beschrijving van de oorspronkelijke aanvrage zijn onder meer de volgende passages opgenomen:
(pagina 2, regels 1 en 2)
The present invention relates to 3-hydroxy-3-methylglutaryl coenzyme A (HMG-CoA) reductase inhibitors.
(pagina 2, regels 9 t/m 29)
The compounds of the present invention inhibit the HMG-CoA reductase, which plays a major role in the synthesis of cholesterol, and thus they suppress the biosynthesis of cholesterol. Therefore, they are useful in the treatment of hypercholesterolemia, hyperlipoproteinemia and atherosclerosis.
The present invention relates to compounds of the formula (I):
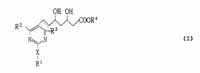
wherein R1 is lower alkyl, aryl of aralkyl, each of which may have one or more substituents; R2 and R3 each is independently hydrogen, lower alkyl or aryl, and each of said lower alkyl and aryl may have one or more substituents; R4 is hydrogen, lower alkyl, or a cation capable of forming a non-toxic pharmaceutically acceptable salt; X is sulfur, oxygen, or sulfonyl, or imino which may have a substituent; the dotted line represents the presence or absence of a double bond, or the corresponding ring-closed lactone. This invention also provides a pharmaceutical composition comprising the same.
(pagina 2, regels 42 t/m 45)
The term “a cation capable of forming a non-toxic pharmaceutically acceptable salt” refers to an alkali metal ion, an alkaline earth metal ion, or an ammonium ion. Examples of alkali metals are lithium, sodium, potassium, and cesium, and examples of alkaline earth metals are beryllium, magnesium, and calcium. Sodium and calcium are preferred.
(pagina 4, regels 29 en 30)
The present invention is illustrated by the following examples and reference examples, which are not to be considered as limiting.
(pagina 8, regels 43 t/m 47)
Example 1
Sodium (+)-7-[4-(4-fluorophenyl)-6-isopropyl-2(N-methyl-N-methylsulfonylaminopyrimidin)-5-yl]-(3R,5S)-dihydroxy-(E)-6-heptenate (Ia-1)
[…]
(pagina 13, regels 16 t/m 58 en pagina 14 regels 1 t/m 22)
Example 7
Calcium salt of the compound (Ia-1)
The compound (Ia-1) (sodium salt) 1.50 g (3.00 mmol) is dissolved in 15 ml of water and stirred at room temperature under a nitrogen atmosphere. Successively 3.00 ml (3.00 mmol) of 1 mol/L calcium chloride 3.00 ml (3.00 mmol) is added dropwise thereto over 3 minutes. The reaction mixture is stirred at the same temperature for 2 hours, and the resulting precipitate is collected, washed with water and dried to give 1.32 g of calcium salt as powder. This compound started to melt at a temperature of 155 ° C, but the definitive melting point is ambiguous. [α]D = +6.3±0.2° (C = 2.011, 25.0 ° C, MeOH)
Anal Calcd. (%) for C22H27N3O4SF*0.5Ca*0.5H2O | ||||||
|---|---|---|---|---|---|---|
: | C,51.85; | H,5.53; | N,8.25; | F,3.73; | Ca,3.93 | |
Found | : | C,51.65; | H,5.51; | N,8.47; | F,3.74; | Ca,4.07 |
Biological Activity
Experiment
The HMG-CoA reductase inhibitory effect
(1) Preparation of rat liver microsomes
Sprague-Dawley rats, which were in free access to ordinary dietes containing 2% cholestyramine and water for 2 weeks, were used for the preparation of rat liver microsomes. The thus obtained microsomes were then purified according to the manner described by Kuroda et al., Biochem. Biophys. Act, 486, 70 (1977). The microsomal fraction obtained by centrifugation at 105000 x g was washed once with a buffered solution containing 15 mM nicotinamide and 2 mM magnesium chloride (in a 100 mM potassium phosphate buffer, pH 7.4). It was homogenized with a buffer containing nicotinamide and magnesium chloride at the same weight as the liver employed. The thus obtained homogenate was cooled down and kept at -80 ° C.
(2) Measurement of the HMG-CoA reductase inhibitory activities
The rat liver microsome sample (100 µ l), which was preserved at -80 ° C, was fused at 0 ° C and diluted with 0.7 ml of a cold potassium phosphate buffer (100 mM pH7.4). This was mixed with 0.8 ml of 50 mM EDTA (buffered with the aforementioned potassium phosphate buffer) and 0.4 ml of 100 mM dithiothreitol solution (buffered with the aforementioned potassium phosphate buffer), and the mixture was kept at 0 ° C. The microsome solution (1.675 ml) was mixed with 670 µ l of 25 mM NADPH (buffered with the aforementioned potassium phosphate buffer), and the solution was added to the solution of 0.5mM [3-14C]HMG-CoA (3mCi/mmol). A solution (5 µ l) of sodium salt of the test compound dissolved in potassium phosphate buffer was added to 45 µ l of the mixture. The resulting mixture was incubated at 37 ° C for 30 minutes and cooled. After termination of the reaction by addition of 10 µ l of 2N-HCL, the mixture was incubated again at 37 ° C for 15 minutes and then 30 µ l of this mixture was applied to thin-layer chromatography on silica gel of 0.5 mm in thickness (Merck AG, Art 5744). The chromatograms were developed in toluene/acetone (1/1) and the spot, whose Rf value was between 0.45 to 0.60, were scraped. The obtained products were put into a vial containing 10 ml of scintillator to measure specific radio-activity with a scintillation counter. The activities of the present compounds are shown in Table 4 as comparative data, based on the assumption that the activity of mevinolin (sodium salt) as the reference drug is 100.
Test Compound | HMG-CoA reductase inhibitory activities |
|---|---|
l a−l | 442 |
l a−3 | 385 |
l a−5 | 297 |
l a−7 | 260 |
Mevinolin Na | 100 |
The test data demonstrates that the compounds of the present invention exhibit HMG-CoA reductase inhibition activities superior to mevinolin.
2.10
EP 471 heeft, anders dan de oorspronkelijke aanvrage waarin door middel van een zogenaamde Markush-formule een groep van verbindingen werd geclaimd, slechts betrekking op rosuvastatine. EP 471 claimt het zuur van rosuvastatine, zie de onderstaande structuurformule (welke is ontleend aan de door Astrazeneca overgelegde verklaring van prof. dr. J.W. Jukema, productie GP3). De in conclusie 1 van de oorspronkelijke aanvrage weergegeven R4-groep (zie 2.8) is dan H, hieronder rood omcirkeld, en ook voor de R1, R2, R3 en X-groepen zijn keuzen gemaakt.
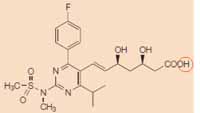
2.11
EP 471 claimt ook non-toxische farmaceutische zouten van rosuvastatine, waaronder het natriumzout en het calciumzout. Bij deze zouten van rosuvastatine is deR4-positie natrium (Na) respectievelijk calcium (Ca). Het rosuvastatine anion wordt in EP 471 niet geclaimd.
2.12
Resolution heeft voor de verhandeling van rosuvastatine zink een marktvergunning gekregen en is voornemens dat product in Nederland op de markt te brengen. Daarvan heeft zij Shionogi c.s. bij brief van 26 maart 2014 in kennis gesteld. Op 4 april 2014 heeft mr. Hoyng namens Shionogi c.s. te kennen gegeven dat Shionogi c.s. niet bereid is te bevestigen dat ABC 300125 niet wordt ingeroepen jegens Resolution, haar afnemers en hun afnemers indien zij rosuvastatine zink zullen gaan verhandelen op de Nederlandse markt.
3. De technische achtergrond
De hierna volgende uiteenzetting van de technische achtergrond van het octrooi is ontleend aan de niet bestreden uiteenzetting in het bestreden vonnis.
3.1
Cholesterol is een vettige substantie die door het menselijk lichaam voornamelijk wordt gebruikt als bouwstof voor celmembranen en om galzuur aan te maken. Aangezien cholesterol niet oplosbaar is, wordt het door het bloed getransporteerd als een complex in bepaalde, verschillende soorten, eiwitten. Men onderscheidt twee hoofdtypen cholesterol, namelijk LDL-cholesterol (LDL staat voor ‘low density lipoprotein’) en HDL-cholesterol (HDL staat voor ‘high density lipoprotein’). Het betreft echter hetzelfde cholesterol maar ‘verpakt’ in andere eiwitten.
3.2
LDL en HDL oefenen verschillende functies uit. LDL transporteert cholesterol vanuit de lever door het lichaam, terwijl HDL (een overschot aan) cholesterol weer terugbrengt naar de lever zodat het daar afgebroken en verder geëlimineerd kan worden. Als het LDL-cholesterol gehalte in het bloed relatief hoog is, zal het aan de binnenkant van de slagaderen blijven plakken. Dit is met name het geval wanneer het geoxideerd is. De slagaderen raken hierdoor verstopt en dit verhoogt de kans op cardiovasculaire aandoeningen zoals hartaanvallen en beroertes. HDL heeft zulke effecten niet.
3.3
Ongeveer 1/3 van het cholesterol dat aanwezig is in het menselijk lichaam is geconsumeerd. De overige 2/3 wordt voornamelijk in de lever aangemaakt. Het in de lever aangemaakte cholesterol wordt voornamelijk in LDL ‘pakketjes’ getransporteerd. Het biologische proces van de aanmaak van cholesterol is zeer complex en bestaat uit een groot aantal stappen waaronder verschillende enzymatische omzettingen.
3.4
De snelheidsbepalende stap in de aanmaak van cholesterol is de omzetting van HMG-CoA in mevolonaat door het enzym HMG-CoA reductase. Statines (ook wel HMG-CoA reductase remmers genoemd) zijn een klasse van geneesmiddelen die gebruikt worden om de cholesterol niveaus (als LDL complex) te verlagen door het enzym HMG-CoA reductase, dat in de lever een centrale rol speelt bij de aanmaak van cholesterol, af te remmen. Door de verminderde aanmaak van cholesterol in de lever, wordt ook de hoeveelheid LDL cholesterol die in het bloed door het lichaam wordt getransporteerd afgeremd.
3.5
Eén van de hiervoor bedoelde statines is rosuvastatine. De farmaceutisch actieve vorm is het rosuvastatine-anion, een negatief geladen deeltje. Dit anion bindt aan het enzym HMG-CoA reductase. Als HMG-CoA reductase bindt aan het rosuvastatine-anion en niet aan HMG-CoA, dan is het reductase geblokkeerd (geïnhibeerd) en wordt de aanmaak van cholesterol in de lever geremd. Hieronder is de structuurformule van het rosuvastatine-anion weergegeven:
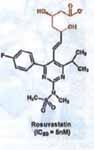
3.6
Alleen het anion is verantwoordelijk voor de biologische activiteit van rosuvastatine, te weten de HGM-CoA reductase remmende werking. Het is niet mogelijk een tablet te maken met als actieve stof het anion; men kan alleen neutrale stoffen hanteren en dat impliceert de aanwezigheid van een kation (een positief geladen deeltje, waarmee rosuvastatinezout wordt gevormd) of waterstof (waarmee rosuvastatinezuur wordt gevormd).
3.7
De zoutvorm van rosuvastatine is van invloed op de praktische bruikbaarheid van het geneesmiddel, omdat de zoutvorm van belang is voor bijvoorbeeld de oplosbaarheid en de chemische en opslagcapaciteit. De geschiktheid van een zoutvorm wordt vastgesteld door een zoutenonderzoek (‘salt screening’).
4. Het geschil in eerste aanleg en in hoger beroep
4.1
In eerste aanleg heeft Resolution – samengevat – gevorderd dat de rechtbank bij vonnis, zo veel mogelijk uitvoerbaar bij voorraad, conclusies 1 en 2 van het Nederlandse deel van EP 471 en de daarvan afhankelijke conclusies vernietigt en voorts ABC 300125 nietig verklaart voor zover de materie daarvan betrekking heeft op een andere verbinding dan rosuvastatine calcium en/of rosuvastatine natrium, alsmede voor recht verklaart dat Resolution (en/of haar klanten) geen directe of indirecte inbreuk maakt/maken op de rechten van Astrazeneca onder ABC 300125 door rosuvastatine zink in Nederland te verhandelen, met hoofdelijke veroordeling van Astrazeneca in de kosten van de procedure te begroten op de voet van artikel 1019h Rv, vermeerderd met de wettelijke rente.
4.2
Resolution heeft daartoe – samengevat – aangevoerd dat de conclusies 1 en 2 van het Nederlandse deel van EP 471, alsmede de daarvan afhankelijke conclusies, vanwege toegevoegde materie niet verleend hadden mogen worden voor zover deze meer omvatten dan rosuvastatine calcium en/of rosuvastatine natrium, alsmede dat Resolution met de voorgenomen verhandeling van rosuvastatinezink in Nederland - ook indien het ABC (geheel) geldig wordt geacht - geen inbreuk zal maken op het ABC omdat rosuvastatinezink niet valt onder de beschermingsomvang daarvan.
4.3
De rechtbank heeft het ABC vernietigd voor zover de bescherming ervan zich uitstrekt over andere producten dan de niet-toxische farmaceutisch aanvaardbare zouten van rosuvastatine waarin het kation bestaat uit een alkalimetaalion, een aardalkalimetaalion of een ammoniumion.
4.4
Daartoe heeft de rechtbank kort weergegeven en voor zover thans van belang geoordeeld dat het in conclusie 1 van EP 471 genoemde kenmerk “a non-toxic pharmaceutically acceptable salt thereof” in het licht van paragraaf 7 van de beschrijving moet worden begrepen als een zout waarin het kation bestaat uit een alkalimetaalion, een aardalkalimetaalion of ammoniumion, zodat de beschermingsomvang van het octrooi daartoe is beperkt (vonnis r.o. 4.13 - 4.20). Voorts heeft rechtbank geoordeeld dat andere zouten van rosuvastatine dan het calcium- of natriumzout geen toegevoegde materie oplevert en het rosuvastatinezuur wel (vonnis r.o. 4.21 - 4.29).
4.5
Astrazeneca heeft grieven gericht tegen het oordeel van de rechtbank dat de gemiddelde vakman paragraaf 7 van de beschrijving van het octrooi zou opvatten als een beperkende definitie en zou begrijpen dat de octrooihouder slechts de aldaar genoemde zouten onder bescherming heeft willen stellen voor gebruik met rosuvastatine (vonnis r.o. 4.16) en de verwerping van haar standpunt dat deze paragraaf 7 alleen zou worden gezien als een niet-limitatieve opsomming (vonnis r.o. 4.17 - 4.19). Verder heeft Astrazeneca (onder meer) een grief gericht tegen het oordeel van de rechtbank (vonnis r.o. 4.28) dat het geclaimde zuur van rosuvastatine toegevoegde materie betreft.
4.6
In haar incidenteel appel komt Resolution onder meer op tegen r.o. 4.10 van het vonnis waarin de feiten omtrent zoutonderzoek te beperkt zouden zijn vastgesteld en voorts tegen het oordeel van de rechtbank (vonnis r.o. 4.21 - 4.27) dat het claimen van andere zouten van rosuvastatine dan het calcium- of natriumzout geen toegevoegde materie oplevert.
5. Beoordeling
In principaal appel
5.1
De vraag die ter beantwoording voorligt is hoe het conclusiekenmerk ‘or a non-toxic pharmaceutically acceptable salt thereof’ in conclusie 1 van EP 471 moet worden uitgelegd. Het standpunt van Resolution dat Astrazeneca niet heeft gegriefd tegen r.o. 4.17 van het vonnis en dat tussen partijen vaststaat dat paragraaf 7 van de beschrijving een definitie geeft in de vorm van een limitatieve opsomming, wordt verworpen. In Grief II van Astrazeneca, gelezen in samenhang met paragrafen 35-39 van de appeldagvaarding, ligt besloten dat Astrazeneca tevens heeft gegriefd tegen de verwerping door de rechtbank van haar stelling dat paragraaf 7 van de beschrijving door de gemiddelde vakman zal worden gezien als een niet-limitatieve opsomming.
5.2
Ter zake de uitleg van een octrooiconclusie heeft de Hoge Raad in het arrest Medinol / Abbott (HR 4 april 2014, ECLI:NL:HR:2014:816) onder meer als volgt overwogen (in r.o. 3.4.2.):
Art. 69 lid 1 Europees Octrooi-verdrag (EOV) houdt in dat de beschermingsomvang van een octrooi wordt bepaald door de conclusies van het octrooischrift, waarbij de beschrijving en de tekeningen dienen tot uitleg van die conclusies. Art. 1 van het bij art. 69 EOV behorende uitlegprotocol (hierna: het Protocol) luidt: “Artikel 69 mag niet worden uitgelegd in de zin als zou de beschermingsomvang van het Europees octrooi worden bepaald door de letterlijke tekst van de conclusies en als zouden de beschrijving en de tekeningen alleen maar mogen dienen om de onduidelijkheden welke in de conclusies zouden kunnen voorkomen op te heffen. Het mag evenmin worden uitgelegd in die zin, als zouden de conclusies alleen als richtlijn dienen en als zou de bescherming zich ook mogen uitstrekken tot datgene wat de octrooihouder, naar het oordeel van de deskundige die de beschrijving en de tekeningen bestudeert, heeft willen beschermen. De uitleg moet daarentegen tussen deze twee uitersten het midden houden, waarbij zowel een redelijke bescherming aan de aanvrager als een redelijke rechtszekerheid aan derden wordt geboden.” In overeenstemming met deze uitlegregel van het Protocol heeft de Hoge Raad de in zijn eerdere uitspraken gebezigde formuleringen, “hetgeen voor de uitvinding waarvan de bescherming wordt ingeroepen, wezenlijk is”, onderscheidenlijk “de achter de woorden van die conclusies liggende uitvindingsgedachte” bestempeld als gezichtspunt, tegenover de letterlijke tekst van de conclusies (de “uitersten” in de woorden van het Protocol) (vgl. HR 7 september 2007, ECLI:NL:HR:2007:BA3522, NJ 2007/466 en HR 25 mei 2012, ECLI:NL:HR:2012:BV3680, NJ 2013/68). Daarbij dient het achterhalen van de achter de woorden van de conclusies liggende uitvindingsgedachte ertoe een uitsluitend op de letterlijke betekenis van de bewoordingen gegronde en daarom voor een redelijke bescherming van de octrooihouder wellicht te beperkte of onnodig ruime uitleg te vermijden (vgl. HR 13 januari 1995, ECLI:NL:HR:1995:ZC1609, NJ 1995/391). De beschrijving en de tekeningen vormen in dat kader een belangrijke bron. Van de beschrijving maakt onderdeel uit een weergave van de stand van de techniek die de aanvrager als nuttig beschouwt voor het begrijpen van de uitvinding (regel 42 van het uitvoeringsreglement bij het EOV). Ook niet in de beschrijving genoemde stand van de techniek kan van belang zijn. Bij de uitleg van een octrooi is immers leidend het perspectief van de gemiddelde vakman met zijn kennis van de stand van de techniek.
De achter de woorden van de conclusies liggende uitvindingsgedachte
5.3
Bij het achterhalen van de uitvindingsgedachte gaat het om de vaststelling van hetgeen het octrooi toevoegt aan de stand van de techniek en is het perspectief van de gemiddelde vakman en diens kennis van de stand van de techniek op de prioriteitsdatum richtinggevend (vgl. HR in Medinol / Abbott, r.o. 3.5.2). Daarnaast vormen de beschrijving en de tekeningen een belangrijke bron voor het achterhalen van de uitvindingsgedachte (vgl. HR in Medinol / Abbott, r.o. 3.4.2 hiervoor geciteerd). Niet in geschil is dat de gemiddelde vakman in dit geval een organisch chemicus is die zich bezig houdt met de ontwikkeling van nieuwe geneesmiddelen en die in elk geval een basiskennis heeft van de werking van de op de markt zijnde geneesmiddelen zoals rosuvastatine.
5.4
Het standpunt van Resolution (bij pleidooi in appel), dat de uitvindingsgedachte is gelegen in het vinden van bepaalde precursors (namelijk een aantal specifieke zouten van rosuvastatine) die na inname de werkzame stof met HMG-CoA reductase remmende werking afgeven, wordt van de hand gewezen. Resolution baseert haar standpunt op paragraaf 7 van het octrooi. Daarbij ziet zij eraan voorbij dat de beschrijving weliswaar een belangrijke bron is voor het achterhalen van de uitvindingsgedachte, maar dat tevens (als richtinggevend) acht moet worden geslagen op het perspectief van de gemiddelde vakman en zijn algemene vakkennis op de prioriteitsdatum.
5.5
De gemiddelde vakman leest in de beschrijving (paragrafen 1-3) dat er reeds eerste generatie (fungale metabolieten) en tweede generatie (synthetische) inhibitoren van HMG-CoA-reductase (ook wel aangeduid als statines) zijn ontwikkeld en dat door het octrooi een nieuwe groep statines, namelijk 3-hydroxy-3-methylglutarylcoënzym A (HMG-CoA)-reductase-inhibitoren, is gevonden. In paragraaf 4 van de beschrijving wordt meer in het bijzonder het in die groep vallende rosuvastatine in zuur- of zoutvorm genoemd, terwijl voorts (in paragraaf 5) wordt verduidelijkt dat de uitvinding tevens betrekking heeft op farmaceutische samenstellingen daarmee en de werkwijze voor het bereiden daarvan. Paragrafen 6 en 7 gaan dan in op de termen “lagere alkylgroep” respectievelijk “een niet-toxisch farmaceutisch aanvaardbaar zout”. In de daarop volgende paragrafen (8-26) wordt de werkwijze voor de bereiding van de nieuwe statines beschreven. In de paragrafen 26-28 worden mogelijke farmaceutische samenstellingen genoemd, hoe deze op een gebruikelijke wijze kunnen worden bereid, alsmede mogelijke doseringen. Daarna volgen referentievoorbeelden waarin werkwijzen voor de bereiding van enkele verbindingen worden uiteengezet, voorbeelden waarin natrium- en calciumzouten van rosuvastatine worden bereid en ten slotte een experiment beschreven waarin de biologische activiteit (het HMG-CoA-reductase-inhibitorische effect) wordt gemeten. Daarbij is in slotparagraaf 51 opgemerkt dat de testgegevens aantonen dat de verbindingen volgens de uitvinding, waarmee blijkens de tabel specifiek gedoeld wordt op rosuvastatine, HMG-CoA-inhibitorische activiteiten vertonen die beter zijn dan die van mevinoline (een eerste generatie statine genoemd in paragraaf 2 van de beschrijving).
5.6
Gelet op de beschrijving in zijn geheel beschouwd, zal de gemiddelde vakman, in aanmerking genomen zijn algemene vakkennis op de prioriteitsdatum, begrijpen dat de uitvinding betrekking heeft op een nieuwe groep van statines – in het bijzonder het specifiek geclaimde rosuvastatine – waarvan de biologische activiteit beter is dan die van een bekende eerste generatie statines. De nieuwheid en inventiviteit van rosuvastatine is niet bestreden. Uitgaand van het perspectief van de gemiddelde vakman op de prioriteitsdatum wordt door het octrooi derhalve een nieuwe groep statines, waaronder meer specifiek rosuvastatine, aan de bekende stand van de techniek toegevoegd. Het vinden daarvan moet worden aangemerkt als de achter de woorden van de conclusie(s) liggende uitvindingsgedachte.
5.7
In de beschrijving vindt de gemiddelde vakman geen aanwijzing dat er speciaal is gezocht naar (de meest) geschikte zouten van die nieuwe groep statines en/of van rosuvastatine. Hij leidt dat niet af uit paragraaf 7 van de beschrijving of de voorbeelden. Het was algemene vakkennis van de gemiddelde vakman op de prioriteitsdatum – op welk moment reeds eerste en tweede generatie statines op de markt waren – dat het werkzame bestanddeel van de statines het anion is (zoals erkend door Resolution in punt 36 pleitnota hoger beroep), maar dat toediening ervan dient te geschieden in zuur- of zoutvorm omdat het niet mogelijk is een tablet te maken met een anion (zie r.o. 3.6 hiervoor). De in paragraaf 7 van de beschrijving genoemde zouten betreffen zouten die op de prioriteitsdatum voor de bereiding van de tabletvorm voor toediening van reeds bekende statines werden gebruikt (waartoe zink niet behoorde). Uit die paragraaf begrijpt de gemiddelde vakman daarom dat dit zouten zijn waarvan verwacht mag worden dat die geschikt zullen zijn voor het maken van een tabletvorm die een nieuwe statine volgens de uitvinding bevat, waarbij na inname in het lichaam en oplossing van het zout de farmaceutisch actieve anionen worden gevormd. De twee in de beschrijving opgenomen voorbeelden beschrijven uitsluitend de bereidingswijze van twee zoutvormen van rosuvastatine, zonder deze met elkaar te vergelijken of aan verder onderzoek te onderwerpen. Het experiment is vervolgens met alleen het natriumzout uitgevoerd, waarbij de biologische activiteit niet is vergeleken met het calcium- (of ander) zout, maar met een andere uit de stand van de techniek bekende statine.
5.8
Het voorgaande betekent dat niet als juist kan worden aanvaard dat de achter de bewoordingen van de conclusie(s) liggende uitvindingsgedachte het vinden van een geschikte precursor (zoutvorm) zou zijn.
5.9
Dat in conclusie 1 van EP 471 alleen rosuvastatinezuur of een niet-toxisch farmaceutisch aanvaardbaar zout wordt genoemd, leidt ook niet tot een ander oordeel. Bij het vaststellen van de uitvindingsgedachte is, zoals hiervoor al overwogen, leidend hetgeen bezien vanuit het perspectief van de gemiddelde vakman aan de stand van de techniek wordt toegevoegd en niet de (letterlijke) bewoordingen van de conclusie(s). De uitvindingsgedachte dient immers juist als gezichtspunt bij de uitleg van de conclusie(s).
Uitleg van ‘of een niet-toxisch farmaceutisch aanvaardbaar zout daarvan’
5.10
Conclusie 1 van EP 471 claimt niet het werkzame bestanddeel van rosuvastatine, het rosuvastatine anion, maar rosuvastatinezuur of een niet-toxisch farmaceutisch aanvaardbaar zout daarvan. Het is met name de uitleg van het kenmerk ‘of een niet-toxisch farmaceutisch aanvaardbaar zout daarvan’ die partijen verdeeld houdt. Resolution stelt zich op het standpunt dat dit kenmerk in het licht van paragraaf 7 van de beschrijving aldus moet worden uitgelegd dat onder ‘zout’ alleen één van de in paragraaf 7 genoemde zouten is te verstaan. Naar de mening van Resolution dient conclusie 1 derhalve beperkter uitgelegd te worden dan waartoe de letterlijke bewoordingen van die conclusie aanleiding geven. Astrazeneca stelt zich op het standpunt dat de gemiddelde vakman, in aanmerking genomen zijn algemene vakkennis op de prioriteitsdatum, paragraaf 7 van de beschrijving zou opvatten als een niet-limitatieve opsomming en dat er geen reden is om conclusie 1 beperkter uit te leggen dan zijn letterlijke betekenis.
5.11
Het hof aanvaardt niet als juist dat indien en zodra een octrooi een nadere omschrijving bevat van een in een octrooiconclusie gebruikte term, dit altijd limitatief dient te worden opgevat, waar Resolution van uit lijkt te gaan. Weliswaar dient die nadere omschrijving als onderdeel van de beschrijving bij de uitleg van de octrooiconclusie te worden betrokken, maar dat laat onverlet dat de vraag of zo’n omschrijving al dan niet als limitatief dient te worden opgevat, afhangt van de vraag hoe de gemiddelde vakman die nadere omschrijving, in aanmerking genomen de beschrijving en zijn algemene vakkennis op de prioriteitsdatum, zou begrijpen. Net zoals bij de uitleg van een conclusie niet zonder meer van de letterlijke betekenis van de woorden van die conclusie mag worden uitgegaan, dient bij de uitleg van die conclusie in het licht van de beschrijving niet zonder meer te worden uitgegaan van de letterlijke tekst van een passage uit die beschrijving. Een voor de uitleg van een conclusie relevante passage uit de beschrijving dient evenzeer te worden uitgelegd in de context van de hele beschrijving en vanuit het perspectief van de gemiddelde vakman met zijn algemene vakkennis op de prioriteitsdatum. Alleen indien een nadere omschrijving (of ‘definitie’) door de gemiddelde vakman wordt begrepen als een limitatieve opsomming geldt dat die bepalend is voor de betekenis van het kenmerk van de conclusie waarop die nadere omschrijving c.q. definitie betrekking heeft.
5.12
Naar het oordeel van het hof heeft de rechtbank in r.o. 4.18 van het vonnis, onder verwijzing naar het AGA / Occlutech arrest (HR 25 mei 2012, ECLI:NL:HR:2012:BV3680), terecht vooropgesteld dat de gemiddelde vakman slechts dan mag aannemen dat afstand is gedaan van een gedeelte van de bescherming waarop het octrooi aanspraak geeft, indien daartoe, gelet op de inhoud van het octrooischrift in het licht van eventuele andere gegevens, waaronder de openbare gegevens uit het verleningsdossier, goede grond bestaat. Uit de voorgaande rechtsoverweging (r.o. 5.11) volgt dat het enkele feit dat de beschrijving een nadere omschrijving van een conclusiekenmerk bevat onvoldoende is om reeds daarom die goede grond aan te nemen. Of dat zo zal zijn zal afhangen van het antwoord op de vraag hoe de gemiddelde vakman die nadere omschrijving zou opvatten, in het bijzonder of hij daarin een limitatieve opsomming zou zien of niet.
5.13
Op grond van hetgeen hierna wordt overwogen is het hof, anders dan de rechtbank, van oordeel dat de gemiddelde vakman op de prioriteitsdatum geen goede grond had om aan te nemen dat de octrooihouder slechts bescherming wenste voor de in paragraaf 7 genoemde zouten van rosuvastatine en afstand deed van de ruimere bescherming die conclusie 1 naar de letterlijke bewoordingen ervan bood.
5.14
Bij de uitleg van een conclusie in het licht van de beschrijving dient als een gezichtspunt de achter de woorden van de conclusie liggende uitvindingsgedachte in aanmerking te worden genomen. Zoals hiervoor overwogen is deze uitvindingsgedachte te formuleren als het vinden van een nieuwe groep statines, waaronder specifiek rosuvastatine, met HMG-CoA reductase remmende werking. De gemiddelde vakman zal inzien dat conclusie 1 beperkter is geformuleerd dan waartoe de uitvindingsgedachte aanleiding geeft, namelijk alleen het rosuvastatinezuur en de farmaceutisch aanvaardbare niet-toxische rosuvastatinezouten daarvan worden door die conclusie onder bescherming gesteld. Hij zal dat daardoor verklaren dat het niet mogelijk is het werkzame bestanddeel (het rosuvastatine-anion) toe te dienen, zodat daarom rosuvastatine in de mogelijke toedieningsvormen is geclaimd. De – ruimere – uitvindingsgedachte geeft de gemiddelde vakman (juist) geen aanleiding te veronderstellen dat de octrooihouder heeft bedoeld alleen bepaalde zoutvormen onder bescherming te stellen en afstand te doen van alle andere zoutvormen. Zoals de gemiddelde vakman op de prioriteitsdatum weet is voor de biologische activiteit van statines de zoutvorm waarin deze wordt toegediend immers niet relevant, omdat het anion van de statine het werkzame bestanddeel is en het zout er alleen toe dient het rosuvastatine-anion in tabletvorm te kunnen toedienen.
5.15
Voor zover Resolution heeft beoogd te stellen dat volgens het Protocol de conclusies dienen te worden uitgelegd in het licht van de beschrijving, zodat geen plaats is voor het in aanmerking nemen van de achter de woorden van de conclusie liggende uitvindingsgedachte, althans dat de bewoordingen van de beschrijving dienen te prevaleren, dan wordt dat standpunt verworpen. Bij de uitleg van de octrooiconclusies in het licht van de beschrijving dient immers steeds te worden uitgegaan van het perspectief van de gemiddelde vakman op de prioriteitsdatum, in aanmerking genomen zijn algemene vakkennis. Dat perspectief wordt mede bepaald door de uitvindingsgedachte.
5.16
Daar waar Resolution erop gewezen heeft dat de uitvindingsgedachte slechts één van de gezichtspunten is die bij de uitleg van een octrooiconclusie moeten worden betrokken, is dat juist, maar kan dat haar niet baten. De andere door de Hoge Raad genoemde gezichtspunten wijzen immers niet in een andere richting.
5.17
Eén van de andere gezichtspunten betreft de mate waarin de uitvinding vernieuwing heeft gebracht (zie ook r.o. 3.3.1 van HR 13 januari 1995 inzake Ciba Geigy / Oté Optics, ECLI:NL:HR:1995:ZC1609). Naar Astrazeneca onvoldoende gemotiveerd bestreden heeft aangevoerd is rosuvastatine een zeer potente statine die ondanks de aanwezigheid van diverse (goedkopere) generieke statines, nog altijd marktleider is.
5.18
Een ander in aanmerking te nemen gezichtspunt betreft de aard van het octrooi en ook dat wijst hier in de richting van een ruimere beschermingsomvang dan Resolution voorstaat. Het octrooi is geen formuleringsoctrooi, waarin een nieuwe toedieningsvorm wordt geopenbaard van een op zichzelf reeds bekende stof, waarbij de beschermingsomvang beperkt is tot uitsluitend die toedieningsvorm. EP 471 openbaart een nieuwe groep van farmaceutisch actieve stoffen, waarvan conclusie 1 meer specifiek de nieuwe en inventieve stof rosuvastatine claimt, en betreft derhalve een zogenaamd ‘stofoctrooi’, waarvoor absolute stofbescherming kan worden verkregen en in het algemeen ook door de octrooihouder beoogd.
5.19
De beschrijving leidt de gemiddelde vakman ook niet tot het inzicht dat conclusie 1 beperkter uitgelegd zou moeten worden dan waartoe de letterlijke woorden ervan aanleiding geven. Zoals hiervoor reeds overwogen (zie r.o. 5.7) zou de gemiddelde vakman op de prioriteitsdatum inzien dat in paragraaf 7 van de beschrijving zouten worden genoemd die voor de bereiding van de tabletvorm voor toediening van reeds bekende statines zijn gebruikt en zou hij daarom begrijpen dat dit zouten zijn waarvan verwacht mag worden dat die geschikt zullen zijn voor het maken van een tabletvorm die een nieuwe statine volgens de uitvinding bevat, waarbij na inname in het lichaam de biologisch actieve anionen worden gevormd. Het octrooischrift biedt de gemiddelde vakman geen aanleiding te veronderstellen dat de in paragraaf 7 gegeven opsomming van zouten is ingegeven door een uitgevoerd zoutenonderzoek. In de voorbeelden worden slechts twee zouten vervaardigd, terwijl in het experiment niet verschillende zoutvormen met elkaar worden vergeleken, maar alleen de effectiviteit van een statine volgens de uitvinding met een statine volgens de stand van de techniek. Ook overigens biedt de beschrijving geen aanknopingspunt voor de gedachte dat de octrooihouder heeft gevonden dat bepaalde zouten (laat staan alle zouten behalve die genoemd in paragraaf 7) ongeschikt zouden zijn voor gebruik met rosuvastatine.
5.20
De algemene vakkennis van de gemiddelde vakman leidt de gemiddelde vakman evenmin ertoe aan te nemen dat de opsomming van zouten in paragraaf 7 limitatief zou zijn bedoeld. Het was de gemiddelde vakman bekend dat het op de prioriteitsdatum gebruikelijk was om bij farmaceutische preparaten die in zoutvorm (moeten) worden toegediend, zoals statines, een zoutenonderzoek te doen. Het gekozen zout kan immers van invloed zijn op bijvoorbeeld de chemische en opslagstabiliteit en oplosbaarheid van het farmaceutisch preparaat. Naar Astrazeneca onder verwijzing naar diverse partij-deskundigenverklaringen (dr. [S] , 3e verklaring, par. 13-16; prof. dr. [F] , par. 14-18 met verwijzing naar J.I. Wells, Pharmaceutical preformulation, 1988; [T] , par. 10, 32-34; dr. [B] par. 13-20; dr. [H] par. 16-21 en dr. [X] par. 15-17) heeft gesteld is de gemiddelde vakman er echter ook mee bekend dat het – zeker in het stadium waarin onder tijdsdruk een octrooiaanvrage moet worden opgesteld en ingediend en veelal slechts een beperkte hoeveelheid van de uitgevonden stof beschikbaar is – niet gebruikelijk was dat een uitputtend zoutenonderzoek werd gedaan. Dit werd beperkt tot een aantal zouten (waaronder in de regel natrium als het veruit meest gebruikte zout, gevolgd door calcium en kalium) en werd alleen uitgebreid tot andere zouten als daar aanleiding voor bestond. Resolution heeft dat niet voldoende gemotiveerd bestreden. Uit de door Resolution aangehaalde publicatie van Morris c.s. (An integrated approach to the selection of optimal salt form for a new drug candidate, 1994 (van na de prioriteitsdatum)) komt geen ander beeld naar voren. Daarin werd een zoutenonderzoek gedaan – hoewel in een later stadium van het ontwikkelingsproces en op een meer gestructureerde manier opgezet dan de meer pragmatische benadering die gebruikelijk was – ook met (slechts) 7 verschillende zouten, waaronder de hiervoor genoemde. In de beschrijving is geen aanwijzing te vinden dat in dit geval, anders dan gebruikelijk, toch een uitputtend zoutenonderzoek was gedaan, op grond waarvan de octrooihouder een bewuste keuze voor specifiek alleen deze zouten zou hebben kunnen maken. Daarom zal de gemiddelde vakman niet aannemen dat zo’n uitputtend zoutenonderzoek aan paragraaf 7 ten grondslag lag en ook niet dat de octrooihouder met deze paragraaf, niettegenstaande de bewoordingen van conclusie 1 waarin geen beperking ten aanzien van het soort zout is opgenomen (anders dan de gebruikelijke dat het zout niet-toxisch en farmaceutisch aanvaardbaar dient te zijn), heeft beoogd alleen deze zouten voor gebruik met rosuvastatine onder bescherming te stellen.
5.21
Evenmin biedt de beschrijving of het verleningsdossier enig aanknopingspunt voor het bestaan van een onderliggend (juridisch) probleem dat voor de octrooihouder reden geweest kan zijn om van een deel van de bescherming die conclusie 1 van het octrooi biedt afstand te willen doen. Resolution heeft dat ook niet voldoende gemotiveerd aangevoerd. Zij heeft slechts gespeculeerd dat de octrooihouder met het (volgens haar) niet mee-claimen van andere zouten dan die genoemd in paragraaf 7 mogelijk eventuele nawerkbaarheidsproblemen over de hele breedte wilde vermijden. Zij heeft evenwel op geen enkele wijze onderbouwd waarom de gemiddelde vakman dat zou veronderstellen en ook geen zogenaamd ‘Gillette-verweer’ gevoerd, in die zin dat als het octrooi niet in de door haar bepleite zin beperkt zou worden uitgelegd, het octrooi ongeldig zou zijn wegens niet-nawerkbaarheid.
5.22
Al het voorgaande leidt tot de conclusie dat de gemiddelde vakman op de prioriteitsdatum geen goede grond had om aan te nemen dat de octrooihouder zijn octrooi wilde beperken tot de in paragraaf 7 genoemde zouten voor gebruik met rosuvastatine en daarmee afstand wilde doen van een deel van de bescherming waarop hij ingevolge de letterlijke bewoordingen van conclusie 1 aanspraak kon maken. Of anders gezegd: de gemiddelde vakman zou niet aannemen dat de octrooihouder er bewust voor heeft gekozen alleen de in paragraaf 7 genoemde zouten van rosuvastatine onder bescherming te stellen. Hij zou de in paragraaf 7 gegeven opsomming daarom niet als limitatief beschouwen. Dat brengt met zich dat conclusie 1 aldus dient te worden uitgelegd dat de beschermingsomvang ervan zich (naast het rosuvastatinezuur) uitstrekt tot alle niet-toxische farmaceutisch aanvaardbare zouten van rosuvastatine, ook die niet zijn genoemd in paragraaf 7 van de beschrijving. Ook onafhankelijk van de ‘goede grond voor afstand-leer’ zou overigens op grond van hetgeen in r.o. 5.14 t/m 5.24 is overwogen tot dezelfde conclusie zijn gekomen.
5.23
De redelijke rechtszekerheid verzet zich niet tegen deze uitleg van de conclusie. Omdat de gemiddelde vakman paragraaf 7 niet limitatief, in beperkende zin, zou begrijpen en dus, anders dan Resolution stelt, niet afgaat op die paragraaf voor de uitleg van de conclusie, wordt hij niet op het verkeerde been gezet indien de conclusie wordt uitgelegd conform de duidelijke, letterlijke bewoordingen daarvan. Integendeel zou juist de redelijke bescherming voor de octrooihouder in het geding zijn indien, niettegenstaande de (veel) ruimere uitvindingsgedachte, de conclusie in de door Resolution voorgestane beperktere zin zou worden uitgelegd.
5.24
Deze uitleg is ook geen ‘weginterpreteren’ van een kenmerk uit de conclusie, zoals door Resolution gesteld. De uitleg ziet immers op het conclusiekenmerk ‘or a non-toxic pharmaceutically acceptable salt thereof’. Zoals volgt uit hetgeen hiervoor in r.o. 5.11 is overwogen is het uitgangspunt niet dat eerst paragraaf 7 in de conclusie moet worden ingelezen om vervolgens die aldus beperkte conclusie uit te leggen, waar Resolution kennelijk en ten onrechte vanuit gaat.
5.25
Evenmin is deze uitleg gebaseerd op de verlaten wezensleer, hetgeen reeds volgt uit het feit dat de beschermingsomvang van de conclusie zoals uitgelegd beperkter is dan de beschermingsomvang indien alleen van de ruimere uitvindingsgedachte zou zijn uitgegaan. De uitvindingsgedachte is slechts een van de in aanmerking genomen gezichtspunten bij de uitleg van het conclusiekenmerk in het licht van de beschrijving in zijn geheel beschouwd, vanuit het perspectief van de gemiddelde vakman in aanmerking genomen zijn algemene vakkennis op de prioriteitsdatum.
Toegevoegde materie
5.26
Resolution stelt zich op het standpunt dat conclusie 1 van EP 471 nietig is wegens strijd met artikel 75 lid 1 onder c Rijksoctrooiwet (toegevoegde materie) voor zover die betrekking heeft op iets anders dan rosuvastatine natrium- of calciumzout, omdat rosuvastatinezuur noch andere zoutvormen in de oorspronkelijke aanvrage direct en ondubbelzinnig aan de gemiddelde vakman zouden zijn geopenbaard. De rechtbank oordeelde dat alleen rosuvastatinezuur toegevoegde materie oplevert.
5.27
De oorspronkelijke aanvrage openbaart een nieuwe groep statines en claimt deze door middel van een Markush formule, waarbij variatie mogelijk is op de groepen R1-R4 en X. Als voorbeeld van deze groep statines is rosuvastatine geopenbaard, in voorbeeld 1 als natriumzout en in voorbeeld 7 als calciumzout (en verder ook als een alkyl-ester). Daarbij zijn dezelfde keuzes gemaakt voor de groepen R1-R3 en X en is uit de voor de R4 positie genoemde mogelijkheden respectievelijk natrium, calcium en methyl gekozen. In de oorspronkelijke aanvrage is vermeld dat voor de R4-positie kon worden gekozen uit ‘hydrogen, lower alkyl, or a cation capable of forming a non-toxic pharmaceutically acceptable salt’.
5.28
Zoals hiervoor overwogen behoorde het tot de algemene vakkennis van de gemiddelde vakman op de prioriteitsdatum dat de biologische activiteit van een statine is gelegen in het anion en dat de statinezuur- of zoutvorm er uitsluitend toe dient om het werkzame bestanddeel in tabletvorm te kunnen toedienen. Na inname zal het zuur of zout in het lichaam oplossen en komt het werkzame anion vrij. In overeenstemming daarmee wordt in het ‘Experiment’ in de oorspronkelijke aanvrage de potentie van verschillende statines (waaronder rosuvastatine) onderzocht en niet verschillende zuur- of zoutvormen van één statine. Voor de werkzaamheid (in de zin van biologische activiteit, te weten de HMG-CoA reductase remmende werking) is de gekozen zuur- of zoutvorm immers niet relevant.
5.29
Het voorgaande brengt met zich dat de gemiddelde vakman bij het in de aanvrage geopenbaarde rosuvastatine ook de andere mogelijke keuzes op R4 dan natrium of calcium – dus ook de zuurvorm en andere zoutvormen – zou meelezen of, anders gezegd, voor ogen had. Omdat die keuze niet relevant is voor de biologische activiteit van rosuvastatine, wordt daarmee geen (technische) informatie verschaft die niet rechtstreeks en ondubbelzinnig uit de oorspronkelijke aanvrage kan worden afgeleid. Van een ontoelaatbare veralgemenisering is evenmin sprake. Rosuvastatine is een nieuw gevonden statine, met bepaalde vaste keuzes op R1-R3 en X, waarvan de biologische activiteit onafhankelijk is van de gekozen zuur- of zoutvorm. Positie R4 bepaalt de zuur- of zoutvorm. Waterstof (waarmee bedoeld wordt het waterstof-ion dat de zuurvorm oplevert) en kationen die met een statine niet-toxische farmaceutisch aanvaardbare zouten kunnen vormen zijn in de oorspronkelijke aanvrage reeds expliciet genoemd als behorend tot de groep waaruit op positie R4 gekozen kan worden. Het expliciet geopenbaarde natrium- en calciumzout uit die groep zijn daarvan – door de gemiddelde vakman als niet-limitatief opgevatte – voorbeelden (welke voorbeelden in de oorspronkelijke aanvrage op p. 4, r.29-30 ook zijn aangeduid als ‘not to be considered as limiting). Natrium en calcium behoren tot de meest gebruikte zouten voor farmaceutische preparaten in zoutvorm en de aanvrage geeft de gemiddelde vakman geen aanleiding te veronderstellen dat er enige specifieke reden is om voor deze zouten te kiezen. De gemiddelde vakman begrijpt daarom dat hij verder kan variëren op de R4 positie met een van de andere genoemde ionen zonder dat dit van invloed is op de biologische activiteit van het expliciet geopenbaarde rosuvastatine. Uit hetgeen hiervoor ter zake de uitleg van conclusie 1 is overwogen volgt dat het hof, anders dan de rechtbank, van oordeel is dat de gemiddelde vakman het waterstof-ion en alle kationen die een niet-toxisch farmaceutisch aanvaardbaar zout opleveren voor ogen heeft en niet alleen die genoemd op pagina 2 regels 42-45 van de aanvrage (die overeenkomt met paragraaf 7 van het octrooischrift).
5.30
Niet valt in te zien waarom een en ander anders zou zijn doordat naast rosuvastatine ook andere statines (dus met andere keuzes op R1-R3 en X) zijn geopenbaard, zoals Resolution aanvoert (paragraaf 36 pleitnota eerste aanleg). Uit de aanvrage is het voor de gemiddelde vakman immers duidelijk waar de uitvinding over gaat, namelijk dat een nieuwe groep statines is gevonden, waarvan in elk geval de in het Experiment genoemde statines potenter zijn dan een uit de stand van de techniek bekende statine. Op dezelfde gronden als hiervoor uiteengezet ten aanzien van rosuvastatine geldt voor elk van de in de voorbeelden expliciet geopenbaarde statines dat deze in elke zuur- of zoutvorm uit de R4 groep direct en ondubbelzinnig zijn geopenbaard. Het gaat om de biologische activiteit van de statine, niet om de zuur- of zoutvorm waarin het in tabletvorm kan worden toegediend, naar de gemiddelde vakman op de prioriteitsdatum wist.
5.31
Dat de gemiddelde vakman niet van te voren kon voorspellen of en in welke mate de zuurvorm en zoutvormen van rosuvastatine in de praktijk daadwerkelijk geschikt zouden blijken te zijn voor toepassing in een farmaceutisch preparaat met rosuvastatine, zoals Resolution stelt, staat aan de directe en ondubbelzinnige openbaarmaking in de aanvrage van de in conclusie 1 van EP 471 geclaimde zuurvorm en zoutvormen niet in de weg. Niet-werkende zoutvormen vallen niet onder conclusie 1 omdat daarin alleen farmaceutisch aanvaardbare zouten worden geclaimd. Overigens heeft Resolution, op wie terzake de stelplicht en zo nodig bewijslast rust, onvoldoende onderbouwd aangevoerd op grond waarvan moet worden aangenomen dat de gemiddelde vakman waterstof (waarmee het zuur wordt gevormd), of enig kation waarmee een zout van rosuvastatine gevormd kan worden, ondanks dat deze expliciet in de aanvrage worden genoemd, toch niet als reële mogelijkheid op positie R4 zou meelezen. Ten aanzien van de zuurvorm heeft Resolution gewezen op de publicatie van Berghe uit 1977 ((Pharmaceutical Salts, Journal of Pharmaceutical Sciences, Vol. 66, 1) waarin, niet specifiek ten aanzien van statines, is opgemerkt dat ‘most organic acids and bases are only poorly soluable in H2O’. Dit is evenwel onvoldoende, mede in het licht van de stelling van Astrazeneca, onder verwijzing naar verklaringen van haar partij-deskundigen [S] (3e verklaring par. 3-8 en de daarin genoemde publicatie van T.M. Serajuddin over verschillende statines (Journal of Pharmaceutical Sciences, Vol. 80, 9), waarin is geopenbaard dat polaire statines zoals rosuvastatine als vrij zuur redelijk goed oplosbaar zijn) en [F] (1e verklaring par. 6-11 ), dat de gemiddelde vakman het vrije zuur en een zout als vrijwel gelijk zal beschouwen. Dat conclusie 1 nawerkbaar is heeft Resolution ook niet bestreden.
5.32
Op grond van het voorgaande is het hof van oordeel dat geen sprake is van toegevoegde materie doordat conclusie 1 van EP 471 zich tevens uitstrekt tot rosuvastatinezuur en ook andere niet-toxische farmaceutisch aanvaardbare zouten dan het natrium- en calciumzout.
In incidenteel appel
5.33
Resolution heeft een grief gericht tegen het oordeel van de rechtbank dat ook de andere zoutvormen van rosuvastatine dan natrium- en calciumzout in de oorspronkelijke aanvrage direct en ondubbelzinnig zijn geopenbaard. Zoals volgt uit hetgeen hiervoor in r.o. 5.26 - 5.32 is overwogen treft die grief geen doel.
5.34
De tweede grief van Resolution is gericht tegen het oordeel van de rechtbank dat zij geen belang heeft bij vernietiging van het octrooi naast vernietiging van het ABC. Deze grief kan Resolution niet baten omdat het vonnis van de rechtbank zal worden vernietigd en het hof het ABC geldig acht.
in principaal en incidenteel appel
Slotsom
5.35
De slotsom is dat er naar het oordeel van het hof geen sprake is van toegevoegde materie en dat rosuvastatinezink valt onder de beschermingsomvang van conclusie 1 van EP 471. Daarom dient het vonnis van de rechtbank te worden vernietigd en zullen de vorderingen van Resolution alsnog worden afgewezen, in aanmerking nemende dat, gelet op het onder 5.22 en 5.32 overwogene, het rosuvastatinezink van Resolution onder EP 471 valt en daarmee dus directe inbreuk wordt gemaakt. Bij haar verklaring voor recht dat zij geen indirecte inbreuk maakt heeft Resolution bij die stand van zaken geen belang.
Proceskosten
5.36
Resolution zal als de in het ongelijk gestelde partij worden veroordeeld in de proceskosten in beide instanties. Partijen hebben overeenstemming bereikt dat de proceskosten in eerste aanleg zijn te begroten op EUR 240.000,- en in hoger beroep op EUR 200.000,-.
6. Beslissing
In principaal en incidenteel appel:
- vernietigt het bestreden vonnis, en alsnog recht doende:
- wijst de vorderingen van Resolution af;
- veroordeelt Resolution tot betaling van de proceskosten aan de zijde van Astrazeneca in beide instanties, begroot op EUR 440.000,-;
- verklaart de proceskostenveroordeling uitvoerbaar bij voorraad.
Dit arrest is gewezen door mrs. R. Kalden, M.Y. Bonneur en C.J.J.C. van Nispen en is uitgesproken ter openbare terechtzitting van 16 februari 2016 in aanwezigheid van de griffier.