Kennelijk per abuis staat op de akte de datum 9 maart 2015 vermeld.
Rb. Den Haag, 05-04-2017, nr. C/09/469148 / HA ZA 14-770
ECLI:NL:RBDHA:2017:3430
- Instantie
Rechtbank Den Haag
- Datum
05-04-2017
- Zaaknummer
C/09/469148 / HA ZA 14-770
- Vakgebied(en)
Civiel recht algemeen (V)
Intellectuele-eigendomsrecht (V)
- Brondocumenten en formele relaties
ECLI:NL:RBDHA:2017:3430, Uitspraak, Rechtbank Den Haag, 05‑04‑2017; (Bodemzaak)
ECLI:NL:RBDHA:2015:14337, Uitspraak, Rechtbank Den Haag, 25‑11‑2015
- Wetingang
- Vindplaatsen
JGR 2017/22
Uitspraak 05‑04‑2017
Inhoudsindicatie
Octrooirecht. Eindvonnis. Tweede medische indicatie. Swiss type claim. Verhandeling in Nederland van rechtstreeks verkregen product van in buitenland toegepaste werkwijze door gelieerde concernonderneming. Directe inbreuk aangenomen.
Partij(en)
vonnis
RECHTBANK DEN HAAG
Team handel – sectie IE
zaaknummer / rolnummer: C/09/469148 / HA ZA 14-770
Vonnis van 5 april 2017
in de zaak van
de besloten vennootschap met beperkte aansprakelijkheid
SUN PHARMACEUTICAL INDUSTRIES (EUROPE) B.V.,
gevestigd te Hoofddorp, gemeente Haarlemmermeer,
eiseres in conventie,
verweerster in reconventie,
advocaat: mr. M.H.J. van den Horst te Den Haag,
tegen
1. de rechtspersoon naar vreemd recht
NOVARTIS AG,
gevestigd te Basel, Zwitserland,
2. de rechtspersoon naar vreemd recht
NOVARTIS PHARMA GMBH,
gevestigd te Wenen, Oostenrijk,
gedaagden in conventie,
eiseressen in reconventie,
advocaat: mr. D. Knottenbelt te Rotterdam.
Partijen zullen hierna Sun en (gedaagden gezamenlijk in enkelvoud) Novartis genoemd worden. Voor Sun is de zaak inhoudelijk behandeld door de advocaat voornoemd en door haar kantoorgenoot mr. D.M. Mulder, advocaat te Den Haag. Voor Novartis is de zaak inhoudelijk behandeld door mrs. R.M. Kleemans en J.D. Drok, advocaten te Amsterdam.
1. De procedure
1.1.
Het verloop van de procedure blijkt uit:
- -
het tussenvonnis van 25 november 2015 (hierna: het tussenvonnis);
- -
de akte na tussenvonnis tevens akte houdende overlegging producties van Novartis van 20 januari 2016 met de producties 25 t/m 28;
- -
de antwoordakte na tussenvonnis tevens akte houdende overlegging producties van Sun van 9 maart 20161.met de producties 42 t/m 60;
- -
de brief van mr. Kleemans aan de rechtbank van 16 maart 2016 waarin hij bezwaar maakt tegen de hoofdstukken 3 en 5 van de antwoordakte van Sun alsmede tegen overlegging door Sun van de producties 44 t/m 55 en 59 en 60;
- -
de brief van mr. Van den Horst aan de rechtbank van 22 maart 2016 waarin zij reageert op het bezwaar van Novartis;
- -
het op 22 maart 2016 namens Novartis ingediende B7-formulier met verzoek pleidooi te bepalen;
- -
de beslissing van de rechtbank van 31 maart 2016 waarbij pleidooi wordt toegestaan;
- -
de brief van mr. Van den Horst aan de rechtbank van 12 april 2016 met twee geactualiseerde producties (producties 44 en 49);
- -
de op voorhand toegestuurde akte houdende overlegging producties van Novartis van 26 april 2016 met de producties 29 en 30;
- -
de brief van mr. Kleemans van 22 april 2016 met productie 31 (geactualiseerd proceskostenoverzicht);
- -
de brief van mr. Van den Horst van 25 april 2016 met productie 60.1 (geactualiseerd proceskostenoverzicht);
- -
de pleitnota’s van mrs. Van den Horst en Kleemans voor de zitting van 26 april 2016, met in de pleitnota van mr. Van den Horst doorgehaald de paragrafen 63 t/m 65, paragraaf 66 tweede en derde zin en paragraaf 67 t/m 71 die niet zijn gepleit.
1.2.
Ter zitting heeft Sun bezwaar gemaakt tegen een volgens haar nieuw gevoerd argument in de paragrafen 22 t/m 29 van de pleitnota van de zijde van Novartis.
1.3.
Vonnis is nader bepaald op heden.
1.4.
Bij e-mail van 27 januari 2017 heeft mr. Kleemans de rechtbank het transscript van de mondelinge behandeling van 26 april 2016 toegezonden.
2. De aanvullende feiten
Naast de feiten die in het tussenvonnis zijn vastgesteld, zijn de onderhavige feiten komen vast te staan.
Sun en het generieke product
2.1.
Sun laat haar zoledroninezuur bereiden door Sun Pharmaceutical Industries Limited, gevestigd te Halol, Gujarat in India (hierna: Sun India). Orders worden wereldwijd geplaatst bij Sun Pharma Global FZE, Verenigde Arabische Emiraten (hierna: Sun FZE), die de bestelling vervolgens bij Sun India plaatst. Ook Sun plaatst haar orders bij Sun FZE. De bestelde producten worden door Sun in Nederland ingevoerd en zij brengt het generieke zoledroninezuur vervolgens in Europa, waaronder Nederland, op de markt. Sun en Sun FZE zijn beide indirecte dochters van Sun India.
2.2.
De verpakking en de bijsluiter van Sun’s zoledroninezuur wordt door Sun India gedrukt. Sun geeft instructies aan Sun India ten aanzien van de wijze waarop de verpakking er uit moet zien en de inhoud van de bijsluiter. In de bijsluiter staat vermeld:
Houder van de vergunning voor het in de handel brengen en fabrikant
Sun Pharmaceutical Industries Europe BV
Polarisavenue 87
2132 JH Hoofddorp
Nederland
Dit middel is ingeschreven onder RVG nummer 111818
en ook:
Houdbaarheid
Ongeopende injectieflacon : 2 jaar
2.3.
Sun heeft een Qualified Person of QP (hierna: QP) in dienst die er de verantwoordelijkheid voor draagt dat iedere uit derde landen door Sun ingevoerde fabricagepartij in Nederland een volledige kwalitatieve analyse, een kwantitatieve analyse van ten minste alle werkzame stoffen en alle andere proeven of controles heeft ondergaan die nodig zijn om de kwaliteit van de geneesmiddelen te waarborgen met inachtneming van de eisen voor de vergunning voor het in de handel brengen. Van de controle in verband met de vrijgifte ondertekent de QP een controlerapport.
2.4.
Uit Farminform, een organisatie die digitaal verkoopinformatie bijhoudt, blijken de volgende verkoopcijfers van het generieke product van Sun en van het spécialité product van Novartis, Aclasta®.
units | 2014/Jan | 2014/Feb | 2014/Mar | 2014/Apr |
|---|---|---|---|---|
SUN 0,05 mg/ml | 51 | 91 | 184 | 215 |
NOVARTIS 0,05 mg/ml | 419 | 306 | 298 | 191 |
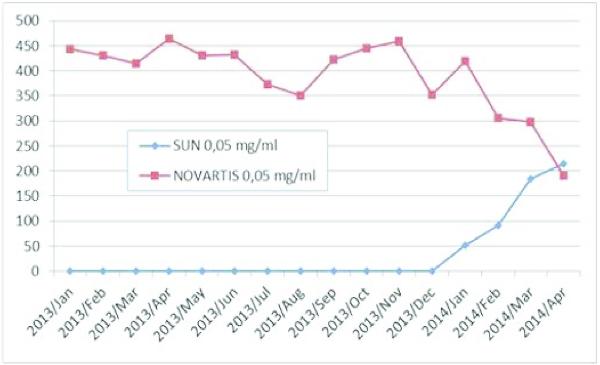
Over de maanden na april 2014 heeft Sun de volgende hoeveelheden van haar generieke product verkocht:
mei | 188 |
juni | 158 |
juli | 219 |
augustus | 240 |
september | 210 |
oktober | 394 |
2.5.
Na sommatie door Novartis heeft de advocaat van Sun per e-mail van 9 december 2013 het College ter Beoordeling van Geneesmiddelen (hierna: CBG) verzocht te bevestigen dat het ongewijzigd laten van de Summary of Product Characteristics (hierna: SmPC) in de Geneesmiddelendatabank staand beleid is van het CBG. De inhoud van de e-mail, met als onderwerpregel: “Vraag betreffende weergave tweede medische indicatie in online SmPC”, luidt als volgt:
Zoals zojuist telefonisch besproken stuur ik mijn vraag per e-mail.
In de aanvraag voor een marktvergunning is het, voor zover wij weten, verplicht om alle medische indicaties van een werkzame stof aan te geven (de SmPC en bijsluiter van het generieke product moeten immers overeenstemmen). Indien een ‘tweede medische’ indicatie van een werkzame stof nog onder octrooibescherming valt is het mogelijk om het CBG te verzoeken deze medische indicatie te verwijderen uit de bijsluiter en uit de gedrukte/papieren versie van de SmPC.
Ons wordt gezegd dat het CBG de online versie van het SmPC niet aanpast. Is dat juist en zo ja, zou u kunnen aangeven om welke reden het CBG de online versie van de SmPC niet aanpast?
Wij hebben hierover op heel korte termijn duidelijkheid nodig in verband met een kort geding dreiging.
2.6.
Bij e-mail van 11 december 2013 heeft het CBG als volgt geantwoord:
Zoals u weet kan de SmPC die wordt gepubliceerd op de geneesmiddeleninformatiebank (hierna: GIB) verschillen van de SmPC die wordt toegevoegd in de verpakking qua indicaties.
Het College beoordeelt de volledige balans werkzaamheid-risico’s, dus inclusief eventueel geoctrooieerde indicaties. Het College wijst erop dat de balans werkzaamheid-risico’s voor het generieke product niet afwijkt van die van de innovator. In de geneesmiddeleninformatiebank wordt de product-informatie opgenomen die bij de registratie hoort. Deze informatie is volledig en hierin worden alle – ook de geoctrooieerde indicaties – genoemd.
Wanneer gebruiksoctrooien van toepassing zijn op bepaalde indicaties, kan de handelsvergunninghouder van het generieke product vóór het op de markt brengen van het product deze informatie uit de gedrukte SmPC en patiëntenbijsluiter verwijderen.
Er kan geen verzoek worden ingediend om de indicatie waarop het gebruiksoctrooi berust uit de SmPC van het generieke geneesmiddelen in de GIB te verwijderen.
Zoals gezegd beoordeelt het College de volledige balans werkzaamheid-risico’s, dus inclusief eventueel geoctrooieerde indicaties. In het belang van de volksgezondheid acht het College het van belang dat de informatie in de GIB volledig is en derhalve worden - ook de geoctrooieerde indicaties - in de SmPC genoemd.
Voor meer informatie over het beleid van het College betreffende gebruiksoctrooien en productinformatie verwijs ik u naar onze website:
(…)
Overigens merk ik op dat het College geen partij is wat betreft het naleven van gebruiksoctrooien.
2.7.
Op 13 februari 2014 heeft mw. [A] van Sun een e-mail aan zorgverzekeraars VGZ en Menzis gestuurd. De inhoud van de e-mail, met als onderwerpregel: “BELANGRIJK: ATTENTIE Zoledroninezuur SUN 5mg/100ml”, luidt als volgt:
In aanvulling op onze eerdere gesprekken en op advies van onze jurist wijzen wij u er nogmaals voor de duidelijkheid op dat het product Zoledroninezuur SUN 5mg/100ml, Z-indexnummer: 15958264 zoals door ons op de markt wordt gebracht, uitsluitend voor de behandeling van de ziekte van Paget is. Dit is ook de indicatie die wordt vermeld in de bijsluiter Zoledroninezuur SUN 5mg/100ml. Vooralsnog is de indicatie osteoporose niet opgenomen, aangezien deze indicatie nog beschermd wordt door een patent van Novartis.
Tevens hebben wij onze afnemers(groothandels) hiervan op de hoogte gebracht.
Graag deze mail doorsturen aan de juiste personen binnen uw organisatie.
Erop vertrouwende u hiermee voldoende te hebben geinformeerd verblijf ik,
Heeft u vragen dan verneem ik dat graag.
2.8.
Daags na het arrest van het Hof Den Haag van 27 januari 2015 (zie 2.23. van het tussenvonnis), i.e. op 28 januari 2015, heeft Sun alle zorgverzekeraars waarmee Sun contact had, aangeschreven. De inhoud van het bericht luidt als volgt:
Geachte relatie,
Bij arrest van 27 januari 2015 heeft het Gerechtshof Den Haag oordelend in kort geding geoordeeld dat wij door de levering dan wel het aanbieden van Zoledroninezuur SUN 5mg/100ml, oplossing voor infusie, indirect inbreuk maken op de octrooirechten van Novartis.
Voor zover de tenderprocedure/overeenkomst die u heeft geïnitieerd/met ons heeft gesloten de indicatie osteoporose omvat, delen wij u mede dat wij niet (langer) in staat zijn om deel te nemen/te leveren. Wij kunnen uitsluitend deelnemen in een tenderprocedure/overeenkomst die voldoende garandeert dat de levering van Zoledroninezuur SUN 5mg/100ml voor de behandeling van osteoporose wordt voorkomen.
2.9.
Eveneens op 28 januari 2015 heeft Sun aan alle groothandels en ziekenhuisapotheken een brief gestuurd waarin een identieke tekst is opgenomen als hierboven in 2.8. vermeld.
2.10.
Op 9 februari 2015 heeft mw. [A] een e-mail aan KNMP Farmanco (zie 2.19. van het tussenvonnis) gestuurd. De inhoud van de e-mail, met als onderwerpregel “Betr: RE: 2e REMINDER: levertijd Zoledroninezuur infvlst en infvlst concentraat?”, luidt als volgt:
Wij hebben inmiddels beide Zoledroninezuur SUN producten op voorraad en beschikbaar voor de markt (zowel de Zoledroninezuur SUN 5mg/100, alleen voor de indicatie Paget, de indicatie osteoporose is nog niet uit patent, als de Zoledroninezuur SUN 4mg/5ml).
LET OP!: Wij moeten u er wel op attenderen dat er inmiddels een rechtszaak is geweest aangaande Zoledroninezuur SUN 5mg/100ml en hiervan heeft het Hof een arrest uitgevaardigd en in onderstaande de tekst zoals SUN Pharma onlangs aan alle groothandels en ziekenhuisapothekers heeft gestuurd:
“Geachte [naam contactpersoon, verzekeringsmaatschappij/ziekenhuis]
Bij arrest van 27 januari 2015 heeft het Gerechtshof Den Haag oordelend in kort geding geoordeeld dat wij door de levering dan wel het aanbieden van Zoledroninezuur SUN 5mg, oplossing voor infusie, indirect inbreuk maken op de octrooirechten van Novartis. Voor zover de tenderprocedure/overeenkomst die u heeft geïnitieerd / met ons heeft gesloten de indicatie osteoporose omvat, delen wij u mede dat wij niet (langer) in staat zijn om deel te nemen / te leveren. Wij kunnen uitsluitend deelnemen in een tenderprocedure/overeenkomt die voldoende garandeert dat de levering van 5mg/100ml zoledroninezuur voor de behandeling van osteoporose wordt voorkomen.”
Erop vertrouwende u hiermee voldoende te hebben geïnformeerd verblijf ik,
KNMP Farmanco heeft bovenstaande tekst op haar website geplaatst.
2.11.
Bij brieven van 18 februari 2015 heeft Sun bij monde van mw. [A] contact gezocht met de relevante verenigingen van specialisten, te weten de Nederlandse Vereniging voor Reumatologie (NVR), de Nederlandse Internisten Vereniging ‘Domus Medica’ en de Nederlandse Vereniging voor Medische Oncologie. De inhoud van die brieven luidt als volgt:
Graag vraag ik uw aandacht voor het volgende.
Sun Pharmaceutical Industries (Europe) B.V. brengt sinds januari 2014 haar generieke product Zoledroninezuur Sun 5mg/100ml op de markt voor de behandeling van de ziekte van Paget. Sun Pharma levert haar product uitdrukkelijk niet voor de behandeling van osteoporose, omdat die indicatie wordt beschermd door een octrooi van Novartis. Dit betekent dat Zoledroninezuur Sun 5mg/100ml niet mag worden voorgeschreven/toegepast voor osteoporose. Aanwending van het product voor alle andere doeleinden valt buiten dat octrooi.
Novartis heeft een kort geding tegen Sun Pharma aangespannen, waarin zij Sun Pharma beticht van indirecte octrooiinbreuk. Novartis meent dat Sun Pharma haar product aflevert wetende dat dit ook zal worden aangewend voor de nog geoctrooieerde indicatie osteoporose, ondanks dat Sun Pharma een zogenaamde ‘carve-out’ heeft bewerkstelligd in haar PIL (bijsluiter) en SmPC ten aanzien van de indicatie osteoporose.
Inmiddels heeft het Hof Den Haag in deze octrooiprocedure in kort geding aan Sun Pharma een indirect inbreukverbod opgelegd dat er op neer komt dat Sun Pharma alleen nog haar generieke Zoledroninezuur SUN 5mg/100ml product mag afleveren als zij voldoende garantie heeft dat dit niet voor osteoporose wordt aangewend. Die “garantie” kan Sun Pharma eigenlijk alleen krijgen als de voorschrijvende artsen onderscheid maken tussen de geoctrooieerde indicatie osteoporose (waarvoor vooralsnog alleen Aclasta van Novartis mag worden afgeleverd, dus door voor te schrijven op medische noodzaak) en de vrije indicaties, waarvoor Sun’s generieke Zoledronine zuur 5mg/100ml kan worden afgeleverd. Een kopie van het arrest van 27 januari jl. stuur ik u op verzoek graag toe.
Sun Pharma heeft uiteraard geen (rechtstreekse) invloed op het voorschrijfbeleid van artsen. In verband daarmee verzoeken wij u uw leden in te lichten omtrent het bovenstaande en er bij hen op aan te dringen bij het voorschrijven van Aclasta/Zoledroninezuur 5mg/100ml uitdrukkelijk aan te geven voor welke indicatie het middel is bedoeld. Is het voor osteoporose, dan is Aclasta vooralsnog het enige product dat gegeven het octrooi van Novartis mag worden afgeleverd. Voor elke andere indicatie kan generiek Zoledroninezuur SUN 5mg/100ml worden afgeleverd.
Zonder het maken van dit onderscheid leidt het verbod ertoe dat Sun’s generieke product, ook voor de vrije indicaties, slechts zeer beperkt op de markt zal kunnen komen, hetgeen ook uit kostenperspectief natuurlijk te betreuren is. Immers, het Hof gaat er vooralsnog van uit dat de markt van Paget maar 140 eenheden/verpakkingen per jaar rechtvaardigt. Dit aantal is gebaseerd op de gegevens van Novartis’ Aclasta verkoop en houdt, ten onrechte, geen rekening met de andere indicaties waarvoor Zoledroninezuur Sun 5 mg/100ml door de bij u aangesloten artsen kan worden/wordt voorgeschreven. In dat verband is Sun Pharma geïnteresseerd van u/uw leden te vernemen of en zo ja voor welke indicaties (anders dan Paget) uw leden behandeling met Zoledroninezuur 5mg/100ml voorschrijven, zoals hypercalcemia e.d. Deze aantallen bepalen wat generiek geleverd kan worden zonder beticht te worden van indirecte octrooiinbreuk.
Het gebruik van Zoledroninezuur 5mg/100ml kan ook nog om andere redenen toenemen. Sun is bekend met het feit dat patiënten in voorkomende gevallen, mede uit kostenoverwegingen, niet Aclasta krijgen voorgeschreven, maar bijvoorbeeld behandeld worden met het goedkopere Pamidroninezuur (APD). Waar Sun’s generieke Zoledroninezuur product veel goedkoper is, kan dit ertoe leiden dat bedoelde patiënten thans wèl Zoledroninezuur Sun 5mg/100ml krijgen voorgeschreven in plaats van bijvoorbeeld Pamidroninezuur (APD), hetgeen ook tot een toename van het gebruik van Zoledroninezuur kan leiden.
Indien en voor zover die informatie u bekend is of wordt, zou Sun het zeer op prijs stellen indien u ons kan laten weten:
1. Voor welke indicaties, anders dan osteoporose of Paget, Zoledroninezuur 5mg/100ml wordt voorgeschreven
2. Of het beschikbaar komen van het goedkopere, generieke Zoledroninezuur 5mg/100ml er toe zal leiden dat dit product voor behandeling zal worden aangewend in plaats van Pamidroninezuur en andere alternatieven.
In verband met de nog lopende bodemprocedure over dit onderwerp verzoeken wij u vriendelijk ons te berichten of en zoja op welke wijze u aan onze verzoeken tegemoet wilt komen. Mocht u naar aanleiding hiervan vragen hebben, dan verzoek ik u met mij contact op te nemen.
2.12.
Op 12 maart 2015 heeft mw. [A] een e-mail gestuurd aan het Ministerie van Volksgezondheid, Welzijn en Sport (hierna ook: VWS) waarin zij wijst op de lijst van 23 geneesmiddelen die op indicatie worden voorgeschreven en vraagt of aan die lijst geneesmiddelen zouden kunnen worden toegevoegd waarvan de tweede medische indicatie nog wordt beschermd door een octrooi.
2.13.
De Nederlandse Vereniging voor Reumatologie heeft bij brief van 16 april 2015 geantwoord op het schrijven van Sun van 18 februari 2015 (vgl. 2.11.). De voorzitter reageert als volgt:
Uw brief van 18 februari jl. is besproken binnen het bestuur van de NVR.
Onze antwoorden op uw 2 vragen zijn:
- Zoledroninezuur kan behalve aan patiënten met Paget en osteoporose, worden voorgeschreven aan patiënten met aandoeningen als hypercalciemie en Osteogenesis Imperfecta. Er zijn zeker reumatologen die daar ervaring mee hebben, het betreft echter zeldzame aandoeningen
- Uw vraag of zoledroninezuur kan worden aangewend voor pamidronaat lijkt ons ingegeven door markttechnische overwegingen, die zeker belangrijk zijn, maar reumatologen later zich ook leiden door andere aspecten, zoals effectiviteit/veiligheid en ervaring met dergelijke medicamenten.
2.14.
De directeur van de Nederlandse Internisten Vereniging heeft bij brief van 2 juni 2015 aan de advocaat van Sun bericht dat de onder 2.11. opgenomen brief is besproken in het bestuur maar dat het bestuur heeft besloten de brief en de daarbij behorende informatie niet te verspreiden onder haar leden. Het bestuur is van mening “dat dit niet de gebruikelijke weg is om internisten te informeren omtrent dergelijke wijzigingen in het voorschrijfbeleid.”
2.15.
Bij brief van 24 juni 2015 (ontvangen op 27 juli 2015) heeft VGZ aan Sun het volgende geschreven:
Dank voor uw brief van 28 januari 2015.
In uw brief vraagt u aandacht voor het arrest in kort geding van d.d. 27 januari 2015 van het Gerechtshof in ’s-Gravenhage. Naar het oordeel van de rechter pleegt u, met het leveren van het product zoledroninezuur SUN in Nederland, octrooi-inbreuk. Tevens geeft u aan dat, het door VGZ aangewezen preferente product van SUN Pharmaceuticals, niet langer op de markt brengt voor zover het product voor indicatie osteoporose wordt gebruikt. U geeft aan dat u wel bereid bent om uw levering voort te zetten voor zover de Coöperatie VGZ (hierna VGZ) de garantie kan geven dat het product van Sun Pharmaceuticals niet voor de indicatie osteoporose wordt gebruikt.
VGZ wijst preferente geneesmiddelen aan op basis van artikel 2.8 van het Besluit zorgverzekering. Op basis van dit artikel is VGZ bevoegd om per werkzame stof, die voorkomt in de bij ministeriele regeling aangewezen geneesmiddelen, ten minste een geneesmiddel te vergoeden. Voorts bepaalt het besluit dat indien behandeling met het preferente geneesmiddel medisch niet verantwoord is, de zorgverzekerde ook aanspraak heeft op enig ander niet-preferent geneesmiddel. Dat zijn, kort gezegd, de inkoopkaders voor een zorgverzekeraar. Ook apotheekhoudenden hebben de verantwoordelijkheid om het preferentiebeleid zodanig uitvoeren dat er geen inbreuk wordt gemaakt op het octrooirecht.
VGZ begrijpt dat u uitvoering probeert te geven aan dit arrest. VGZ kan echter niet de garantie geven dat uw product niet afgeleverd en gebruikt wordt voor de indicatie osteoporose. Als zorgverzekeraar houden wij geen toezicht op de indicatie waarvoor een (preferente) geneesmiddel wordt voorgeschreven of gebruikt. VGZ gaat ervan uit dat alle betrokken partijen in het veld patentbescherming voor geneesmiddelen respecteren.
Op basis van ons document “procedure contractering preferente geneesmiddelen” van 2013 worden preferente geneesmiddelen aangewezen op basis van de stofnaam. Daarbij wordt geen rekening gehouden met indicaties, waarvoor artsen een geneesmiddel voorschrijven. Bij de inschrijving voor de aanwijzing van het preferent geneesmiddel was er dan ook niet de mogelijkheid om een voorbehoud te maken met betrekking tot de indicaties.
VGZ beraadt zich op het aanpassen van de procedure voor aanwijzing van een preferent geneesmiddel voor de toekomst.
Tot slot, VGZ is in afwachting van de uitspraak in de bodemprocedure alvorens eventuele maatregelen te treffen.
Wij vertrouwen erop u hiermee voldoende te hebben geïnformeerd.
2.16.
Op 13 juli 2015 heeft naar aanleiding van de e-mail van Sun van 12 maart 2015 (vgl. 2.12.) en onder meer een herinnering van Sun van 25 mei 2015 een gesprek plaatsgevonden tussen Sun en vertegenwoordigers van het Ministerie van VWS en het Ministerie van Economische Zaken over de mogelijkheden de bestaande praktijk van voorschrijven van geneesmiddelen, het beleid van het CBG en het preferentiebeleid van zorgverzekeraars te veranderen.
2.17.
Op 25 augustus 2015 heeft de advocaat van Sun een e-mail gestuurd aan het CBG waarvan de inhoud als volgt luidt:
Tijdens ons telefonisch overleg op 7 juli jl. bespraken wij, naar aanleiding van mijn eerdere email inzake Sun Pharma, onder meer het huidige CBG beleid om geen carve-out door te voeren in de online bijsluiter en SmPC op de website.
Zoals door mij aangegeven, wordt dit beleid in de (generieke) markt als beknellend ervaren en contraproductief ten opzichte van het doel waarvoor de carve-out destijds door de Europese wetgever in het leven is geroepen, namelijk het niet onnodig blokkeren van generieke toetreding tot de markt. Ik wees er op dat hiermee in diverse Europese landen anders wordt omgegaan en vroeg mij af of dit ook niet iets is wat Europees (CMDh) geharmoniseerd kan worden (uitgelegd).
In ons gesprek gaf je aan dat het CBG beleid op basis van juridisch advies tot stand is gekomen en dat de visie destijds (meer dan 10 jaar geleden) was om de carve-out alleen in de marketing documenten (door CBG gelijk gesteld aan de printed hardcopy version) door te voeren. De online versies van de SmPC en PIL worden in de praktijk echter veel meer en eerder dan de papieren versie geraadpleegd door bedrijfsmatig handelende spelers in het veld, zoals apotheekhoudenden en artsen (dit geldt uiteraard niet voor de patiënt). Ook de online versies, waarop de naam van de registratiehouder vermeld wordt, kunnen worden gezien als marketingdocumenten. Bij het bepalen van het beleid is, zo lijkt het, geen rekening gehouden met het feit dat de online vermelding van de geoctrooieerde indicatie in PIL en SmPC kan worden toegerekend aan de registratiehouder en binnen het octrooirecht kan worden aangemerkt als een vorm van inbreukmakend handelen.
Aan de orde kwam de vraag of dit beleid in het kader van toegenomen internetgebruik en online informatievoorziening wellicht opnieuw bekeken zou dienen te worden. Dit probleem doet zich immers niet alleen voor in de zaak Novartis/Sun Pharma (zoledroninezuur), maar is een algemeen probleem dat bij elke handhaving van 2e medische indicatie octrooien opdoemt. De volgende zaak, waarin het gaat om het geneesmiddel pregabalin, dient zich reeds aan. Het is een probleem dat thans volop in de belangstelling staan en waarover behalve in Nederland, ook in de UK, Duitsland, Denemarken en Frankrijk wordt geprocedeerd. Ter ondersteuning hiervan stuur ik je bijgevoegdee-mail, die ik eind juli ontving van [door Sun afgeblokt, rb]. Naar aanleiding van deze emailwisseling is mij vervolgens gevraagd welke (juridische) actie ter beschikking staat om het CBG te dwingen haar koers te wijzigen. Het lijkt mij niet dat juridische actie de route is die wij zouden moeten volgen.
Ik verzoek je mij te berichten hoe deze kwestie binnen het CBG officieel aan de orde kan worden gesteld en hoe kan worden bewerkstelligd dat het CBG haar beleid herziet. Uiteraard ben ik graag bereid de problematiek, ook vanuit octrooirechtelijk standpunt, nader uit te leggen en toe te lichten, mocht daaraan behoefte bestaan. Ik hoop op korte termijn van je te mogen vernemen, waarvoor dank.
2.18.
Na een rappel van de advocaat van Sun heeft het CBG op 1 oktober 2015 als volgt gereageerd:
Wederom excuses voor de vertraging.
Inmiddels heb ik feedback van mijn collega’s en kan ik je de volgende reactie/informatie sturen:
Het CBG ziet geen aanleiding het bestaande beleid te wijzigen. Op de CBG website staat reeds een toelichting over dit beleid (http://www.cbg-meb.nl/voor-mensen/voor-handelsvergunninghouders/inhoud/wettelijke-basis-van-geneesmiddelen/generiek-geneesmiddel).
Hier wordt o.a. het volgende vermeld: “Het CBG beoordeelt de volledige balans werkzaamheid-risico’s dus inclusief eventueel geoctrooieerde indicaties. Het CBG wijst erop dat de balans werkzaamheid-risico’s voor het generieke product niet afwijkt van die van de innovator. In de geneesmiddeleninformatiebank wordt de product-informatie opgenomen die bij de registratie hoort. Deze informatie is volledig en hierin worden alle - ook de geoctrooieerde indicaties - genoemd.”
Het CBG-beleid omtrent carve outs is destijds in overleg met de branche tot stand gekomen, waarbij het in het belang van de patiënt wordt geacht dat de informatie in de GIB volledig is en derhalve ook de geoctrooieerde indicaties (die ook zijn terug te zien in het beoordelingsrapport) worden genoemd.
Tevens vallen de teksten in het GIB niet onder het patentrecht.
De opmerking in je onderstaande e-mail “Bij het bepalen van het beleid is, zo lijkt het, geen rekening gehouden met het feit dat de online vermelding van de geoctrooieerde indicatie in PIL en SmPC kan worden toegerekend aan de registratiehouder en binnen het octrooirecht kan worden aangemerkt als een vorm van inbreuknakend handelen.” is volgens ons niet juist. Het volgt ook niet uit de door de advocaat aangehaalde uitspraak Novartis/Sun Pharma. De toerekening van de octrooi inbreuk lag daar -kortgezegd- in het feit dat Sun Pharma het bij de zorgverzekeraar VGZ had aangemeld onder beide indicaties (dus ook de geoctrooieerde).
Tot slot n.a.v. je vraag hoe de kwestie binnen het CBG aan de orde kan worden gesteld, kan ik je meedelen dat formeel er niet zoiets bestaat als een bezwaarmogelijkheid tegen beleidsregels. Echter het staat iedereen uiteraard vrij om het beleid aan de orde te stellen door middel van het sturen van een brief aan het CBG.
Ik hoop dat ik hiermee je vragen heb beantwoord.
2.19.
Na vonnis van 15 januari 2016 van de voorzieningenrechter van deze rechtbank in een zaak tussen Warner-Lambert Company LLS en de Staat der Nederlanden (CBG) (zie 2.28.) heeft de advocaat van Sun bij brief van 5 februari 2016 het CBG als volgt bericht:
1. Op 26 augustus 2013 is op aanvraag van cliënte, Sun Pharmaceutical Industries Europe B.V. (hierna: Sun), door het CBG een verklaring voor het verwijderen van informatie uit de gedrukte SmPC en bijsluiter afgegeven in verband met geoctrooieerde indicaties. Deze verklaring ziet op het product Zoledroninezuur SUN 5mg, oplossing voor infusie, met zoledroninezuur als werkzame stof (bijlage 1).
2. Omdat het CBG deze carve out van cliënte niet tevens in de geneesmiddeleninformatiebank (hierna: GIB) had doorgevoerd, hebben wij op 9 december 2013 respectievelijk op 7 juli 2015 contact gezocht met het CBG. Zowel bij e-mail van 11 december 2013 als bij e-mail van 1 oktober 2015 informeerde het CBG ons dat het CBG het beleid hanteert om in de online versies van de SmPCs en bijsluiters, zoals opgenomen in de GIB, geen carve out door te voeren. Het zou daarom niet mogelijk zijn om een verzoek in te dienen om de carve out in de GIB door te voeren (bijlagen 2 en 3).
3. Recent heeft Warner-Lambert Company LCC (hierna: WLC) in een vergelijkbare situatie in een kort geding tegen de Staat gevorderd dat het CBG voornoemd beleid dient aan te passen. Het CBG had ook in die zaak in de GIB de full label SmPCs en bijsluiters van de generieke pregabaline producten opgenomen, ondanks het feit dat de aanbieders van de generieke producten carve outs hadden doorgevoerd. Bij vonnis van 15 januari 2016, ECLI:RBDHA:2016:334, heeft de voorzieningenrechter van de rechtbank Den Haag geoordeeld dat het CBG, met dit beleid, in strijd handelt met de jegens WLC in acht te nemen maatschappelijke zorgvuldigheid. Dit, door onverplicht en in weerwil van het verzoek van aanvrager Aurobindo melding te maken van de geoctrooieerde indicatie zonder daarbij te waarschuwen of zelfs maar aan te geven dat het een geoctrooieerde indicatie betreft. Een en ander is daarmee onrechtmatig jegens WLC. De voorzieningenrechter heeft zijn oordeel, gelet op het beperkte kader van de procedure in kort geding, beperkt tot een voorziening ten aanzien van generieke pregabaline producten waarvoor om een carve out is verzocht. Het is echter overduidelijk dat het CBG met dit beleid in vergelijkbare situaties ook onrechtmatig handelt jegens octrooihouders en/of aanbieders van generieke producten waarvoor eveneens om een carve out is verzocht. Het is (aldus de voorzieningenrechter in ov. 4.14) namelijk zeer aannemelijk dat door dit beleid schade wordt geleden.
4. Het CBG handelt onrechtmatig jegens aanbieders van generieke producten die een carve out hebben verzocht, maar niet geheel verkregen, nu zij door de octrooihouder in kwestie kunnen worden aangesproken wegens octrooi inbreuk. Hen kan immers worden verweten dat zij hun generieke product, zoals ook het door Sun aangeboden Zoledroninezuur SUN 5mg, oplossing voor infusie, voor de geoctrooieerde indicatie(s) aanbieden dan wel aan derden afleveren die daarmee op hun beurt inbreuk plegen. In het licht hiervan houdt Sun de Staat (het CBG) aansprakelijk voor de door Sun, als gevolg van het onrechtmatig handelen van de Staat (het CBG) geleden en mogelijk nog verder te lijden schade, waaronder maar niet beperkt tot het niet op de markt kunnen brengen van haar Zoledroninezuur SUN 5mg, oplossing voor infusie.
5. Namens Sun verzoek ik u dringend om uiterlijk binnen 3 weken na heden, derhalve uiterlijk op 26 februari 2016, de carve out in de SmPC en bijsluiter van Zoledroninezuur SUN 5mg, oplossing voor infusie, alsnog in de GIB door te voeren. Uw reactie zien wij graag tijdig tegemoet.
2.20.
Bij brief van 11 februari 2016 heeft het CBG aan de advocaat van Sun als volgt geantwoord:
Naar aanleiding van uw brief van 5 februari 2016 kan ik u als volgt berichten.
In uw brief van 5 februari 2016 verzoekt u het College de carve out in de SmPC en bijsluiter van Zoledroninezuur SUN 5mg, oplossing voor infusie, door te voeren in de Geneesmiddeleninformatiebank (GIB).
Het College heeft kennisgenomen van de argumenten in uw brief. Het College kan geen gevolg geven aan uw verzoek. Sinds 2009 is het beleid van het College om de volledige SmPC en bijsluiter op zijn website te publiceren van generieke geneesmiddelen, ook als op een indicatie nog een octrooi rust. Het College beoordeelt en registreert generieke geneesmiddelen immers ook voor alle indicaties. Daarnaast is deze volledigheid in het belang van patiënten die een generiek medicijn krijgen voor een ziekte of een klacht die zij niet terugvinden in de bijsluiter van het doosje.
Graag informeer ik u dat het College voornemens is het beleid te wijzigen. Het voorstel is de geoctrooieerde indicatie te markeren zodat duidelijk wordt dat het gaat om een geoctrooieerde indicatie. Het belang van goede patiëntenvoorlichting en het kenbaar maken van octrooien kunnen op deze manier worden verenigd. Volgende week wordt deze voorgenomen beleidswijziging voor publieke consultatie gepubliceerd op de CBG-website. Het College nodigt u van harte uit uw reactie op de voorgenomen beleidswijziging in te zenden. Uw inbreng wordt zeer gewaardeerd.
Ik hoop u hiermede voldoende te hebben geïnformeerd.
2.21.
Bij e-mail van 22 februari 2016 heeft de advocaat van Sun zorgverzekeraars VGZ en Menzis gewezen op het arrest van het Oberlandesgericht Düsseldorf van 1 december 2015. De advocaat schrijft:
Na de (…) reactie (…) op onze brief van 28 januari 2015 is het stil gebleven in afwachting van de uitspraak in de bodemprocedure tussen Sun Pharma en Novartis. Ofschoon die uitspraak werd verwacht in april 2015 heeft het tot eind november 2015 geduurd, eer het vonnis werd gewezen. Ik hecht dit vonnis als bijlage aan deze email.
Het vonnis van 25 november 2015 was geen eindbeslissing maar een tussenvonnis, waarbij Novartis de gelegenheid heeft gekregen haar vordering tegen Sun op een andere juridische grondslag nader te onderbouwen (directe inbreuk in plaats van indirecte inbreuk). Wij mogen daar nu op reageren (2 maart a.s.). De discussie is nogal octrooirechtelijk van aard en wat lastiger te volgen voor iemand die niet in het octrooirecht is gespecialiseerd. Echter, het maakt uiteindelijk niet zoveel uit voor de rol en verantwoordelijkheid van de zorgverzekeraars. Die zijn en blijven immers bepalend voor de aflevering door apotheekhoudenden van generieke geneesmiddelen die zonder onderscheid in indicatie door hen als preferent zijn aangewezen.
Tijdens ons gesprek in Zeist in maart vorig jaar gaf ik al aan dat in de ons omringende landen soortgelijke procedures (onder meer betreffende pregabaline) worden gevoerd, waarbij ook de rol van zorgverzekeraars ter discussie wordt gesteld.
Bijgaand stuur ik u de Engelse vertaling van een recente Duitse uitspraak van het Oberlandesgericht Düsseldorf van 1 december 2015 (die ik kortgeleden ontving), waarin een zorgverzekeraar werd opgedragen de uitgeschreven en op dat moment lopende tender procedure te staken en opnieuw op te zetten op een zodanige wijze dat onderscheid wordt gemaakt tussen de vrije indicaties en de geoctrooieerde indicatie. Het Duitse Hof was van oordeel dat de zorgverzekeraar onrechtmatig handelde door de tender zonder onderscheid in indicatie te organiseren (ik verwijs met name naar bladzijden 8-9), nu hierdoor octrooiinbreuk wordt gefaciliteerd en ook verzekeraars het octrooirecht hebben te respecteren.
In het licht hiervan is bepaald niet uit te sluiten dat ook de Nederlandse rechter, indien deze vraag specifiek aan hem wordt voorgelegd in vergelijkbare zin zal oordelen.
Ik hecht er aan u er op te wijzen dat cliënte, doordat u uw beleid ongewijzigd handhaaft, vanwege de dreiging van octrooiinbreuk al sinds de uitspraak van de kortgeding rechter in hoger beroep van 27 januari 2015 met haar product geheel van de Nederlandse markt is verdwenen. Effectief betekent dit dat ook voor de vrije indicaties (alles behalve voor osteoporose) niet langer het generieke Zoledroninezuur van Sun beschikbaar komt, hetgeen uit kostenperspectief onwenselijk is te achten.
Graag verneem ik op korte termijn of u in het bovenstaande alsnog aanleiding ziet uw beleid aan te passen.
2.22.
Op 23 februari 2016 heeft in vervolg op het overleg van 13 juli 2015 (zie 2.16.) andermaal overleg met VWS plaatsgevonden, dit keer met de Directie Curatieve Zorg. De besproken issues worden in onderstaande e-mail van de advocaat van Sun Pharma van 23 februari 2016 aan VWS opgesomd.
Geachte heer [B] ,
Onder dankzegging voor het constructieve gesprek dat de heer [C] en ik vanmiddag met u en de heer [D] mochten hebben, stuur ik u bijgaand het zojuist door mij ontvangen Position Paper over 2nd medical use patents van de EGA (European Generic Association), dat een goed overzicht geeft van de situatie op dit gebied en laat zien dat de kwestie die Sun u heeft voorgelegd, bepaald niet alleen staat en aangeeft dat procedures op dit gebied in de toekomst zullen toenemen.
Ik hoor graag of uw Ministerie:
a) bereid is tot plaatsing van geneesmiddelen die vallen onder een geldige 2e medische indicatie op de lijst van 23 geneesmiddelen die op indicatie worden voorgeschreven, dan wel
b) wil overgaan tot het uitvaardigen van andersoortige aanwijzingen aan voorschrijvende artsen om in het geval van geoctrooieerde indicaties ofwel de indicatie te vermelden ofwel het merkgeneesmiddel voor te schrijven (waarbij naast medische noodzaak mogelijk een nieuwe categorie, te weten octrooibescherming, kan worden geïntroduceerd;
c) kan bewerkstelligen dat het CBG, in lijn met de meeste andere ‘MEBs’ [Medicine Evaluation Boards, rb] in Europa, de carve-out volledig doorvoert, dus ook in de online versies, om zo uitvoering te geven aan de bedoeling aan de in 2004 geeffectueerde wijziging van richtlijn 2001/83 en, los van recent geëntameerde consultatieronde, in ieder geval voorlopig de uitspraak van de KG rechter ook te effectueren in de situatie van cliënte ten aanzien van zoledronate;
d) invloed wil aanwenden richting zorgverzekeraars om te bewerkstelligen dat in het door hen gevoerde preferentiebeleid ten aanzien van geneesmiddelen met meerdere indicaties onderscheid wordt gemaakt tussen geoctrooieerde en vrije indicaties resp. het er toe te leiden dat naast medische noodzaak ook octrooibescherming als reden wordt geaccepteerd om het nog geoctrooieerde merkgeneesmiddel te vergoeden (ik verwijs naar de uitspraak van het hof Düsseldorf, u eerder toegestuurd);
e) welke andere maatregelen of oplossingen uw Ministerie in gedachten heeft.
Tot het beantwoorden van nadere vragen ben ik uiteraard graag bereid.
2.23.
Sun heeft bij mailing van 1 maart 2016 – via IMS Health, die het adressenbestand bezit en de mailing heeft verzorgd – alle apotheekhoudenden, groothandels, zorgverzekeraars en artsen het volgende bericht gestuurd:
BELANGRIJKE INFORMATIE VOOR HET VERSTREKKEN VAN ZOLEDRONINEZUUR SUN 5mg/100ml
TER VERSPREIDING ONDER APOTHEEKHOUDENDEN, ZORGVERZEKERAARS EN GROOTHANDELS
Graag vragen wij uw aandacht voor het volgende.
Zoledroninezuur Sun 5mg, oplossing voor infusie
Sun Pharmaceutical Industries (Europe) B.V. wil u door middel van deze brief nogmaals informeren over haar product, Zoledroninezuur SUN 5mg, oplossing voor infusie.
Achtergrond
Novartis AG is houdster van het Europese octrooi EP 1 296 689 B3, dat het gebruik van zoledroninezuur voor de behandeling van osteoporose beschermt, een zogenaamd tweede medische indicatie octrooi.
Indicaties Zoledroninezuur SUN 5mg
Sun brengt haar generieke zoledroninezuur niet op de markt voor de geoctrooieerde indicatie osteoporose, maar uitsluitend voor vrije indicaties, zoals de ziekte van Paget. Sun verzoekt u er derhalve op toe te zien dat zoledroninezuur Sun 5mg niet wordt voorgeschreven, afgeleverd of vergoed voor de behandeling van osteoporose, zolang het octrooi van Novartis in Nederland van kracht is.
Sun behoudt zich, gelet op het voorgaande, het recht voor om de levering van haar product te staken, indien zij verneemt dat Zoledroninezuur SUN 5mg wordt afgeleverd, verhandeld of vergoed voor de geoctrooieerde indicatie osteoporose. Het moge duidelijk zijn dat Sun geen aansprakelijkheid aanvaardt voor het afleveren, verhandelen en/of vergoeden van haar product door apotheekhoudenden, groothandels en/of zorgverzekeraars voor de geoctrooieerde indicatie, indien en voor zover Novartis besluit haar octrooi jegens hen te handhaven.
Sun zal u informeren indien de situatie verandert.
Voor vragen kunt u contact opnemen met ons kantoor in Hoofddorp te bereiken op telefoonnummer [telefoonnummer, rb] of per e-mail naar [e-mail, rb].
Parallelle procedures
2.24.
Op 30 september 2016 heeft Advocaat-Generaal Van Peursem geconcludeerd in de kort geding procedure tussen Novartis en Sun. Hij heeft onder meer geconcludeerd dat de vraag naar de beschermingsomvang van Swiss-type claims en de vraag of daarop indirecte inbreuk wel mogelijk is, in dat kort geding niet aan de orde is gesteld, zodat in die procedure als uitgangspunt moet worden genomen dat indirecte inbreuk op een Swiss-type claim op zichzelf juridisch mogelijk is. De Advocaat-Generaal heeft geen overwegingen gewijd aan directe inbreuk op een Swiss-type claim.
Andere relevante procedures
2.25.
Bij beslissing van 2 april 2015 heeft het Landgericht Hamburg in een zaak tussen Warner-Lambert Company LLC en 1 A Pharma GmbH geoordeeld dat het onvoorwaardelijk inschrijven op een niet-gelimiteerde tender voor het leveren van generieke geneesmiddelen, dat wil zeggen ook ten aanzien van de geoctrooieerde indicatie, (indirecte) octrooiinbreuk oplevert.
2.26.
Bij arrest van 28 mei 2015 ([2015] EWCA Civ 556]) heeft de England and Wales Court of Appeal (Civil Division – LJ Floyd) in een zaak tussen Warner-Lambert Company en Actavis Group PTC EHF c.s.2.onder meer als volgt overwogen:
113. I start with the claim of direct infringement under section 60(1)(c)3.of the Act4.. The issue under this subsection is a question of construction of the claim. Like any such question, the task for the court is to determine what the skilled reader of the patent would understand the patentee to be using the language of the claim to mean. In this connection there is a certain amount of common ground in that both sides accept that the claim must involve some form of mental element. It is thus not sufficient to construe “for” in the conventional, objective sense of “suitable for”. The reason is that the skilled person would understand that the claim so construed could not possibly distinguish over known uses of the known drug. Pregabalin as used for the known use would be “suitable” in this sense for the new use. To construe the claim as covering the manufacture of a drug merely because it was suitable for pain treatment would be to give it a scope which was far broader than the patentee’s contribution to the art.
114. The next point to note is that both parties have retreated to a degree from the common ground before the judge that “for” means “suitable and intended for”. Thus Mr Turner, in his written submissions, whilst continuing to accept that the claim requires an element of “intention-like mens rea”, submits that it is wrong to start with the word “intention” and embark on an exercise of deciding what that means, and to go on to hold that that form of intention must be attributed to the manufacturer. The word in the claim is “for”, which denotes purpose. Mr Speck, for his part submits that it is not appropriate to fix on the word intention and then embark “on a wide ranging review of how the word ‘intention’ or ‘intended’ is used in different areas of the law” when the real issue is what the mental element in the claim is. I agree that a search for the appropriate meaning of “intention” which does not appear in the claim, is likely to throw one off the scent.
115. One important matter to have in mind is the distinction between the technical subject matter of the claim, on the one hand, and the rights which a patent gives rise to in national law to the owner of a patent based on that technical subject matter, on the other. This distinction was clearly made by the Enlarged Board in Mobil at paragraph 3.3:
“As touched upon previously in paragraph 2.5 above, the protection conferred by a patent is to be determined by interpretation of the terms of the claims, and the rights of the patent proprietor flow from the protection which is conferred. There is a clear distinction between the protection which is conferred and the rights which are conferred by a European patent, however. The protection conferred by a patent is determined by the terms of the claims (Article 69(1) EPC), and in particular by the categories of such claims and their technical features. In this connection, Article 69 EPC and its Protocol are to be applied, both in proceedings before the EPO and in proceedings within Contracting States, whenever it is necessary to determine the protection which is conferred.
In contrast, the rights conferred on the proprietor of a European patent (Article 64(1) EPC) are the legal rights which the law of a designated Contracting State may confer upon the proprietor, for example, as regards what acts of third parties constitute infringement of the patent, and as regards the remedies which are available in respect of any infringement.”
116. In Kirin Amgen [2004] UKHL 46, for example at [34], Lord Hoffmann, used the expression “the technical matter for which the patentee seeks protection in the claims” to describe what it is that the skilled person is trying to ascertain. On the other hand, the primary rights which the patent gives in national law are those set out in section 60 of the Act.
117. The distinction in the present case between the technical subject matter for which the patentee seeks protection in the claims and the legal rights which flow from it is perhaps obscured because the word “use” appears both in the claim and in section 60(1)(c). However in the claim (“use … in the manufacture”), the use is a step in a process, whereas in the statutory provision it is concerned with whether there is use by some person of the process as a whole.
118. Thus the first question is to determine the category of claim and its technical features: the technical subject matter of the claim. We know from the authorities cited above that the claim is a process claim. The skilled person would understand that the technical features of the present claim extend beyond making pregabalin, yet fall short of including the step of actually using pregabalin for treating pain. Instead it includes a feature concerned with the ultimate purpose of the product manufactured, namely the intentional treatment of pain. I would describe the subject matter of the claim, therefore, as making pregabalin for patients to whom it will be intentionally administered for treating pain. Making pregabalin for patients to whom it is to be administered for the non-patented indications is not within the technical subject matter of the claim. Only the former category of manufacture makes use of the technical contribution of the patentee.
119. I think the skilled person would understand the technical subject matter of the claim in the way I have indicated because he or she would first understand that it was necessary for the claim to include a manufacturing step to ensure that the claim does not touch the doctor, and fall foul of the method of treatment exclusion. However the skilled person would understand that any manufacturing step is adequate for this purpose, as the doctor does not manufacture the medicament.
120. The skilled person would understand that the claim in question owes its novelty to the discovery of the new therapeutic use of the medicament. This emerges from a number of the cases, for example see the passages from Eisai quoted at [26] and [27] in Actavis v Merck. As Jacob LJ said at the end of [27]:
“the novelty of the process (i.e. use of X in the manufacture of a medicament for Y” comes from the “new therapeutic use”.
121. Thus the skilled person would understand that the technical subject matter of the claim was concerned with the ultimate end use of the medicament, from which it derived its novelty. The therapeutic treatment is of course new because, and only because, it is carried out with the intention of producing the new therapeutic effect. The prior use of the compound may have in fact produced the effect, for example if a patient taking it for GAD or epilepsy was at the time experiencing pain as well. This demonstrates, to my mind, that it is the intention for which the compound is administered which is at the heart of the invention.
122. Against that background the skilled person would understand the word “for” in the claim to be providing a link between the act of manufacture using pregabalin and the ultimate intentional use of the drug by the end user to treat pain. The critical issue for me to decide is what is sufficient to constitute that link. An extreme view might be that if the drug is in fact used for the patented indication then it has been made “for” that indication, whatever the manufacturer’s intention might be. Mr Turner did not contend for that construction. I think he was right not to do so. It would mean that a manufacturer could not tell whether he had made use of the subject matter until after, and perhaps a long time after, he had disposed of the product. The realistic candidates are therefore (a) foreseeability that the drug will intentionally be used for the patented indication and (b) a subjective intention to that effect.
123. Mr Speck is right that the skilled person would understand the purpose of the Swiss form of claim to be that of avoiding the twin perils of lack of novelty and lack of patentable subject matter. However, as this court made clear in Actavis v Merck, the objection of lack of patentable subject matter is overcome by the fact that the claim is a manufacturing process claim. The skilled person would thus appreciate that there is no reason to imply a narrow or strict mental element in order ensure that this peril is avoided.
124. If Mr Speck were correct that a subjective mental element on the part of the manufacturer were necessary in order to provide the claim with novelty, there would be powerful reasons for adopting it. However, I do not see how that can in fact be so. If a product is “for” a particular therapeutic indication if it is reasonably foreseeable that it will be used intentionally for the treatment of pain, then it will not be rendered lacking in novelty by showing that products in the prior art had been manufactured in circumstances when it was not possible to foresee such a result.
125. Mr Speck’s point is a slightly different one, namely that no-one should be prevented by the grant of a patent from doing that which they did, or could have done, before. He called this the “golden thread” of English patent law. That principle is not, however, an entirely reliable one. It was relied on in Merrell Dow (supra) to suggest that the patent was invalid because it would have the effect of restraining the continuance of the prior use. The principle was ineffective there because the old use itself was “uninformative”. At pages 86-87 Lord Hoffmann recognised that a gap had opened up under the 1977 Act between anticipation and infringement. The present case is another situation in which one cannot rely on the principle, because the subject matter of the invention is concerned with the purpose of acts which are in themselves no different from those which were done before. In any case it is not correct that the patent can prevent that which was done before. It was not possible before the patent was granted to foresee that the product would intentionally be used for treating pain.
126. The test which I have proposed has structural similarities to that under section 60(2), where the question is also what a person (in that case the seller) knows or could reasonably foresee about the end use of a product. That, of course, is not a reason for adopting it when construing the claim in this patent. It does, however, provide confirmation that the test I have proposed is a workable one. On the other hand, I can see real difficulties with the application of an “aiming or targeting” test in the present circumstances if it means more than the test I have proposed. It means in effect that the patentee must prove that it is Actavis’ wish or desire that they sell some Lecaent for pain. How does the patentee go about establishing this wish or desire if it is not enough to show that it is known or foreseeable that some of their product is being intentionally used for pain? It seems to me that there is substance in Mr Turner’s complaint that to adopt such a strict requirement of intention will rob Swiss claims of much of their enforceability.
127. I can therefore see no reason why the skilled person would conclude that the word “for” implied subjective intent. He would understand that the manufacturer who knows (and for this purpose constructive knowledge is enough) or could reasonably foresee that some of his drug will intentionally be used for pain is making use of the patentee’s inventive contribution, in the same way as a manufacturer who actively desires that result. In my judgment, therefore, the skilled person would understand that the patentee was using the word “for” in the claim to require that the manufacturer knows (in the above sense) or can reasonably foresee the ultimate intentional use for pain, not that he have that specific intention or desire himself.
128. In reaching his conclusion that it was the manufacturer’s intention that was determinative, the judge relied on what Jacob LJ said in Actavis v Merck at [75], namely that claims in Swiss form were aimed at the manufacturer and did not touch the doctor. I think the judge may have read too much in to this passage. Jacob LJ was there considering whether the claim was a disguised claim to a method of treatment. The inclusion of a manufacturing step ensures that it is not. Jacob LJ was not addressing the nature of the mental element in the claim. It is, I think, important to bear in mind that there are two mental elements involved: the question is what the manufacturer knows or foresees about the intentional use of the drug by the end user which counts.
129. Turning to the second question, section 60(1)(b) makes it an infringement to use the process. Unlike “offering a process for use” and indirect infringement under section 60(2), liability under this part of section 60(1)(b) has no mental requirement: liability is strict. How does one tell whether a manufacturer is using the manufacturing process of the claim, and therefore rendering himself liable for patent infringement? The answer must be when he manufactures pregabalin when he knows or foresees that users will intentionally administer it for pain.
130. A number of hard cases were canvassed in argument. Firstly, suppose a manufacturer has been selling the medicine in question from before the priority date. Is it fair that he be made an infringer when his sales increase because of the uptake of the old product for the new use, and when he has done nothing to solicit this new business? I think the answer to any potential unfairness in such a case may lie in the relief to be granted. A general injunction prohibiting sale of the product itself is plainly not justifiable, and it may be unjust and inconvenient (to invert the words in section 37 of the Senior Courts Act) to grant an injunction at all. The same may follow even where the manufacturer was not a prior user, such as in this case, where to grant an unqualified injunction would unfairly prejudice his right to sell the drug for the non-patented indication.
131. Mr Speck points out that, even if an injunction is not granted, the manufacturer may have to pay damages based on the patentee’s profit margin, which, if on a sufficient scale, would potentially make his sales of the non-patented indication uneconomic. This is a justifiable concern, but it is not a basis for adopting the narrow claim construction for which he contends. The scope of the claim cannot realistically depend on a national rule about damages, so that it would mean something different in a territory where only royalty damages were available.
132. Another hard case is that in which a defendant has taken all the steps open to him to avoid his medicine being prescribed for the new use, yet those steps are, due to the structure of the marketplace, insufficient to stop it happening. Actavis’ test would provide a defence in those circumstances, because the defendant could credibly say that he did not target those sales which he was striving manfully to prevent. The hard case arises because of the peculiarities of the UK’s market place for drugs. Normally a vendor of a product can control by contract the uses to which his product is put and require any intermediary to include similar terms. I do not think we should allow the regulatory environment to dictate the scope of the claim in this way.
133. Applying the law as I believe it to be, it is plain that Warner-Lambert have an arguable case of infringement. On the assumption that infringement is shown at trial, it does not follow that unqualified relief will follow as of right. Those are issues for the trial or any enquiry which follows.
2.27.
Op 1 december 2015 heeft het Oberlandesgericht Düsseldorf uitspraak gedaan in een (application for review)zaak tussen ziektekostenverzekeraar Kaufmännische Krankenkasse – KKH en Pfizer Pharma GmbH. Het Oberlandesgericht was van oordeel dat de zorgverzekeraar onrechtmatig handelde door de tender zonder onderscheid in indicatie te organiseren. Het overwoog (in de Engelse vertaling):
The content of Respondent’s [i.e. de zorgverzekeraar, rb] invitation to tender threatens the patent with illegal use (…) in the application area for which it is still in effect (for the treatment of neuropathic pain). The patent may not be manufactured, offered, marketed or used for the purpose of application of the active ingredient pregabalin by third parties in the protected area and may not be introduced or possessed for the aforementioned purpose. It may only be administered for off-patent purposes, i.e. the treatment of epileptic attacks and anxiety disorders.
The current content of the invitation to tender (…) does not ensure any such restriction of the range of application of pregabalin. First, the purpose of the prescription is not identified in a physician’s prescription order and consequently pharmacists cannot ascertain whether the patent-protected area is affected. Even though the purposes of treating epilepsy and anxiety disorders are off-patent, it is always possible that pregabalin may be prescribed for the treatment of neuropathic pain and this will not be evident from the prescription order. The assumption that physicians and/or pharmacists always – or even generally – act in conformity with the law and avoid patent infringements with respect to prescription orders and the dispensing of drugs is unrealistic in practice, since this is predominantly a bulk business.
For these reasons, there is a risk that generic drugs will be substituted for pregabalin and LYRICA® in the patent-protected application area from ignorance or for other reasons, as long as physicians have not prohibited substitution (aut idem) in the prescription order (…). When patent law is violated in this manner, at least the generic drug suppliers, which are aware of these circumstances, but also pharmacists and possibly even physicians and the statutory health insurance fund expose themselves to injunctions by the patent holder or by persons and companies authorized by the patent holder by the issuance of an exclusive license or otherwise. (…)
Therefore, with regard to invitations to tender of this type, there are doubts as to the (technical) capability of generic drug suppliers on legal grounds, due to their sure knowledge, which the client can only dispel by excluding such bidders from the procurement procedure. The Respondent is ignoring this. The content of the invitation to tender permits patent infringements by unsuitable bidders (and possibly by other participants). It accepts this, as well as “wild” substitutions, under the legal cloak of respectability offered by SGB V and thereby cooperates in what it should disapprove from a legal standpoint.
2.28.
Bij vonnis van 15 januari 2016 heeft de voorzieningenrechter van de rechtbank Den Haag in een zaak tussen Warner-Lambert Company LLC en de Staat der Nederlanden (CBG) de Staat bevolen de via de website van het CBG toegankelijke full label SmPC en bijsluiter van generieke pregabaline producten die bestemd zijn voor de Nederlandse markt, te vervangen door versies van deze documenten waarin een carve out is opgenomen, net als in de papieren versies van de SmPC en bijsluiter voor de pregabaline producten. Naar het voorlopig oordeel van de voorzieningenrechter handelt het CBG in strijd met de jegens Warner-Lambert in acht te nemen maatschappelijke zorgvuldigheid door onverplicht en in weerwil van het verzoek van de aanvrager van een generieke handelsvergunning melding te maken van de geoctrooieerde indicatie zonder daarbij te waarschuwen of zelfs maar aan te geven dat het een geoctrooieerde indicatie betreft.
2.29.
Bij arrest van 13 oktober 2016 ([2016] EWCA Civ 1006]) heeft de Engelse Court of Appeal (LJ Patten, LJ Kitchin, LJ Floyd) onder meer als volgt overwogen:
206. (…) From an objective standpoint one would normally regard a person to intend what he knows or can reasonably foresee as the consequences of his actions. That is the test which I formulated in Warner-Lambert CoA [dit is het arrest aangehaald in 2.26. hiervoor, rb].
207. If that is the basic test to be adopted, what is sufficient to negative the existence of intention? In my judgment the absence of the patented indication from the label cannot conceivably be sufficient to negative the intention. Mr Speck recognised that there could be objective factual circumstances where the absence of a label identifying the patented indication did not negative intention, for example a manufacturer who proposes to sell far more of the drug than the market for the non-patented indication could bear.
208. Viewed in this way I think the answer becomes clear. The intention will be negative where the manufacturer has taken all reasonable steps within his power to prevent the consequences occurring. In such circumstances his true objective is a lawful one, and one would be entitled to say that the foreseen consequences were not intended, but were an unintended incident of his otherwise lawful activity. (…)
(…)
212. In Warner-Lambert CoA I said that a manufacturer who knew or could reasonably foresee that some of his drug would intentionally be used for treating pain would be making use of the patentee’s inventive contribution in the same way as a manufacturer who actively desired that result. At paragraph 127 I said that the skilled person would understand that the patentee was using the word “for” in the claim to require that the manufacturer knows (and for this purpose constructive knowledge is enough) or can reasonably foresee the ultimate intentional use for pain.
(…)
216. (…) Because claims in this form rely for their novelty on the purpose of the use of the drug, it is only essential that the manufacturer is able to foresee that there will be intentional use for the new medical indication. Intentional use is to be distinguished from use where the drug is prescribed for a different indication and, without it in any sense being the intention of the treatment, a pain condition is in fact treated.
217. The issue which the judge was called upon to decide was whether Actavis knew or could foresee that at least some of the prescriptions written generically for pregabalin to treat pain would in fact be fulfilled with Lecaent. Had Warner-Lambert succeeded in upholding valid claims on which they relied for infringement, it would then have been necessary to decide whether, at any of the various dates analysed by the judge, that test of knowledge or foresight was satisfied. If so the judge should have gone on to consider whether Actavis had taken all reasonable steps in their power to prevent Lecaent from being used to treat pain.
2.30.
Bij tussenarrest van 14 maart 2017 heeft het hof Den Haag in de kort geding procedure tussen Warner-Lambert Company LLC en de Staat der Nederlanden (CBG) (zie 2.28.) geoordeeld te overwegen om de volgende prejudiciële vragen te stellen aan het Hof van Justitie:
1. Verzetten de artikelen 11 en 21, derde lid, van richtlijn 2001/83 of andere bepalingen van het Unierecht zich ertegen dat de bevoegde autoriteit bij een krachtens artikel 10 van richtlijn 2001/83 gegeven vergunning de samenvatting van de productkenmerken openbaar maakt inclusief de delen die verwijzen naar indicaties of doseringsvormen die onder het octrooirecht van een derde vallen, in de situatie dat de vergunninghouder de bevoegde autoriteit heeft laten weten de bedoelde delen niet of niet meer te vermelden in de samenvatting van de productkenmerken?
2. Maakt het voor de beantwoording van vraag 1 uit dat de bevoegde autoriteit eist dat de vergunninghouder in de gedrukte versie van de samenvatting van de productkenmerken een verwijzing opneemt naar de website van die autoriteit waarop de samenvatting van de productkenmerken is gepubliceerd inclusief de delen die verwijzen naar indicaties of doseringsvormen die onder het octrooirecht van een derde vallen?
3. Luidt het antwoord op de voorgaande vragen hetzelfde voor de bijsluiter als voor de SmPC?
3. De verdere beoordeling
in conventie en in reconventie
3.1.
De rechtbank volhardt bij hetgeen bij het tussenvonnis is overwogen en beslist.
in reconventie
Aanvulling technische achtergrond
3.2.
De hierna volgende aanvulling op de technische achtergrond (zie 4.3. tot en met 4.13. van het tussenvonnis) is afkomstig van onbetwiste delen van het door Novartis overgelegde rapport (productie GP11) van professor [E] (hierna [E] ), die werkzaam is als Senior Medical Specialist en consultant bij het Centrum voor Botkwaliteit van het Leids Universitair Medisch Centrum (hierna: LUMC).
3.3.
Ongeveer 3,5% van de Nederlandse bevolking van 55 jaar en ouder lijdt aan de ziekte van Paget.
3.4.
Voor de behandeling van de ziekte van Paget is doorgaans slechts een enkele toediening nodig, terwijl voor de behandeling van osteoporose een toedieningsinterval van een jaar geldt. In de SmPC van Aclasta® (productie EP59.5 van de zijde van Sun) staat daarover bij de ziekte van Paget: “De aanbevolen dosis bedraagt één intraveneuze infusie van 5 mg Aclasta”. Uit die SmPC en uit het Farmacotherapeutisch Kompas (zie productie EP28 van Sun) volgt dat in bepaalde gevallen (de SmPC van Aclasta® vermeldt op basis van beperkte gegevens een percentage van 7,2%) herbehandeling nodig is.
3.5.
Slechts een klein percentage van de Paget’s patiënten vertoont symptomen. Bijgevolg worden de meeste Paget’s patiënten nooit gediagnosticeerd en behandeld.
Bezwaren Novartis en Sun
3.6.
Novartis heeft bezwaar gemaakt tegen toelating van hoofdstukken in en producties bij de antwoordakte van Sun van 9 maart 2016 – kort gezegd – omdat die de omvang van het debat na tussenvonnis en het VRO-reglement te buiten zouden gaan. Op haar beurt heeft Sun bezwaar gemaakt tegen het door Novartis bij pleidooi gevoerde argument gebaseerd op artikel 51 van de Geneesmiddelenrichtlijn5.en artikel 13, derde lid van Richtlijn 2001/20/EG6.inhoudende – kort gezegd – dat Sun verantwoordelijk is voor de bereiding volgens de Geneesmiddelenwet en daarom aangemerkt dient te worden als fabrikant in regulatoire zin, maar tevens daadwerkelijk fabrikant is omdat zij actief de bereiding afrondt (door vrijgifte van de geneesmiddelen door de bij haar in dienst zijnde QP) en ervoor zorgt dat het product een geneesmiddel wordt dat geschikt is om in Nederland op de markt te worden gebracht.
3.7.
De bezwaren worden over en weer verworpen.
3.8.
Wat het bezwaar van Novartis betreft geldt dat het beroep op strikte naleving van het VRO-reglement niet (langer) opgaat. Het is aan Novartis te wijten dat het debat over directe inbreuk eerst in deze fase van de procedure plaatsvindt. Daar komt bij dat de rechtbank partijen heeft toegestaan zich bij akte uit te laten over de vraag of Sun directe inbreuk op conclusie 7 van EP 1 296 689 B3 (hierna ook: EP 689 B3 of het octrooi) kan worden verweten en een en ander niet is geclausuleerd. Ten slotte is niet gebleken dat Novartis ter zake in haar verdediging is geschaad. Novartis heeft voorafgaand aan pleidooi aanvullende producties kunnen indienen en heeft dat ook gedaan. Novartis heeft vervolgens bij pleidooi gemotiveerd verweer kunnen voeren.
3.9.
Wat het bezwaar van Sun betreft geldt dat Novartis al bij akte na tussenvonnis (onder 2.41. en 2.42.) feitelijk de stelling heeft betrokken dat Sun de werkwijze (mede) toepast, hetgeen zij bij pleidooi, in reactie op de antwoordakte van Sun, verder heeft onderbouwd. Sun is ook niet in haar verdediging geschaad nu de advocaat van Sun in haar eerste termijn ten aanzien van dit argument gemotiveerd verweer heeft gevoerd.
Standpunt partijen
3.10.
Zoals in r.o. 4.66. en 4.67. van het tussenvonnis is overwogen, is het debat in deze fase van de procedure nog slechts beperkt tot de vraag of Sun directe inbreuk op conclusie 7 van EP 689 B3 kan worden verweten.
3.11.
Op een werkwijzeconclusie (als conclusie 7 van EP 689 B3) van een (Nederlands deel van een) Europees octrooi kan gelet op artikel 53 lid 1 sub b ROW op twee manieren directe inbreuk worden gemaakt. Enerzijds door de werkwijze toe te passen, anderzijds door het door de geoctrooieerde werkwijze rechtstreeks verkregen voortbrengsel in of voor zijn bedrijf te gebruiken, in het verkeer te brengen of verder te verkopen, te verhuren, af te leveren of anderszins te verhandelen, dan wel voor een of ander aan te bieden, in te voeren of in voorraad te hebben.
3.12.
Novartis meent dat Sun directe inbreuk maakt op conclusie 7 van EP 689 B3 en stelt daartoe dat de inbreuk plaatsvindt omdat – kort gezegd –:
(i) Sun het rechtstreeks verkregen voortbrengsel van de werkwijze (het zoledroninezuur) in Nederland op de markt brengt (hierna ook: directe inbreuk sub (i)) en zij dat doet in de wetenschap dat het voor de geoctrooieerde indicatie osteoporose gebruikt gaat worden;
(ii) Sun de werkwijze (mede) toepast – onder meer – nu zij het zoledroninezuur, in elk geval in farmaceutische zin, mede bereidt, in die zin dat zij de door Sun India bereide actieve stof completeert en afmaakt (Sun is volgens Novartis verantwoordelijk voor de verpakking, de bijsluiter en SmPC alsmede voor het testen van de batch en de vrijgifte van de geneesmiddelen), zodat de stof als geneesmiddel in Nederland door haar als fabrikant op de markt kan worden gebracht (hierna ook: directe inbreuk sub (ii)), terwijl zij weet dat het geneesmiddel voor de geoctrooieerde indicatie osteoporose gebruikt gaat worden.
3.13.
Sun heeft hiertegen gemotiveerd het volgende – kort weergegeven – verweer gevoerd. Ten aanzien van de door Novartis gestelde directe inbreuk sub (i) heeft zij niet betwist dat het door Sun in Nederland verhandelde product rechtstreeks is verkregen door toepassing door Sun India van de geoctrooieerde werkwijze volgens conclusie 7 van EP 689 B3. Zij heeft gesteld dat alleen de wetenschap/voorzienbaarheid van het gebruik van het geneesmiddel voor de geoctrooieerde indicatie van Sun India als vervaardiger (en niet die van Sun als verhandelaar) van belang is, en ten tijde van de bereiding van het generieke product Sun India die wetenschap/voorzienbaarheid niet had. Daarbij komt dat, voor zover die wetenschap wel zou hebben bestaan, Sun en Sun India alles hebben gedaan wat redelijkerwijs van hen kon worden verwacht om inbreuk te voorkomen, aldus nog steeds Sun. Ten aanzien van de door Novartis gestelde directe inbreuk sub (ii) heeft Sun aangevoerd dat Sun geen bereidingshandelingen verricht en daarom niet als bereider in de zin van conclusie 7 van EP 689 B3 kan worden aangemerkt. Sun meent dus dat haar geen directe inbreuk op conclusie 7 van EP 689 B3 kan worden verweten.
3.14.
Om de geschilpunten te kunnen beoordelen en de vraag te kunnen beantwoorden of Sun directe inbreuk maakt op conclusie 7 van EP 689 B3, is vooraleerst van belang (nogmaals) in te gaan op de beschermingsomvang van een Swiss-type conclusie.
Conclusie 7 van EP 689 B3: ‘voor (de behandeling van)’
3.15.
Zoals in het tussenvonnis overwogen (vgl. r.o. 4.49.) is de octrooibescherming van een zogenaamd ‘tweede medische indicatie’ octrooi als EP 689 B3 lastig. Er zijn immers twee problemen die aan de verlening van octrooien voor tweede medisch gebruik van een bekende stof in de weg staan, i.e. de stof zelf is niet nieuw en een geneeskundige behandeling is (om de beroepsbeoefenaar te beschermen tegen inbreuk) niet octrooieerbaar. Conclusies na de uitspraak van de Grote Kamer van Beroep van het EOB in G5/83 op Zwitserse wijze geredigeerd (als ‘gebruik van stof X voor de vervaardiging van geneesmiddel Y voor de behandeling van ziekte Z’), zoals de van conclusie 5 afhankelijke conclusie 7 van EP 689 B3 (de tekst van de conclusies is in 2.7. en 2.8. van het tussenvonnis weergegeven), proberen die problemen te overkomen en behelzen in feite een juridische fictie. Bij die conclusies is het ‘bereidings’-kenmerk (‘for the manufacture of’ / ‘for the preparation of’) in de conclusie opgenomen om de uitsluiting van octrooieerbaarheid van geneeskundige behandelingsmethoden (artikel 3 lid 1 sub f ROW / artikel 53 aanhef en sub c EOV) te omzeilen. De uitvinding (en nieuwheid) ligt in de wetenschap dat de bekende stof kan worden gebruikt voor de behandeling van een nieuwe medische indicatie. Van belang is dus niet alleen het deel van de conclusie waar geclaimd wordt dat – kort gezegd – zoledroninezuur wordt toegepast voor de bereiding (‘preparation’ in de tekst van conclusie 5) van een geneesmiddel, maar juist ook het deel voor de behandeling van osteoporose. De vraag is hoe de gemiddelde vakman, gesteld voor de uitleg van de beschermingsomvang van het octrooi, dit ‘voor (de behandeling van)’ zou uitleggen.
3.16.
In de Engelse procedures (vgl. 2.26. en 2.29.) is voor de uitleg van dat begrip in het kader van de beoordeling van directe inbreuk door de Court of Appeal en (in navolging daarvan) de High Court aansluiting gezocht bij artikel 30 van het (nooit in werking getreden) Gemeenschapsoctrooiverdrag7.. Van dat artikel is (de indirecte inbreuk-toets van) artikel 73 ROW afkomstig. De Court of Appeal leest in de term ‘voor’ een mentaal element en meent dat de gemiddelde vakman het zou begrijpen als dat de octrooihouder die term in de conclusie heeft opgenomen ‘to require that the manufacturer knows (and for this purpose constructive knowledge is enough) or can reasonably foresee the ultimate intentional use for pain [de geoctrooieerde indicatie, rb], not that he have that specific intention or desire himself’. In het Nederlands uitgedrukt is de aan te leggen maatstaf volgens de Engelse rechter dus dat de generieke fabrikant weet, althans voor hem voorzienbaar is, dat het geneesmiddel bewust (‘intentional)’ gebruikt zal worden voor de geoctrooieerde indicatie.
3.17.
Partijen lijken het in de Engelse rechtspraak ontwikkelde criterium voor wat betreft de uitleg van het begrip ‘voor (de behandeling van)’ te omarmen.8.Voor zover Novartis met haar stelling in de akte na tussenvonnis dat er in Nederland vanuit wordt gegaan dat geen ‘schuld of wetenschapsvereiste’ nodig is voor het plegen van (directe) octrooiinbreuk9.(primair) heeft bedoeld te stellen dat de wetenschap van de generieke fabrikant (toch) niet relevant is, ziet zij er aan voorbij dat conclusie 7 van EP 689 B3 geen gewone werkwijze conclusie is, maar een Swiss form second medical use claim waar het wetenschapselement wél relevant is.
3.18.
De rechtbank is met partijen en overeenkomstig voornoemde Engelse rechtspraak van oordeel dat het begrip ‘voor (de behandeling van)’ / ‘for (the treatment of)’ van een op Zwitserse wijze geformuleerde conclusie een zeker mentaal element omvat ziende op wetenschap of voorzienbaarheid omtrent het bewuste gebruik van het geneesmiddel voor de geoctrooieerde indicatie. Voornoemd criterium wordt dan ook in de verdere beoordeling tot uitgangspunt genomen.
Wiens wetenschap/voorzienbaarheid van belang?
3.19.
De vraag die zich dan aandient is wiens wetenschap of voorzienbaarheid relevant is. Partijen twisten over die vraag.
3.20.
Het standpunt van Novartis te dien aanzien is dat of het nu gaat om de gestelde directe inbreuk sub (i) of de gestelde directe inbreuk sub (ii), de wetenschap/voorzienbaarheid van Sun als degene die het generieke product op de markt brengt respectievelijk als (mede)bereider/fabrikant van het generieke product (mede) bepalend is. Novartis wijst daarbij op de bijzondere rol van Sun (onder meer als houdster van de fabrikantenvergunning, als verantwoordelijke voor de verpakking en de inhoud van de bijsluiter en de SmPC en als juridisch verantwoordelijke voor de QP).
3.21.
Volgens Sun gaat het daarentegen steeds (zowel in het geval van de gestelde directe inbreuk sub (i) als sub (ii)) om de wetenschap/voorzienbaarheid van de vervaardiger/fabrikant in de zin van het octrooirecht (en niet in de zin van de Geneesmiddelenrichtlijn), oftewel Sun India, en niet om die van de verhandelaar/ (door)verkoper. Omdat de in deze procedure gedaagde Sun volgens haar stellingen niet de daadwerkelijke bereider is van de actieve stof en Novartis, aldus nog steeds Sun, niet heeft gesteld dat Sun India wist of had kunnen weten, dan wel voorzien, dat de intentie bestond dat de door haar bereide actieve stof voor de geoctrooieerde indicatie zou worden gebruikt, is volgens Sun van directe inbreuk geen sprake. De rechtbank is van oordeel dat dit verweer in ieder geval niet slaagt voor de gestelde inbreuk sub (i) en overweegt daarover als volgt.
3.22.
Anders dan Sun acht de rechtbank de wetenschap/voorzienbaarheid van de daadwerkelijke bereider van de actieve stof dat die stof bestemd is voor een geoctrooieerde indicatie niet altijd doorslaggevend voor de vraag of de uiteindelijke generieke verhandelaar van het door toepassing van die werkwijze rechtstreeks verkregen product inbreuk maakt op het octrooi. In gevallen als de onderhavige, waarbij het geneesmiddel op instructie van de generieke verhandelaar wordt bereid door een gecontracteerde (buitenlandse) concernonderneming, maar bijvoorbeeld ook in situaties waarbij (een) derde fabrikant(en) de actieve stof of (een) halffabrica(a)t(en) daarvan op instructie bereid(t)(en), zou de octrooihouder met lege handen staan als de generieke verhandelaar die opdracht gaf voor de fabricage bij een derde fabrikant (en die van de bestemming van die geneesmiddelen geen weet heeft) vervolgens de handen in onschuld kan wassen door te verwijzen naar de (mogelijk afwezige) intentie van de derde fabrikant. De wetenschap/voorzienbaarheid van het generieke bedrijf dat het rechtstreeks verkregen product bewust voor de geoctrooieerde indicatie zal worden gebruikt, kan naar het oordeel van de rechtbank daarom onder omstandigheden evenzeer van belang zijn. Omgekeerd geredeneerd geldt dat, zoals Novartis terecht heeft betoogd, ook niet goed kan worden ingezien hoe de generieke verhandelaar van het door toepassing van de werkwijze (door een derde fabrikant) rechtstreeks verkregen product, die haar producten niet aanbiedt en levert voor de geoctrooieerde indicatie en alles eraan heeft gedaan om gebruik van het geneesmiddel voor de geoctrooieerde indicatie te voorkomen, inbreuk zou maken enkel en alleen omdat de fabrikant die intentie wel had.
3.23.
In zoverre wijkt het oordeel van de rechtbank (mogelijk) af van het oordeel van de Engelse rechters, waarbij voornoemd probleem zich overigens niet manifesteerde omdat de generieke verhandelaar in de pregabalin-zaken, Actavis, zoals Arnold J in zijn vonnis van 10 september 2016 heeft opgemerkt, geen onderscheid maakte ‘between their own knowledge and intention and that of Balkanpharma (the manufacturer of Lecaent)’10., hoewel ook in de pregabalin-zaken door Arnold J wel is aangenomen dat het verdedigbaar is dat ‘manufacturing for the purpose of a Swiss form claim includes packaging with appropriate instructions’ en dat ‘the fact that a generic supplier subcontracts manufacture will not necessarily cause any difficulty’.11.
3.24.
In het onderhavige geval is ter zitting komen vast te staan dat Sun via Sun FZE (net als Sun zelf een indirecte dochteronderneming van Sun India) de bestelling plaatst voor het zoledroninezuur, welke bestelling door Sun FZE vervolgens aan Sun India wordt doorgegeven. Evenzeer is ter zitting duidelijk geworden dat Sun als marktvergunninghouder verantwoordelijk is voor de tekst van de verpakking en de bijsluiter, waarvoor zij de goedkeuring van het CBG behoeft, en het Sun is die aan Sun India opdracht geeft die verpakking en bijsluiter volgens haar instructie (met carve out) te vervaardigen. Na vervaardiging van verpakking en bijsluiter en bereiding van het actieve ingrediënt, worden de bestelde producten naar Nederland verscheept en daar door Sun, aan wie op grond van artikel 1mm jo. artikel 18 van de Geneesmiddelenwet een fabrikantenvergunning is verleend voor het bereiden of invoeren van geneesmiddelen en het afleveren of uitvoeren van door haar bereide of ingevoerde geneesmiddelen12., ingevoerd. Vervolgens voert de QP van Sun analyses en controles uit die nodig zijn om te kunnen vaststellen of de kwaliteit van het ingevoerde geneesmiddel voldoet aan de kwaliteit die door het dossier dat aan de handelsvergunning ten grondslag ligt, wordt beschreven. Als dat het geval is, worden de producten door de QP vrijgegeven voor de handel. Ten slotte brengt Sun de geneesmiddelen in Europa, waaronder Nederland, op de markt.
3.25.
Zo op grond van het voorgaande niet reeds moet worden aangenomen dat Sun (in octrooirechtelijke zin) in feite zelf als fabrikant moet worden aangemerkt (in regulatoire zin is zij dat in ieder geval) omdat zij de werkwijze (mede) toepast of doet toepassen, dan geldt ten minste dat de wetenschap/voorzienbaarheid van Sun, als generieke verhandelaar van het rechtstreeks verkregen product van de werkwijze, dat haar product bewust voor de geoctrooieerde indicatie gebruikt zou kunnen worden, (eventueel) naast, of in het verlengde van die van de bereider van het actieve ingrediënt, in deze zaak van belang is. De rechtbank zal in het hierna volgende dan ook de vraag beantwoorden of Sun die wetenschap/voorzienbaarheid had.
3.26.
Overigens heeft de advocaat van Sun ter zitting bij dupliek aangegeven dat het wel heel ongeloofwaardig zou zijn als Sun zou doen alsof Sun India nog steeds niet weet wat er aan de hand is: “natuurlijk weet zij dat”. “Op een gegeven moment”, aldus de advocaat van Sun, “ergens in 2014, midden 2014, eind 2014 is die problematiek wel ingezonken” en is dat reden geweest de markt verder voor te lichten. Dat, zoals mr. Drok het vervolgens formuleerde, de kennis van Sun India dan gelijk op gaat met die van Sun, heeft Sun (in het licht van haar eigen stellingen) niet kunnen ontkennen. Sun heeft nog wel aangevoerd dat die wetenschap van Sun India er niet was ten tijde van de bereiding van de eerste (en volgens Sun enige) tranches op respectievelijk 31 oktober 2013, 31 januari 2014 en 1 maart 2014 maar de rechtbank acht dat verweer niet ter zake doende nu Sun ter zitting van 26 april 2016 desgevraagd heeft aangegeven dat ook op dat moment nog, zij het zeer mondjesmaat, haar generieke zoledroninezuur werd verhandeld in Nederland. Gelet op de in de SmPC en bijsluiter vermelde houdbaarheid van twee jaar van een ongeopende injectieflacon (zie 2.2.), moet dat ondanks de ontkenning van Sun dienaangaande betekenen dat Sun India nadien opnieuw het actieve ingrediënt heeft vervaardigd.
Bestond er bij Sun wetenschap/voorzienbaarheid dat haar geneesmiddel bewust gebruikt zou worden voor osteoporose?
3.27.
De rechtbank is van oordeel dat Sun wist, althans voor haar voorzienbaar moet zijn geweest, dat haar generieke product in Nederland bewust gebruikt zou worden voor de behandeling van osteoporose. Voor dat oordeel zijn, in onderling verband beschouwd, de volgende omstandigheden van belang.
(a) marktvergunning
3.27.1.
Sun heeft een marktvergunning verkregen voor de verhandeling van zoledroninezuur niet alleen voor de behandeling van de ziekte van Paget maar ook voor de geoctrooieerde indicatie osteoporose (vgl. 2.11. van het tussenvonnis).
(b) voorschrijven
3.27.2.
Sun is bekend met de praktijk in Nederland waarbij een geneesmiddel door de arts of specialist niet op indicatie wordt voorgeschreven.
(c) carve out
3.27.3.
Hoewel Sun een carve out heeft aangevraagd voor de papieren bijsluiter (ook PIL - patient information leaflet - geheten) en SmPC, is zij bekend met het beleid van het CBG waarbij de carve out niet wordt doorgevoerd in de online SmPC en bijsluiter in de Geneesmiddeleninformatiebank op de website van het CBG. Sun weet, zoals zij ook zelf stelt, dat de online versies van de SmPC en PIL in de praktijk echter veel meer en eerder dan de papieren versies worden geraadpleegd door bedrijfsmatig handelende spelers in het veld, zoals apotheekhoudenden en artsen (vgl. 2.17.).
(d) tenders
3.27.4.
Sun heeft met haar generieke product onvoorwaardelijk, dat wil zeggen niet beperkt tot levering voor uitsluitend off-patent indicaties, ingeschreven op de tenders van de twee grootste ziektekostenverzekeraars in Nederland, te weten VGZ (oktober 2013) en Menzis (april 2014), en die tenders gewonnen, terwijl zij wist dat haar product in dat geval als preferent product zou worden voorgeschreven voor alle indicaties, oftewel ook voor de geoctrooieerde indicatie osteoporose.
(e) omvang markt
3.27.5.
Sun mag als aanbieder van een product bekend worden verondersteld met de omvang van de markt waarbij de commerciële markt voor de ziekte van Paget verwaarloosbaar is: de ziekte van Paget is een zeer zeldzame aandoening terwijl osteoporose een veel voorkomende ziekte is, vooral bij vrouwen ouder dan 50 jaar (zie ook 4.9. en 4.10. van het tussenvonnis). Daarbij komt dat voor de behandeling van de ziekte van Paget doorgaans slechts een enkele toediening nodig is, terwijl voor de behandeling van osteoporose een toedieningsinterval van een jaar geldt (zie 3.4.). Novartis heeft onder verwijzing naar het rapport van [E] gesteld dat jaarlijks hooguit 135 behandelingen van patiënten met de ziekte van Paget met zoledroninezuur plaatsvinden, neerkomend op 2,7% van de jaarlijkse verkoopaantallen (5000 stuks) van zoledroninezuur. Dit komt neer op een verhouding behandelde patiënten met de ziekte van Paget versus osteoporose van (ongeveer) 3% versus 97%.
3.27.6.
Sun heeft kritiek op de cijfers in het rapport van [E] en heeft bestreden dat de omvang van de markt voor de behandeling van de ziekte van Paget slechts uit 135 behandelingen bestaat. Zij komt zelf op een totaal aantal behandelingen van ongeveer 938 per jaar door aan de hand van de totale populatie van Paget’s patiënten in de leeftijd van 55 jaar en ouder (3,5% van – volgens gegevens van het CBS – 5.205.255 mensen) en er van uitgaande dat de gemiddelde Nederlander 85 jaar oud wordt te berekenen hoeveel nieuwe patiënten met de ziekte van Paget er jaarlijks bijkomen en (dus) behandeling nodig hebben. Daar telt zij bij op een percentage van 7,2% (zie 3.4) voor de patiënten die herbehandeling nodig hebben. Naar de stelling van Sun is de daadwerkelijke markt voor haar generieke product nog groter omdat ook andere off-label toepassingen bestaan (zoals voor hypercalciëmie, preventie van botcomplicaties en Osteogenesis Imperfecta).
3.27.7.
De kritiek die Sun heeft op het rapport van [E] is naar het oordeel van de rechtbank in elk geval op onderdelen onvoldoende onderbouwd. Zo heeft zij niet weersproken en in haar eigen berekening niet meegenomen (zie 3.5.) dat slechts een klein percentage van de Paget’s patiënten symptomen vertoont en de meeste Paget’s patiënten bijgevolg nooit gediagnosticeerd en behandeld worden ( [E] legt uit dat zelfs niet alle patiënten in aanmerking komen voor behandeling). Evenmin heeft Sun de stelling van Novartis (buiten de pleitnota om bij paragraaf 78 van die pleitnota) weersproken dat het LUMC, op wiens gegevens [E] zijn cijfers heeft gebaseerd, vrijwel het enige ziekenhuis in Nederland is dat patiënten die lijden aan de ziekte van Paget behandelt (en dat de perifere ziekenhuizen maar ook academische ziekenhuizen in de andere delen van het land naar het LUMC doorverwijzen). Dit terwijl Sun ter zitting desgevraagd ook niet heeft kunnen aangeven wat volgens haar dan de correcte verhouding behandelde patiënten Paget versus osteoporose zou zijn, zodat van genoemde verhouding van circa 3% versus 97% kan worden uitgegaan.
3.27.8.
Als dat percentage echter iets anders zou liggen en met Sun zou moeten worden uitgegaan van 938 behandelingen per jaar van Paget patiënten (neerkomend op circa 18% van de jaarlijkse verkoopaantallen zoledroninezuur) en daarbij nog off-label gebruik (ten aanzien waarvan Novartis terecht heeft betoogd dat Sun niet aangeeft om welke aantallen dat gaat, terwijl de Nederlandse vereniging voor Reumatologie, die geantwoord heeft op de brief van de advocaat van Sun, spreekt van zeldzame aandoeningen (vgl. 2.13.)) zou worden meegenomen (voor een percentage – zoals Novartis heeft voorgesteld – van 2%), staat als onvoldoende weersproken vast dat altijd nog 80% van het product (paragraaf 79 pleitnota Novartis) wordt geleverd voor de geoctrooieerde indicatie.
(f) verkoopcijfers
3.27.9.
Ook op basis van de verkoopcijfers (zie 2.4.) moet Sun geweten hebben dat haar product niet slechts voor de ziekte van Paget werd voorgeschreven. In de periode december 2013 tot oktober 2014 heeft Sun immers 1950 eenheden van haar generieke product verkocht. Dat is al meer dan het dubbele van het door Sun zelf voorgerekende aantal behandelingen voor de ziekte van Paget van 938 per jaar. Sun heeft ter zitting ook erkend dat welke hoeveelheid van het generieke product zij ook levert, dat allemaal kan worden gebruikt voor de behandeling van osteoporose.
(g) ziekenhuisapotheken
3.27.10.
Sun heeft, zo heeft zij ter zitting gesteld, waarvan Novartis akte heeft gevraagd, gecontracteerd met ziekenhuisapotheken. Zij heeft verder niet weersproken de stelling van Novartis dat perifere ziekenhuizen en ook academische ziekenhuizen in andere delen van het land patiënten met de ziekte van Paget verwijzen naar het gespecialiseerde LUMC, dat vrijwel het enige ziekenhuis is waar Paget patiënten in Nederland worden behandeld. Daaruit kan worden afgeleid dat het overgrote deel van het aan ziekenhuisapotheken verkochte zoledroninezuur niet wordt gebruikt voor Paget maar voor de behandeling van osteoporose.
Heeft Sun er alles aan gedaan om gebruik van haar product voor de geoctrooieerde indicatie zoveel mogelijk te voorkomen?
3.28.
Nu de rechtbank op grond van voornoemde omstandigheden ervan uit gaat dat Sun wist althans het voor haar voorzienbaar was dat haar generieke product bewust voor de geoctrooieerde indicatie zou worden voorgeschreven, dient de vraag te worden beantwoord of Sun er alles aan heeft gedaan, voor zover dat in haar macht lag, om dat gebruik te voorkomen. Het duidelijke antwoord hierop luidt ontkennend. De acties die Sun heeft genomen kunnen worden samengevat als ‘too little, too late’. Veel van Sun’s acties zijn van na de sommaties van Novartis (in november en december 2013) en de kort geding dagvaarding (van 24 februari 2014) in plaats van het enige echte relevante moment, namelijk het moment voordat Sun met haar product in januari 2014 op de markt kwam.
3.29.
In het tussenvonnis zijn al opgenomen de e-mails van mw. [A] (vgl. 2.16. en 2.17. van dat vonnis) die blijkens hun inhoud (‘Deze informatie betreft een formaliteit’) niet tot doel hadden de markt erop te wijzen dat het generieke Sun product niet mocht worden voorgeschreven voor de geoctrooieerde indicatie osteoporose. De advocaat van Sun heeft aangegeven dat ‘de feiten worden gekleurd door de bril die men opzet’ maar de rechtbank kan beide e-mails evenwel niet anders begrijpen dan een halfslachtige poging om onder druk van sommaties en een kort geding de afnemers (‘op advies van onze jurist’) formeel te informeren dat haar product wordt verhandeld voor Paget en de indicatie osteoporose ‘vooralsnog’ niet in de bijsluiter is opgenomen. De e-mail van 28 januari 2014 (zie 2.17. van het tussenvonnis) heeft zelfs een aanprijzende inhoud gelet op de onderwerpregel ‘BELANGRIJK: RUIM voldoende voorraad Zoledroninezuur SUN 5mg/100 ml en 4mg/5ml’ en de afsluitende zin ‘Vandaag besteld voor 12.00 uur is, is morgen in huis’. In feite is dat niet anders voor de e-mail van 13 februari 2014 (zie 2.7.) die Sun stuurde aan de zorgverzekeraars. Ook in die e-mail wordt ‘op advies van onze jurist’ nogmaals aangegeven dat het generieke product alleen voor de ziekte van Paget wordt verhandeld en dat de indicatie osteoporose ‘vooralsnog (…) niet [is] opgenomen, aangezien deze indicatie nog beschermd wordt door een patent van Novartis’. Hierbij dient te worden bedacht dat Sun in oktober 2013 al onvoorwaardelijk, dat wil zeggen ongeacht de indicatie waarvoor haar product zou worden gebruikt, had ingeschreven op de tender van VGZ en die had gewonnen terwijl het niet anders kan dan dat de gesprekken met de andere zorgverzekeraar, Menzis, gaande waren. Bij Menzis werd haar generieke product immers op 1 april 2014 preferent.
3.30.
Die halfslachtigheid keert ook terug in de correspondentie van Sun met het CBG (vgl. 2.5. en 2.6.). Sun heeft het CBG niet verzocht om de geoctrooieerde indicatie uit de online SmPC en PIL te halen, maar gevraagd of het juist is dat het CBG de online versie van de SmPC niet aanpast en, zo ja, of aangegeven kan worden om welke reden dat niet gebeurt omdat Sun hierover ‘op heel korte termijn duidelijkheid nodig [heeft] in verband met een kort geding dreiging’. Sun doet geen serieuze poging het CBG ertoe te bewegen de carve out ook online door te voeren, desnoods door, zoals Warner-Lambert LCC met succes wél heeft gedaan (vgl. 2.28.), zulks te vorderen in kort geding. Sun neemt echter genoegen met het antwoord op de retorische vraag en, in de wetenschap dat beroepsbeoefenaren die de online SmPC raadplegen zien dat het generieke Sun product ook kan worden voorgeschreven voor de geoctrooieerde indicatie, komt met haar product op de markt en gaat door met de verhandeling ervan.
3.31.
Alle andere acties die Sun zegt te hebben ondernomen, zijn pas van na het arrest van het hof Den Haag van 27 januari 2015 waarbij Sun een indirect inbreukverbod werd opgelegd (en waarbij zij ook verplicht werd alle gecontracteerde verzekeringsmaatschappijen en ziekenhuizen te informeren over het door het hof opgelegde verbod) en van kort voor de tweede mondelinge behandeling in deze zaak op 26 april 2016, kennelijk in een poging de rechtbank te laten zien dat zij al het redelijke had gedaan om de markt te informeren. In deze periode, na het wijzen van vonnis in het kort geding van Warner-Lambert tegen het CBG, schrijft de advocaat van Sun het CBG weer aan (vgl. 2.19.). Opnieuw neemt zij dan echter met een afwijzend antwoord (vgl. 2.20.) genoegen en laat het daarbij.
3.32.
Wat betreft het ongeclausuleerd inschrijven op de tenders van zorgverzekeraars VGZ en Menzis geldt dat Sun wist dat, als zij de tender zou winnen, haar zoledroninezuur als enige (preferente) product zou worden vergoed, ook als het zou worden voorgeschreven voor osteoporose. Dat, zoals Sun heeft aangevoerd, de inschrijving geen voorbehoud voor een indicatie toeliet (bij welke praktijk, zoals blijkt uit het oordeel van het Oberlandesgericht Düsseldorf (vgl. 2.27.), bepaald vragen zijn te stellen), maakt niet dat zij, zoals zij deed, haar schouders kon ophalen, en gewoon kon leveren. Gegeven de omstandigheden had van Sun mogen worden verwacht dat zij al het mogelijke in het werk had gesteld om te voorkomen dat het product zou worden uitgeleverd voor de behandeling van osteoporose. Het enkel, na het winnen van de tender, sturen van een formele brief aan de zorgverzekeraars (vgl. 2.7.) is in dit verband ten enenmale onvoldoende. Ook nadien heeft Sun niet serieus geprobeerd de tenderprocedure aangepast te krijgen, hoewel zij hier, getuige de e-mail van 22 februari 2016 van haar advocaat aan de zorgverzekeraars (vgl. 2.21.), kennelijk wel een oplossing ziet. Vastgesteld moet dan ook worden dat Sun in haar genoemde verplichting tekort is geschoten.
3.33.
Op dit laatste stuit ook af het verweer van Sun dat zij op grond van het Handvest grondrechten EU – kort gezegd – belang heeft bij het vrijelijk kunnen ontwikkelen van haar legitieme handel in het generieke product voor de vrije indicaties.
Slotsom
3.34.
Op grond van al het vorenstaande is de slotsom dat Sun wist althans voor haar voorzienbaar was dat haar generieke geneesmiddel bewust gebruikt zou worden voor de behandeling van osteoporose, terwijl zij bepaald onvoldoende heeft gedaan om het gebruik voor de geoctrooieerde indicatie te voorkomen. Daarmee heeft Sun zich schuldig gemaakt aan en maakt zij zich schuldig aan directe inbreuk sub (i) op conclusie 7 van EP 689 B3 (te weten het in Nederland op de markt brengen van het rechtstreeks verkregen voortbrengsel van de werkwijze).
Vorderingen
3.35.
De verbodsvordering sub 1 van het petitum zal worden toegewezen als na te melden. De door Sun verzochte termijn van 15 werkdagen om aan het verbod te voldoen (vgl. paragraaf 83 conclusie van antwoord in reconventie), zal worden toegewezen nu zulks door Novartis niet is weersproken.
3.36.
Novartis heeft nagelaten aan te geven wat de juridische grondslag is van haar vorderingen sub 2 t/m 4 van het petitum (verbod deelname tenders/overeenkomsten, (beperkt) verbod levering onder tenders/overeenkomsten en bevel administratie te houden van de verkoop van het generieke product), althans welk belang zij daarbij heeft naast het toe te wijzen verbod, zodat die worden afgewezen.
3.37.
Nu Novartis de gevorderde opgave onder sub 5 van het petitum (zie paragraaf 223 van haar conclusie van antwoord tevens van eis in reconventie) uitdrukkelijk koppelt aan de af te wijzen vordering sub 3 (althans het tweede deel daarvan) en overigens niet heeft gesteld dat die opgave mede betrekking heeft op de sub 6 van het petitum gevorderde schade/winstafdracht, zal ook de gevorderde opgave worden afgewezen.
3.38.
Het is aannemelijk dat Novartis door de inbreuk schade heeft geleden. De sub 6 van het petitum gevorderde veroordeling de schade te vergoeden en de zaak te verwijzen naar de schadestaat, dan wel de door Sun genoten winst af te dragen, komt voor toewijzing in aanmerking, met dat verschil ten opzichte van de formulering van de vordering dat zowel voor de schade als voor de winstafdracht zal worden verwezen naar de schadestaatprocedure.
3.39.
De sub 7 van het petitum gevorderde rectificatie zal worden toegewezen, met dien verstande dat ook hier geen grond bestaat voor, althans (naast het toe te wijzen verbod) belang bestaat bij, toezending van een brief aan eventuele toekomstige (tender-/contracts)partijen en Sun een termijn zal worden gegund om aan het bevel tot rectificatie te voldoen.
3.40.
De gevorderde dwangsommen zullen worden gematigd en gemaximeerd.
Verder in conventie en in reconventie
Proceskosten
3.41.
In het tussenvonnis (r.o. 4.41.) is overwogen dat de vordering van Sun in conventie tot vernietiging van het Nederlandse deel van EP 689 niet slaagt en dat Sun als de in het ongelijk gestelde partij bij eindvonnis in de kosten aan de zijde van Novartis in conventie gemaakt, zal worden verwezen. De kosten zijn in het tussenvonnis reeds begroot op € 80.850,13. Sun zal mitsdien tot betaling van die kosten aan Novartis worden veroordeeld, zoals gevorderd uitvoerbaar bij voorraad.
3.42.
Novartis heeft een gespecificeerde opgave gedaan van haar proceskosten in reconventie ten bedrage van € 118.172,46. Dat betreffen de proceskosten, zoals de advocaat desgevraagd heeft aangegeven, die gemoeid zijn met werkzaamheden gemaakt na het tussenvonnis van 25 november 2015 tot en met pleidooi op 26 april 2016. Sun heeft ten aanzien van deze kosten aangevoerd dat in de specificatie een post van € 30.000,- als ‘unbilled’ staat vermeld. Sun heeft aangegeven dat zij niet kan nagaan of die kosten daadwerkelijk zijn gemaakt en of die kosten redelijk en evenredig zijn. Novartis heeft zich hierover niet meer uitgelaten zodat deze post in mindering zal worden gebracht. Datzelfde geldt voor de factuur van de procesadvocaat ten bedrage van € 415,- omdat Sun onbestreden heeft gesteld dat die kosten niet zien op de onderhavige procedure maar op de kort geding procedure in appel. Gelet hierop resteert een bedrag van (€ 118.172,46 - € 30.000,- -€ 415,- =) € 87.757,46 als proceskosten over de periode vanaf het tussenvonnis.
Dit bedrag dient in beginsel te worden vermeerderd met de kosten die Novartis heeft gemaakt in reconventie tot aan het tussenvonnis. Bij gebreke van een door partijen voorgestelde verdeling is in het tussenvonnis reeds een schatting van de verdeling gemaakt in die zin dat de kosten bij helfte worden verdeeld over de conventie en de reconventie (vgl. r.o. 4.41.). Dat zo zijnde kunnen de kosten van Novartis in reconventie tot aan het tussenvonnis worden begroot op een bedrag van (1/2 x € 161.700,26 =) € 80.850,13. In totaal bedragen de kosten van Novartis in reconventie derhalve (€ 87.757,46 + € 80.850,13 =) € 168.607,59.
3.43.
Sun heeft echter aangevoerd dat de afwijzing van de indirecte inbreuk-grondslag zijn weerslag dient te hebben op de proceskostenveroordeling in reconventie.13.Dat is in zoverre juist dat de proceshouding van Novartis er toe heeft geleid dat de zaak in twee bedrijven heeft plaatsgevonden hetgeen de proceskosten onmiskenbaar hoger heeft doen maken dan wanneer Novartis van meet af aan het debat mede (onderbouwd) vanuit de directe inbreuk-grondslag had ingestoken. Mitsdien zal schattenderwijs een korting worden toegepast van 25% zodat de redelijke en evenredige proceskosten in reconventie worden begroot op € 126.455,69. Tot die kosten zal Sun worden veroordeeld. Zoals gevorderd, zullen de kostenveroordelingen uitvoerbaar bij voorraad worden verklaard.
4. De beslissing
De rechtbank
in conventie
4.1.
wijst de vorderingen af;
4.2.
veroordeelt Sun in de proceskosten in conventie, tot zover aan de zijde van Novartis begroot op € 80.850,13;
4.3.
verklaart de proceskostenveroordeling uitvoerbaar bij voorraad.
in reconventie
4.4.
verbiedt Sun met ingang van vijftien (15) werkdagen na betekening van dit vonnis directe inbreuk te maken op (het Nederlandse deel van) EP 689 B3, zulks op straffe van een onmiddellijk opeisbare dwangsom van € 50.000,- (zegge: vijftigduizend Euro) voor iedere dag of gedeelte daarvan dat Sun dit bevel overtreedt, dan wel, ter keuze van Novartis, van€ 5.000,- (zegge: vijfduizend Euro) per product waarmee dit bevel wordt overtreden, met een maximum van € 5.000.000,- (zegge: vijf miljoen Euro);
4.5.
veroordeelt Sun om de door Novartis ten gevolge van de inbreuk geleden schade, dan wel, naar keuze van Novartis, de door Sun genoten nettowinst als gevolg van de inbreuk, aan Novartis te vergoeden, nader op te maken bij staat en te vereffenen volgens de wet;
4.6.
veroordeelt Sun om binnen vijf (5) werkdagen na betekening van dit vonnis alle
verzekeringsmaatschappijen in Nederland die een tender hebben uitgeschreven waaraan Sun met haar generieke zoledroninezuur heeft meegedaan en aan alle partijen in Nederland waarmee Sun ten aanzien van haar generieke zoledroninezuur een overeenkomst heeft gesloten, schriftelijk te informeren met uitsluitend de navolgende tekst (dat wil zeggen zonder additionele tekst of begeleidende brief), met gelijktijdige verstrekking van kopieën van die brieven (met geadresseerden) aan de advocaten van Novartis:
‘Geachte [naam contactpersoon, verzekeringsmaatschappij/contractspartij]
Bij vonnis van 5 april 2017 heeft de rechtbank Den Haag geoordeeld dat wij door de levering dan wel het aanbieden van Zoledroninezuur SUN 5mg, oplossing voor infusie, inbreuk maken op de octrooirechten van Novartis. Voor zover de tenderprocedure/overeenkomst die u heeft geïnitieerd / met ons heeft gesloten de
indicatie osteoporose omvat, delen wij u mede dat wij niet (langer) in staat zijn om deel te nemen / te leveren. Wij kunnen met ingang van [datum invullen van 15 werkdagen na betekening van het vonnis] uitsluitend deelnemen in een tenderprocedure/leveren volgens een overeenkomst die voldoende garandeert dat de levering van 5mg/100ml zoledroninezuur voor de behandeling van osteoporose wordt voorkomen.’
zulks op straffe van een onmiddellijk opeisbare dwangsom van € 10.000,- (zegge: vijftigduizend Euro) voor iedere dag of gedeelte daarvan dat Sun dit bevel overtreedt, met een maximum van € 1.000.000,- (zegge: één miljoen Euro);
4.7.
veroordeelt Sun in de kosten van de procedure, tot zover aan de zijde van Novartis begroot op € 126.455,69;
4.8.
verklaart het vonnis tot zover uitvoerbaar bij voorraad;
4.9.
wijst af het meer of anders gevorderde.
Dit vonnis is gewezen door mr. J.Th. van Walderveen, mr. M. Knijff en mr. M.P.M. Loos en in het openbaar uitgesproken op 5 april 2017 in tegenwoordigheid van de griffier.
Voetnoten
Voetnoten Uitspraak 05‑04‑2017
De randnummers 134 t/m 140 van dit arrest werden (in het kader van indirecte inbreuk) al aangehaald in 2.25. van het tussenvonnis.
Bedoeld wordt: Patents Act 1977.
Richtlijn 2001/83/EG van het Europees Parlement en de Raad van 6 november 2001 tot vaststelling van een communautair wetboek betreffende geneesmiddelen voor menselijk gebruik.
Richtlijn 2001/20/EG van het Europees Parlement en de Raad van 4 april 2001 betreffende de onderlinge aanpassing van goede klinische praktijken bij de uitvoering van klinische proeven met geneesmiddelen voor menselijk gebruik.
Verdrag betreffende het Europees octrooi voor de gemeenschappelijke markt, Trb. 1976, 103.
Vgl. Paragraaf 2.20 akte Novartis en paragraaf 29 akte Sun.
in paragraaf 2.19 van haar akte
England and Wales High Court (Chancery Division - Patent Court) 10 september 2015 ([2015] EWHC 2548 (Patt)), r.o. 591.
England and Wales High Court (Chancery Division - Patent Court), t.a.p., r.o. 638; England and Wales High Court (Chancery Division – Patent Court) 6 februari 2015 ([2015] EWHC 223 (Pat), r.o. 37).
Vgl. 2.12. van het tussenvonnis van 25 november 2015 en 2.2. hiervoor.
Voetnoot 1 van de antwoordakte na tussenvonnis van Sun en paragraaf 122 van die akte.
Uitspraak 25‑11‑2015
Inhoudsindicatie
Octrooirecht. Tussenvonnis. Tweede medische indicatie. Swiss type claim. Geldige prioriteit. Nieuw en inventief. Geen indirecte inbreuk aangenomen. Nadere akte over directe inbreuk.
Partij(en)
vonnis
RECHTBANK DEN HAAG
Team handel
zaaknummer / rolnummer: C/09/469148 / HA ZA 14-770
Vonnis van 25 november 2015
in de zaak van
de besloten vennootschap met beperkte aansprakelijkheid
SUN PHARMACEUTICAL INDUSTRIES (EUROPE) B.V.,
gevestigd te Hoofddorp, gemeente Haarlemmermeer,
eiseres in conventie,
verweerster in reconventie,
advocaten: mr. M.H.J. van den Horst en mr. J.J.E. Bremer te Den Haag,
tegen
1. de rechtspersoon naar vreemd recht
NOVARTIS AG,
gevestigd te Basel, Zwitserland,
2. de rechtspersoon naar vreemd recht
NOVARTIS PHARMA GMBH,
gevestigd te Wenen, Oostenrijk,
gedaagden in conventie,
eiseressen in reconventie,
advocaat: mr. D. Knottenbelt te Rotterdam.
Partijen zullen hierna Sun en (gedaagden gezamenlijk in enkelvoud) Novartis genoemd worden. Waar nodig zullen gedaagde sub 1 en gedaagde sub 2 afzonderlijk worden aangeduid als Novartis CH respectievelijk Novartis AT.
Voor Sun is de zaak inhoudelijk behandeld door de advocaten voornoemd, met bijstand van dr. ir. H.W. Prins, octrooigemachtigde. Voor Novartis is de zaak inhoudelijk behandeld door mr. R.M. Kleemans en mr. J.D. Drok, advocaten te Amsterdam, met bijstand van drs. K.M.L. Bijvank, octrooigemachtigde.
1. De procedure
1.1.
Het verloop van de procedure blijkt uit:
- -
de beschikking van de voorzieningenrechter van deze rechtbank van 3 juni 2014 waarbij Sun verlof is verleend om te procederen volgens het Versneld Regime in Octrooizaken;
- -
de exploten van dagvaarding van 10 juni 2014;
- -
de akte overlegging producties van 9 juli 2014 van Sun, met producties 1-12;
- -
de conclusie van antwoord, tevens conclusie van eis in reconventie van 17 september 2014, met producties 1-15;
- -
de conclusie van antwoord in reconventie van 12 november 2014, met producties 13-30;
- -
de akte overlegging nadere producties van 24 december 2014 van Sun, met producties 31-36;
- -
de akte houdende overlegging producties van 24 december 2014 van Novartis, met producties 16-17;
- -
de akte overlegging reactieve producties alsmede kostenoverzicht ex 1019h Wetboek van Burgerlijke Rechtsvordering (hierna: Rv) van 20 februari 2015 van Sun, met producties 37-39;
- -
de akte houdende overlegging reactieve producties van 20 februari 2015 van Novartis, met producties 18-20;
- -
de akte houdende overlegging aanvullende productie van 20 februari 2015 van Novartis, met productie 22;
- -
de brief van 11 februari 2015 van Sun, met het verzoek aan de rechtbank tot uitstel van het geplande pleidooi van 20 februari 2015;
- -
de akte overlegging reactieve producties van 20 februari 2015 van Sun, met producties 40-41;
- -
de brief van 12 februari 2015 van Novartis waarbij zij bezwaar maakt tegen productie 41 van Sun op de grond dat die niet tijdig is ingediend en niet kan worden gekwalificeerd als een reactie op het inbrengen van productie 22 door Novartis;
- -
de brief van 12 februari 2015 van Novartis, waarin zij bezwaar maakt tegen het verzoek van Sun om uitstel van het pleidooi;
- -
het e-mailbericht van de rechtbank van 12 februari 2015 aan partijen, waarin het verzoek van Sun om aanhouding van het geplande pleidooi wordt geweigerd;
- -
de akte houdende overlegging aanvullende productie van 20 februari 2015 van Novartis, met productie 23;
- -
de brief van 19 februari 2015 van Sun met een als productie 39.1 genummerde actuele kostenopgave;
- -
de brief van 19 februari 2015 van Novartis, met een als productie 24 genummerde actuele kostenopgave;
- -
het pleidooi van 20 februari 2015 en de daarbij door beide partijen overgelegde pleitnotities, met in de pleitnotities van mr. Van den Horst en mr. Bremer doorgehaald de paragrafen 165 tot en met 169, 173 en 176 tot en met 186, welke niet zijn gepleit, en in de pleitnotities van mr. Kleemans en mr. Drok doorgehaald de paragrafen 178 tot en met 184, welke niet zijn gepleit.
1.2.
Bij gelegenheid van het pleidooi heeft mr. Kleemans bevestigd dat van de zijde van Novartis geen productie 21 in het geding is gebracht.
1.3.
Aan het slot van het pleidooi is de zaak verwezen naar de rol voor vonnis.
1.4.
Bij e-mail van 24 april 2015 aan de rechtbank heeft mr. Van den Horst verzocht partijen gelegenheid te geven in te gaan op ‘de actuele ontwikkelingen en vragen uit de markt’. Bij e-mail van 28 april 2015 aan de rechtbank heeft mr. Kleemans bezwaar gemaakt tegen het verzoek. De rechtbank heeft partijen bij brief van 13 mei 2015 bericht dat de zaak voor vonnis staat en dat zij gelet daarop en gezien de reactie van mr. Kleemans in verbinding met artikel 6.1 van het landelijk procesreglement voor civiele dagvaardingszaken bij de rechtbanken geen kennis neemt van de inhoud van genoemde e-mail van mr. Van den Horst.
1.5.
Vervolgens is het vonnis nader bepaald op heden.
2. De feiten
Novartis en het octrooi
2.1.
Novartis is een wereldwijd opererend farmaceutisch bedrijf.
2.2.
In de jaren 80 van de vorige eeuw heeft een rechtsvoorganger van Novartis het bisfosfonaat zoledroninezuur (ook wel aangeduid als zoledronaat) ontdekt. Novartis heeft met zoledroninezuur als werkzame stof een geneesmiddel ontwikkeld dat wordt gebruikt op oncologisch gebied, vooral bij de behandeling van tumor-gerelateerde hypercalcemia (i.e. verhoogd calciumgehalte in het bloed) en de preventie van bot-gerelateerde complicaties bij patiënten met vergevorderde naar de botten uitgezaaide tumoraandoeningen. Voor deze indicatie heeft Novartis het farmaceutisch product Zometa® op de markt gebracht als een 4 mg/5 ml concentraat voor het bereiden van een infuusoplossing.
2.3.
Zoledroninezuur was tot 16 mei 2013 als werkzame stof beschermd door het Europese octrooi EP 0 275 821 en het corresponderende aanvullende beschermingscertificaat 300058 voor het product Zometa®.
2.4.
Novartis brengt thans het geneesmiddel Aclasta® op de markt, dat, net als Zometa®, zoledroninezuur als werkzame stof bevat. Aclasta® is een 5 mg/100 ml oplossing voor intraveneuze infusie die eenmaal per jaar wordt toegediend ter behandeling van osteoporose. Aclasta® is tevens goedgekeurd als geneesmiddel voor de behandeling van de ziekte van Paget.
2.5.
Novartis CH en Novartis AT zijn gezamenlijk houdster van het Europese octrooi EP 1 296 689 B3 (hierna ook: EP 689 of het octrooi) voor een “Method of administering bisphosphonates”. EP 689 is verleend op een aanvrage van 18 juni 2001, met een beroep op de prioriteitsdocumenten US 597135 van 20 juni 2000 (hierna: US 135) en US 267689 P van 9 februari 2001 (hierna: US 689). De verlening van het octrooi voor onder meer Nederland is op 21 september 2005 gepubliceerd. EP 689 is een zogenaamd tweede medische indicatie-octrooi en ziet – kort gezegd – op het gebruik van zoledroninezuur 5 mg eens per jaar intraveneus toegediend voor de behandeling van osteoporose. De beschermingsomvang van het octrooi strekt zich niet uit tot de andere (eerste) medische indicatie waarvoor Aclasta® tevens is goedgekeurd, te weten de ziekte van Paget.
2.6.
De inhoud van het tweede prioriteitsdocument US 689 verschilt van het eerste prioriteitsdocument US 135 slechts hierin dat US 689 twee aanvullende paragrafen bevat. US 689 heeft – voor zover relevant – de volgende beschrijving:
(p. 1 t/m p. 4, 3e alinea)
METHOD OF ADMINISTERING BISPHOSPHONATES
This invention relates to bisphosphonates, in particular to the pharmaceutical use of bisphosphonates in the treatment of conditions of abnormally increased bone turnover, such as osteoporosis.
Bisphosphonates are widely used to inhibit osteoclast activity in a variety of both benign and malignant diseases in which bone resorption is increased. Thus bisphosphonates have recently become available for long-term treatment of patients with Multiple Myeloma (MM). These pyrophosphate analogs not only reduce the occurrence of skeletal related events but they also provide patients with clinical benefit and improve survival. Bisphosphonates are able to prevent bone resorption in vivo; the therapeutic efficacy of bisphosphonates has been demonstrated in the treatment of Paget's disease of bone, tumour-induced hypercalcemia and, more recently, bone metastasis and multiple myeloma (MM) (for review see Fleisch H 1997 Bisphosphonates clinical. In Bisphosphonates in Bone Disease. From the Laboratory to the Patient. Eds: The Parthenon Publishing Group, New York/London pp 68-163). The mechanisms by which bisphosphonates inhibit bone resorption are still poorly understood and seem to vary according to the bisphosphonates studied. Bisphosphonates have been shown to bind strongly to the hydroxyapatite crystals of bone, to reduce bone turn-over and resorption, to decrease the levels of hydroxyproline or alkaline phosphatase in the blood, and in addition to inhibit both the activation and the activity of osteoclasts.
In addition bisphosphonates have been proposed for use in the treatment of osteoporosis.
Thus for instance, as described in USP 4,812,304 (Procter & Gamble) a method has been proposed for treating or preventing osteoporosis in humans comprising administering to a subject afflicted with or at risk to osteoporosis a bone cell activating compound and a bone resorption inhibiting polyphosphate according to a regime consisting of one or more cycles, whereby each cycle consists of: (a) a bone activating period of from about 1 day to about 5 days during which a bone cell activating amount of a bone cell activating compound is administered to said subject; followed by (b) a bone resorption inhibition period of from about 10 days to about 20 days during which ethane-l-hydroxy-1,1-diphophonic acid, or a pharmaceutically acceptable salt or ester thereof, is administered daily to said subject in an amount from about 0.25 mgP/kg/day to about 3.3mgP/kg/day; followed by (c) a rest period of from about 70 days to about 180 days during which the subject receives neither a bone cell activating compound nor a bone resorption inhibiting polyphophonate.
Also, for example, USP 4,761,406 (Procter & Gamble) proposes a method for treating osteoporosis, in humans or lower animals afflicted with or at risk of osteoporosis, comprising administering to said human or lower animal an effective amount of a bone resorption inhibiting polyphosphonate according to the following schedule: (a) a period of from about 1 day to about 90 days during which said bone resorption inhibiting polyphosphonate is administered daily in a limited amount, followed by (b) a rest period of from about 50 days to about 120 days, and (c) repeating (a) and (b) two or more times where a net increase in bone mass of said human or animal results.
Surprisingly we have now found that bisphosphonates, in particular recent more potent bisphosphonates, can be used for prolonged inhibition of bone resorption in conditions of abnormally increased bone turnover by intermittent administration, wherein the periods between bisphosphonate administrations are longer than was previously considered appropriate to achieve satisfactory treatment. In particular and contrary to expectation we have found that satisfactory treatment results can be obtained even when the dosing intervals greatly exceed the natural bone remodelling cycle.
Accordingly the present invention provides a method for the treatment of conditions of abnormally increased bone turnover in a patient in need of such treatment which comprises intermittently administering an effective amount of a bisphosphonate to the patient, wherein the period between administrations of bisphosphonate is at least about 6 months.
The invention further provides use of a bisphosphonate in the preparation of a medicament for the treatment of conditions of abnormally increased bone turnover in which the bisphosphonate is administered intermittently and in which the period between administrations of bisphosphonate is at least about 6 months.
Conditions of abnormally increased bone turnover which may be treated in accordance with
the present invention include: treatment of postmenopausal osteoporosis, e.g. to reduce the risk of osteoporotic fractures; prevention of postmenopausal osteoporosis, e.g. prevention of postmenopausal bone loss; treatment or prevention of male osteoporosis; treatment or prevention of corticosteroid-induced osteoporosis and other forms of bone loss secondary to or due to medication, e.g. diphenylhydantoin, thyroid hormone replacement therapy; treatment or prevention of bone loss associated with immobilisation and space flight; treatment or prevention of bone loss associated with rheumatoid arthritis, osteogenesis imperfecta, hyperthyroidism, anorexia nervosa, organ transplantation, joint prosthesis loosening, and other medical conditions. For example, such other medical conditions may include treatment or prevention of periarticular bone erosions in rheumatoid arthritis; treatment of osteoarthritis, e.g. prevention/treatment of subchondral osteosclerosis, subchondral bone cysts, osteophyte formation; treatment or prevention of hypercalcemia resulting from excessive bone resorption secondary to hyperparathyroidism, thyrotoxicosis, sarcoidosis, hypervitaminosis D.
Thus in the present description the terms "treatment" or "treat" refer to both prophylactic or preventative treatment as well as curative or disease modifying treatment, including treatment of patients at risk of contracting the disease or suspected to have contracted the disease as well as patients who are ill or have been diagnosed as suffering from a disease or medical condition. In particularly preferred embodiments the invention may be used for the prophylactic treatment of osteoporosis and similar diseases. Thus for example, bisphosphonate may be administered to individuals at risk of developing osteoporosis on a regular basis at dosing intervals of at least about 6 months, e.g. bisphosphnates [bedoeld zal zijn: bisphosphonates, rb] may be administered routinely to postmenopausal women at dosing intervals of once every 6 months or less frequently.
In accordance with the present invention the bisphosphonate dosing interval is at least about 6 months, e.g. once every 180 days, or less frequently, conveniently once a year, or at any interval in between, e.g. once every 7, 8, 9, 10, or 11 months. Dosing intervals of greater than once per year may be used, e.g. about once every 18 months or about once every 2 years, or even less frequently, e.g. a frequency of up to about once every 3 years or less often.
The bisphosphonates used in the present invention are typically those which inhibit bone resorption.
Thus, for example, suitable bisphosphonates for use in the invention may include the following compounds or a pharmaceutically acceptable salt thereof, or any hydrate thereof: (…) 1-hydroxy-2-(imidazole-1-yl)ethane-1,1-diphosphonic acid, e.g. zoledronic acid; (…)
(…)
(p. 7, 3e alinea t/m p. 16)
The Agents of the Invention (the bisphosphonates) are preferably used in the form of pharmaceutical compositions that contain a therapeutically effective amount of active ingredient optionally together with or in admixture with inorganic or organic, solid or liquid, pharmaceutically acceptable carriers which are suitable for administration.
The Agents of the Invention may be administered alone or in combination with other bone active drugs, either in fixed combinations or separately both physically and in time, such as hormones, e.g. estrogen, calcitonins, parathyroid hormone or analogues of any of these, raloxifene or other selective estrogen receptor modulators (SERMs), selective androgen receptor modulators (SARMs), bone morphogenetic proteins (BMPs) and other bone growth factors. Such additional bone active drugs may be administered more frequently than the bisphosphonate.
The pharmaceutical compositions may be, for example, compositions for enteral, such as oral, rectal, aerosol inhalation or nasal administration, compositions for parenteral, such as intravenous or subcutaneous administration, or compositions for transdermal administration (e.g. passive or iontophoretic).
Preferably, the pharmaceutical compositions are adapted to oral or parenteral (especially intravenous, intra-arterial or transdermal) administration. Intra-arterial and oral, first and foremost intra-arterial, administration is considered to be of particular importance. Preferably the bisphosphonate active ingredient is in the form of a parenteral, most preferably an intra-arterial form.
The particular mode of administration and the dosage may be selected by the attending physician taking into account the particulars of the patient, especially age, weight, life style, activity level, hormonal status (e.g. post-menopausal) and bone mineral density as appropriate.
The dosage of the Agents of the Invention may depend on various factors, such as effectiveness and duration of action of the active ingredient, e.g. including the relative potency of the bisphosphonate used, mode of administration, warm-blooded species, and/or sex, age, weight and individual condition of the warm-blooded animal.
Normally the dosage is such that a single dose of the bisphosphonate active ingredient from
0.005 - 20 mg/kg, especially 0.01 - 10 mg/kg, is administered to a warm-blooded animal weighing approximately 75kg.
"mg/kg" means mg drug per kg body weight of the mammal - including man - to be treated.
The dose mentioned above is typically administered intermittently with a period of at least 6 months between doses. The period between bisphosphonate administrations may be longer, e.g. conveniently once per year, once per 18 months or once every 2 years, or even longer, or any period in between.
Formulations in single dose unit form contain preferably from about 1% to about 90%, and formulations not in single dose unit form contain preferably from about 0.1% to about 20%, of the active ingredient. Single dose unit forms such as ampoules of infusion solution or solid for preparation of infusion solution doses, capsules, tablets or dragées contain e.g. from about 0.5 mg to about 500mg of the active ingredient. It will be appreciated that the actual unit dose used will depend upon the potency of the bisphosphonate and the dosing interval amongst other things. Thus the size of the unit dose is typically lower for more potent bisphosphonates and greater the longer the dosing interval. For example, for more potent, recent bisphosphonates such as zoledronic acid a unit dose of from about 1 up to about 10 mg may be used. For example, also for such recent, more potent bisphosphonates a unit dose of from about 1 to about 5 mg may be used for dosing once every 6 months; whereas a dose of from about 2 up to about 10 mg may be used for once a year dosing.
Unit doses may be administered as a single or divided dose, i.e. a dose in which the unit dose is divided into two or more equal or unequal parts and in which the parts are administered to the patient at the same time, during overlapping time periods or at separate time points. When the unit dose is administered as a divided dose at separate time points, the interval between the separate administrations of the divided dose may be from hours, e.g. 1 hour, up to about 1 month (approximately 30 days). In accordance with the invention, the time interval between administration of the last part of the divided dose and administration of the first part of the next, following divided dose is at least 6 months or longer, e.g. about 1 year.
Thus, for example, a 10 mg unit dose may be administered as two equal 5 mg parts at an interval of about 1 week to about 1 month, e.g. about 2 weeks, between administration of the parts. Alternatively, for example, a 5 mg unit dose may be administered as two unequal parts of 4 mg and 1 mg (or 3 mg and 2 mg) at an interval of from 1 to 3 days to 1 to 3 weeks, e.g. about 1 week, between administration of the parts.
Pharmaceutical preparations for enteral and parenteral administration are, for example, those in dosage unit forms, such as dragées, tablets or capsules and also ampoules. They are prepared in a manner known per se, for example by means of conventional mixing, granulating, confectioning, dissolving or lyophilising processes. For example, pharmaceutical preparations for oral administration can be obtained by combining the active ingredient with solid carriers, where appropriate granulating a resulting mixture, and processing the mixture or granulate, if desired or necessary after the addition of suitable adjuncts, into tablets or dragée cores.
Suitable carriers are especially fillers, such as sugars, for example lactose, saccharose, mannitol or sorbitol, cellulose preparations and/or calcium phosphates, for example tricalcium phosphate or calcium hydrogen phosphate, and also binders, such as starch pastes, using, for example, corn, wheat, rice or potato starch, gelatin, tragacanth, methylcellulose and/or polyvinylpyrrolidone and, if desired, disintegrators, such as the above-mentioned starches, also carboxymethyl starch, crosslinked polyvinylpyrrolidone, agar or alginic acid or a salt thereof, such as sodium alginate. Adjuncts are especially flow-regulating agents and lubricants, for example silicic acid, talc, stearic acid or salts thereof, such as magnesium or calcium stearate, and/or polyethylene glycol. Dragee cores are provided with suitable coatings that may be resistant to gastric juices, there being used, inter alia, concentrated sugar solutions that optionally contain gum arabic, talc, polyvinylpyrrolidone, polyethylene glycol and/or titanium dioxide, or lacquer solutions in suitable organic solvents or solvent mixtures or, to produce coatings that are resistant to gastric juices, solutions of suitable cellulose preparations, such as acetylcellulose phthalate or hydroxypropylmethylcellulose phthalate. Colouring substances or pigments may be added to the tablets or dragee coatings, for example for the purpose of identification or to indicate different doses of active ingredient.
Other orally administrable pharmaceutical preparations are dry-filled capsules made of gelatin, and also soft, sealed capsules made of gelatin and a plasticiser, such as glycerol or sorbitol. The dry-filled capsules may contain the active ingredient in the form of a granulate, for example in admixture with fillers, such as lactose, binders, such as starches, and/or glidants, such as talc or magnesium stearate, and, where appropriate, stabilisers. In soft capsules the active ingredient is preferably dissolved or suspended in suitable liquids, such as fatty oils, paraffin oil or liquid polyethylene glycols, it being possible also for stabilisers to be added.
Parenteral formulations are especially injectable fluids that are effective in various manners, such as intravenously, intramuscularly, intraperitoneally, intranasally, intradermally, subcutaneously or preferably intra-arterially. Such fluids are preferably isotonic aqueous solutions or suspensions which can be prepared before use, for example from lyophilised preparations which contain the active ingredient alone or together with a pharmaceutically acceptable carrier. The pharmaceutical preparations may be sterilised and/or contain adjuncts, for example preservatives, stabilisers, wetting agents and/or emulsifiers, solubilisers, salts for regulating the osmotic pressure and/or buffers.
Suitable formulations for transdermal application include an effective amount of the active ingredient with carrier. Advantageous carriers include absorbable pharmacologically acceptable solvents to assist passage through the skin of the host. Characteristically, transdermal devices are in the form of a bandage comprising a backing member, a reservoir containing the compound optionally with carriers, optionally a rate controlling barrier to deliver the active ingredient to the skin of the host at a controlled and predetermined rate over a prolonged period of time, and means to secure the device to the skin.
The following Examples illustrate the invention described hereinbefore.
In the following Examples the term "active ingredient" is to be understood as being any one
of the bisphosphonic acid derivatives mentioned above as being useful according to the present invention.
EXAMPLES
Example 1: Capsules containing coated pellets of active ingredient, for example, disodium pamidronate pentahydrate, as active ingredient:
(…)
Example 2: Monolith adhesive transdermal system, containing as active ingredient, for example, 1-hydroxy-2-(imidazol-l-yl)-ethane-1,1-diphosphonic acid:
(…)
Example 3: Vial containing 1.0 mg dry, lyophilized 1-hydroxy-2-(imidazol-1-yl)ethane-1,1-diphosphonic acid (mixed sodium salts thereof). After dilution with 1 ml of water, a solution (concentration 1 mg/ml) for i.v. infusion is obtained.
(…)
Example 4: Ampoule containing active ingredient, for instance disodium pamidronate pentahydrate dissolved in water. The solution (concentration 3 mg/ml) is for i.v. infusion after dilution.
(…)
Example 5 Treatment of Patients
"A Multinational, Randomized, Double-Blind, Placebo-Controlled, Parallel-Group, Dose-
Ranging, Safety and Efficacy Trial With Intravenous Bolus Injections of Zoledronate In the
Treatment of Postmenopausal Osteoporosis"
This was a dose and dose regimen-finding 12 month trial of iv zoledronic acid in patients with postmenopausal osteoporosis. Three hundred and fifty one patients were randomized to six study arms. Patients who had recent exposure to bone active drugs, e.g. bisphosphonates, estrogen, calcitonin, raloxifene, or a history of metabolic bone diseases were excluded. All patients were evaluated at baseline and in 3-monthly visits. Zoledronic acid or placebo was administered as a bolus iv injection into a peripheral vein over 5 minutes at every visit.
Efficacy was ascertained by measurement of percent change from baseline in bone mineral density (BMD) measured by dual energy X-ray absorptiometry (DEXA) as compared to placebo, at 6, 9, and 12 months.
As a special safety measures trans-iliac bone biopsies were obtained in a subset of patients from all study arms at 12 months, and X-rays of the thoracic and lumbar spine from all study participants were evaluated at baseline and at 12 months for the occurrence of incident vertebral fractures.
Additionally, the degree and duration of suppression of biochemical markers of bone turnover - parathyroid hormone (PTH), bone specific alkaline phosphatase (BSAP), serum C-telopeptide (CTX), serum osteocalcin, urine N-telopeptide (NTX)/creatinine ratio, urine deoxypyridinoline (d-pyd)/creatinine ratio, urine pyridinoline (pyd)creatinine ratio - was obtained every 3 months and measured in a central laboratory.
Study Arms
- -
Placebo
- -
0.25 mg zoledronic acid every 3 months
- -
0.5 mg zoledronic acid every 3 months
- -
1.0 mg zoledronic acid every 3 months
- -
2.0 mg zoledronic acid every 6 months
- -
4.0 mg zoledronic acid every 12 months
The 12 month results showed that all treatment arms demonstrated a percent change from baseline in BMD significantly (p < 0.001) greater than placebo and not dissimilar one from another.

Note: Stepwise multiple comparison of the active doses of zoledronate versus placebo at a one-sided multiple alpha level of 2.5% adjusting for multiple comparisons according to Marcus, Peritz and Gabriel (1976)
Bone mineral density increased compared to placebo at the spine, hip, distal radius, and "total body". Suppression of biochemical markers of bone formation and bone resorption confirmed and supported the BMD results, demonstrating suppression of bone turnover to the pre-menopausal level throughout the 6 and 12 month dosing intervals.
The BMD data indicate that zoledronic acid dose administration as infrequent as every 6 or 12 months can safely result in a statistically significant and medically relevant bone mass increase. It is believed that these data further indicate that a continued preservation of new bone beyond one year, without additional dose administration, is likely or that further bone mass increase is possible. It is also believed that re-treatment in additional cycles of every 6-month, 12-month, or less frequent dose administration will lead to further BMD increase. A reduction of risk of osteoporotic fracture is expected to accompany the bone mass increases.
2.7.
EP 689 B1 is onderwerp geweest van een centrale beperkingsprocedure als bedoeld in artikel 105a e.v. van het Verdrag inzake de verlening van Europese octrooien (hierna: EOV). Bij beslissing van 3 februari 2013 is EP 689 B1 beperkt tot de inhoud van EP 689 B3. De (authentieke) Engelse tekst van de conclusies 1 t/m 7 van EP 689 B3 luidt als volgt:
1. Use of 1-hydroxy-2-(imidazol-1-yl)ethane-1,1-diphosphonic acid, or a pharmaceutically acceptable salt thereof, or any hydrate thereof in the preparation of a medicament for the treatment of osteoporosis in which the 1-hydroxy-2-(imidazol-1-yl)ethane-1,1-diphosphonic acid, or a pharmaceutically acceptable salt thereof, or any hydrate thereof is administered intravenously and intermittently and in which the period between administrations is at least about 6 months.
2. Use according to claim 1, wherein the period between administrations is at least about once a year.
3. Use according to claim 1, for the prophylactic treatment of osteoporosis wherein the period between administrations is about once per year or less frequent.
4. Use according to claim 1, for the prophylactic treatment of osteoporosis wherein the period between administrations is about once every 18 months, about once every two years or less frequent.
5. Use of 1-hydroxy-2-(imidazol-1-yl)ethane-1,1-diphosphonic acid, or a pharmaceutically acceptable salt thereof, or any hydrate thereof for the preparation of a medicament for the treatment of osteoporosis wherein said medicament is adapted for intravenous administration in a unit dosage form which comprises from about 1 up to about 10 mg of 1-hydroxy-2-(imidazol-1-yl)ethane-1,1-diphosphonic acid, or a pharmaceutically acceptable salt thereof, or any hydrate thereof, wherein the period between administrations of bisphosphonate is at least about 6 months.
6. Use according to claim 5, wherein the unit dosage form comprises from about 1 up to about 5 mg and the period between administrations is about once every 6 months.
7. Use according to claim 5, wherein the unit dosage form comprises from about 2 up to about 10 mg and the period between administrations is about once a year.
2.8.
De (onbestreden) Nederlandse vertaling van deze conclusies luidt:
1. Toepassing van 1-hydroxy-2-(imidazool-1-yl)ethaan-1,1-difosfonzuur, of een farmaceutisch aanvaardbaar zout daarvan, of ieder hydraat daarvan voor de bereiding van een geneesmiddel voor de behandeling van osteoporose, waarbij het 1-hydroxy-2-(imidazool-1-yl)ethaan-1,1-difosfonzuur, of een farmaceutisch aanvaardbaar zout daarvan, of ieder hydraat daarvan intraveneus en periodiek wordt toegediend en waarbij de periode tussen toedieningen ten minste ongeveer 6 maanden bedraagt.
2. Toepassing volgens conclusie 1, waarbij de periode tussen toedieningen ten minste ongeveer één keer per jaar is.
3. Toepassing volgens conclusie 1 voor de profylactische behandeling van osteoporose, waarbij de periode tussen toedieningen ongeveer één keer per jaar of minder frequent is.
4. Toepassing volgens conclusie 1 voor de profylactische behandeling van osteoporose, waarbij de periode tussen toedieningen ongeveer één keer iedere 18 maanden, ongeveer één keer iedere twee jaar of minder vaak, is.
5. Toepassing van 1-hydroxy-2-(imidazool-1-yl)-ethaan-1,1-difosfonzuur, of een farmaceutisch aanvaardbaar zout daarvan, of ieder hydraat daarvan voor de bereiding van een geneesmiddel voor de behandeling van osteoporose, waarbij het geneesmiddel is aangepast voor intraveneuze toediening in een eenheidsdoseringsvorm welke ongeveer 1 tot ongeveer 10 mg 1-hydroxy-2-(imidazool-1-yl)-ethaan-1,1-difosfonzuur, of een farmaceutisch aanvaardbaar zout daarvan, of ieder hydraat daarvan, omvat, waarbij de periode tussen toedieningen van bisfosfonaat ten minste ongeveer 6 maanden is.
6. Toepassing volgens conclusie 5, waarbij de eenheidsdoseringsvorm ongeveer 1 tot ongeveer 5 mg omvat en de periode tussen toedieningen ongeveer één keer iedere 6 maanden is.
7. Toepassing volgens conclusie 5, waarbij de eenheidsdoseringsvorm ongeveer 2 tot ongeveer 10 mg omvat en de periode tussen toedieningen ongeveer één keer per jaar is.
2.9.
De beschrijving in het octrooi komt voor zover relevant overeen met de beschrijving in US 689 (hiervoor opgenomen). Het octrooi kent geen figuren.
Sun en het generieke product
2.10.
Sun is een farmaceutisch bedrijf dat zich bezighoudt met de verkoop en distributie van generieke en spécialité-geneesmiddelen. Het bedrijf is onderdeel van een wereldwijd concern. Het hoofdkantoor is gevestigd in India.
2.11.
Op 29 juli 2013 heeft Sun van het College ter Beoordeling van Geneesmiddelen (hierna: CBG) een marktvergunning verkregen voor Nederland met betrekking tot generiek zoledroninezuur 5 mg/100 ml (RVG 111818) (hierna: generiek zoledroninezuur 5 mg/100 ml of het generieke product). In het kader van de aanvraag van die marktvergunning heeft Sun verwezen naar Aclasta® als referentieproduct. De marktvergunning omvat goedkeuring van het product voor de behandeling van zowel osteoporose als de ziekte van Paget.
2.12.
Aan Sun is door de minister krachtens artikel 1mm jo. artikel 18 van de Geneesmiddelenwet een fabrikantenvergunning verleend voor het bereiden of invoeren van geneesmiddelen en het afleveren of uitvoeren van door haar bereide of ingevoerde geneesmiddelen.
2.13.
Op 26 augustus 2013 heeft Sun het CBG verzocht om de indicatie osteoporose door middel van een zogeheten “carve-out” (ook wel “skinny label” genaamd) te verwijderen uit de gedrukte SmPC (Summary of Product Characteristics) en de bijsluiter (ook wel aangeduid als Patient Information Leaflet - ‘PIL’) voor haar generieke product in verband met een geoctrooieerde indicatie.1.Het CBG heeft Sun op 27 augustus 2013 laten weten dat het verzoek is verwerkt. Het beleid van het CBG zorgt er echter voor dat de carve-out niet wordt doorgevoerd in de digitale versie van de bijsluiter en SmPC die het CBG op haar website publiceert.
2.14.
In oktober 2013 heeft Sun ingeschreven op een zogeheten tender van zorgverzekeraar VGZ. Door middel van deze tenderprocedure heeft VGZ een aantal
preferente producten geselecteerd, waaronder een zoledroninezuur 5 mg/100 ml product voor patiënten bij wie het infuus thuis wordt toegediend. Sun heeft de tender gewonnen. Dat houdt in dat haar generieke product het enige zoledroninezuur 5 mg/100 ml product is dat door VGZ voor alle indicaties wordt vergoed, behoudens medische noodzaak. De tender van VGZ maakte het niet mogelijk dat werd ingeschreven voor het product zoledroninezuur 5 mg/100 ml bestemd voor een bepaalde indicatie. Het door VGZ gehanteerde preferentiebeleid houdt in dat alleen kan worden ingeschreven op werkzame stofnaam zonder vermelding van indicaties. Sun heeft bij haar inschrijving op de tenderprocedure niet uitdrukkelijk aangegeven dat zij haar generieke product alleen levert voor de ziekte van Paget.2.
2.15.
Sun heeft haar generieke zoledroninezuur 5 mg/100 ml doen opnemen in de
G-standaard van het bedrijf Z-index. De launch was januari 2014.
2.16.
Na sommatie door Novartis in november en december 2013, heeft mw. [A] van Sun op 22 januari 2014 een e-mail gestuurd aan de groothandels (en ziekenhuisapotheken die rechtstreeks bij Sun bestellen) met de navolgende inhoud:
Geachte relatie,
Deze informatie betreft een formaliteit.
Op advies van onze jurist wijzen wij u er op dat ons product Zoledroninezuur SUN 5 mg/100 ml,
Z-indexnummer: 15958264 door ons op de markt wordt gebracht, momenteel alleen voor de behandeling van de ziekte van Paget is bestemd. Dit is ook de indicatie die wordt vermeld in de bijsluiter Zoledroninezuur SUN 5mg/100ml. Vooralsnog is de indicatie osteoporose niet opgenomen, aangezien deze indicatie nog beschermd wordt door een patent van Novartis.
Door de zending Zoledroninezuur SUN 5mg/100ml oplossing voor infusie te accepteren, geeft u aan op de hoogte te zijn van bovengenoemde.
2.17.
Op 28 januari 2014 verstuurde mw. [A] van Sun een e-mail aan haar relaties. De inhoud van de e-mail, met als onderwerpregel: “BELANGRIJK: RUIM voldoende voorraad Zoledroninezuur SUN 5mg/100ml en 4mg/5ml”, luidt als volgt:
Geachte relatie,
Wij hebben geconstateerd dat medewerker(s) van Novartis onjuiste informatie in de markt verstrekken aangaande de verkrijgbaarheid van Zoledroninezuur SUN (4mg/5ml en specifiek 5mg/100ml).
Novartis geeft aan dat wij, SUN Pharma, producten Zoledroninezuur SUN tot tenminste half februari niet zouden kunnen leveren echter dit is absoluut onjuist.
Wij hebben ruim voldoende voorraad van zowel Zoledroninezuur SUN 4mg/5ml als ook de 5mg/100ml (resp Z-indexnr: 15913368 en 15958264).
Alle contract-afspraken die wij hebben afgesloten met ziekenhuizen dan wel met zorgverzekeraars kunnen wij dan ook zonder problemen onze genoemde producten uitleveren.
Indien u in uw systeem nog niet adequate (lees: up to date) informatie heeft staan verzoek ik u z.s.m. deze aan te passen zodat alle (ziekenhuis)apothekers kunnen zien dat onze producten per direct beschikbaar zijn.
Vandaag besteld voor 12.00 uur is, is morgen in huis.
2.18.
Op 1 april 2014 werd Sun’s generieke product preferent bij zorgverzekeraar Menzis.
2.19.
Het product van Sun is in elk geval tot oktober 2014 op de Nederlandse markt geweest. Daarna is het product tijdelijk niet beschikbaar geweest door leveringsproblemen bij de door Sun overgenomen fabrikant Ranbaxy in India. Ten tijde van het pleidooi had Sun het generieke zoledroninezuur in Nederland weer op voorraad. Dat zou naar verwachting op een termijn van 8 weken nadat het product door haar Hongaarse laboratorium na een veiligheidscontrole zou zijn vrijgegeven voor verhandeling weer uitgeleverd gaan worden voor de Nederlandse markt. Op de zitting is vastgesteld dat op de Farmanco-website van de Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP), op welke site leveranciers, apothekers en groothandels melding kunnen maken van beschikbaarheidsproblemen van een geneesmiddel, stond vermeld dat het generieke zoledroninezuur van Sun weer beschikbaar was.
Tussenkomende stand van de techniek (als de prioriteitsdatum niet geldig is)
2.20.
Na 9 februari 2001 (de aanvraagdatum van US 689, het tweede prioriteitsdocument), maar vóór de aanvraagdatum van het octrooi is een artikel gepubliceerd (Reid e.a., ‘A single annual injection of the bisphosphonate, zoledronic acid, stably reduces bone turnover and increases bone density in postmenopausal osteoporosis’, Bone 28(5), S89 (2001), productie EP6, hierna: Reid), waarin alle kenmerken van de conclusies van EP 689 worden geopenbaard.
Parallelle procedures
2.21.
In een door derden tegen Novartis CH aangespannen nietigheidsprocedure heeft de Engelse High Court (Arnold J) bij vonnis van 15 maart 2013 ([2013] EWHC 516 (Pat)) geoordeeld dat het Britse deel van EP 689 geen aanspraak kan maken op de prioriteit van US 135 en US 689 en dat dat deel daarom nietig is vanwege een gebrek aan nieuwheid ten opzichte van het artikel van Reid. Dit oordeel heeft de Court of Appeal bij uitspraak van 19 december 2013 ([2013] EWCA Civ 1663) bekrachtigd.
2.22.
Tussen Novartis CH en Sun is voor deze rechtbank eerder een kort geding procedure aanhangig geweest. Bij vonnis van 12 mei 2014 heeft de voorzieningenrechter van deze rechtbank de vorderingen van Novartis CH afgewezen omdat naar zijn voorlopig oordeel EP 689 geen aanspraak kan maken op prioriteit van US 135 en US 689 waardoor de tussenkomende publicatie van Reid nieuwheidsschadelijk is voor conclusie 7 van het Nederlandse deel van EP 689.
2.23.
Bij arrest van het Gerechtshof Den Haag van 27 januari 2015 (hierna: het arrest en hof Den Haag, ook: het hof) is het vonnis van de voorzieningenrechter vernietigd. Het hof heeft geoordeeld dat Novartis CH voorshands een beroep toekomt op de prioriteitsdatum van US 689. Bijgevolg heeft het hof – omdat niet in geschil was dat bij een geldig beroep op prioriteit die publicatie niet tot de stand van de techniek behoorde – Reid niet nieuwheidsschadelijk bevonden. Verder voorlopig oordelend, heeft het hof EP 689 inventief geacht en Sun verboden indirect inbreuk te maken op conclusie 7 van het octrooi, op straffe van een dwangsom, en met veroordeling van Sun in de kosten van de procedure.
Andere relevante procedures
2.24.
Bij vonnis van 21 januari 2015 ([2015] EWHC 72 (Pat)) en twee vonnissen van 6 februari 2015 ([2015] EWHC 223 (Pat)) en ([2015] EWHC 249 (Pat)) heeft de Engelse High Court (Arnold J) in een met dit geschil vergelijkbare zaak over het gebruik van het geneesmiddel pregabalin voor pijnbestrijding, zich gebogen over de vraag naar de beschermingsomvang van zogenaamde Swiss-type claims bij tweede medische indicatie-octrooien. In het tweede van de op 6 februari 2015 gewezen vonnissen (dat ging over het te elfder ure – volgens de Engelse rechter ‘zonder twijfel’ ingegeven door het toen net gewezen arrest van het hof Den Haag – alsnog ingeroepen ‘anker’ van indirecte inbreuk) heeft Arnold J voorshands geoordeeld dat indirecte inbreuk op een Swiss-type claim niet mogelijk is. Hij overwoog:
First and most fundamentally, it seems to me that the claim under section 60(2)3.is simply hopeless. As counsel for Warner‑Lambert accepted, the claim under section 60(2) is premised upon interpreting a Swiss form claim in the same way as an EPC 2000 claim, and in particular in interpreting it as a product claim or, at any rate, as equivalent to a product claim. In my view, that contention is wholly unsustainable. It is contrary to settled jurisprudence both in this country and in the EPO Boards of Appeal. I refer in particular to John Wyeth & Brother Ltd's Application [1985] RPC 545, 563; Monsanto & Co. v Merck & Co. Inc. [2000] RPC 77, 92‑93; Actavis UK Ltd v Merck & Co. Inc. [2008] EWCA Civ 444, [2009] 1 WLR 1186 at paragraphs 27 and 75; and Case T 1780/12 University of Texas Board of Regents/Cancer treatment [2014] EPOR 28 at paragraphs 18‑27. In order to succeed in its claim under section 60(2) Warner‑Lambert would have to persuade the Supreme Court to overrule Monsanto v Merck on this point. I see no prospect of that occurring.
2.25.
Bij arrest van 28 mei 2015 ([2015] EWCA CIV 556) heeft de Court of Appeal appel toegestaan van het tweede op 6 februari 2015 gewezen vonnis en bepaald dat (ook) de indirecte inbreukzaak naar ‘trial’ mag. De Court of Appeal (Floyd LJ) overwoog:
134. It will be seen that courts of two member states have, at least in provisional proceedings, granted relief to prevent what they considered to be indirect infringement of Swiss claims without any express indication of how they considered that the invention would be put into effect.
135. I agree that there are difficulties with the indirect infringement claim for the reason which the judge gave, namely the absence of a downstream event which, as a whole, can be regarded as putting the invention into effect. However, for three reasons, each of which is in my judgment sufficient, I would allow the indirect infringement case to go to trial.
136. The first reason is that which I have already given, namely that the courts of two EPC member states considering this same question have held that, at face value, indirect infringement can arise in these circumstances.
137. The second reason is that, if, as I have held, there is a case of threatened or actual infringement of the process claim under section 60(1)(b), then it follows that dealings downstream in the direct product of the process are also infringements under section 60(1)(c). Although this may not add anything to the direct infringement case, it is wrong to strike it out as a viable additional cause of action.
138. The third reason is that I consider it is arguable to say that when section 60(2) speaks of “putting the invention into effect”, it may be legitimate to look not just at whether any one person is carrying out the invention in a sense which would give rise to liability of that person for an act of infringement. It may be that the invention is put into effect if pregabalin is manufactured by one person and supplied to another who intentionally uses it for the treatment of pain. In those circumstances, a person who supplies pregabalin with the requisite knowledge (i.e. that prescribed in section 60(2) itself) does provide means suitable and intended to put the invention into effect, albeit by the combination of manufacturer and user, rather than by any one person alone. It may be that this is the reasoning which underlies the decisions in the Dutch and German cases which I have referred to.
139. An analogous problem arises where one step of a two step process is carried out by A and the second step is carried out by B. Absent a claim of joint tortfeasance, could it not be said that by supplying the result of the first step to B, A is contributing to putting the invention into effect (by A and B together)?
140. It follows that I would allow the appeal against the striking out of the section 60(2) claim.
2.26.
Bij vonnis van 10 september 2015 ([2015] EWHC 2548 (Pat)) heeft de Engelse High Court (Arnold J) in de bodemprocedure van de hiervoor genoemde zaken herhaald dat een Swiss-type claim een werkwijze claim is (par. 240):
All of the claims of the Patent are in Swiss form. It has repeatedly been held that such claims are process claims (as distinct from product claims): see John Wyeth & Brother Ltd's Application [1985] RPC 545, 563 (Whitford and Falconer JJ sitting en banc); Monsanto & Co v Merck & Co Inc [2000] RPC 77, 92-93 (Aldous LJ, with whom Auld LJ agreed); Actavis UK Ltd v Merck & Co Inc [2008] EWCA Civ 444, [2009] 1 WLR 1186 at [26]-[27] (Jacob LJ giving the judgment of the Court of Appeal); Case T 1780/12 University of Texas Board of Regents/Cancer treatment [2014] EPOR 28 at [18]-[27] (EPO Technical Board of Appeal); and Warner-Lambert CA at [45], [54], [56], [118] and [129] (Floyd LJ, with whom Arden and Ryder LJJ agreed)
2.27.
Verder heeft Arnold J geoordeeld dat geen sprake kan zijn van indirecte inbreuk op een Swiss-type claim (par. 684):
The fundamental difficulty with Pfizer's claim under section 60(2) remains, as it has always done, that claims 1 and 3 of the Patent are claims to processes of manufacture, but there is no act of manufacture by any party downstream from Actavis, nor even the prospect of such an act. This is so even if manufacturing (or "preparation", to use the word in the claims) for this purpose includes packaging with appropriate instructions. In particular, there is no act of manufacture by pharmacists, nor any prospect of such an act. It follows that, although there is no difficulty in concluding that Lecaent's [i.e. het merk waaronder het generieke product wordt verhandeld, rb] active ingredient is "means, relating to an essential element of the invention, for putting the invention into effect", Lecaent is not suitable for putting, or intended to put, the invention into effect: either the invention has already been put into effect by the time that Lecaent leaves Actavis' hands or it is not put into effect at all. Accordingly, I conclude that Actavis have not infringed claims 1 and 3 of the Patent pursuant to section 60(2).
3. Het geschil
in conventie
3.1.
Sun vordert vernietiging van het Nederlandse deel van EP 689, met veroordeling van Novartis, uitvoerbaar bij voorraad, in de proceskosten in de zin van artikel 1019h Rv.
3.2.
Aan haar vordering legt Sun ten grondslag dat conclusie 7 van het Nederlandse deel van EP 689 geen aanspraak kan maken op prioriteit van US 689 (en daarmee evenmin van US 135), zodat die conclusie nietig is vanwege een gebrek aan nieuwheid ten opzichte van het artikel van Reid. Sun betoogt verder dat het Nederlandse deel van EP 689 niet-inventief is. Sun heeft bij de motivering van het gebrek aan prioriteit en inventiviteit conclusie 7 van het Nederlandse deel van US 689 tot uitgangspunt genomen en bepleit dat conclusies 1 tot en met 6 het lot van conclusie 7 volgen, nu de beschermingsomvang van conclusies 1 tot en met 6 ruimer is dan de beschermingsomvang van conclusie 7.
3.3.
Bij de conclusie van antwoord in reconventie alsook bij pleidooi heeft Sun zich op het standpunt gesteld dat conclusie 1 (tot en met 4) van het Nederlandse deel van EP 689 ook wegens niet-nawerkbaarheid nietig is/zijn.
3.4.
Novartis voert gemotiveerd verweer.
3.5.
Op de stellingen van partijen in conventie wordt hierna, voor zover van belang, nader ingegaan.
in reconventie
3.6.
Novartis vordert – samengevat – dat de rechtbank, bij vonnis, voor zover mogelijk uitvoerbaar bij voorraad,
- -
Sun met onmiddellijke ingang na betekening van dit vonnis en op straffe van een dwangsom verbiedt in Nederland (indirect) inbreuk te maken op (het Nederlandse deel van) EP 689, in het bijzonder door het aanbieden of leveren van generiek zoledroninezuur 5 mg/100 ml (oplossing voor infusie), terwijl zij weet of moet weten dat het middel gebruikt gaat worden voor de behandeling van osteoporose,
- -
Sun met onmiddellijke ingang na betekening van dit vonnis, tot expiratie, vernietiging of nietigverklaring van EP 689 en op straffe van een dwangsom, verbiedt deel te nemen aan tenders/overeenkomsten voor de levering in Nederland van generiek zoledroninezuur 5 mg/100 ml en verbiedt generiek zoledroninezuur 5 mg/100 ml te leveren in Nederland onder bestaande tenders/overeenkomsten, tenzij de tender/overeenkomst uitsluitend beperkt is tot de behandeling van de ziekte van Paget, en zodanig dat het generieke product alleen vergoed zal worden voor de ziekte van Paget, althans (subsidiair) verbiedt meer dan 135 eenheden per jaar (of een andere door de rechtbank in goede justitie te bepalen hoeveelheid) van het generieke product te leveren in Nederland onder bestaande tenders/overeenkomsten,
- -
Sun veroordeelt om met onmiddellijke ingang na betekening van dit vonnis en tot expiratie, vernietiging of nietigverklaring van EP 689, administratie te houden van de verkoop van generiek zoledroninezuur 5 mg/100 ml in Nederland en daarvan bij de raadslieden van Novartis periodiek opgave te doen,
- -
Sun gebiedt om binnen 14 dagen na betekening van dit vonnis aan de advocaten van Novartis een door een registeraccountant gecontroleerde en gewaarmerkte opgave te doen toekomen van verkoopcijfers, kopers, aanwezige voorraad en behaalde omzet en winst van (verkoop van) het generieke product,
- -
(volgens nadere uitleg van mr. Kleemans bij gelegenheid van het pleidooi van dit deel van de vorderingen) Sun veroordeelt tot schadevergoeding, dan wel winstafdracht, nader op te maken bij staat, en naar keuze van Sun,
- -
Sun veroordeelt om met onmiddellijke ingang na betekening van dit vonnis en op straffe van een dwangsom alle verzekeringsmaatschappijen die een tender met betrekking tot zoledroninezuur 5 mg/100 ml hebben uitgeschreven of voornemens zijn dat te gaan doen, alsmede alle partijen waarmee Sun een overeenkomst ter zake heeft gesloten of die Sun daartoe benaderen, schriftelijk te informeren door middel van een door Novartis voorgeschreven of een door de rechtbank in goede justitie te bepalen tekst, terwijl Sun aan Novartis daarvan kopieën en een lijst met geadresseerden zal verstrekken,
- -
met veroordeling van Sun in de volledige proceskosten overeenkomstig artikel 1019h Rv.
3.7.
Novartis heeft hiertoe aangevoerd dat het generieke zoledroninezuur 5 mg/100 ml product waarvoor Sun een marktvergunning heeft verkregen en dat Sun heeft doen opnemen in de G-standaard (indirect) inbreuk maakt op conclusie 7 van EP 689 omdat Sun wist of het voor haar gezien de omstandigheden duidelijk moest zijn dat dit product geschikt en bestemd is voor de in conclusie 7 van EP 689 geclaimde toepassing. Sun maakt volgens Novartis ook inbreuk op conclusie 1 van het octrooi.
3.8.
Ter zitting heeft Novartis bepleit dat Sun ook directe inbreuk op het octrooi kan worden verweten, namelijk nu Sun door haar wetenschap van hetgeen in de verdere keten van afnemers met het middel gebeurt in feite reeds bij het aanbieden en leveren van het generieke product daar de bestemming osteoporose aan geeft, alsook nu uit de feiten en omstandigheden van de onderhavige zaak kan worden afgeleid dat Sun van meet af aan de subjectieve intentie heeft gehad haar zoledroninezuur 5 mg/100 ml toe te (doen) passen bij osteoporosepatiënten.
3.9.
Sun voert gemotiveerd verweer en heeft bezwaar gemaakt tegen de volgens haar voor het eerst bij pleidooi door Novartis ingenomen stelling dat Sun niet alleen indirect maar ook direct inbreuk maakt op het octrooi.
3.10.
Ook op de stellingen van partijen in reconventie wordt hierna, voor zover van belang, nader ingegaan.
4. De beoordeling
in conventie en reconventie
Bevoegdheid
4.1.
De internationale bevoegdheid van deze rechtbank in conventie om van de vordering tegen Novartis CH en Novartis AU kennis te nemen volgt uit artikel 22 lid 4 EVEX-Verdrag4.respectievelijk EEX-Vo oud5.nu de vordering van Sun strekt tot vernietiging van het Nederlandse deel van EP 689. Relatieve bevoegdheid bestaat op grond van artikel 80 lid 1 sub a Rijksoctrooiwet 1995 (hierna: ROW).
4.2.
De internationale bevoegdheid van deze rechtbank om in reconventie van de vorderingen tegen Sun kennis te nemen is gebaseerd op artikel 2 jo. artikel 22 lid 4 EEX-Vo oud respectievelijk artikel 2 jo. artikel 22 lid 4 EVEX-Verdrag nu Sun woonplaats heeft in Nederland en haar verweer onder meer aan de geldigheid van EP 689 raakt. De relatieve bevoegdheid volgt uit artikel 80 lid 2 sub a ROW.
Technische achtergrond
4.3.
De hierna volgende uiteenzetting over het mechanisme achter botvorming en botresorptie in het algemeen, de ziekte osteoporose en de ziekte van Paget is ontleend aan de wederzijds niet bestreden uiteenzettingen door Sun bij dagvaarding en door Novartis in de conclusie van antwoord, tevens conclusie van eis in reconventie.
4.4.
Menselijke botten bestaan uit botweefsel. Dit is complex en dynamisch, levend weefsel, hoofdzakelijk samengesteld uit mineralen en bindweefsel. Het bindweefsel vormt een goed georganiseerd, losmazig netwerk dat verstevigd wordt door mineralen, vooral calcium. Het bindweefsel maakt het bot flexibel, de mineralen geven het bot hardheid.
4.5.
Botweefsel groeit, vervormt en wordt gerepareerd door middel van twee biologische mechanismen: botmodellering (bone modelling) en remodellering (bone remodelling). Botmodellering speelt een belangrijke rol in de groeifase van jonge mensen. Bij volgroeide volwassenen wordt botremodellering belangrijker. Dankzij dit mechanisme, dat over een periode van zeven tot tien jaar resulteert in een kwantitatieve regeneratie van de complete menselijke botmassa, blijft het skelet stabiel en functioneel. Vooral drie typen cellen zijn betrokken bij het botremodelleringsproces, namelijk osteoclasten, osteoblasten and osteocyten. Samen worden zij botremodellerende units (bone remodelling units, ‘BMUs’) genoemd.
4.6.
Botweefsel remodellering begint met osteoclasten die botweefsel afbreken (resorberen). Om dit te kunnen doen ‘graven’ zij in de botmatrix met behulp van verschillende enzymen om zogenaamde resorptieputjes te vormen, die samen ‘geulen’ van geresorbeerd botmateriaal vormen. Dergelijke resorptie vindt tamelijk snel plaats, vooral omdat de osteoclasten een korte levenscyclus hebben van slechts twee tot drie weken. De beduidend kleinere osteoblasten laten vervolgens nieuw collageen botmateriaal (osteoïde) in resorptieputjes achter, dat langzamerhand calcificeert om nieuw bot te vormen. Gedurende dit proces kan een deel van de osteoblasten in het beenweefsel ingebouwd raken. Dergelijke ingebouwde osteoblasten worden osteocyten genoemd. De heersende opvatting op de prioriteitsdatum was dat de botremodelleringscyclus (bone remodelling cycle) na ongeveer drie tot vier maanden goeddeels afgerond was (zie het handboek ‘Primer on the Metabolic Bone Diseases and Disorders of Mineral Metabolism’, An Official Publication of The American Society for Bone and Mineral Research, 4th Edition, 1999, p. 30, overgelegd door Novartis als productie 4).
4.7.
Normaliter is de activiteit van de osteoclasten en de osteoblasten met elkaar in balans. De balans tussen de afbraak en aanmaak van bot bepaalt voor een groot deel de uiteindelijke botmassa. Botmassa wordt bepaald door het meten van de botmineraaldichtheid (bone mineral density, ‘BMD’). Op de prioriteitsdatum werd de BMD gemeten met behulp van een densitometer die nagaat in welke mate mineralen in het bot (met name calcium) röntgenstraling absorberen. De meting wordt vergeleken met de gemiddelde botdichtheid van een jong volwassene. Bij een score van meer dan 2.5 standaardafwijking onder het gemiddelde van een jong volwassene is sprake van osteoporose.
4.8.
Op de prioriteitsdatum was bekend dat bisfosfonaten botresorptie kunnen remmen omdat ze de activiteit van osteoclasten negatief beïnvloeden. In het beginstadium van de onderzoeken naar de effectiviteit van bisfosfonaten in de behandeling van osteoporose was de BMD de voornaamste graadmeter die beschikbaar was voor medisch specialisten.
4.9.
Osteoporose is een veel voorkomende, vaak leeftijdgebonden, systematische botziekte waarbij het remodelleren van het botweefsel verstoord is. Bij patiënten die aan osteoporose lijden, vindt er meer botresorptie plaats dan botregeneratie. De meest voorkomende vorm van osteoporose is postmenopauzaal, maar osteoporose komt ook voor bij mannen. Alle typen osteoporose leiden tot broze botten die gevoeliger zijn voor breuk.
4.10.
De ziekte van Paget (osteitis deformans) is een zeldzame lokale, chronische aandoening die bij de getroffen botten tot vergrotingen, misvormingen en afwijkingen leidt die het bot ondermijnen. De ziekte van Paget wordt veroorzaakt door abnormale modellering en remodellering op specifieke plaatsen aan het skelet.
4.11.
Op de prioriteitsdatum waren in Nederland twee bisfosfonaten goedgekeurd voor de behandeling van osteoporose, namelijk Didronel® (etidronaat) en Fosamax® (alendronaat). Deze preparaten waren in orale toedieningsvorm en moesten dagelijks worden ingenomen.
4.12.
Op de prioriteitsdatum was bekend dat de biologische beschikbaarheid bij oraal gebruik van bisfosfonaten veel lager is dan bij intraveneuze toediening. Bij een intraveneuze toediening is de absorptie van de stof 100%, terwijl deze bij orale toediening slechts 1% is.
4.13.
Hoe potenter een bisfosfonaat, hoe minder werkzame stof nodig is om hetzelfde therapeutische effect te bereiken. Van alle bisfosfonaten werd zoledroninezuur in het begin van de jaren 90 van de vorige eeuw beschouwd als de meest potente botresorptieremmer.
voorts in conventie
Prioriteit van US 689 – nieuwheid (conclusie 7)
4.14.
De eerste vraag die partijen verdeeld houdt, is of Novartis een beroep toekomt op de prioriteit van het tweede prioriteitsdocument US 689.6.Vast staat dat indien het beroep op US 689 (en daarmee ook het beroep op US 135) niet slaagt, het artikel van Reid (vgl. 2.20.) als tussenkomende stand van de techniek nieuwheidsschadelijk is voor conclusie 7 van EP 689. Tegelijkertijd leidt een terechte claim van Novartis op US 689 als prioriteitsdocument direct tot de slotsom dat conclusie 7 van het octrooi nieuw is, nu Sun de nieuwheid van conclusie 7 op geen andere wijze heeft bestreden dan door US 689 (en US 135) als prioriteitsdocument te betwisten en te wijzen op het na dat document en voor de datum van de aanvrage van het octrooi gepubliceerde artikel van Reid.
4.15.
Novartis komt het beroep op prioriteit toe indien in het document US 689, in zijn geheel beschouwd, de in conclusie 7 van het octrooi7.geclaimde uitvinding direct en ondubbelzinnig aan de gemiddelde vakman, gebruikmakend van zijn algemene vakkennis, wordt geopenbaard: het moet gaan om ‘the same invention’, zoals artikel 87 EOV verwoordt.8.Voor een gegrond beroep dient de geclaimde uitvinding bovendien, zoals Sun terecht stelt, in het prioriteitsdocument nawerkbaar te zijn geopenbaard, in die zin dat aannemelijk dient te zijn dat de geclaimde uitvinding werkt.9.In casu, waar het gaat om een tweede medische indicatie-octrooi (en waar het bereiken van het geclaimde therapeutische effect een functioneel technisch kenmerk is van de conclusie), betekent dit dat uit US 689 de geschiktheid van het te bereiden zoledroninezuur voor de geclaimde therapeutische toepassing moet kunnen worden afgeleid.
4.16.
Partijen zijn het erover eens dat de uitvinding van conclusie 7 uiteenvalt in verschillende elementen, namelijk a) gebruik van zoledroninezuur, b) voor de bereiding van een geneesmiddel voor de behandeling van osteoporose, c) waarbij het geneesmiddel is aangepast voor intraveneuze toediening, d) in een eenheidsdosering van ongeveer 2 tot ongeveer 10 mg en e) met een toedieningsinterval van ongeveer één keer per jaar. Sun stelt zich op het standpunt dat US 689 niet direct en ondubbelzinnig de combinatie van die elementen openbaart. Verder voert Sun aan dat uit US 689 niet direct en ondubbelzinnig volgt dat het gebruik van zoledroninezuur effectief is in de behandeling van osteoporose. Als die effectiviteit al kan worden afgeleid uit voorbeeld 5 van het prioriteitsdocument, dan heeft dat volgens Sun enkel betrekking op 4 mg en biedt US 689 geen basis voor het in het octrooi geclaimde bereik van 2-10 mg.
4.17.
Verder bestaat er geen echt verschil van mening over de persoon van de gemiddelde vakman. Beide partijen gaan uit van een ‘skilled’ team van vaklieden, bestaande uit in ieder geval een arts die regelmatig patiënten met metabolische botafwijkingen behandelt, waaraan Sun nog toevoegt een farmacoloog die ervaring heeft met de ontwikkeling van farmaceutische producten voor de behandeling van botaandoeningen. Nu Novartis niet heeft bestreden dat de clinicus uit het team in een academisch ziekenhuis werkzaam dient te zijn, zal daarvan worden uitgegaan. Verder is er van uit te gaan, zoals Sun heeft gesteld10.en ter zitting desgevraagd bevestigd, dat het op de prioriteitsdatum tot de algemene vakkennis van de gemiddelde vakman behoorde dat zoledroninezuur alleen intraveneus werd toegediend.
4.18.
Uitgaande van voornoemde maatstaf is de rechtbank net als het hof in de kort geding procedure, maar anders dan de voorzieningenrechter, de Engelse High Court (Arnold J) en de Court of Appeal (Floyd LJ), van oordeel dat Novartis een beroep op de prioriteit van US 689 toekomt. Het is met name door de in de overweging hiervoor aangehaalde stelling van Sun over de algemene vakkennis van de gemiddelde vakman, dat de rechtbank tot dit (van de Engelse collega’s afwijkende) bodemoordeel komt. Een en ander wordt hierna toegelicht.
4.19.
Zoals ook het hof Den Haag in het arrest heeft overwogen, ligt het voor de hand dat de gemiddelde vakman die US 689 leest, in het bijzonder aandacht zal hebben voor het daarin beschreven Voorbeeld 5 ‘Treatment of Patients’ omdat hierin de resultaten van een klinische studie worden gepresenteerd. In die studie is aan patiënten met osteoporose gedurende een jaar dan wel placebo dan wel (periodiek) verschillende doseringen, namelijk 0,25 mg elke 3 maanden (totaal 1,0 mg), 0,5 mg elke 3 maanden (totaal 2 mg), 1,0 mg elke 3 maanden (totaal 4,0 mg), 2,0 mg elke 6 maanden (totaal 4,0 mg) en eens 4,0 mg, zoledroninezuur intraveneus toegediend. Het resultaat van de studie wordt in US 689 als volgt verwoord (zie ook 2.6.):
“The 12 month results showed that all treatment arms demonstrated a percent change from baseline in BMD significantly (p < 0.001) greater than placebo and not dissimilar one from another.”
en ook:
“Bone mineral density increased compared to placebo at the spine, hip, distal radius, and "total body". Suppression of biochemical markers of bone formation and bone resorption confirmed and supported the BMD results, demonstrating suppression of bone turnover to the pre-menopausal level throughout the 6 and 12 month dosing intervals.
The BMD data indicate that zoledronic acid dose administration as infrequent as every 6 or 12 months can safely result in a statistically significant and medically relevant bone mass increase. It is believed that these data further indicate that a continued preservation of new bone beyond one year, without additional dose administration, is likely or that further bone mass increase is possible. It is also believed that re-treatment in additional cycles of every 6-month, 12-month, or less frequent dose administration will lead to further BMD increase. A reduction of risk of osteoporotic fracture is expected to accompany the bone mass increases.”
4.20.
Deze resultaten openbaren dan ook direct en ondubbelzinnig aan de gemiddelde vakman dat indien 4 mg zoledroninezuur intraveneus wordt toegediend bij osteoporose patiënten, na verloop van een jaar een significant toegenomen BMD wordt waargenomen ten opzichte van de osteoporose patiënten die placebo toegediend hebben gekregen.
Nu een directe relatie bestaat tussen de BMD en (de verschijnselen die horen bij) osteoporose (zie r.o. 4.7., 4.7. en 4.8.), zal de gemiddelde vakman in deze resultaten zonder meer ook lezen dat intraveneuze toediening van 4 mg zoledroninezuur met een toedieningsinterval van een jaar therapeutisch werkzaam zal zijn voor de behandeling van osteoporose.
4.21.
In de studie van Voorbeeld 5 zijn (kennelijk) naast eenmaal per jaar dosering van 4 mg zoledroninezuur niet ook andere eenmaal per jaar doseringen, zoals de doseringen die vallen binnen het in het octrooi geclaimde doseringsbereik van 2-10 mg, getest. Dat neemt niet weg dat de gemiddelde vakman, op basis van de klinische studie en zijn algemene vakkennis, zal verwachten dat ook een zekere range om de dosering van 4 mg heen als jaardosering werkzaam zal zijn. Zoals immers ook opgemerkt in de beschrijving is onderdeel van zijn algemene vakkennis dat de werkzame dosis van bisfosfonaten afhankelijk is van verschillende factoren en geen vastliggend gegeven is (zie 2.6.):
“The particular mode of administration and the dosage may be selected by the attending
physician taking into account the particulars of the patient, especially age, weight, life style, activity level, hormonal status (e.g. post-menopausal) and bone mineral density as appropriate.
The dosage of the Agents of the Invention may depend on various factors, such as
effectiveness and duration of action of the active ingredient, e.g. including the relative potency of the bisphosphonate used, mode of administration, warm-blooded species, and/or sex, age, weight and individual condition of the warm-blooded animal.”
4.22.
Deze kennis over de werking van bisfosfonaten gecombineerd met hetgeen valt af te leiden uit de klinische studie, namelijk dat bij verschillende doseringen (met verschillende intervallen) een significant toegenomen BMD wordt waargenomen, zal voornoemde verwachting bij de gemiddelde vakman doen ontstaan.
4.23.
De rechtbank gaat al vanwege Voorbeeld 5 voorbij aan het betoog van Sun dat Novartis verschillende elementen uit los van elkaar staande passages in het prioriteitsdocument zonder grond met elkaar combineert tot conclusie 7. De gemiddelde vakman zal bij het lezen van US 689 door de resultaten van de klinische studie de elementen a) gebruik van zoledroninezuur, b) voor de bereiding van een geneesmiddel voor de behandeling van osteoporose, c) intraveneus toegediend en e) met een toedieningsinterval van ongeveer één keer per jaar reeds met elkaar hebben gecombineerd. Het enige element dat nog ontbreekt, is de doseringsrange van het eerder onder d) genoemde element.
4.24.
De doseringsrange van ongeveer 2-10 mg wordt in de beschrijving van US 689 genoemd, namelijk in de alinea die luidt als volgt (zie 2.6.):
“Formulations in single dose unit form contain preferably from about 1% to about 90%, and
formulations not in single dose unit form contain preferably from about 0.1% to about 20%, of the active ingredient. Single dose unit forms such as ampoules of infusion solution or solid for preparation of infusion solution doses, capsules, tablets or dragées contain e.g, from about 0.5 mg to about 500mg of the active ingredient. It will be appreciated that the actual unit dose used will depend upon the potency of the bisphosphonate and the dosing interval amongst other things. Thus the size of the unit dose is typically lower for more potent bisphosphonates and greater the longer the dosing interval. For example, for more potent, recent bisphosphonates such as zoledronic acid a unit dose of from about 1 up to about 10 mg may be used. For example, also for such recent, more potent bisphosphonates a unit dose of from about 1 to about 5 mg may be used for dosing once every 6 months; whereas a dose of from about 2 up to about 10 mg may be used for once a year dosing.”
4.25.
De gemiddelde vakman zal naar het oordeel van de rechtbank het verband tussen de elementen die volgen uit Voorbeeld 5 en deze doseringsrange leggen, alleen al omdat de doseringsrange van ongeveer 2 tot ongeveer 10 mg volgens de hiervoor weergegeven alinea juist ziet op potente bisfosfonaten, in het bijzonder op het met name genoemde zoledroninezuur. De gemiddelde vakman die door Voorbeeld 5 op zoek is naar een doseringsrange om 4 mg zoledroninezuur heen, zal die doseringsrange dan in deze alinea hebben gevonden.
4.26.
Sun heeft naar voren gebracht dat in voornoemde alinea van de beschrijving van US 689 in het geheel geen koppeling met intraveneuze toediening wordt gemaakt. De rechtbank verwerpt dit argument reeds omdat – zoals hiervoor al aan de orde – Sun zelf stelt dat het op de prioriteitsdatum algemene vakkennis was dat zoledroninezuur alleen intraveneus werd toegediend. Om die reden zou de gemiddelde vakman het verband tussen de doseringsrange van ongeveer 2-10 mg voor zoledroninezuur en intraveneuze toediening eenvoudig leggen.
4.27.
De rechtbank verwerpt ook de stelling van Sun dat US 689 niet voor de volledige range van 2-10 mg de geschiktheid van zoledroninezuur voor de behandeling van osteoporose openbaart. Naar het oordeel van de rechtbank bevatten de resultaten van de klinische studie weergegeven in Voorbeeld 5 voor de gemiddelde vakman voldoende aanwijzingen om daaruit direct en ondubbelzinnig te kunnen afleiden dat een behandeling met zoledroninezuur volgens conclusie 7, derhalve met een doseringsrange van 2-10 mg met een toedieningsinterval van een jaar, geschikt is voor de geclaimde behandeling en een therapeutisch effect inderdaad wordt bereikt. Dat geen resultaten zijn opgenomen van een studie naar de effecten van behandeling over de hele breedte van de doseringsrange van 2-10 mg met een toedieningsinterval van een jaar, staat aan dat oordeel niet in de weg. Dat toediening van 4 mg werkzaam is, volgt rechtstreeks uit Voorbeeld 5, zoals hiervoor reeds overwogen in r.o. 4.20., en wordt als zodanig ook niet door Sun betwist. De doseringsrange van ongeveer 2-10 mg ligt zo dicht om de 4 mg dosering heen, dat de gemiddelde vakman, op basis van Voorbeeld 5 gelezen in samenhang met de volledige beschrijving, zou aannemen dat de dosering binnen die range ook werkzaam zal zijn. In Voorbeeld 5 is ook niet uitsluitend 4 mg met een toedieningsinterval van een jaar getest maar zijn ook andere doseringsregimes en -intervallen getest, zoals 2 mg halfjaarlijks en 1 mg per drie maanden, die ook werkzaam bleken. Het prioriteitsdocument dient enige informatie te bevatten waaruit kan worden afgeleid dat de behandeling het geclaimde therapeutische effect heeft. Aan dat vereiste voldoet US 689 met Voorbeeld 5. Er is ten slotte ook geen enkele aanwijzing, en Sun – op wie volgens de hoofdregel van artikel 150 Rv de stelplicht en, bij gemotiveerde betwisting, de bewijslast rust – heeft niets gesteld, waaruit zou moeten volgen dat de dosering van 4 mg wel en één of meer van de andere doseringen binnen de doseringsrange van 2-10 mg niet werkzaam zal zijn.
4.28.
Uit het voorgaande volgt dat Novartis ten aanzien van conclusie 7 van EP 689 een beroep toekomt op de prioriteit van US 689. Gelet op hetgeen hiervoor is overwogen over het artikel van Reid (vgl. r.o. 4.14.) betekent dit dat conclusie 7 geacht wordt nieuw te zijn.
Prioriteit van US 689 – nieuwheid (conclusies 1-6)
4.29.
Sun heeft bij dagvaarding ten aanzien van de conclusies 1-6 van EP 689 slechts gesteld dat die het lot van conclusie 7 volgen. Nog daargelaten dat die redenering Sun gelet op hetgeen hiervoor is overwogen niet verder helpt, is de redenering ook niet valide omdat het al dan niet bestaan van prioriteit voor een volgconclusie niet per se iets zegt over de geldigheid van de prioriteit van voorgaande conclusies. Nu Sun geen zelfstandig argument heeft aangevoerd voor de conclusies 1-6 van EP 689, is mitsdien van een gegrond beroep op prioriteit van die conclusies uit te gaan.
4.30.
Eerst bij pleidooi – zo heeft zij desgevraagd bevestigd – heeft Sun (onder randnummers 53 tot en met 57) op basis van nieuwe (voor die conclusies zelfstandige) argumenten aangevoerd dat conclusies 1-6 aanspraak op prioriteit van US 689 ontberen. Novartis heeft op grond van de conclusiewisseling met deze nieuwe argumenten in redelijkheid geen rekening kunnen en hoeven houden. Ook de rechtbank heeft zich op deze nieuwe, zelfstandige argumenten niet kunnen voorbereiden. Deze bij pleidooi opgeworpen argumenten van Sun worden daarom ambtshalve buiten beschouwing gelaten vanwege strijd met de goede procesorde.
Inventiviteit (conclusie 7)
4.31.
Bij de beoordeling van de inventiviteit zal de rechtbank de zogeheten problem-and-solution-approach hanteren, die beide partijen ook hebben gebruikt in hun argumentatie. In die benadering dient eerst te worden vastgesteld wat de meest nabije stand van de techniek, de closest prior art, is. Volgens Sun dient te worden uitgegaan van WO95/30421, gepubliceerd op 16 november 1995, (hierna WO 421) als meest nabije stand van de techniek. Volgens Sun hebben zowel WO 421 als EP 689 hetzelfde doel, te weten het verschaffen van een effectieve behandeling van aandoeningen van verhoogde botresorptie door middel van bisfosfonaten. Novartis heeft betwist dat WO 421 als meest nabije stand van de techniek kan worden beschouwd.
4.32.
De rechtbank stelt voorop dat de meest nabije stand van de techniek de openbaarmaking is, die de combinatie van kenmerken toont die het meest geschikte uitgangspunt oplevert (most promising springboard) in de richting van een voor de hand liggende ontwikkeling naar de geclaimde uitvinding. Het moet bij de selectie van de meest nabije stand van de techniek gaan om hetzelfde of een nauw verwant technisch gebied en hetzelfde doel als de geclaimde uitvinding.
4.33.
Novartis heeft gemotiveerd aangevoerd dat WO 421 niet – zoals EP 689 – gericht is op de behandeling van osteoporose maar op het voorkomen van het losraken of zich verplaatsen van prothesen en dat een overeenkomst in de onderliggende oorzaak van beide aandoeningen (verhoogde botresorptie) geen reden is om een gelijke therapie te volgen. Novartis heeft daarbij onder meer gewezen op een productie van de zijde van Sun met een deskundigenverklaring van Professor R.G.G. Russell (productie 12), waarin hij uitlegt dat het losraken van prothesen en osteoporose sterk van elkaar verschillende aandoeningen zijn. Het losraken van prothesen is een lokaal optredend probleem dat acuut behandeld moet worden, dikwijls door chirurgisch ingrijpen, terwijl osteoporose een chronische aandoening is die door het gehele lichaam optreedt. Onder verwijzing naar een overzichtsartikel uit 1998 van Fleisch (bijlage 5 bij de verklaring van Pazianas - productie 1 van de zijde van Sun) heeft Novartis bovendien gesteld dat op de prioriteitsdatum algemeen bekend was dat het niet mogelijk is om de behandeling van een bepaalde aandoening die is terug te voeren op abnormale botresorptie te extrapoleren naar de behandeling van een andere aandoening die eveneens is terug te voeren op abnormale botresorptie.
4.34.
Dit betoog van Novartis en de inhoud van de door haar daarbij aangehaalde producties zijn door Sun niet betwist. Sun heeft enkel gesteld dat osteoporose in WO 421 wordt genoemd. Osteoporose wordt echter enkel genoemd op pagina 1, laatste alinea, als een aandoening die met bisfosfonaten wordt behandeld: “bisphosphonates are used clinically to inhibit excessive bone resorption in a variety of diseases such as tumourinduced osteolysis, Paget’s disease and osteoporosis”. Verder wordt uitsluitend nog aan osteoporose gerefereerd in relatie tot de gesuggereerde ruime doseringsrange van genoemde bisfosfonaten voor de behandeling van loslatende of migrerende protheses (pagina 7, 4e alinea): “doses which are in the same order of magnitude as those used in the treatment of the diseases classically treated with methanebisphosphonic acid deratives, such as Paget’s disease, tumourinduced hypercalcaemia or osteoporosis”. Deze vermeldingen maken niet dat aan WO 421 hetzelfde doel (behandeling van dezelfde aandoening) kan worden toegeschreven als aan EP 689.
4.35.
De conclusie is dan ook dat WO 421 geen geschikt uitgangspunt oplevert (most promising springboard) voor de uitvinding in EP 689.
4.36.
Maar zelfs als uitgegaan zou worden van WO 421 als vertrekpunt, ziet de rechtbank niet in hoe de gemiddelde vakman zonder inventieve denkarbeid zou uitkomen bij de uitvinding van het octrooi, ten aanzien waarvan (zie eerder onder r.o. 4.16.) partijen het erover eens zijn dat die uiteenvalt in verschillende elementen. Zoals het hof in het arrest ook heeft overwogen zouden uitgaande van WO 421 de verschilmaatregelen ten opzichte van conclusie 7 van het octrooi in elk geval zijn: 1) specifiek zoledroninezuur (WO 421 noemt vele bisfosfonaten en noemt zoledroninzuur en pamidronaat als de geprefereerde terwijl conclusie 7 van het octrooi specifiek handelt over zoledroninezuur), 2) de indicatie osteoporose, 3) de doseringsrange van ongeveer 2-10 mg (WO 421 noemt enkel een zeer brede doseringsrange van 1-500 mg) en 4) het doseringsinterval van een jaar (WO 421 noemt een interval variërend van eens per dag tot eens per jaar). Sun heeft betoogd dat het objectieve technische probleem is het vinden van een doseringshoeveelheid en -frequentie van zoledroninezuur waarmee osteoporose effectief en veilig behandeld kan worden. Dat kan niet als juist worden aanvaard omdat daarin de keuze zowel voor specifiek zoledroninezuur als voor de behandeling van osteoporose reeds besloten ligt. Gelet op de verschilmaatregelen moet de probleemstelling eerder (veel breder) worden geformuleerd als het zoeken naar (een) andere effectieve toepassing(en) van bisfosfonaten, zo is de rechtbank met het hof van oordeel.
4.37.
Op basis van dezelfde (aanzienlijke hoeveelheid) documenten als ingebracht in de kort geding procedure heeft Sun de rechtbank getracht ervan te overtuigen dat de keuze voor zoledroninezuur en vervolgens het bepalen van de juiste doseringshoeveelheid en -frequentie voor de hand lag. Op gelijke gronden als het hof heeft overwogen (de rechtbank verwijst hiertoe naar de overwegingen 4.15 tot en met 4.26 van het arrest die zij tot de hare maakt), heeft Sun evenmin in de bodemprocedure laten zien dat de gemiddelde vakman een aanwijzing (pointer) zou hebben op grond waarvan hij op de prioriteitsdatum, uitgaande van WO 421, zonder inventieve denkarbeid zou (‘would’ - not ‘could’) komen tot de toepassing van specifiek zoledroninezuur voor de behandeling van osteoporose door intraveneuze toediening in een doseringsrange van ongeveer 2-10 mg en een doseringsinterval van een jaar.
4.38.
Sun heeft voor het eerst bij pleidooi betoogd dat indien WO 421 door de rechtbank niet wordt aangemerkt als closest prior art, net zo goed “The Pink Sheet”, een biofarmaceutisch vakblad, Vol. 62, No. 8 van 21 februari 2000 (productie 1.23 van de zijde van Sun) (hierna: The Pink Sheet) aangemerkt kan worden als meest nabije stand van de techniek en zij heeft haar inventiviteitsaanval vervolgens met deze publicatie vervlochten. De rechtbank zal The Pink Sheet bij de inventiviteitsbeoordeling, op gelijke gronden als zij ten aanzien van de bij pleidooi nieuw gevoerde argumenten voor wat betreft prioriteit van US 689 ten opzichte van de conclusies 1-6 van het octrooi heeft gedaan (vgl. r.o. 4.30.), ambtshalve buiten beschouwing laten wegens strijd met de goede procesorde.
4.39.
Het voorgaande brengt mee dat WO 421 niet inventiviteitsschadelijk is voor conclusie 7 van het octrooi. Conclusie 7 is dan ook geldig. De inventiviteit van de conclusies 1 t/m 6 van EP 689 is door Sun niet zelfstandig bestreden. De redenering van Sun dat de conclusies 1-6 het lot van conclusie 7 volgen, wat daarvan in dit verband ook zij, gaat reeds niet op omdat aan de premisse daarvan, te weten dat conclusie 7 niet inventief is, reeds niet wordt voldaan. De conclusies 1-6 zijn bijgevolg inventief te achten.
Nawerkbaarheid (conclusie 1)
4.40.
Eerst bij conclusie van antwoord in reconventie, in reactie op de door Novartis gestelde inbreuk door Sun op (onder meer conclusie 1 van het octrooi), alsook bij pleidooi, heeft Sun naar voren gebracht dat conclusie 1 (en ook de conclusies 2, 3 en 4 zoals zij ter zitting nog heeft aangevuld) van EP 689 (ook) wegens niet-nawerkbaarheid nietig is/zijn. Wederom onder verwijzing naar hetgeen de rechtbank ten aanzien van de nieuw gevoerde argumenten voor wat betreft prioriteit van US 689 ten opzichte van de conclusies 1-6 van het octrooi heeft overwogen (vgl. r.o. 4.30.), wijst zij ook deze nieuwe grond voor nietigheid van de hand omdat dit in strijd met een goede procesorde is aangevoerd. Aan een inhoudelijke beoordeling van dit argument komt de rechtbank dan ook niet toe.
Conclusie
4.41.
Dit alles leidt tot de slotsom dat de vordering van Sun tot vernietiging van het Nederlandse deel van EP 689 niet slaagt. Om redenen van proceseconomie zal de vordering echter eerst bij eindvonnis worden afgewezen. Datzelfde geldt voor de toewijzing van de door Novartis gevorderde proceskosten in conventie waarin Sun als de in het ongelijk gestelde partij zal worden verwezen. Die kosten zullen wel alvast worden begroot. Novartis vordert onder verwijzing naar artikel 1019h Rv een vergoeding van haar volledige proceskosten, voor de gehele procedure (in conventie en in reconventie) een bedrag van € 161.700,26. De nietigheidsprocedure is door Sun ingesteld na sommatie door Novartis en na het door Novartis tegen Sun geëntameerde kort geding. Zodoende is in conventie sprake van samenhang met een concrete (dreigende) inbreukactie, die vervolgens in reconventie ook is ingesteld.11.Artikel 1019h Rv is zodoende in conventie van toepassing, hetgeen door Sun ook niet is bestreden. Ook de redelijkheid en evenredigheid van de gevorderde kosten heeft Sun niet bestreden.
Bij gebreke van een door partijen voorgestelde verdeling, moet de rechtbank de verdeling schatten en zal zij de kosten bij helfte verdelen over de conventie en de reconventie.
De rechtbank zal daarom voor Novartis in conventie uitgaan van een bedrag van € 80.850,13 (1/2 × € 161.700,26).
4.42.
Iedere beslissing in conventie wordt derhalve aangehouden.
voorts in reconventie
Productie 41 van de zijde van Sun
4.43.
Productie 41 van de zijde van Sun zal worden geweigerd nu deze productie niet reactief is en bovendien te laat en daarmee in strijd met de goede procesorde is ingebracht.
Indirecte inbreuk
4.44.
Novartis stelt dat Sun indirecte inbreuk maakt op conclusies 1 en 7 van EP 689.
4.45.
Bij akte na conclusiewisseling heeft Sun de hiervoor in 2.24. genoemde uitspraken overgelegd van Justice Arnold van 21 januari 2015 en 6 februari 2015 in de zaak Warner-Lambert v. Actavis, waarin hij zich uitspreekt over de octrooi-inbreuk bij Swiss-type claims. Sun heeft daarbij aangegeven zich bij die overwegingen aan te sluiten en die mede aan haar niet-inbreukverweer ten grondslag te leggen zodat volgens haar in deze zaak geen sprake kan zijn van indirecte inbreuk. Novartis heeft bezwaar gemaakt tegen dit verweer, dat wat haar betreft te laat en daarmee in strijd met een goede procesorde is gevoerd, zodat het dient te worden gepasseerd.
4.46.
De rechtbank zal echter niet voorbij gaan aan het verweer, nu Sun reeds bij conclusie van antwoord in reconventie onderbouwd de door Novartis gestelde indirecte inbreuk heeft bestreden. De door Sun nadien in het geding gebrachte uitspraken van Justice Arnold (producties 38, 40.1 en 40.2) zijn bepaald aan te merken als een koersverlegging van haar verweer, doch dat laat onverlet dat nu zij zich tijdig tegen de indirecte inbreuk an sich heeft verweerd, de rechtbank zal moeten beoordelen of Sun indirecte inbreuk kan worden verweten. Onderdeel van die beoordeling is de vraag of op indirecte wijze inbreuk kan worden gemaakt op een Swiss-type claim, hetgeen de rechtbank (bijvoorbeeld ook als het nadere verweer van Sun niet zou zijn gevoerd) ambtshalve dient vast te stellen.
4.47.
De rechtbank is van oordeel dat van indirecte inbreuk geen sprake is en licht dit hierna toe.
4.48.
De rechtbank stelt voorop dat van indirecte inbreuk als bedoeld in artikel 73 ROW sprake is indien een persoon in Nederland in of voor zijn bedrijf middelen betreffende een wezenlijk bestanddeel van de uitvinding aan onbevoegde derden aanbiedt of levert voor de toepassing van de geoctrooieerde uitvinding in Nederland, een en ander mits die persoon weet dan wel het gezien de omstandigheden duidelijk is, dat die middelen voor die toepassing geschikt en bestemd zijn.
4.49.
Van belang bij de beoordeling van de vraag of Sun indirecte inbreuk maakt op conclusies 1 en 7 van EP 689 is de beschermingsomvang van die conclusies. EP 689 is een ‘tweede medische indicatie’ octrooi. De octrooibescherming van dergelijke octrooien is lastig om twee redenen. In de eerste plaats komt aan de uitvinder van een tweede medische indicatie van een reeds bekende stof geen stofbescherming toe omdat de stof niet nieuw is. In de tweede plaats zijn van octrooieerbaarheid uitgesloten – kort gezegd – geneeskundige behandelingsmethoden teneinde medische beroepsbeoefenaren te vrijwaren van octrooi-inbreuk. In een poging om deze problemen te omzeilen heeft de Grote Kamer van Beroep van het EOB in de uitspraak G5/83 toegestaan dat conclusies die zien op een tweede medische indicatie van een bekende stof kunnen worden geredigeerd in de vorm van een conclusie “directed to the use of a substance or composition for the manufacture of a medicament for a specified new and inventive therapeutic application”, een praktijk die zijn oorsprong vond in het Zwitserse octrooibureau (vandaar de benaming ‘Swiss-type’). Een Swiss-type claim werd daarna steeds geredigeerd als ‘gebruik van stof X voor de vervaardiging van geneesmiddel Y voor de behandeling van ziekte Z’. In de literatuur12.werd aangenomen dat een Swiss-type claim een werkwijze onder bescherming stelt:
Altogether, the second medical use claim approved by the EPO is a process claim to the manufacture of a known medicament for a specific novel application.
4.50.
Aan de praktijk van het verlenen van Swiss-type claims kwam een einde door wijzigingen in het Europees octrooiverdrag (aangeduid als EPC 200013.) waarbij het ingevolge artikel 54 lid 5 EPC 2000 is toegestaan tweede medische indicatie conclusies in een andere vorm (het gebruik van stof X voor behandeling van ziekte Y) te claimen. Octrooien met Swiss-type claims die verleend zijn voor de inwerkingtreding van EPC 2000 behouden echter hun effect, zo oordeelde de Grote Kamer van Beroep in de beslissing G2/08.14.
4.51.
In de uitspraak T 1780/1215.heeft de Technische Kamer van Beroep geoordeeld dat een Swiss-type claim een andere beschermingsomvang heeft dan een EPC 2000 claim. Swiss-type claims zijn ‘purpose limited process claims’, oftewel doelgebonden werkwijzeconclusies, terwijl EPC 2000 claims ‘purpose limited product claims’, oftewel doelgebonden productconclusies betreffen. In deze laatste claims ontbreekt de voor Swiss-type claims kenmerkende maatregel ‘het bereiden van een geneesmiddel’.
4.52.
Keren wij terug naar de conclusies 1 en 7 van EP 689 en naar de door Novartis gestelde indirecte inbreuk daarop door Sun. De conclusies zijn in Swiss Form geredigeerd. Gelet op hetgeen hiervoor is besproken, is er in deze procedure van uit te gaan, en ook Novartis gaat daar van uit16., dat de conclusies werkwijzeconclusies betreffen. In het geval van conclusie 717.gaat het dan om een werkwijze die ziet op de toepassing van a) zoledroninezuur, b) voor de bereiding van een geneesmiddel voor de behandeling van osteoporose, c) door intraveneuze toediening, d) in een eenheidsdosering van ongeveer 2-10 mg en e) met een toedieningsinterval van ongeveer één keer per jaar.
4.53.
Novartis legt deze conclusies zo uit dat zij zijn gericht op de bereiding van een geneesmiddel, die zijn nieuwheid niet aan de vervaardigingswijze (die was al bekend) maar aan zijn bestemming (de tweede medische indicatie) ontleent. Op die conclusies maakt Sun indirecte inbreuk, aldus Novartis, doordat, alvorens het medicijn aan de patiënt wordt toegediend, op meerdere momenten in de keten van afnemers aan haar zoledroninezuur 5 mg/100 ml (door de voorschrijver, de apotheker, de verpleegkundige die het toedient) de bestemming osteoporose wordt gegeven. Novartis meent dan ook dat op meerdere momenten in de keten van afnemers door het geven van de bestemming aan het geneesmiddel de uitvinding wordt toegepast. Sun wist althans behoorde te weten dat dit ging gebeuren en niettemin leverde zij het wezenlijk bestanddeel waarmee de inbreuk gepleegd ging worden. Daarom maakt zij indirecte inbreuk, aldus nog steeds Novartis.
4.54.
De rechtbank is van oordeel dat deze redenering niet opgaat nu die op twee gedachten hinkt en daarmee innerlijk tegenstrijdig is. Uitgaande van een werkwijzeconclusie en aannemende dat het generieke zoledroninezuur aangemerkt dient te worden als een wezenlijk bestanddeel, kan ‘voor toepassing van de geoctrooieerde uitvinding’, zoals artikel 73 ROW verwoordt, wat conclusie 7 betreft, niet anders worden begrepen dan het bereiden (‘the preparation’ zoals conclusie 7 het noemt) van het geneesmiddel zoledroninezuur voor de behandeling van osteoporose. Vast staat echter dat de werkwijze, te weten het bereiden van het geneesmiddel, nergens in de keten na levering door Sun van het geneesmiddel (meer) wordt toegepast. De andersluidende lezing van Novartis dat toepassing van de geoctrooieerde uitvinding, ‘manufacturing’, gelijk moet worden gesteld aan het geven van een bestemming aan het geneesmiddel (product) kan enkel opgaan als een Swiss-type claim wordt aangemerkt als een ‘purpose limited product claim’, zoals de EPC 2000 claims dat zijn, althans daarmee gelijkgesteld zou moeten worden. Terecht beroept Novartis zich daar nu juist niet op. Waar Novartis met een verwijzing naar artikel 64 lid 2 EOV betoogt dat ook bij een Swiss-type claim het direct verkregen resultaat van de werkwijze, het geneesmiddel, is meebeschermd, verlaat zij de grondslag van de indirecte inbreuk en betreedt zij het terrein van de directe inbreuk18., waarover hierna meer.
4.55.
Ten slotte kan niet worden aangenomen, anders dan Novartis ter zitting nog heeft aangevoerd – zonder dit overigens concludent te maken – dat de verpleegkundige die het zoledroninezuur toedient aan de patiënt het geneesmiddel bereidt. Zoals Sun onweersproken heeft gesteld, is het generiek zoledroninezuur 5 mg/100 ml klaar voor gebruik om via een infuus te worden toegediend.
4.56.
Daarmee valt het doek voor de indirecte inbreuk.
4.57.
In vergelijkbare zin oordeelde Justice Arnold in de pregabalin zaken (hiervoor vermeld in 2.24., 2.26. en 2.27.)19.. Het hof kwam in het arrest in de kort geding procedure wel tot het voorlopig oordeel dat sprake is van indirecte inbreuk op conclusie 7 van EP 689. Uit het arrest is evenwel niet op te maken welke overwegingen aan dat oordeel ten grondslag liggen. In het bijzonder blijkt niet of het hof het voor indirecte inbreuk op een Swiss-type claim noodzakelijk acht dat er in de keten van afnemers een persoon is die zoledroninezuur gebruikt voor de bereiding van een geneesmiddel.
4.58.
Voor zover de vorderingen van Novartis zijn gebaseerd op indirecte inbreuk op conclusies 1 en 7 van EP 689 komen zij reeds op voornoemde gronden niet voor toewijzing in aanmerking.
Directe inbreuk
4.59.
Voor het eerst op zitting heeft Novartis onderbouwd gesteld dat Sun direct inbreuk maakt op het octrooi. Sun heeft daartegen bezwaar gemaakt. Anders dan zij ten aanzien van de door Sun voor het eerst bij pleidooi gevoerde nietigheidsargumenten ten aanzien van prioriteit en The Pink Sheet (ambtshalve) heeft beslist, zal de rechtbank aan de gestelde directe inbreuk niet voorbij gaan, en wel op grond van het volgende.
4.60.
Daar naar gevraagd heeft Novartis ter zitting enkele plaatsen in de conclusie van antwoord tevens eis in reconventie genoemd waar impliciet ook uit zou kunnen worden begrepen dat zij zich niet uitsluitend op indirecte inbreuk ten aanzien van de conclusies 1 en 7 beroept, ofschoon de onderbouwing van de inbreuk in de dagvaarding in feite geheel is gericht op de indirecte inbreuk op die conclusies. Onder verwijzing naar paragraaf 9 e.v. van de conclusie van antwoord in reconventie heeft Novartis voorts aangegeven dat Sun heeft begrepen dat Novartis ook directe inbreuk op dezelfde conclusies aan haar vordering ten grondslag heeft gelegd. Aan Novartis kan worden toegegeven dat Sun in de aangehaalde paragrafen, waarin zij daartegen gemotiveerd verweer voert, inderdaad anticipeert op de (niet onderbouwde) stelling van Novartis dat Sun ook directe inbreuk maakt op EP 689. In feite lijkt de vraag of Sun bij het fabriceren en leveren van haar generieke product wetenschap had dat dit product verder in de keten de bestemming van de geoctrooieerde indicatie zou kunnen krijgen, zowel bij directe als indirecte inbreuk een belangrijke rol te spelen (vgl. paragraaf 123 pleitnota Novartis). Dat debat is in de sleutel van indirecte inbreuk reeds omstandig gevoerd. Gelet hierop kan niet gezegd worden dat Sun door de eerst ter zitting gedane onderbouwing van het directe inbreuk argument daadwerkelijk in haar verdediging is geschaad.
4.61.
Niettemin hebben zich kort voor de mondelinge behandeling in deze zaak in hoog tempo een aantal belangrijke ontwikkelingen voorgedaan die ertoe leiden dat het debat ter zitting niet optimaal is geweest. Met name kunnen worden genoemd het hiervoor aangehaalde arrest van hof Den Haag (vgl. 2.23.) en – in het bijzonder – de uitspraak van Arnold J in de zaak Warner-Lambert v. Actavis (vgl. 2.24.). Het is deze laatste uitspraak geweest die heeft gemaakt dat het debat ter zitting, zij het wat gemankeerd, ten opzichte van de conclusiewisseling voorafgaande aan het pleidooi nadrukkelijker is gegaan over directe inbreuk. Het verweer van Sun tegen de vorderingen van Novartis is ook eerst ter zitting in de sleutel van de uitspraak van Arnold J geplaatst (vgl. r.o. 4.45.). Beide partijen hebben zich noch in de kort geding-procedures noch eerder in deze procedure over en weer bekommerd om de vraag of indirecte inbreuk op een Swiss-type claim überhaupt – in octrooi-technische zin – wel mogelijk is. Het thans gevoerde verweer is ook niet in de procedure bij het hof Den Haag aan de orde gekomen, zo heeft Sun desgevraagd aangegeven. De uitspraak van Arnold J van 21 januari 2015 vormde de katalysator voor partijen het debat over een andere boeg te gooien. Na de mondelinge behandeling is daar nog bijgekomen de uitspraak van de Court of Appeal van 28 mei 2015 (vgl. 2.25.) en de uitspraak van Justice Arnold van 10 september 2015 (vgl. 2.26.) met de inhoud waarvan de rechtbank ambtshalve bekend is.
4.62.
Hoewel in deze zaak wordt geprocedeerd volgens het VRO-regime, waarin in de regel de mondelinge behandeling het sluitstuk van het debat vormt, ziet de rechtbank in de bijzondere omstandigheden van dit geval, aanleiding een nadere schriftelijke ronde te gelasten.
4.63.
Daarbij speelt mee dat de vraag hoe moet worden geoordeeld over inbreuk op Swiss-type claims (met kwesties als wetenschap over de bestemming van het geneesmiddel, wie geldt als bereider etc.), zoals beide partijen ook hebben benadrukt, ook voor toekomstige zaken (er staan nog een flink aantal geneesmiddelen onder octrooi waarvan de conclusies op Zwitserse wijze zijn opgesteld) van belang is. De markt is er bij gebaat als er duidelijkheid zou worden gegeven over de beschermingsomvang van dergelijke claims, zo is door beide partijen betoogd. In dat opzicht zou het enerzijds vanuit een rechtsvormende gedachte zeer ongelukkig zijn als partijen zich hierover niet in twee instanties zouden kunnen uitlaten. Anderzijds is, zoals de Engelse rechters ook overwogen (‘this is a developing area of law’), het debat over inbreuk op Swiss-type claims bepaald niet uitgekristalliseerd.
4.64.
Dat de rechtbank uiteindelijk tot het oordeel zou kunnen komen dat Sun direct inbreuk maakt op conclusie 7 van EP 689 is op voorhand dan ook niet uit te sluiten. Die omstandigheid draagt eveneens bij aan de beslissing het debat deels te heropenen. Ook Sun is er immers niet bij gebaat dat zij nu, indachtig het oordeel van de rechtbank over indirecte inbreuk op Swiss- type claims, mogelijk de markt (ook) voor de geoctrooieerde indicatie zou willen betreden maar op een later moment, bijvoorbeeld in kort geding, in verband daarmee op grond van directe inbreuk zou worden teruggefloten.
4.65.
Dat deze al aan vertraging onderhevige VRO-procedure nog verder vertraging zal oplopen, is naar het oordeel van de rechtbank in het licht van het voorgaande onvoldoende reden om van een nadere aktewisseling af te zien.
4.66.
Het debat zal worden beperkt tot directe inbreuk op conclusie 7 van EP 689 nu Sun terecht heeft aangevoerd dat de ook gestelde (in)directe inbreuk op conclusie 1 van EP 689 (die van conclusie 7 verschilt in het kenmerk dat de periode tussen toedieningen ten minste ongeveer 6 maanden bedraagt en niet ongeveer één keer per jaar) niet is onderbouwd. Voor zover de vorderingen van Novartis in reconventie daarop zijn gebaseerd, zullen zij bij eindvonnis worden afgewezen.
Verdere gang van zaken
4.67.
Uit het voorgaande volgt dat partijen in reconventie in de gelegenheid worden gesteld zich bij akte uit te laten over de vraag of Sun directe inbreuk op conclusie 7 van EP 689 kan worden verweten. Novartis zal eerst een akte kunnen nemen en daarin haar stellingen ter zake preciseren, waarna Sun haar verweer op dit punt in een antwoord-akte nader kan adstrueren. De zaak wordt verwezen naar de rol van 6 januari 2016 voor akte aan de zijde van Novartis en vervolgens voor een periode van zes weken nadien voor antwoordakte aan de zijde van Sun. Het staat partijen vrij om hun akte, zo zij dit wensen, op een eerdere rolzitting te nemen.
4.68.
Iedere verdere beslissing in reconventie wordt aangehouden.
5. De beslissing
De rechtbank
in conventie
5.1.
houdt iedere beslissing aan;
in reconventie
5.2.
verwijst de zaak naar de rolzitting van woensdag 6 januari 2016 voor akte aan de zijde van Novartis ten aanzien van het in r.o. 4.67. beschreven doel;
5.3.
bepaalt dat Sun op de rolzitting van woensdag 17 februari 2016 een antwoordakte mag nemen;
5.4.
houdt iedere verdere beslissing aan.
Dit vonnis is gewezen door mr. J.Th. van Walderveen, mr. M. Knijff en mr. M.P.M. Loos en in het openbaar uitgesproken op 25 november 2015 in tegenwoordigheid van de griffier.
Voetnoten
Voetnoten Uitspraak 25‑11‑2015
Dit is mogelijk op grond van artikel 3 aanhef onder b van Verordening (EG) nr. 726/2004 van het Europees Parlement en de Raad van 31 maart 2004 tot vaststelling van communautaire procedures voor het verlenen van vergunningen en het toezicht op geneesmiddelen voor menselijk en diergeneeskundig gebruik en tot oprichting van een Europees Geneesmiddelenbureau.
Positum 43 conclusie van antwoord in reconventie Sun.
Section 60(2) van de Patent Act 1977 is een met artikel 73 Rijksoctrooiwet 1995 vergelijkbare bepaling aangaande indirecte inbreuk.
Verdrag van 30 oktober 2007, PbEU 2009, L 147.
Verordening (EG) nr. 44/2001 betreffende de rechterlijke bevoegdheid, de erkenning en de tenuitvoerlegging van beslissingen in burgerlijke en handelszaken. Deze verordening is in deze procedure nog van kracht omdat de dagvaarding niet is uitgebracht ná 10 januari 2015 (in welk geval de herschikte EEX-Vo 1215/2012 van toepassing zou zijn).
Partijen zijn het erover eens dat indien geen prioriteit ingeroepen kan worden op grond van het tweede prioriteitsdocument (US 689) er ook geen prioriteit kan worden ingeroepen op grond van het eerste prioriteitsdocument (US 135).
In het debat over de geldigheid van de ingeroepen prioriteit hebben beide partijen niet de (door Sun als productie 32 overgelegde) oorspronkelijke aanvrage, maar (de materie van conclusie 7 van) het verleende en nadien beperkte octrooi (i.e. de B3-versie) vergeleken met het prioriteitsdocument.
Zie de Enlarged Board of Appeal van het Europees Octrooibureau in G 0002/98 en de uitspraak van de Technical Board of Appeal in T 190/99.
Zie de uitspraken van de Technical Board van het Europees Octrooibureau in T 0903/05 en T 609/02 en Hof Den Haag 2 november 2010, Glaxo Group v Pharmachemie, ECLI:NL:GHSGR:2010:BO4380, r.o. 29 onder verwijzing naar T 609/02.
Dit blijkt volgens Sun uit een overzichtsartikel van Sorbera uit 2000 (bijlage 22 bij de verklaring van partijdeskundige Pazianas - vgl. positum 97 dagvaarding/paragraaf 68 pleitnota Sun), waarin klinische studies met zoledronaat worden besproken waarbij het zoledronaat steeds zonder uitzondering intraveneus werd toegediend.
Gerechtshof Den Haag 26 februari 2013, ECLI:NL:GHDHA:2013: BZ1902 (Danisco/Novozymes) en Hof van Justitie EU, 15 november 2012, C-180/11 (Bericap v Plastinnova)
A. Benyamini, Patent Infringement in the European Community, 1993, IIC Studies, p. 94.
EPC 2000 is in werking getreden op 13 december 2007.
Grote Kamer van Beroep van het EOB in G2/08 (Abbott Respiratory), OJ 2010, 456.
Technische Kamer van Beroep van het EOB in T 1780/12 University of Texas Board of Regents/Cancer treatment [2014], par. 18‑27.
Paragraaf 100 pleitnota Novartis.
Conclusie 1 ziet op een periode tussen toedieningen van ten minste ongeveer 6 maanden; zie ook hierna r.o. 4.62.
Zie ook Benyamini, p. 95: The question, however, is whether the patentee can prevent the marketing of a medicament packaged and labeled for the second indication. The only way to do this is to treat such a medicament as ‘a product obtained directly by a process which is the subject-matter of the patent’ within the meaning of Art. 25(c) CPC [i.e. het nimmer in werking getreden Community Patent Convention, waar de regeling over de indirecte inbreuk (zoals bij ons: artikel 73 ROW) van afkomstig is, rb] and Art. 64(2) EPC. (…) The making of the medicament for the second indication will amount to a direct infringement under Art. 25(b), while offering, or putting on the market the medicament, or its importation or stocking for these purposes, will comprise a direct infringement under Art. 25(c).
De rechtbank is ambtshalve bekend met het vonnis van 10 september 2015. Partijen hebben zich daarover niet uit kunnen laten maar Justice Arnold heeft daarin op het punt van indirecte inbreuk hetzelfde standpunt ingenomen als in zijn eerdere vonnissen van 21 januari en 6 februari 2015 (waarover partijen zich wel hebben uitgelaten).