Einde inhoudsopgave
Verordening (EG) Nr. 648/2004 betreffende detergentia
Bijlage VIII Test- en analysemethoden
Geldend
Geldend vanaf 08-10-2005
- Bronpublicatie:
31-03-2004, PbEU 2004, L 104 (uitgifte: 08-04-2004, regelingnummer: 648/2004)
- Inwerkingtreding
08-10-2005
- Bronpublicatie inwerkingtreding:
31-03-2004, PbEU 2004, L 104 (uitgifte: 08-04-2004, regelingnummer: 648/2004)
- Vakgebied(en)
Milieurecht / Milieugevaarlijke stoffen
EU-recht / Marktintegratie
De lidstaten gebruiken de volgende test- en analysemethoden voor hun controle op detergentia die in de handel zijn:
- 1.
Referentiemethode (bevestigingstest)
- 1.1.
Definitie
Deze methode beschrijft een laboratoriummodel van een actiefslibinstallatie + nabezinktank dat is bedoeld als simulatie van een gemeentelijke rioolwaterzuivering. De beschreven omstandigheden zijn die van richtlijnen die aan deze verordening vooraf zijn gegaan. Op deze testmethode kunnen verbeterde, geavanceerde bedrijfsomstandigheden worden toegepast, als beschreven in EN ISO 11733.
- 1.2.
Benodigde uitrusting
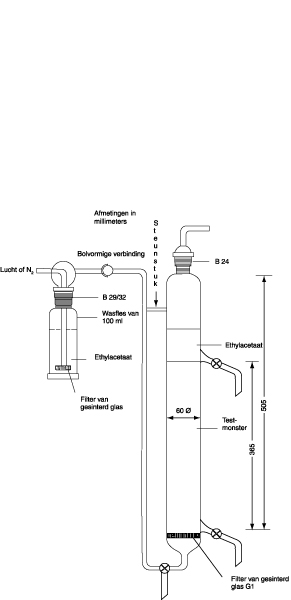
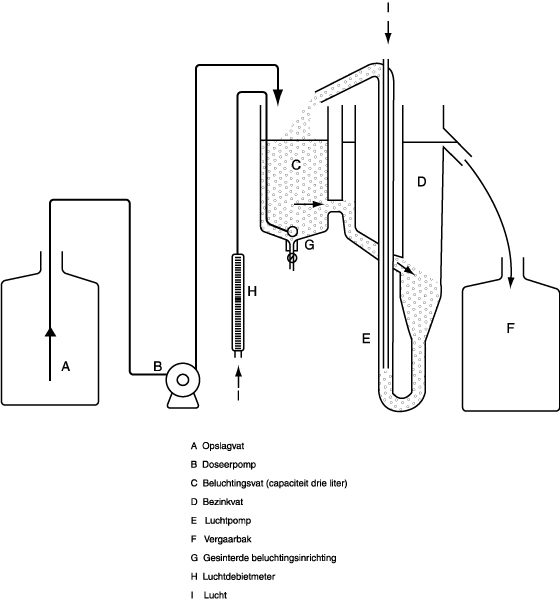
De meetmethode is gebaseerd op het gebruik van een kleine actiefslibinstallatie, die in figuur 1 schematisch is afgebeeld en in figuur 2 gedetailleerder is weergegeven. De apparatuur bestaat uit een afvalwatervat A voor kunstmatig afvalwater, een doseerpomp B, een beluchtingsvat C, een bezinkvat D, een luchtpomp E voor de terugvoer van actief slib en een vergaarbak F voor het opvangen van het behandelde afvalwater.
De vaten A en F moeten van glas of geschikte kunststof zijn gemaakt en een inhoud van ten minste 24 liter hebben. Pomp B zorgt voor regelmatige toevoer van kunstmatig afvalwater naar het beluchtingsvat; bij normaal bedrijf moet dit vat drie liter van het mengsel bevatten. Een plaatje G van gesinterd glas voor de beluchting hangt in vat C op het laagste punt. De hoeveelheid via de beluchtingsinrichting ingeblazen lucht wordt gecontroleerd met een debietmeter H.
- 1.3.
Kunstmatig afvalwater
Voor deze test wordt kunstmatig afvalwater gebruikt. Los per liter leidingwater onderstaande stoffen op:
- —
160 mg pepton;
- —
110 mg vleesextract;
- —
30 mg ureum, CO(NH2)2;
- —
7 mg natriumchloride, NaCl;
- —
4 mg calciumchloride, CaCl2.2H2O;
- —
2 mg magnesiumsulfaat, MgSO4.7H2O;
- —
28 mg dikaliumwaterstoffosfaat, K2HPO4;
- —
en 10 ± 1 mg van de oppervlakteactieve stof.
Het kunstmatige afvalwater wordt elke dag vers bereid.
- 1.4.
Bereiding van de monsters
Niet-samengestelde oppervlakteactieve stoffen worden als zodanig getest. Het actieve gehalte van monsters van de oppervlakteactieve stof moet worden bepaald voor het bereiden van het kunstmatige afvalwater (1.3).
- 1.5.
Werking van de installatie
Om te beginnen worden het beluchtingsvat C en het bezinkvat D gevuld met het kunstmatige afvalwater. Bezinkvat D moet op zodanige hoogte zijn aangebracht dat beluchtingsvat C drie liter water bevat. Inoculatie geschiedt door inbrengen van 3 ml secundair afvalwater van goede kwaliteit, dat vers verzameld is uit een zuiveringsinstallatie die overwegend huishoudelijk afvalwater zuivert. Dit afvalwater moet tussen monsterneming en toepassing onder aërobe omstandigheden worden bewaard. Vervolgens worden beluchtingsinrichting G, luchtpomp E en doseerpomp B in werking gesteld. Het kunstmatige afvalwater moet met een debiet van één liter per uur in beluchtingsvat C stromen; het afvalwater blijft daardoor gemiddeld drie uur in het vat.
De beluchting moet zodanig worden geregeld dat de inhoud van vat C constant in suspensie blijft en het gehalte aan opgeloste zuurstof ten minste 2 mg per liter bedraagt. Schuimvorming moet met geschikte middelen worden tegengegaan. Er mogen evenwel geen antischuimmiddelen worden gebruikt die een remmende werking uitoefenen op het actieve slib of die oppervlakteactieve stoffen bevatten. Luchtpomp E moet zodanig worden ingesteld dat in beluchtingsvat C een doorlopende en regelmatige terugvoer ontstaat van het uit het bezinkvat komende actieve slib. Het zich ophopende slib boven in beluchtingsvat C, onder in bezinkvat D of in het omloopcircuit moet ten minste eenmaal per dag weer in circulatie worden gebracht door roeren of ieder ander geschikt middel. Wanneer het slib niet bezinkt, kan het bezinken ervan worden bevorderd door eventueel herhaalde toevoeging van hoeveelheden van 2 ml van een 5 % ferrichlorideoplossing.
Het uit bezinkvat D stromende water wordt gedurende 24 uur in vat F opgevangen; na verloop van deze tijd wordt een monster getrokken na homogenisatie van het mengsel. Vat F moet dan zorgvuldig worden gereinigd.
- 1.6.
Controle op de meetinrichting
Het gehalte aan oppervlakteactieve stof (in mg/liter) van het kunstmatige afvalwater wordt onmiddellijk voor het gebruik bepaald.
Het gehalte aan oppervlakteactieve stof (in mg/liter) van het uitstromende water dat gedurende 24 uur in vat F is opgevangen moet onmiddellijk na monstername op dezelfde wijze analytisch worden bepaald; anders moeten de monsters worden geconserveerd, bij voorkeur door bevriezing. De concentraties moeten worden bepaald op 0,1 mg/liter oppervlakteactieve stof nauwkeurig.
Ter controle van de goede werking van het proces wordt ten minste tweemaal per week het chemisch zuurstofverbruik (CZV) of de opgeloste organische koolstof (DOC) van het zich in vat F bevindende uitstromende door glasvezel gefiltreerde water en van het in vat A opgeslagen gefiltreerde kunstmatige afvalwater gemeten.
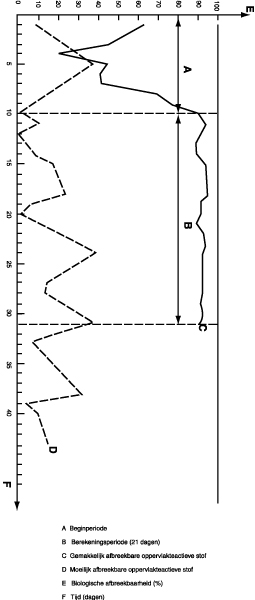
De afname van CZV of DOC moet zich stabiliseren wanneer de dagelijkse biologische afbraak van de oppervlakteactieve stof min of meer regelmatig is, dat wil zeggen aan het eind van de in figuur 3 aangegeven beginperiode.
Het gehalte aan droge stof van het actieve slib in het beluchtingsvat moet tweemaal per week worden bepaald (in g/liter). Wanneer dit meer dan 2,5 g/liter bedraagt moet de overmaat aan actief slib worden verwijderd.
De afbreekbaarheidstest wordt uitgevoerd bij kamertemperatuur; deze temperatuur moet gelijkmatig zijn en gehouden worden tussen 19 en 24 ° C.
- 1.7.
Berekening van de biologische afbreekbaarheid
Het percentage van biologische afbraak van de oppervlakteactieve stof moet dagelijks worden berekend op basis van het gehalte aan oppervlakteactieve stof (uitgedrukt in mg/liter) van het kunstmatige afvalwater en van de overeenkomstige uitloop in vat F.
De aldus verkregen waarden moeten in een grafiek worden weergegeven als geïllustreerd in figuur 3.
De biologische afbreekbaarheid van de oppervlakteactieve stof wordt berekend als het rekenkundig gemiddelde van de verkregen waarden over 21 dagen volgend op de begin- en acclimatiseringsperiode, gedurende welk tijdvak de biologische afbraak regelmatig moet zijn geweest en de installatie zonder onderbreking goed moet hebben gefunctioneerd. In geen geval mag de beginperiode meer dan zes weken bedragen.
De dagelijkse biologische afbraakwaarden moeten tot op 0,1 % nauwkeurig worden berekend, maar het eindresultaat wordt op het laatste gehele getal afgerond.
In sommige gevallen kan de frequentie van de monsterneming worden verminderd, maar voor de berekening van het gemiddelde moeten ten minste 14 resultaten van monsters worden gebruikt die in de periode van 21 dagen volgend op de beginperiode zijn verzameld.
- 2.
Bepaling van anionogene oppervlakteactieve stoffen bij biologische afbreekbaarheidtests
- 2.1.
Principe
Bij deze methode wordt uitgegaan van het feit dat de kationogene kleurstof methyleenblauw met anionogene oppervlakteactieve stoffen blauwe complexen vormt (MBAS) die met chloroform kunnen worden geëxtraheerd. Om storing te voorkomen wordt eerst geëxtraheerd uit de alkalische oplossing, waarna het extract met de zure methyleenblauwoplossing wordt geschud. De extinctie van de afgescheiden organische fase wordt fotometrisch gemeten bij de golflengte van de maximale extinctie (650 nm) van het complex.
- 2.2.
Reagentia en apparatuur
- 2.2.1.
Bufferoplossing pH 10
Los 24 g natriumbicarbonaat, NaHCO3 p.a., en 27 g watervrij natriumcarbonaat (Na2CO3) p.a. in gedeïoniseerd water op en vul aan tot 1 000 ml.
- 2.2.2.
Neutrale methyleenblauwoplossing
Los 0,35 g methyleenblauw p.a. in gedeïoniseerd water op en vul aan tot 1 000 ml. Bereid de oplossing ten minste 24 uur voor het gebruik. De extinctie van de blanco chloroformfase, gemeten tegen chloroform, mag niet meer bedragen dan 0,015 per cm dikte van de laag bij 650 nm.
- 2.2.3.
Zure methyleenblauwoplossing
Los 0,35 g methyleenblauw p.a. in 500 ml gedeïoniseerd water op en meng met 6,5 ml H2SO4 (d = 1,8 g/ml). Vul met gedeïoniseerd water aan tot 1 000 ml. Bereid de oplossing ten minste 24 uur voor het gebruik. De extinctie van de blanco chloroformfase, gemeten tegen chloroform, mag niet meer bedragen dan 0,015 per cm dikte van de laag bij 650 nm.
- 2.2.4.
Chloroform (trichloormethaan) p.a., vers gedestilleerd
- 2.2.5.
Dodecylbenzeensulfonzuurmethylester
- 2.2.6.
Oplossing van kaliumhydroxyde in ethanol, KOH 0,1 M
- 2.2.7.
Zuiver ethanol, C2H5OH
- 2.2.8.
Zwavelzuur, H2SO4 0,5 M
- 2.2.9.
Fenolftaleïenoplossing
Los 1 g fenolftaleïen in 50 ml ethanol op en voeg onder voortdurend roeren 50 ml gedeïoniseerd water toe. Filtreer de oplossing.
- 2.2.10.
Zoutzuur in methanol: 250 ml zoutzuur p.a. en 750 ml methanol
- 2.2.11.
Scheitrechter van 250 ml
- 2.2.12.
Maatkolf van 50 ml
- 2.2.13.
Maatkolf van 500 ml
- 2.2.14.
Maatkolf van 1 000 ml
- 2.2.15.
Kolf met ronde bodem van 250 ml, met ingeslepen stop en terugvloeikoeler; kooksteentjes
- 2.2.16.
pH-meter
- 2.2.17.
Fotometer voor metingen bij 650 nm, met cuvetten van 1 tot 5 cm
- 2.2.18.
Kwalitatief filterpapier
- 2.3.
Procedure
De analysemonsters mogen niet door een schuimlaag worden genomen.
Na en grondige reiniging met water moet de bij de analyse gebruikte apparatuur grondig met een oplossing van zoutzuur in methanol (2.2.10) en vervolgens met gedeïoniseerd water voor het gebruik worden uitgespoeld.
Filtreer de te onderzoeken in- en uitloop van de actiefslibinstallatie onmiddellijk na de monsterneming. Gooi de eerste 100 ml van de filtraten weg.
Breng een afgemeten, zo nodig geneutraliseerde hoeveelheid van het monster in een scheitrechter van 250 ml (2.2.11). De hoeveelheid monster moet tussen de 20 en de 150 μg MBAS bevatten. Bij een lager MBAS-gehalte kan tot 100 ml van het monster worden gebruikt. Bij gebruik van minder dan 100 ml moet met gedeïoniseerd water tot 100 ml worden aangevuld. Voeg aan het monster 10 ml van de bufferoplossing (2.2.1), 5 ml van de neutrale methyleenblauwoplossing (2.2.2) en 15 ml chloroform (2.2.4) toe. Schud het mengsel gelijkmatig en niet te krachtig gedurende 1 minuut. Laat na de scheiding van de fasen de chloroformlaag in een tweede scheitrechter lopen, die 110 ml gedeïoniseerd water en 5 ml zure methyleenblauwoplossing (2.2.3) bevat. Schud het mengsel gedurende 1 minuut. Laat de chloroformlaag over een van tevoren met alcohol gewassen en met chloroform bevochtigd wattenfilter percoleren in een maatkolf (2.2.12).
Extraheer de alkalische en zure oplossingen driemaal, bij de tweede en derde extractie met 10 ml chloroform. Filtreer de verenigde chloroformextracten over dezelfde wattenfilter en vul met de chloroform die voor het nawassen van de watten werd gebruikt tot de streep aan in de kolf van 50 ml (2.2.12). Meet de extinctie van de chloroformoplossing met een fotometer bij 650 nm in cuvetten van 1 tot 5 cm tegen chloroform. Pas de gehele procesgang toe op een blancobepaling.
- 2.4.
IJkcurve
Bereid een ijkoplossing uit de standaardstof dodecylbenzeensulfonzuurmethylester (tetrapropyleen type PM 340) na omzetting in het kaliumzout. De MBAS wordt uitgedrukt als natriumdodecylbenzeensulfonaat (PM 348).
Weeg 400 tot 450 mg dodecylbenzeensulfonzuurmethylester (2.2.5) tot op 0,1 mg nauwkeurig in een kolf met ronde bodem en voeg 50 ml van de oplossing van kaliumhydroxide in ethanol (2.2.6), alsmede enkele kooksteentjes toe. Laat na aanbrenging van de terugvloeikoeler 1 uur koken. Was na het koelen de koeler en het verbindingsstuk van geslepen glas met ongeveer 30 ml ethanol en voeg de wasvloeistof toe aan de inhoud van de kolf. Titreer de oplossing met zwavelzuur tegen fenolftaleïen totdat deze kleurloos is. Breng deze oplossing over in een maatkolf van 1 000 ml (2.2.14), vul met gedeïoniseerd water aan tot de streep en meng.
Een deel van deze oppervlakteactieve voorraadoplossing wordt daarna verder verdund. Neem 25 ml af, breng deze over in een maatkolf van 500 ml (2.2.13), vul met gedeïoniseerd water tot de streep en meng.
Deze standaardoplossing bevat: (E × 1,023 mg MBAS per ml,)/20 000
waarbij: E = gewicht van het monster in mg.
Neem voor de ijkcurve achtereenvolgens hoeveelheden van 1, 2, 4, 6 en 8 ml van de standaardoplossing en vul telkens met gedeïoniseerd water aan tot 100 ml. Ga vervolgens te werk zoals in punt 2.3 is beschreven, met inbegrip van een blancobepaling.
- 2.5.
Berekening van de resultaten
De hoeveelheid anionogene oppervlakteactieve stof (MBAS) in het monster wordt afgelezen van de ijkcurve (2.4). Het MBAS-gehalte van het monster wordt verkregen aan de hand van de volgende formule: (mg MBAS × 1 000)/V = MBAS mg/1
waarbij: V = de gebruikte hoeveelheid monster in ml.
Geef de resultaten weer in natriumdodecylbenzeensulfonaat (PM 348).
- 2.6.
Weergave van de resultaten
Geef de resultaten weer in MBAS mg/liter en wel tot op 0,1 mg/liter nauwkeurig.
- 3.
Bepaling van niet-ionogene oppervlakteactieve stoffen bij biologische afbreekbaarheidstests
- 3.1.
Principe
De oppervlakteactieve stoffen worden door gasstripping geconcentreerd en geïsoleerd. Bij het gebruikte monster moet de hoeveelheid niet-ionogene oppervlakteactieve stoffen gelegen zijn tussen 250 en 800 μg.
De gestripte oppervlakteactieve stof wordt in ethylacetaat opgelost.
Na faseafscheiding en verdamping van het oplosmiddel wordt de niet-ionogene oppervlakteactieve stof in een oplossing in water geprecipiteerd door toevoeging van gewijzigd Dragendorff-reagens (KBiI4 + BaCl2 + ijsazijn).
Het precipitaat wordt gefiltreerd, met ijsazijn gewassen en in een ammoniumtartraatoplossing opgelost. Het bismut in de oplossing wordt potentiometrisch getitreerd met een pyrolidinedithiocarbamaatoplossing (pH 4–5), waarbij gebruik wordt gemaakt van een blank-platina-indicatorelektrode en een kalomel- of zilver/zilverchloridereferentie-elektrode. De methode is van toepassing op niet-ionogene oppervlakteactieve stoffen die 6–30 alkeenoxydegroepen bevatten.
Het resultaat van de titratie wordt met de empirische factor 54 vermenigvuldigd voor omzetting in de referentiestof nonylfenol, gecondenseerd met 10 mol ethyleenoxyde (NP 10).
- 3.2.
Reagentia en apparatuur
Reagentia moeten worden aangelengd met gedeïoniseerd water.
- 3.2.1.
Zuiver ethylacetaat, vers gedestilleerd
- 3.2.2.
Natriumbicarbonaat, NaHCO3 p.a.
- 3.2.3.
Verdund zoutzuur [20 ml geconcentreerd zoutzuur (HCl), verdund tot 1 000 ml met water.]
- 3.2.4.
Methanol p.a., vers gedestilleerd en in een glazen fles bewaard
- 3.2.5.
Broomkresolpurper, 0,1 g in 100 ml methanol
- 3.2.6.
Neerslagmiddel: het neerslagmiddel is een mengsel van twee volumedelen oplossing A en een volumedeel oplossing B. Het mengsel wordt in een bruine fles bewaard en kan tot een week na de vermenging worden gebruikt.
- 3.2.6.1.
Oplossing A
Los 1,7 g basisch bismutnitraat, BiONO3.H2O p.a., in 20 ml ijsazijn op en vul aan met water tot 100 ml. Los vervolgens 65 g kaliumjodide p.a. in 200 ml water op. Vermeng deze twee oplossingen in een maatkolf van 1 000 ml, voeg aan het mengsel 200 ml ijsazijn (3.2.7) toe en vul aan met water tot 1 000 ml.
- 3.2.6.2.
Oplossing B
Los 290 g bariumchloride, BaCl2.2H2O p.a., op in 1 000 ml water.
- 3.2.7.
IJsazijn 99-100 % (lagere concentraties zijn ongeschikt)
- 3.2.8.
Ammoniumtartraatoplossing: vermeng 12,4 g wijnsteenzuur p.a. en 12,4 ml ammoniumoplossing p.a. (d = 0,910 g/ml) en vul tot 1 000 ml aan met water (of gebruik een equivalente hoeveelheid ammoniumtartraat p.a.).
- 3.2.9.
Verdunde ammoniakoplossing: 40 ml ammoniakoplossing p.a. (d = 0,910 g/ml) die met water wordt verdund tot 1 000 ml.
- 3.2.10.
Acetaatbuffer: los in een bekerglas 40 g vast natriumhydroxyde p.a. in 500 ml water op en laat afkoelen. Voeg hieraan 120 ml ijsazijn (3.2.7) toe. Meng grondig, laat afkoelen en giet over in een maatkolf van 1 000 ml. Vul tot de streep aan met water.
- 3.2.11.
Pyrolidinedithiocarbamaatoplossing (staat bekend als ‘carbaatoplossing’): los 103 mg natriumpyrolidinedithiocarbamaat, C5H8NNaS2.2H2O, in ongeveer 500 ml water op, voeg er 10 ml n-amylalcohol p.a. en 0,5 g NaHCO3 p.a. aan toe en vul aan tot 1 000 ml met water.
- 3.2.12.
Kopersulfaatoplossing (voor standaardisatie van 3.2.11).
VOORRAADOPLOSSING
Meng 1 249 g kopersulfaat, CuSO4.5H2O p.a., met 50 ml 0,5 M zwavelzuur en vul aan tot 1 000 ml met water.
STANDAARDOPLOSSING
Meng 50 ml voorraadoplossing met 10 ml 0,5 M H2SO4 en vul aan tot 1 000 ml met water.
- 3.2.13.
Natriumchloride p.a.
- 3.2.14.
Gasstripper (zie figuur 5)
De diameter van de schijf van gesinterd materiaal moet gelijk zijn aan de binnendiameter van de cilinder.
- 3.2.15.
Scheitrechter van 250 ml
- 3.2.16.
Magneetroerder met magneet van 25-30 mm
- 3.2.17.
Goochkroes, diameter van de geperforeerde bodem = 25 mm, type G4
- 3.2.18.
Rond filtreerpapier van glasvezel, diameter 27 mm met vezeldiameter 0,3–1,5 m
- 3.2.19.
Twee filtreerkolven met verbindingsstuk en rubberhals, van respectievelijk 500 ml en 250 ml
- 3.2.20.
Registrerende potentiometer met een blank-platina-indicatorelektrode en een kalomel- of zilver/zilverchloridereferentie-elektrode met een meetgebied van 250 mV en met een automatische buret met een inhoud van 20–25 ml, of soortgelijke, met de hand bediende apparatuur
- 3.3.
Methode
- 3.3.1.
Concentratie en afscheiding van de oppervlakteactieve stof
Filtreer het waterige monster over kwalitatief filtreerpapier. Gooi de eerste 100 ml van het filtraat weg.
Breng in de stripper, na spoeling met ethylacetaat, een zodanig afgemeten hoeveelheid van het monster dat dit 250–800 g niet-ionogene oppervlakteactieve stof bevat.
Voeg hieraan, om de afscheiding te bevorderen, 100 g natriumchloride en 5 g natriumbicarbonaat toe.
Indien het volume van het monster meer dan 500 ml bedraagt, moeten deze zouten in vaste vorm aan de stripper worden toegevoegd en een en ander worden opgelost door stikstof of lucht door het apparaat te laten stromen.
Indien gebruik wordt gemaakt van een kleiner monster, moeten de zouten in 400 ml water worden opgelost en vervolgens aan de stripper worden toegevoegd.
Voeg water toe om het niveau tot aan de bovenste afsluiter te brengen.
Voeg voorzichtig een laag van 100 ml ethylacetaat toe boven het water.
Vul de wasfles in de gasleiding (stikstof of lucht) voor tweederde met ethylacetaat.
Laat een gasstroom van 30–60 liter/uur door de stripper gaan; hierbij verdient het aanbeveling een debietmeter te gebruiken. De doorstroomsnelheid moet in het begin geleidelijk worden opgevoerd. De gastoevoersnelheid moet zodanig zijn geregeld dat de fasen merkbaar gescheiden blijven om de vermenging van de fasen en de oplossing van het ethylacetaat in het water zo klein mogelijk te houden. Sluit de gasstroom na vijf minuten.
Indien er een vermindering van het volume van de organische fase door oplossing in water met meer dan 20 % plaatsvindt, moet het verwijderen worden herhaald met een zwakkere gasstroom.
Laat de organische fase in een scheitrechter aflopen. Breng het water in de scheitrechter dat afkomstig is van de waterige fase — dit mag slechts een hoeveelheid van enkele ml zijn — terug in de stripper. Filtreer de ethylacetaatfase over droog kwalitatief filtreerpapier in een bekerglas van 250 ml.
Breng nog 100 ml ethylacetaat in de stripper en laat er opnieuw gedurende vijf minuten stikstof of lucht doorstromen. Laat de organische fase afvloeien in de scheitrechter waarvan gebruik werd gemaakt bij de eerste scheiding, werp de waterige fase weg en laat de organische fase door dezelfde filter stromen als de eerste ethylacetaathoeveelheid. Spoel zowel scheitrechter als filter uit met 20 ml ethylacetaat.
Damp het ethylacetaatextract volledig in met behulp van een waterbad (zuurkast). Laat een lichte luchtstroom over het oppervlak van de oplossing gaan om de verdamping te bespoedigen.
- 3.3.2.
Precipitatie en filtratie
Los het droge residu van 3.3.1 in 5 ml methanol op, voeg 40 ml water en 0,5 ml verdund HCl (3.2.3) toe en roer het mengsel om met een magneetroerder.
Voeg aan deze oplossing 30 ml neerslagmiddel (3.2.6) uit een maatcilinder toe. Het precipitaat vormt zich na herhaald roeren. Laat het mengsel na tien minuten roeren ten minste vijf minuten staan.
Filtreer het mengsel door een Goochkroes, waarvan de bodem bedekt is met filtreerpapier van glasvezel. Was eerst de filter onder afzuiging met ongeveer 2 ml ijsazijn. Was vervolgens het bekerglas, de magneet en de kroes grondig met ijsazijn, waarvan men ongeveer 40–50 ml nodig heeft. Het is niet noodzakelijk het precipitaat dat aan de wanden van het bekerglas kleeft kwantitatief in de filter over te brengen, omdat de oplossing van het precipitaat voor de titratie weer in het bij de precipitatie gebruikte bekerglas wordt overgebracht en het resterende precipitaat daarna opgelost zal worden.
- 3.3.3.
Oplossing van het precipitaat
Los het precipitaat op in de filterkroes door toevoeging van de hete (ongeveer 80 ° C) ammoniumtartraatoplossing (3.2.8) in drie gedeelten van elk 10 ml. Laat elk gedeelte enkele minuten in de kroes staan alvorens het door de filter wordt afgezogen in de fles.
Breng de inhoud van de filtreerkolf in het bekerglas waarvan gebruik werd gemaakt bij de precipitatie. Spoel de wanden van het bekerglas af met nogmaals 20 ml tartraatoplossing om de rest van het precipitaat op te lossen.
Was de kroes, het verbindingsstuk en de filtreerkolf zorgvuldig met 150–200 ml water en breng het spoelwater terug in het bekerglas dat bij de precipitatie werd gebruikt.
- 3.3.4.
Titratie
Roer de oplossing om met een magneetroerder (3.2.16), voeg er enkele druppels broomkresolpurper (3.2.5) aan toe en vervolgens de verdunde ammoniakoplossing (3.2.9) totdat de oplossing een paarse kleur vertoont (de oplossing is aanvankelijk zwak zuur door het azijnzuurresidu waarvan gebruik werd gemaakt bij het uitspoelen).
Voeg vervolgens 10 ml acetaatbuffer (3.2.10) toe, dompel de elektroden in de oplossing en titreer potentiometrisch met standaard ‘carbaatoplossing’ (3.2.11), waarbij het uiteinde van de buret in de oplossing is ondergedompeld.
De titreersnelheid mag niet meer bedragen dan 2 ml/min.
Het eindpunt wordt gevormd door het snijpunt van de raaklijnen aan de twee takken van de potentiaalkromme.
Soms vervlakt de buiging in de potentiaalkromme; dit kan worden voorkomen door zorgvuldige reiniging van de platina-elektrode (schuren met amarilpapier).
- 3.3.5.
Blancobepalingen
Pas tegelijkertijd de gehele procesgang toe op een blancobepaling met 5 ml methanol en 40 ml water, overeenkomstig de instructies die in punt 3.3.2 zijn gegeven. Bij titratie moet men beneden de 1 ml blijven omdat anders de zuiverheid van de reagentia (3.2.3, 3.2.7, 3.2.8, 3.2.9, 3.2.10), met name het gehalte ervan aan zware metalen, verdacht is en dan moeten zij worden vervangen. Met deze blancobepaling moet bij de berekening van de resultaten rekening worden gehouden.
- 3.3.6.
Bepaling van de factor van de ‘carbaatoplossing’
Bepaal dagelijks voor gebruik de factor van de carbaatoplossing. Titreer daarvoor 10 ml van de kopersulfaatoplossing (3.2.12) met ‘carbaatoplossing’ na toevoeging van 100 ml water en 10 ml acetaatbuffer (3.2.10). Indien de gebruikte hoeveelheid a ml is, dan is factor f: f (= 10)/a
Alle resultaten van de titratie moeten met deze factor worden vermenigvuldigd.
- 3.4.
Berekening van de resultaten
Elke niet-ionogene oppervlakteactieve stof heeft een eigen omrekeningsfactor, die wordt bepaald door zijn samenstelling, in het bijzonder de lengte van de alkeenoxydeketen. Het gehalte aan niet-ionogene oppervlakteactieve stof wordt gerelateerd aan een standaardstof — een nonylfenol met tien ethyleenoxyde-eenheden (NP 10) — waarvan de omrekeningsfactor 0,054 bedraagt.
Met behulp van deze factor wordt de hoeveelheid in het monster aanwezige oppervlakteactieve stof gevonden en in mg NP 10-equivalent uitgedrukt aan de hand van de volgende formule: (b - c)xfx0,054 = mg niet-ionogene oppervlakteactieve stof als NP 10
waarbij:
b = het volume ‘carbaatoplossing’ gebruikt voor het monster (ml),
c = het volume ‘carbaatoplossing’ gebruikt voor de blancobepaling (ml),
f = de factor van de ‘carbaatoplossing’.
- 3.5.
Weergave van de resultaten
Geef de resultaten weer in mg/liter als NP 10 en wel tot op 0,1 nauwkeurig.
- 4.
Voorbehandeling van de te onderzoeken anionogene oppervlakteactieve stoffen
- 4.1.
Inleiding
- 4.1.1.
Behandeling van de monsters
Op de anionogene oppervlakteactieve stoffen en detergentia moet de volgende behandeling worden toegepast voordat de biologische afbreekbaarheid wordt bepaald door middel van de bevestigingstest:
PRODUCTEN
BEHANDELING
Anionogene oppervlakteactieve stoffen
Geen
Detergentia
Alcoholextractie en vervolgens afscheiding van de anionogene oppervlakteactieve stoffen door ionenwisseling
Het doel van de alcoholextractie is het verwijderen van de onoplosbare en anorganische bestanddelen uit het handelsproduct; genoemde bestanddelen kunnen namelijk in sommige omstandigheden de biologische afbreekbaarheidstest verstoren.
- 4.1.2.
Ionenwisselingsproces
Voor een goede uitvoering van biologische afbreekbaarheidstests is het nodig de anionogene oppervlakteactieve stoffen uit zeep en uit niet-ionogene en kationogene oppervlakteactieve stoffen te isoleren en af te scheiden.
Een en ander wordt bereikt door toepassing van een ionenwisselingstechniek waarbij gebruik wordt gemaakt van macroporeus wisselingshars en van elutie. Zeep, anionogene en niet-ionogene oppervlakteactieve stoffen kunnen aldus in één proces worden afgezonderd.
- 4.1.3.
Analytische controle
Na homogenisatie wordt het gehalte aan anionogene oppervlakteactieve stoffen in het detergens bepaald volgens de MBAS-analysemethode. Het zeepgehalte wordt aan de hand van een geschikte analysemethode bepaald.
Deze analyse van de producten is noodzakelijk om de hoeveelheden te berekenen die nodig zijn om de fracties voor de biologische afbreekbaarheidstest te bereiden.
Kwantitatieve extractie is niet noodzakelijk; ten minste 80 % van de anionogene oppervlakteactieve stoffen moet echter worden geëxtraheerd. Doorgaans wordt 90 % of meer verkregen.
- 4.2.
Principe
Uit een homogeen monster (poeders, gedroogde pasta's en gedroogde vloeistoffen) wordt een ethanolextract verkregen, dat de oppervlakteactieve stoffen, zeep en andere in alcohol oplosbare bestanddelen van het monster van het detergens bevat.
Het ethanolextract wordt ingedampt en opgelost in een mengsel van isopropanol en water, waarna men de verkregen oplossing laat percoleren over een combinatie van een sterk zure kationenwisselaar en een macroporeuze anionenwisselaar, die tot 50 ° C wordt verhit. Deze temperatuur is noodzakelijk om precipitatie van vetzuren in zure media te voorkomen.
De niet-ionogene oppervlakteactieve stoffen blijven in de uitlopende vloeistof.
De zeep-vetzuren worden door extractie met CO2-bevattend ethanol afgescheiden. Daarna worden de anionogene oppervlakteactieve stoffen door elutie met een waterige oplossing van ammoniumbicarbonaat in isopropanol als ammoniumzouten verkregen. Deze ammoniumzouten worden gebruikt voor de afbreekbaarheidstest.
Kationogene oppervlakteactieve stoffen die de biologische afbreekbaarheidstest en het analyseproces zouden kunnen verstoren, worden verwijderd door de kationenwisselaar, die op de anionenwisselaar wordt geplaatst.
- 4.3.
Chemicaliën en apparatuur
- 4.3.1.
Gedeïoniseerd water
- 4.3.2.
Ethanol, 95 % (v/v) C2H5OH (toegestaan denatureringsmiddel: methylethylketon of methanol)
- 4.3.3.
Mengsel van isopropanol en water (50/50 v/v):
- —
50 volumedelen isopropanol, CH3CHOH.CH3, en
- —
50 volumedelen water (4.3.1).
- 4.3.4.
Oplossing van kooldioxide in ethanol (ongeveer 0,1 % CO2): laat via een afloopbuis met een ingebouwd gesinterd glasplaatje kooldioxide, CO2, over het ethanol (4.3.2) percoleren gedurende tien minuten. De oplossing moet onmiddellijk voor het gebruik worden bereid.
- 4.3.5.
Ammoniumbicarbonaatoplossing (60/40 v/v): 0,3 mol NH4HCO3 in 1 000 ml van een mengsel van isopropanol en water, bestaande uit 60 volumedelen isopropanol en 40 volumedelen water (4,3.1)
- 4.3.6.
Kationenwisselaar (KAT), sterk zuur, bestand tegen alcohol (50–100 mesh)
- 4.3.7.
Anionenwisselaar (AAT), macroporeus, Merck Lewatit MP 7080 (70–150 mesh) of equivalent
- 4.3.8.
Zoutzuur, 10 % HCl g/g
- 4.3.9.
Kolf met ronde bodem van 2 000 ml, met ingeslepen stop en terugvloeikoeler
- 4.3.10.
Zuigfilter met een diameter van 90 mm (verwarmbaar) voor papieren filters
- 4.3.11.
Filtreerkolf van 2 000 ml
- 4.3.12.
Wisselingskolommen met verhittingsmantel en kraan: binnenbuis: diameter 60 mm en hoogte 450 mm (zie figuur 4)
- 4.3.13.
Waterbad
- 4.3.14.
Vacuümdroogoven
- 4.3.15.
Thermostaat
- 4.3.16.
Rotatieverdamper
- 4.4.
Bereiding van het extract en afscheiding van de anionogene oppervlakteactieve stoffen
- 4.4.1.
Bereiding van het extract
De voor de biologische afbreekbaarheidstest benodigde hoeveelheid oppervlakteactieve stoffen bedraagt ongeveer 50 g MBAS.
Normaal zal de hoeveelheid product waaruit wordt geëxtraheerd niet meer dan 1 000 g bedragen, maar het kan nodig zijn aanvullende hoeveelheden van het monster te behandelen. Om praktische redenen zal de bovengrens meestal bij 5 000 g liggen.
Uit ervaring is gebleken dat het aanbeveling verdient verscheidene kleine extracties uit te voeren in plaats van één grote. De aangegeven hoeveelheden wisselaar hebben het vermogen 600–700 mmol oppervlakteactieve stoffen en zeep af te scheiden.
- 4.4.2.
Isolatie van in alcohol oplosbare bestanddelen
Voeg aan 1 250 ml ethanol 250 g van het te onderzoeken detergens toe, breng dit mengsel aan de kook en laat het gedurende een uur onder terugloop al roerend koken. Laat de hete alcoholische oplossing lopen over een grove zuigfilter verhit tot 50 °C en zuig vlug af. Was kolf en zuigfilter met ongeveer 200 ml hete ethanol. Vang filtraat en filterwaswater op in een filtreerkolf.
Indien dikvloeibare of vloeibare producten worden onderzocht, moet men zich ervan vergewissen dat het monster niet meer dan 55 g anionogene oppervlakteactieve stoffen en 35 g zeep bevat. Damp dit gewogen monster volledig in. Los het residu op in 2 000 ml ethanol en ga te werk zoals hierboven is beschreven.
Voor poeders met een laag schudgewicht (< 300 g/l) wordt aanbevolen een ethanol/monster-verhouding van 20:1 te gebruiken. Damp het ethanolbevattend filtraat volledig in, bij voorkeur met een rotatieverdamper. Herhaal een en ander indien een grotere hoeveelheid extract nodig is. Los het residu op in 5 000 ml van een mengsel van isopropanol en water.
- 4.4.3.
Voorbereiding van de ionenwisselingskolommen
KATIONENWISSELINGSKOLOM
Breng 600 ml kationenwisselingshars (4.3.6) in een bekerglas van 3 000 ml en dek af door toevoeging van 2 000 ml zoutzuur (4.3.8). Laat dit ten minste twee uur staan, waarbij af en toe wordt geroerd.
Giet het zuur af en breng het hars met gedeïoniseerd water in de kolom (4.03.2012) over. De kolom moet een stop van glaswol bevatten.
Was de kolom met gedeïoniseerd water met een snelheid van 10–30 ml/min tot het eluaat chloridevrij is.
Verplaats het water met 2 000 ml van het mengsel van isopropanol en water (4,3.3) met een snelheid van 10–30 ml/min. De wisselingskolom is nu gebruiksklaar.
ANIONENWISSELINGSKOLOM
Breng 600 ml anionenwisselingshars (4.3.7) in een bekerglas van 3 000 ml en dek af door toevoeging van 2 000 ml gedeïoniseerd water.
Laat het hars gedurende ten minste twee uur opzwellen.
Breng het hars met gedeïoniseerd water in de kolom over. De kolom moet een stop van glaswol bevatten.
Was de kolom met 0,3 M ammoniumbicarbonaatoplossing (4,30,5) tot deze chloridevrij is. Hiervoor is ongeveer 5 000 ml oplossing nodig. Was opnieuw met 2 000 ml gedeïoniseerd water. Verplaats het water met 2 000 ml van het mengsel van isopropanol en water (4.3.3) met een snelheid van 10–30 ml/min. De wisselingskolom vertoont nu de OH-vorm en is gebruiksklaar.
- 4.4.4.
Ionenwisselingsproces
Verbind de wisselingskolommen op een zodanige wijze dat de kationenwisselingskolom zich op de anionenwisselingskolom bevindt.
Verhit de wisselingskolommen tot 50 ° C, waarbij gebruik wordt gemaakt van een thermostaat.
Verhit 5 000 ml van de in punt 4.4.2 verkregen oplossing tot 60 ° C en laat de oplossing door de wisselaarscombinatie lopen met een snelheid van 20 ml/min. Was de kolommen met 1 000 ml van het hete mengsel van isopropanol en water (4.3.3).
Maak om de anionogene oppervlakteactieve stoffen (MBAS) te verkrijgen de KAT-kolom los. Elueer met 5000 ml ethanol/CO2-oplossing bij 50 ° C (4.3.4) de zeep-vetzuren uit de KAT-kolom. Verwijder het eluaat.
Elueer vervolgens de MBAS uit de AAT-kolom met 5 000 ml ammoniumbicarbonaatoplossing (4.3.5). Damp het eluaat volledig in met behulp van een stoombad of in een rotatieverdamper.
Het residu bevat de MBAS (als ammoniumzout) en eventueel niet-oppervlakteactieve anionogene stoffen waarvan geen nadelige invloed uitgaat op de biologische afbreekbaarheidstest. Voeg aan het residu gedeïoniseerd water toe totdat een bepaald volume is bereikt en bepaal het MBAS-gehalte in een aliquot deel. De oplossing wordt gebruikt als standaardoplossing van de anionogene detergentia voor de biologische afbreekbaarheidstest. De oplossing moet bij een temperatuur van minder dan 5 ° C worden bewaard.
- 4.4.5.
Regeneratie van de ionenwisselingsharsen
De kationenwisselaar wordt na gebruik weggegooid.
Het anionenwisselingshars wordt geregenereerd door een aanvullende hoeveelheid ammoniumbicarbonaatoplossing (4.3.5) door de kolom te laten lopen met een snelheid van ongeveer 10 ml/min, totdat het eluaat vrij is van anionogene oppervlakteactieve stoffen (methyleenblauwtest).
Laat vervolgens 2 000 ml van het mengsel van isopropanol en water (4.3.3) door de anionenwisselaar lopen om door te spoelen. De anionenwisselaar is opnieuw gebruiksklaar.
- 5.
Voorbehandeling van de te onderzoeken niet-ionogene oppervlakteactieve stoffen
- 5.1.
Inleiding
- 5.1.1.
Behandeling van de monsters
Op de niet-ionogene oppervlakteactieve stoffen en detergentia moet de volgende behandeling worden toegepast voordat de biologische afbreekbaarheid wordt bepaald door middel van de bevestigingstest:
PRODUCTEN
BEHANDELING
Niet-ionogene oppervlakteactieve stoffen
Geen
Detergentia
Alcoholextractie en vervolgens afscheiding van de niet-ionogene oppervlakteactieve stoffen door ionenwisseling
Het doel van de alcoholextractie is het verwijderen van de onoplosbare en anorganische bestanddelen uit het handelsproduct; genoemde bestanddelen kunnen namelijk in sommige omstandigheden de biologische afbreekbaarheidstest verstoren.
- 5.1.2.
Ionenwisselingsproces
Voor een goede uitvoering van biologische afbreekbaarheidstests is het nodig de niet-ionogene oppervlakteactieve stoffen uit zeep en uit anionogene en kationogene oppervlakteactieve stoffen te isoleren en af te scheiden.
Een en ander wordt bereikt door toepassing van een ionenwisselingstechniek waarbij gebruik wordt gemaakt van macroporeus wisselingshars en van elutie. Zeep, anionogene en niet-ionogene oppervlakteactieve stoffen kunnen aldus in één proces worden afgezonderd.
- 5.1.3.
Analytische controle
Na homogenisatie wordt het gehalte aan anionogene en niet-ionogene oppervlakteactieve stoffen in het detergens bepaald volgens de MBAS- en BiAS-analysemethode. Het zeepgehalte wordt aan de hand van een geschikte analysemethode bepaald.
Deze analyse van het product is noodzakelijk om de hoeveelheden te berekenen die nodig zijn om de fracties voor de biologische afbreekbaarheidstests te bereiden.
Kwantitatieve extractie is niet noodzakelijk; ten minste 80 % van de niet-ionogene oppervlakteactieve stoffen moet echter worden geëxtraheerd. Doorgaans wordt 90 % of meer verkregen.
- 5.2.
Principe
Uit een homogeen monster (poeders, gedroogde pasta's en gedroogde vloeistoffen) wordt een ethanolextract verkregen, dat de oppervlakteactieve stoffen, zeep en andere in alcohol oplosbare bestanddelen van het monster van het detergens bevat.
Het ethanolextract wordt ingedampt en opgelost in een mengsel van isopropanol en water, waarna men de verkregen oplossing laat percoleren over een combinatie van een sterk zure kationenwisselaar en een macroporeuze anionenwisselaar, die tot 50 ° C wordt verhit. Deze temperatuur is noodzakelijk om precipitatie van vetzuren in zure media te voorkomen. De niet-ionogene oppervlakteactieve stoffen worden door verdamping van de uitlopende vloeistof verkregen.
Kationogene oppervlakteactieve stoffen, die de biologische afbreekbaarheidstest en het analyseproces zouden kunnen verstoren, worden verwijderd door de kationenwisselaar, die op de anionenwisselaar wordt geplaatst.
- 5.3.
Chemicaliën en apparatuur
- 5.3.1.
Gedeïoniseerd water
- 5.3.2.
Ethanol, C2H5OH 95 % (v/v) (toegestaan denatureringsmiddel: methylethylketon of methanol)
- 5.3.3.
Mengsel van isopropanol en water (50/50 v/v):
- —
50 volumedelen isopropanol, CH3CHOH.CH3, en
- —
50 volumedelen water (5.3.1).
- 5.3.4.
Ammoniumbicarbonaatoplossing (60/40 v/v):
0,3 mol NH4HCO3 in 1 000 ml van een mengsel van isopropanol en water, bestaande uit 60 volumedelen isopropanol en 40 volumedelen water (5.3.1)
- 5.3.5.
Kationenwisselaar (KAT), sterk zuur, bestand tegen alcohol (50–100 mesh)
- 5.3.6.
Anionenwisselaar (AAT), macroporeus, Merck Lewatit MP 7080 (70–150 mesh) of equivalent
- 5.3.7.
Zoutzuur, 10 % HCl g/g
- 5.3.8.
Kolf met ronde bodem van 2 000 ml, met ingeslepen stop en terugvloeikoeler
- 5.3.9.
Zuigfilter met een diameter van 90 mm (verwarmbaar) voor papieren filters
- 5.3.10.
Filtreerkolf van 2 000 ml
- 5.3.11.
Wisselingskolommen met verhittingsmantel en kraan: binnenbuis: diameter 60 mm en hoogte 450 mm (zie figuur 4)
- 5.3.12.
Waterbad
- 5.3.13.
Vacuümdroogoven
- 5.3.14.
Thermostaat
- 5.3.15.
Rotatieverdamper
- 5.4.
Bereiding van het extract en afscheiding van de niet-ionogene oppervlakteactieve stoffen
- 5.4.1.
Bereiding van het extract
De voor de afbreekbaarheidstest benodigde hoeveelheid oppervlakteactieve stoffen bedraagt ongeveer 25 g BiAS.
Bij de bereiding van extracten voor de afbreekbaarheidstests moet de te gebruiken hoeveelheid product tot een maximum van 2 000 g worden beperkt. Daarom kan het nodig zijn de bewerking tweemaal of vaker uit te voeren om de hoeveelheid te verkrijgen die voor de afbreekbaarheidstests voldoende is.
Uit ervaring is gebleken dat het aanbeveling verdient verscheidene kleine extracties uit te voeren in plaats van één grote.
- 5.4.2.
Isolatie van in alcohol oplosbare bestanddelen
Voeg aan 1 250 ml ethanol 250 g van het te onderzoeken detergens toe, breng dit mengsel aan de kook en laat het gedurende een uur onder terugloop al roerend koken. Laat de hete alcoholische oplossing lopen over een grove zuigfilter verhit tot 50 ° C en zuig vlug af. Was kolf en zuigfilter met ongeveer 200 ml hete ethanol. Vang filtraat en filterwaswater op in een filtreerkolf.
Indien dikvloeibare of vloeibare producten worden onderzocht, moet men zich ervan vergewissen dat het monster niet meer dan 25 g anionogene oppervlakteactieve stoffen en 35 g zeep bevat. Damp dit gewogen monster volledig in. Los het residu op in 500 ml ethanol en ga te werk zoals hierboven is beschreven. Voor poeders met een laag schudgewicht (< 300 g/l) wordt aanbevolen een ethanol/monsterverhouding van 20:1 te gebruiken.
Damp het ethanolbevattend filtraat volledig in, bij voorkeur met een rotatieverdamper. Herhaal een en ander indien een grotere hoeveelheid extract nodig is. Los het residu op in 5 000 ml van een mengsel van isopropanol en water.
- 5.4.3.
Voorbereiding van de ionenwisselingskolommen
KATIONENWISSELINGSKOLOM
Breng 600 ml kationenwisselingshars (5.3.5) in een bekerglas van 3 000 ml en dek af door toevoeging van 2 000 ml zoutzuur (5.3.7). Laat dit ten minste twee uur staan, waarbij af en toe wordt geroerd.
Giet het zuur af en breng het hars met gedeïoniseerd water in de kolom (5.3.11) over. De kolom moet een stop van glaswol bevatten. Was de kolom met gedeïoniseerd water met een snelheid van 10–30 ml/min tot het eluaat chloridevrij is.
Verplaats het water met 2 000 ml van het mengsel van isopropanol en water (5.3.3) met een snelheid van 10–30 ml/min. De wisselingskolom is nu gebruiksklaar.
ANIONENWISSELINGSKOLOM
Breng 600 ml anionenwisselingshars (5.3.6) in een bekerglas en dek af door toevoeging van 2 000 ml gedeïoniseerd water. Laat het hars gedurende ten minste twee uur opzwellen. Breng het hars met gedeïoniseerd water in de kolom over. De kolom moet een stop van glaswol bevatten.
Was de kolom met 0,3 M ammoniumbicarbonaatoplossing (5.3.4) tot deze chloridevrij is. Hiervoor is ongeveer 5 000 ml oplossing nodig. Was opnieuw met 2 000 ml gedeïoniseerd water.
Verplaats het water met 2 000 ml van het mengsel van isopropanol en water (5.3.3) met een snelheid van 10–30 ml/min. De wisselingskolom vertoont nu de OH-vorm en is gebruiksklaar.
- 5.4.4.
Ionenwisselingsproces
Verbind de wisselingskolommen op een zodanige wijze dat de kationenwisselingskolom zich op de anionenwisselingskolom bevindt. Verhit de wisselingskolommen tot 50 ° C, waarbij gebruik wordt gemaakt van een thermostaat. Verhit 5 000 ml van de in punt 5.4.2 verkregen oplossing tot 60 ° C en laat de oplossing door de wisselaarscombinatie lopen met een snelheid van 20 ml/min. Was de kolommen met 1 000 ml van het hete mengsel van isopropanol en water (5.3.3).
Vang, om de niet-ionogene oppervlakteactieve stoffen te verkrijgen, het eluaat en het waswater op en damp deze volledig in, bij voorkeur met een rotatieverdamper. Het residu bevat de BiAS. Voeg gedeïoniseerd water toe totdat een bepaald volume is bereikt en bepaal het BiAS-gehalte in een aliquot deel. De oplossing wordt gebruikt als standaardoplossing van de niet-ionogene oppervlakteactieve stoffen voor de afbreekbaarheidstest. De oplossing moet bij een temperatuur van minder dan 5 ° C worden bewaard.
- 5.4.5.
Regeneratie van de ionenwisselingsharsen
De kationenwisselaar wordt na gebruik weggegooid.
Het anionenwisselingshars wordt geregenereerd door ongeveer 5 000–6 000 ml ammoniumbicarbonaatoplossing (5.3.4) door de kolom te laten lopen met een snelheid van ongeveer 10 ml/min, totdat het eluaat vrij is van anionogene oppervlakteactieve stoffen (methyleenblauwtest). Laat vervolgens 2 000 ml van het mengsel van isopropanol en water (5.3.3) door de anionenwisselaar lopen om door te spoelen. De anionenwisselaar is opnieuw gebruiksklaar.
Figuur 1. Actiefslibinstallatie: overzicht
Figuur 2. Actiefslibinstallatie: details
(afmetingen in millimeters)
Figuur 3. Berekening van de biologische afbreekbaarheid — bevestigingstest
Figuur 4. Verwarmde wisselingskolom
(afmetingen in millimeters)
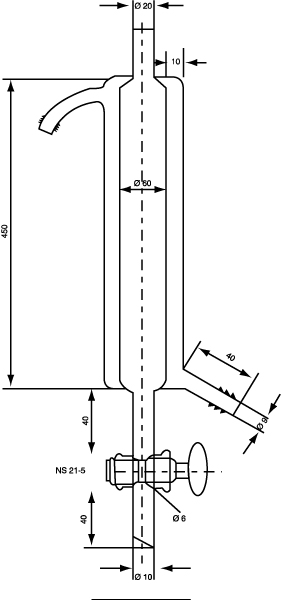
Figuur 5. Gasstripper
(afmetingen in millimeters)