In deze zaak wordt over de bio beschikbaarheid van de orale tablet onder meer het volgende gesteld. In de inleidende dagvaarding (punt 30) wordt 0,1-0,15% genoemd bij toediening van 100 µg orale tablet. In de WO 707 is vermeld: For the desmopressin oral tablet with only 0.1-0.15% bioavalaibility, a standard dose of 200-400 mcg would also produce a peak plasma/plasma/serum level of 20-30 pg/mL [vertrouwelijke informatie].
Hof Den Haag, 22-02-2022, nr. 200.156.630/02 en 200.156.625/02
ECLI:NL:GHDHA:2022:862
- Instantie
Hof Den Haag
- Datum
22-02-2022
- Zaaknummer
200.156.630/02 en 200.156.625/02
- Vakgebied(en)
Intellectuele-eigendomsrecht (V)
- Brondocumenten en formele relaties
ECLI:NL:GHDHA:2022:862, Uitspraak, Hof Den Haag, 22‑02‑2022; (Hoger beroep)
Eerste aanleg: ECLI:NL:RBDHA:2014:11941
Uitspraak 22‑02‑2022
Inhoudsindicatie
Gedaagde/ verweerder in hoger beroep sub 2 F. heeft in 2003 een internationale octrooiaanvrage gedaan met als titel “PHARMACEUTICAL COMPOSITIONS INCLUDING LOW DOSAGES OF DESMOPRESSIN”, waarin hij staat genoemd als uitvinder en eerste aanvrager. Deze aanvrage heeft geleid tot een Europese octrooiaanvrage, tot de daarvan afgesplitste aanvragen en tot aanvragen buiten Europa in Australië, Canada, Japan en China. De andere gedaagden/ verweerders in hoger beroep zijn rechtsopvolgers van F. (geweest). Eiseres/appellante Ferring meent dat de rechten op de aanvragen aan haar toekomen omdat F. het in de octrooiaanvragen neergelegde onderwerp en de daarvoor benodigde kennis heeft overgenomen van en ontleend aan (werknemers van) de Ferring-Groep en heeft, kort gezegd, de octrooiaanvragen opgeëist. De rechtbank heeft het gevorderde afgewezen, het hof wijst dit toe.
Partij(en)
DEN HAAG
Afdeling Civiel recht
Zaaknummers : 200.156.630/02 en 200.156.625/02
Zaak/rolnummers rechtbank : C/09/399700/HA ZA 11-2167 en C/09/409591/
HA ZA 11/2849
arrest van 22 februari 2022
in de zaak met zaaknummer 200.156.630/02 (hierna ook: zaak1) van
FERRING B.V.,
gevestigd te Hoofddorp,
hierna te noemen: Ferring,
appellante,
advocaat: mr. G. Kuipers te Amsterdam,
tegen
1. de rechtspersoon naar vreemd recht REPRISE BIOPHARMACEUTICS, LLC,
gevestigd te New York City, New York, Verenigde Staten van Amerika,
geïntimeerde;
2. [geïntimeerde 2],
wonende te [woonplaats] ,
geïntimeerde
3. de rechtspersoon naar vreemd recht ALLERGAN, INC,
gevestigd te Irvine, California, Verenigde Staten van Amerika,
geïntimeerde, gevoegde partij in eerste aanleg;
4. de rechtspersoon naar vreemd recht SERENITY PHARMACEUTICALS LLC,
gevestigd te Milford PA, Verenigde Staten van Amerika,
geïntimeerde, gevoegde partij in eerste aanleg;
hierna ook te noemen: Reprise, [geïntimeerde 2] , Allergan en Serenity en alle tezamen: [geïntimeerde 2] c.s.,
geïntimeerden,
advocaat: mr. B.J. Berghuis van Woortman te Amsterdam.
en
in de zaak met 200.156.625/02 (hierna ook: zaak 2) van
FERRING B.V.,
gevestigd te Hoofddorp,
hierna te noemen: Ferring,
appellante,
advocaat: mr. G. Kuipers te Amsterdam,
tegen
1. [geïntimeerde 2] ,
wonende te [woonplaats] ,
geïntimeerde;
2. de rechtspersoon naar vreemd recht ALLERGAN, INC,
gevestigd te Irvine, California, Verenigde Staten van Amerika,
geïntimeerde;
hierna ook te noemen: [geïntimeerde 2] en Allergan en tezamen: Allergan c.s.,
geïntimeerden,
advocaat: mr. B.J. Berghuis van Woortman te Amsterdam.
Het geding
Het hof verwijst naar zijn tussenarrest van 29 oktober 2019, waarbij een meervoudige comparitie van partijen is gelast. De comparitie heeft op 25 februari 2020 plaatsgevonden.
Voor de comparitie heeft het hof op 4 februari 2020 een akte d.d. 25 februari 2020 houdende aanvullende producties van Ferring, met producties 98 tot en met 102, ontvangen.
Partijen, Ferring bijgestaan door mr. Kuipers voornoemd en mrs. T. Douma, C.A. van Staveren en S.C.Y. van Ansenwoude, advocaten te Amsterdam en [geïntimeerde 2] c.s. door mr. Berghuis van Woortman voornoemd en mr A.F. Kupecz , advocaat te Amsterdam, hebben nadere inlichtingen verschaft aan de hand van door hen overgelegde comparitie-aantekeningen. Vervolgens is de zaak naar de rol verwezen en heeft Ferring een akte houdende uitlating d.d. 7 april 2020 over de nieuwe feiten, met producties 104 tot en met 107B, en [geïntimeerde 2] c.s. een akte houdende uitlating inzake beweerdelijk nieuwe feiten d.d. 19 mei 2020 genomen.
Vervolgens heeft op 1 juli 2020 via een videoverbinding nogmaals een meervoudige comparitie van partijen plaatsgevonden, waar partijen nadere inlichtingen hebben verschaft aan de hand van overgelegde comparitieaantekeningen. Vervolgens is arrest bepaald.
Het hof heeft vanaf oktober 2019 een aanzienlijk aantal e-mails, brieven en andere berichten van de advocaten van partijen ontvangen.
Partijen hebben in hoger beroep in totaal de volgende aktes genomen:
- -
Ferring van 19 april 2016 (met producties 77-88), 13 september 2018 voor het pleidooi bij het hof (met producties 89-97), 4/25 februari 2020 (met producties 98-102) en 7 april 2020 (met producties 104-107B). Deze aktes zullen hierna worden aangeduid als akte Ferring 2016, 2018, februari 2020 en april 2020.
- -
[geïntimeerde 2] c.s van 13 september 2018 voor het pleidooi bij het hof (met producties 92-98) en 19 mei 2020 (zonder producties). Deze aktes zullen hierna worden aangeduid als akte [geïntimeerde 2] c.s. 2018 en 2020
Partijen hebben hun producties in eerst aanleg en hoger beroep doorgenummerd. De producties zullen hierna worden aangeduid als productie [nummer] Ferring respectievelijk [geïntimeerde 2] .
1. Waar het in deze zaak over gaat: opeising van octrooiaanvragen
Op 10 november 2003 heeft [geïntimeerde 2] een internationale octrooiaanvrage gedaan met als titel “PHARMACEUTICAL COMPOSITIONS INCLUDING LOW DOSAGES OF DESMOPRESSIN”, die op 26 mei 2005 is gepubliceerd als WO 2005/046707 (hierna: WO 707), waarin hij staat genoemd als uitvinder en eerste aanvrager. Deze aanvrage heeft geleid tot een Europese octrooiaanvrage 03 781 836, gepubliceerd als EP 1 689 419 (hierna: EP 419), tot de daarvan afgesplitste aanvragen (hierna: de divisionals) en tot aanvragen buiten Europa in Australië, Canada, Japan en China (hierna: de nationale of niet-Europese aanvragen).
Ferring meent dat de rechten op de aanvragen aan haar toekomen omdat [geïntimeerde 2] het in de octrooiaanvragen neergelegde onderwerp (“het concept”) en de daarvoor benodigde kennis heeft overgenomen van en ontleend aan (werknemers van) de Ferring-Groep.
2. De technische achtergrond
De navolgende beschrijving van de technische achtergrond die vóór de door Ferring gestelde uitvinding in 1999 of 2000 bekend was, is ontleend aan processtukken van partijen en is als zodanig niet in geschil.
2.1.
De stof desmopressine – ook aangeduid als dDAVP of DDAVP – is eind jaren '70 op de markt gebracht door Ferring en werd aanvankelijk gebruikt voor de behandeling van zeldzame aandoeningen, zoals centrale diabetes insipidus of CDI, een aandoening die wordt veroorzaakt door een gebrekkige vasopressineproductie door de hypofyse, en de ziekte van Von Willebrand, een bloedstollingsstoornis. Recenter is desmopressine gebruikt voor de behandeling van bedplassen bij kinderen, een aandoening die bekend staat als primaire nachtelijke enurese of PNE.
2.2.
Het peptide desmopressine is een synthetische vervanger (peptide-analoog) van het
hormoon vasopressine (ook wel 'antidiuretisch hormoon' of 'ADH' genoemd). De
chemische naam van desmopressine is l-desamino-8-D-argininevasopressine. ADH (en ook
desmopressine) vermindert de urineproductie door de hoeveelheid water te beperken die via
de urine wordt uitgescheiden. ADH activeert V2-receptoren (ook wel 'waterkanalen', eng:
‘water channels') in de opvangbuisjes van de nieren, die water uit pro-urine halen en het
water in de bloedstroom brengen. Bijgevolg houden patiënten die desmopressine krijgen
toegediend water vast en produceren ze geen urine of (en dit is gebruikelijker) kleine
hoeveelheden geconcentreerde urine. Dit wordt het 'antidiuretisch effect' genoemd.
2.3.
Nocturia is een aandoening bij volwassenen, waarbij patiënten meerdere malen
gedurende de nacht de behoefte voelen om te urineren of de blaas te legen. Dit is een relatief
veel voorkomende stoornis die leidt tot slaapgebrek, hetgeen gepaard gaat met aanzienlijke
nadelige gevolgen voor de gezondheid.
2.4.
In het vakgebied werd onderzocht of desmopressine ook zou kunnen worden
gebruikt voor de behandeling van nocturia. Bij de uitvoering van klinische studies met
desmopressine voor de behandeling van nocturia bij volwassenen, trad in sommige patiënten
echter de bijwerking hyponatriëmie (watervergiftiging, veroorzaakt door een te laag natriumgehalte door het te lang vasthouden van water door het lichaam) op. Door toediening van desmopressine kan de situatie ontstaan dat de natrium (of sodium) concentratie in het bloed extreem laag is door het te lang vasthouden van water in het lichaam.
Hyponatriëmie treedt in zonder waarschuwing en kan leiden tot ernstige medische gevolgen, zoals arythmieën, cerebraal oedeem en aanvallen. Hyponatriëmie kan zelfs de dood tot gevolg hebben.
2.5.
Bij (de beschrijving van) de reactie van het lichaam op toediening van een medicijn moet een onderscheid gemaakt worden tussen de plasma- of serumconcentratie in het bloed dat het gevolg daarvan is en het effect (in casu het antidiuretische effect) dat van de door het medicijn veroorzaakte plasmaconcentratie het gevolg is.
2.6.
Plasmaconcentratie is een begrip dat de hoeveelheid werkzame stof in het bloed aangeeft. In dit geval wordt de plasmaconcentratie uitgedrukt in pg/ml of mL. Biologische beschikbaarheid of bio beschikbaarheid is een begrip dat aangeeft hoeveel van de werkzame stof na toediening middels een bepaalde doseringsvorm uiteindelijk in het bloed wordt opgenomen. Bij intraveneuze toediening wordt 100% van de werkzame stof opgenomen. Bij toediening middels een te slikken orale tablet is dat in dit geval zeer laag. Sublinguale toediening resulteert in een hogere bio beschikbaarheid dan toediening per orale tablet1.. Als de bio beschikbaarheid van een bepaalde toedieningsvorm hoger is kan worden volstaan met een lagere hoeveelheid toe te dienen werkzame stof om eenzelfde plasmaconcentratie te bereiken. De bio beschikbaarheid kan voorts binnen dezelfde doseringsvorm variëren. Dit wordt variabiliteit genoemd. Dit geldt zowel per patiënt omdat zij verschillend reageren op een bepaalde toedieningsvorm (interpatiënt variabiliteit) als ook voor dezelfde patiënt omdat die ene keer anders reageert op de toedieningsvorm dan de andere keer (intrapatiënt variabiliteit).
2.7.
De plasmaconcentratie (concentratie dDAVP pg/mL) bepaalt het intrinsiek effect, in casu het antidiuretische effect (het produceren van minder urine). Dit kan in dit geval worden gemeten door middel van urine osmolality. In dit verband wordt gesproken over C50 als de plasmaconcentratie waarbij bij 50% van het antidiuretisch effect is bereikt en over Cmax als de plasmaconcentratie waarbij het antidiuretisch effect maximaal is.
2.8.
Het gemeten antidiuretische effect in een klinische studie resulteert overigens niet altijd in het gewenste geneeskundige effect in iedere patiënt (in casu bij nocturia: een verminderde behoefte om te urineren).
3. De (overige) feiten
Het hof zal uitgaan van de door de rechtbank in overwegingen 3.1 tot en met 3.21 van het bestreden vonnis als vaststaand aangemerkte feiten die niet gemotiveerd zijn bestreden. Met inachtneming van hetgeen in eerste aanleg en hoger beroep in aanvulling daarop tussen partijen is komen vast te staan als enerzijds gesteld en anderzijds erkend dan wel niet of onvoldoende gemotiveerd weersproken, gaat het in deze zaak om het volgende.
3.1.
De betrokkenen en hun relevante bezigheden
3.1.1.
Ferring behoort tot een groep van ondernemingen die zich onder meer bezig houdt met de ontwikkeling van farmaceutische producten op het gebied van urologie (hierna: de Ferring-groep). De Ferring-groep brengt sinds 1987 onder de naam Minirin tabletten met desmopressine op de markt voor de behandeling van CDI en later ook voor de behandeling van PNE (bedplassen bij kinderen). Al eerder bracht zij desmopressine-producten in andere toedieningsvormen voor CDI op de markt. Vanaf de jaren ’90 heeft de Ferring-groep onderzoek gedaan naar een desmopressine-product voor Nocturia. In 2001 kreeg de Ferring-groep een marktvergunning voor haar Minirin tablet met een startdosering van 100 µg voor de behandeling van Nocturia in Europa, voor het eerst in Finland op 13 augustus 2001. In de jaren 2000 tot en met 2002 verhandelde de Ferring-groep Minirin tabletten met 100 μg, 200 μg en 400 μg werkzame stof. In 2005 kreeg Ferring een marktvergunning voor een nieuwe doseringsvorm voor desmopressine, namelijk een orodispergeerbare doseringsvorm. Thans is een orodispergeerbare doseringsvorm, die sublinguaal wordt toegediend, onder de naam Minirin Melt op de markt. Aan Ferring is een octrooi EP 1 501 534 (EP 534) (op basis van WO 2003/094885 en -886 (WO 885 en 886), welke prioriteit claimt van GB 0210397 (GB 397) voor deze doseringsvorm verleend. In conclusie 3 wordt onder andere sublinguale toediening (sublingual administration) genoemd.
3.1.2.
[A] (hierna: [A] ) is vanaf 1 maart 1997 in dienst van (een rechtspersoon binnen) de Ferring-groep en als [functienaam 1] werkzaam bij de Urology Division in Kopenhagen, Denemarken. Hij promoveerde in 1991 met een onderzoek naar PNE.
3.1.3.
[B] (hierna: [B] ) is in 1999 in dienst getreden van de Ferring-groep. Hij hield zich bezig met PK/PD farmacokinetiek en met analyse van bestaande klinische onderzoeksgegevens door middel van statistische methoden en modelling.
3.1.4.
[C] (hierna: [C] ) was van 2000 tot ongeveer 2007 werkzaam bij de Ferring-groep en betrokken bij de ontwikkeling van desmopressine.
3.1.5.
[geïntimeerde 2] is, na in de periode van november 1997 tot december 1998 in dienst te zijn geweest bij de Ferring-groep in de VS, in de periode van 1 december 1998 tot en met 7 november 2002 (als consultant, niet in dienstverband) werkzaam geweest voor Ferring Pharmaceuticals Inc. in de Verenigde Staten en/of voor de Ferring-Groep, laatstelijk als executive voor een bedrag van 40,000 tot 50,000 US dollar per maand. [geïntimeerde 2] is vóór juli 2001 niet betrokken geweest bij (de R&D betreffende) Ferrings desmopressine-project. Hij hield zich in die periode met name bezig met het product Degarelix van Ferring (een product voor de behandeling van prostaatkanker, dat niet gerelateerd is aan desmopressine). [geïntimeerde 2] was lid van de Research Development Marketing Commitee (RDMC) van de Ferring-groep, die voor het eerst 16 januari 2002 bijeen kwam. Op 7 november 2002 is zijn contract met onmiddellijke ingang beëindigd. [geïntimeerde 2] heeft op 10 november 2003 de WO 707 ingediend, waarin hij genoemd staat als uitvinder en eerste aanvrager.
3.1.6.
[geïntimeerde 2] heeft samen met toxicologe en klinisch onderzoekster [D] (hierna: [D] ) CNF Pharma LLC (hierna: CNF) opgericht, welke vennootschap zich bezighoudt met klinisch onderzoek en ontwikkeling van farmaceutische producten. Bij dit onderzoek waren ook de zussen van [D] en/of [E] betrokken. De naam van CNF is later gewijzigd in Serenity Corp (een andere rechtspersoon dan procespartij Serenity). [geïntimeerde 2] heeft ook Reprise opgericht.
3.1.7.
[E] (hierna: [E] ) was vanaf begin 1996 tot de zomer of het najaar van 2002 werkzaam bij de Ferring-groep, vanaf medio 2001 in de functie van [functienaam 2] van de Ferring-groep. Binnen Ferring Pharmaceuticals Inc. was [E] verantwoordelijk voor het inhuren van [geïntimeerde 2] . Na de beëindiging van zijn dienstverband met de Ferringgroep is hij gaan samenwerken met [geïntimeerde 2] , onder meer als consultant voor Serenity.
3.1.8.
Reprise is een op 2 januari 2007 opgerichte vennootschap waarvan [geïntimeerde 2] bestuurder en (mede-)aandeelhouder is. [E] en [D] hebben eveneens een belang in Reprise.
[geïntimeerde 2] heeft de rechten op EP 419 overgedragen aan Reprise (productie 3.10 Ferring), die vanaf maart 2007 tot 20 april 2011 als aanvrager in het register van het Europees octrooibureau (hierna: het EOB) was vermeld. Daarna is tijdelijk Allergan als aanvrager vermeld geweest. Reprise staat thans weer vermeld als aanvrager met terugwerkende kracht vanaf 20 april 2011 (zie ook overweging 3.1.9).
3.1.9.
Allergan is een biofarmaceutisch bedrijf. De rechten op EP 419 en de divisionals zijn blijkens het octrooiregister op grond van een overeenkomst van overdracht in maart of april 2011 tussen Reprise en Allergan aan Allergan overgedragen, waarna Allergan met ingang van 20 april 2011 als aanvrager in het register werd vermeld. Bij beslissing van 13 november 2013 heeft de Legal Board of Appeal van het EOB geoordeeld dat de inschrijving van Allergan als aanvrager van het octrooi moet worden teruggedraaid (productie 53 Ferring). In of rond januari 2014 is Reprise met terugwerkende kracht weer als aanvrager van de EP 419 en de divisionals in het register vermeld. Allergan werkte aanvankelijk samen met Reprise, [geïntimeerde 2] en Serenity op basis van een in 2010 aangekondigde Global Agreement. In 2017 heeft Allergan “zich teruggetrokken uit genoemde Agreement”, althans is de samenwerking beëindigd. In ieder geval is zij sedertdien niet langer de rechthebbende met betrekking tot de octrooien.
3.1.10.
Serenity heeft zich in deze procedure gevoegd. Haar vordering tot voeging is toegewezen op grond van haar stelling dat zij exclusief licentieneemster was van Allergan (vergl punt 4.1 van het tussenvonnis in de incidenten van 13 juni 2012).
3.2.
De in het geding zijnde octrooiaanvragen
3.2.1.
Op 10 november 2003 heeft [geïntimeerde 2] een internationale octrooiaanvrage gedaan die is gepubliceerd als WO 2005/046707 (WO 707) op 26 mei 2005, waarin hij staat genoemd als uitvinder en eerste aanvrager. Deze aanvrage heeft geleid tot een Europese octrooiaanvrage 03 781 836, gepubliceerd als EP 1 689 419 (EP 419), tot de daarvan afgesplitste aanvragen EP20110000464, EP20110000465, EP20110000466, EP20110000467 en EP20110000468 (hierna: de divisionals) en tot aanvragen buiten Europa, namelijk de Australische octrooiaanvrage AU2003287591 die is gepubliceerd als AU2003287591, de Canadese octrooiaanvrage CA20032545194 die is gepubliceerd als CA2545194, de Chinese octrooiaanvrage CN20038110675 die is gepubliceerd als CN1878563 en de Japanse octrooiaanvrage JP20050510644T die is gepubliceerd als JP2007521244 (hierna: de nationale of niet-Europese aanvragen).
3.2.2.
WO 707 bevatte oorspronkelijk de volgende conclusies (productie 3.1 Ferring):
WHAT IS CLAIMED IS:
1. A pharmaceutical composition, comprising 0.5 ng to 20 μg desmopressin and a pharmaceutically acceptable carrier.
2. The pharmaceutical composition of claim 1, wherein said pharmaceutical composition comprises from about 0.5 ng to about 2000 ng desmopressin.
3. The pharmaceutical composition of claim 1, wherein said pharmaceutical composition
comprises from about 0.05 μg to about 10 μg desmopressin.
4. The pharmaceutical composition of claim 1, wherein said pharmaceutical composition comprises from about 0.1 μg to about 20 μg desmopressin.
5. The pharmaceutical composition of claim 1, wherein said pharmaceutical composition is adapted for intravenous, subcutaneous, transmucosal, transdermal, or intradermal delivery.
6. The pharmaceutical composition of claim 1, wherein said pharmaceutical composition is in the form of an orodispersible solid.
7. The pharmaceutical composition of claim 1, further comprising an open matrix network, said open matrix network comprising a water-soluble or water-dispersible carrier material that is inert towards desmopressin.
8. A pharmaceutical composition, comprising desmopressin and a pharmaceutically acceptable carrier, wherein said pharmaceutical composition is effective to establish a steady plasma/serum desmopressin concentration in the range of from about 0.1 picograms desmopressin per mL plasma/serum to about 10.0 picogram desmopressin per mL plasma/serum.
9. The pharmaceutical composition of claim 8, wherein said steady plasma/serum desmopressin concentration is in the range of from about 0.5 picograms desmopressin per mL plasma/serum to about 5.0 picogram desmopressin per mL plasma/serum.
10. The pharmaceutical composition of claim 8, wherein said pharmaceutical composition comprises from about 0.5 ng to about 2000 ng desmopressin.
11. The pharmaceutical composition of claim 8, wherein said pharmaceutical composition comprises from about 0.05 μg to about 10 μg desmopressin.
12. The pharmaceutical composition of claim 8, wherein said pharmaceutical composition comprises from about 0.1 μg to about 20 μg desmopressin.
13. The pharmaceutical composition of claim 8, wherein said pharmaceutical composition is adapted for intravenous, subcutaneous, transmucosal, transdermal, or intradermal delivery.
14. An article of manufacture comprising packaging material and a pharmaceutical composition contained within said packaging material, wherein said pharmaceutical composition is therapeutically effective for treating or preventing hemophilia, Von Willebrand's Disease, incontinence, primary nocturnal enuresis (PNE), nocturia, or central diabetes insipidus, and wherein said packaging material comprises a label which indicates that the pharmaceutical composition can be used for treating or preventing hemophilia, Von Willebrand's Disease, incontinence, primary nocturnal enuresis (PNE), nocturia, or central diabetes insipidus, and wherein said pharmaceutical composition comprises 0.5 ng to 20 μg desmopressin and a pharmaceutically acceptable carrier.
15. A method of treating or preventing a disease or condition which is treatable or preventable by desmopressin, said method comprising administering to a patient a daily dose of a therapeutically effective amount of a pharmaceutical composition comprising 0.5 ng to 20 μg desmopressin and a pharmaceutically acceptable carrier.
16. The method of claim 15, wherein said disease or condition is selected from the group consisting of hemophilia, Von Willebrand's Disease, incontinence, primary nocturnal enuresis (PNE), nocturia, or central diabetes insipidus.
17. A method inducing an antidiuretic effect in a patient, comprising the step of administering to a patient a daily dose of a therapeutically effective amount of a pharmaceutical composition comprising 0.5 ng to 20μg desmopressin and a pharmaceutically acceptable carrier.
18. The method of claim 17, wherein said patient is suffering from a disease selected from the group consisting of Von Willebrand’s Disease, incontinence, primary nocturnal enuresis (PNE), nocturia, or central diabetes insipidus.
3.2.3.
De beschrijving van WO 707 bevat de volgende passages onder het kopje “Brief Description of the Related Art”:
The maximum plasma/plasma/serum concentrations achieved with a typical intranasal dose of desmopressin for CDI or PNE of 20 micrograms (mcg of μg) would be approximately 20-30 pg/mL based on 3-5% bioavailability. For the desmopressin oral tablet with only 0.1-0.15% bioavalaibility, a standard dose of 200-400 mcg would also produce a peak plasma/plasma/serum level of 20-30 pg/mL.
While existing formulations of desmopressin have met the needs of patients, there is still a need for improvement. Tablets are often preferred by patients because of their ease of use, discretion and the lack of uncertainty of correct administration. However, tablets generally need to be taken with a glass of water or other drink, which is a problem as fluid intake needs to be restricted in connection with desmopressin treatment, and the
message to the patient is much clearer when there is no water intake at all.
In addition, while the above doses and plasma/plasma/serum concentrations are effective for treating CDI and PNE, standard dosages of desmopressin have been shown to cause undesirable side-effects including high incidences of hyponatremia. Lower dosages are preferable if the same desired effect could be produced. However, the current trend in this field is the evaluation of higher dosages of desmopressin for treatment purposes.
(pagina 2)
3.2.4.
Vervolgens bevat WO 707 bij de beschrijving van de uitvinding de volgende passages:
SUMMARY OF THE INVENTION
In one aspect, the present invention is directed to a pharmaceutical composition, compromising 0.5 ng to 20 μg desmopressin and a pharmaceutical acceptable carrier. In another aspect, the present invention is directed to a pharmaceutical composition, comprising desmopressin and a pharmaceutically acceptable carrier, wherein the pharmaceutical composition is effective to establish a steady plasma/plasma/serum desmopressin concentration in the range of from about 0.1 picograms desmopressin per mL plasma/plasma/serum to about 10.00 picogram desmopressin per mL plasma/plasma/serum.
DETAILED DESCRIPTION OF THE INVENTION
It has now been discovered that desmopressin can be administered as a solid dosage from which is absorbed from the mouth and which provides improved bioavailability. It is surprising that desmopressin can be absorbed at all in this way, since the available evidence showed that desmopressin administered in the oral cavity (sublingually)was not significantly absorbed (Fjellestad-Paulsen A. et al, Clin. Endocrinol. 38 77-82(1993)). It is even more unexpected that bioavailability can be improved compared to a conventional per oral tablet formulation (i.e. which is swallowed by the patient).
It has also been unexpectedly discovered that low doses and plasma/plasma/serum levels of desmopressin are pharmacologically active and can achieve desired therapeutic efficacy. The present inventor has found that doses and plasma/plasma/serum concentrations of desmopressin which are from 5 to 40% of the current recommended doses and resulting plasma/plasma/serum levels are therapeutically effective, and in some cases safer for treatment of CDI, PNE, and additional clinical indications requiring pharmacological concentration of the urine. It has been discovered that the actual dose response curve of desmopressin is shifted to the left relative to current theory and practice and that at each plasma/plasma/serum concentration point over the dose range predicted and incremental pharmacological effect in terms of urine concentration is observed.
The daily dosage of desmopressin, measured as the free base, will generally be from 0.5 or 1 μg to 1mg per dosage form. In one preferred dosage range, the dosage will typically range from 2 μg to 800 μg per dosage from and preferably from 10 μg to 600 μg. Comparatively lower doses (e.g. lower dosages relative to the dosage above or provided in the art) are also specifically contemplated, for example from 0.5 ng to 20,000 ng, preferably 0.05 mcg (50 ng) to 10 mcg (10,000 ng), and more preferably 0.1 mcg (100ng) to 2000 ng. When one dosage form per day is administered, as is usual for PNE and nocturia, this will typically be the dose per dosage form.(…)”
(pagina 4-5)
3.2.5.
Onder het kopje Low Dosage Analysis and Application is in de beschrijving het volgende vermeld:
In accordance with the present invention, plasma/plasma/serum desmopressin
concentrations following administration of the pharmaceutical composition of the
invention preferably range from about 0.1 pg/mL to about 10.0 pg/mL, and more
preferabely from about 0.5 pg/mL to about 5.0 pg/mL. These amounts and ranges of
desmopressin may be administered by any method known in the art, including, without limitation, intravenous (bolus, infusion); subcutaneous (bolus, infusion, depot); intranasal; transmucosal (buccal and sublingual, e.g., orodispersible tablets, wafers, film, and effervescent formulations; conjunctival (eyedrops); rectal (suppository, enema)); transdermal (passive via patch, gel, cream, ointment or iontophoretic); or intradermal (bolus, infusion, depot) as outlined below. Additionally, pharmaceutical compositions that contain desmopressin in an amount that provide the above plasma/plasma/serum desmopressin levels may be prepared by the above methods and using the above carriers, or any other method known in the art.
The dose ranges of desmopressin outlined above can produce appropriate
antidiuretic effect when administered by various routes as summarized in the examples below:
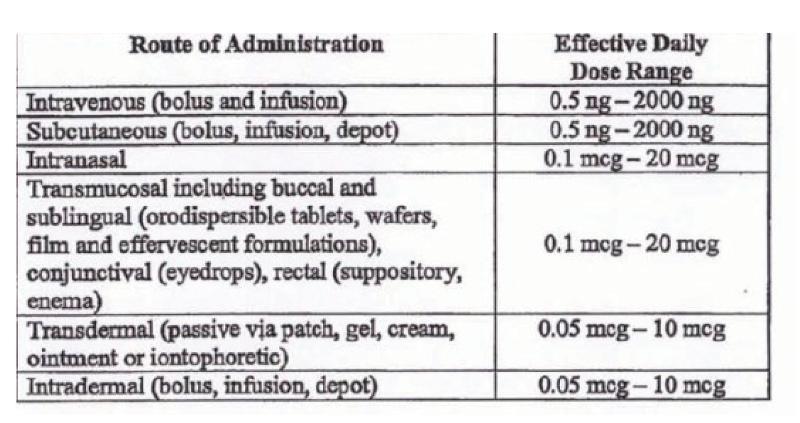
(pagina 23 en 24)
3.2.6.
In de beschrijving wordt voorts verwezen naar “EXAMPLE 8 Crossover Study Investigating the Antidiuretic Effect of Three Low Doses of Desmopressin:
The following Example describes a study showing the antidiuretic effect of three
low doses of desmopressin administered via intravenous infusion for 2 hours in overhydrated, healthy, non-smoking male and female volunteers. Briefly, an open-label, crossover study with 8 healthy, over-hydrated, non-smoking male and female volunteers, age 18-40. The subjects were dosed initially with 0.5 ng/kg dose, then with the 1.0 ng/kg dose and finally the 2.0 ng/kg dose. Pharmacodynamic and pharmacokinetic parameters were evaluated at each dose level
(…)
Summary of Results
All three doses (I.V. infusions) of desmopressin produced a measurable,
antidiuretic effects in terms of increased urine concentration (osmolality) and decreased
urine output in a dose response fashion.. The pharmacodynamic duration of antidiuretic
effect also demonstrated a dose response curve with the lowest dose having tiie shortest
10 duration of effect. The mean peak urine osmolality (mOsm/kg) occurred at the end of the
2 hour infusion for each dose level.(…) The duration of antidiuretic effect was approximately 180 minutes for the 0.5 ng/kg dose, 240 to 280 minutes for the 1.0 ng/kg dose and 360 minutes for the 2.0 ng/kg dose. The urine osmolality and output results for each subject and the means for each time period are described in Tables 1-6 and Figures 1-9.
(…)
As shown in Tables 1-6 and Figures 1-9, low doses of desmopressin administered as
I.V. infusions over 2 hours produced significant antidiuretic effects in over-hydrated, normal subjects in a dose response fashion. These doses and calculated plasma/serum concentrations of desmopressin were far lower than the current labeled eecommendations and current clinical practice by a factor of more than one order of magnitude. The pharmacodynamic duration of action was also proportional to the dose with the 1.0 and 2.0 ng/kg doses providing durations of 4 to 6 hours. This may be adequate to produce the desired therapeutic effects for existing and potential new clinical indications for desmopressin. Safety and tolerability were excellent.
The results of this study confirm the low-dose hypothesis for desmopressin and
provide an empirical basis for further clinical studies in patients to evaluate low doses of desmopressin for such conditions as primary nocturnal enuresis, adult nocturia, incontinence and central diabetes insipidus.
The therapeutic effectiveness of desmopressin for all these clinical indications is
based on desmopressin’s antidiuretic pharmacological effect which results in production of smaller volumes of more concentrated urine.
(pagina 29-35).
3.2.7.
In november 2004 zijn de conclusies 1 tot en met 8 van WO 707 samengevoegd tot de volgende conclusie 1:
1. A pharmaceutical composition, comprising 0.5 ng to 20 μg desmopressin and a pharmaceutically acceptable carrier, wherein said pharmaceutical composition establishes a steady plasma/serum desmopressin concentration in the range of from about 0.1 picograms desmopressin per mL plasma/serum to about 10.0 picogram desmopressin per mL plasma/serum.
3.2.8.
In oktober 2007 zijn de conclusies wederom aangepast, waarna conclusie 1 luidde:
A pharmaceutical dosage form comprising desmopressin and a pharmaceutically
acceptable carrier adapted for intranasal, sublingual, buccal, transmucosal, transdermal,
or intradermal administration which when administered to a patient establishes a steady
plasma/serum desmopressin concentration in the range of from about 0.1 picograms
desmopressin per mL plasma/serum to about 10.0 picograms desmopressin per mL
plasma/serum and decreases urine production (productie 3.08 Ferring).
3.2.9.
Naar aanleiding van bezwaren van de examiner schrijft de vertegenwoordiger van [geïntimeerde 2] c.s., [F] (hierna: [F] ) op 12 juni 2009 (productie 3.20 Ferring):
(…)
As a threshold matter, the Examiner is asked to consider the fact that the invention as now defined in the amended claims is not predicated on the patentability of any particular dosage form, delivery vehicle or drug formulation per se, but rather is based (at least in part) on the discovery that very low doses of desmopressin can be used to effect antidiuresis without inducing life-threatening hyponatraemia (…).
In such circumstances, it is submitted that the recited plasma/serum concentrations are in fact “essential features” of the Invention as now claimed, since the core of the Invention lies in the discovery of the utility of very low desmopressin doses and not in the discovery of any surprisingly effective delivery vehicle or drug formulation per se. (pagina 2)
(…)
5. Inventive step
(…)
Thus, the invention now claimed achieves a novel and surprising effect: desmopressin can safely be used to effectively interrupt urine production - that is, induce voiding postponement, less frequent urination, and other antidiuretic effects, and yet avoid, decrease or eliminate induction of hyponatraemia. This is accomplished by controlling the duration of the anti-diuretic effect of desmopressin by controlling its blood concentration and switching it “off” at the desired time as the concentration of the circulating drug is cleared by the body and falls below a concentration effective to activate kidney water channels.
Thus, the application in suit provides a way essentially to uncouple desmopressin's known antidiuretic effects from its known hyponatraemia-inducing effect administering a small dose of desmopressin so as to maintain a blood concentration within a narrow range considerably lower than that used in any clinical practice of the past.
The experiments described in the application in suit in Example 8 (pages 29 et seq.) show that much lower blood concentrations of desmopressin than have been used clinically in the prior art are sufficient to induce an interruption in urine production to obtain a drug effect with a desmopressin dose so low that the drug's concentration falls below the activation level in a short time as it is cleared naturally by the body. Such natural clearance mechanisms "automatically" terminate drug-induced urine production inhibition: as the drug concentration falls below a level effective to activate kidney water channels, normal urine production resumes.
It is therefore submitted that the invention as now claimed is based on a discovery that is far too significant to be dismissed as lacking an inventive step. (pagina 7).
3.2.10.
In de periode daarna zijn de in conclusie 1 genoemde toedieningswijzen geschrapt en is conclusie 1 beperkt tot adult nocturia.
3.2.11.
Het EOB heeft op 7 februari 2011 aangegeven van plan te zijn een Europees octrooi te verlenen op de conclusies van EP 419 zoals toen in behandeling. De aanvrage voor EP 419 waarvoor het EOB bereid is octrooi te verlenen, bevat de volgende conclusies:
CLAIMS
1. A pharmaceutical composition comprising desmopressin and a pharmaceutically acceptable carrier for use in the treatment of adult nocturia, said use comprising the delivery of said composition to establish a steady plasma/serum desmopressin concentration in the range of from about 0.1 picograms to about 10.0 picograms per mL plasma/serum.
2. The composition for use according to claim 1 wherein said use establishes a steady plasma/serum desmopressin concentration in the range of from about 0.5 picograms to about 5.0 picograms desmopressin per mL plasma/serum.
3. The composition for use according to claim 1 or claim 2 wherein said delivery is selected from: subcutaneous, transmucosal, intranasal, transdermal and intradermal delivery.
4. The composition for use according to claim 1 or claim 2 wherein the composition is formulated for delivery across the sublingual mucosa.
(productie 3.29 Ferring, door Ferring aangeduid als het Druckexemplar)
In de beschrijving van deze aanvraag is onder meer vermeld:
“This clinical study demonstrates that desmopressin can produce this essential antidiuretic effect at much lower doses and lower blood concentrations than previously thought. Therefore, lower doses and concentrations of desmopressin may be used for treating patients with all of the above conditions.”
3.2.12.
Reprise staat als aanvraagster in het octrooiregister van het EOB (hierna ook: het octrooiregister) vermeld sedert maart 2007. Reprise verwierf volgens het octrooiregister de rechten op EP 419 door overdracht door [geïntimeerde 2] aan Reprise (productie 3.10 Ferring).
3.2.13.
[geïntimeerde 2] heeft WO 707 doorgezet in een aantal landen buiten Europa, hetgeen leidde tot nationale aanvragen in die landen. Vlak voordat het EOB had aangegeven een octrooi te verlenen heeft Reprise vijf divisionals ingediend (die moeten worden gedekt door de inhoud van de oorspronkelijke aanvrage).
3.2.14.
Op een verzoek van Ferring van 28 maart 2011 heeft het EOB de verlenings-procedure van EP 419 en de divisionals geschorst. Allergan heeft het EOB verzocht die schorsing op te heffen. In een beslissing van 13 november 2013 heeft de Legal Board of Appeal dat verzoek van Allergan afgewezen.
3.3.
Overige feiten tot november 2002
3.3.1.
Ferring heeft Fase II (45A07- 39) en fase III (NOCT-2A in mannen en NOCT-3A in vrouwen) studies met tabletten van 0,1 mg, 0,2 mg en 0,4 mg naar de werking van desmopressine in Nocturia-patiënten uitgevoerd in respectievelijk 1996 en de periode van oktober 1998 tot april 2000. In 2000 en 2001 heeft de Ferringgroep voor diverse landen marktvergunningen aangevraagd voor haar Minirin tabletten voor de indicatie nocturia.
3.3.2.
In Finland werd een marktvergunning als eerste verleend in augustus 2001 en vanaf dat moment bracht Ferring daar desmopressine tabletten op de markt van 0.1 mg (= 100 µg/mcg) voor de behandeling van nocturia.
3.3.3.
In een intern Expert Report over desmopressine van [A] en [B] van 6 december 2000 (productie 20 Ferring, waarbij slechts 3 van de 23 pagina’s zijn overgelegd) is in de samenvatting vermeld:
[vertrouwelijke informatie]. en

3.3.4.
Eind 2000 werd een Hyponatraemia Task Force binnen de Ferring-groep opgericht. In het eindrapport van deze task force van 29 mei 2001 is vermeld (productie 17 Ferring): [vertrouwelijke informatie].
De Hyponatraemia Task Force concludeert dat de behandeling van nocturia patienten met desmopressine zou moeten aanvangen met een dosering van 0,1 mg voor het slapen gaan: [vertrouwelijke informatie].
3.3.5.
Op 30 augustus 2001 vond een Newmin team project meeting plaats te Kopenhagen over desmopressine en nocturia. [geïntimeerde 2] was in Kopenhagen van 27 tot met 29 augustus 2001 en reisde terug naar de VS op 29 augustus 2001. [geïntimeerde 2] is in die periode aanwezig geweest bij een bijeenkomst of bijeenkomsten over Degarelix van de Ferring-groep, een medicijn voor de behandeling van prostaatkanker van de Ferringgroep dat niets met nocturia te maken heeft. In timesheets van [geïntimeerde 2] ’s over augustus 2001 heeft hij genoteerd dat hij in die maand 1,5 uur heeft besteed aan “Desmopressin Nocturia program” (producties 25a en 25b [geïntimeerde 2] ). [geïntimeerde 2] en [E] hielden zich in die periode ook bezig met goedkeuring van het bestaande desmopressine product in de VS. [geïntimeerde 2] heeft 10 september 2001 (betreffende Estimated Costs of Additional Clinical Program for Desmopressin Adult Nocturia) en 4 januari 2002 (samen met [E] ) (betreffende Review of Desmopressin Nocturia Clinical Dossier) memo’s aan medewerkers van de Ferring-groep geschreven over desmopressine voor nocturia (productie 40 en 42 [geïntimeerde 2] ). Deze gaan over de regulatory in verband met het verkrijgen van een marktvergunning van de FDA in de VS. In de memo van 10 september 2001 schrijft [geïntimeerde 2] :
I have only recently and in a cursory fashion begun to review the Desmopressin Nocturia FDA briefing document and summary of EU regulatory questions. My thoughts and recommendations on the program are not fully formed at present.
3.3.6.
In het najaar van 2001 werd een studie (CS004) verricht waarbij sublinguale toediening van desmopressine werd onderzocht. Aan gezonde vrijwilligers werd 200, 400 en 800 µg desmopressine toegediend onder de tong teneinde te onderzoeken of sublingusle toediening leidde tot en betere biobeschikbaarheid.
3.3.7.
In het najaar van 2001 heeft de Ferringgroep aan EMF Consulting (hierna:EMF) opdracht gegeven om door middel van zogenaamde ‘PKPD modelling’ van beschikbare data (uit de fases I, II en III studies van desmopressine in gezonde vrijwilligers en patiënten) een statistische studie te doen naar plasmaconcentraties bij verschillende doseringen desmopressine.
3.3.8.
Tijdens een Board Meeting op 11 oktober 2001 heeft [E] de hieronder weergegeven slide getoond:
[vertrouwelijke informatie].
3.3.9.
Op 16 januari 2002 heeft een bijeenkomst plaatsgevonden van de RDMC, waarbij [A] , [B] , [geïntimeerde 2] en [E] aanwezig waren en waarbij de mogelijke sublinguale toediening is besproken (zie notulen RDMC Meeting, productie 47 [geïntimeerde 2] ).
3.3.10.
[B] was betrokken bij de modellering van de data door EMF. Dit onderzoek ving aan in september 2001en leidde tot rapportages van 19 februari en 6 mei 2002. In het eindrapport van EMF van 6 mei 2002 (deels overgelegd als productie 21 Ferring) is vermeld, althans daaruit bleek
[vertrouwelijke informatie].
3.3.11.
In een e-mail van 18 maart 2002 heeft [C] een voorstel gedaan voor nieuwe studies aan onder andere [A] , [B] , [E] en [geïntimeerde 2] (productie 22 Ferring). Hierin is onder meer vermeld:
[vertrouwelijke informatie].
3.3.12.
Gedurende een bijeenkomst van de R&D Committee van de Ferringgroep op 15 en 16 april 2002 in Chilworth, Verenigd Koninkrijk, heeft [A] een presentatie gegeven. Op een slide van die presentatie is vermeld:
[vertrouwelijke informatie].
3.3.13.
Voordat een product op de markt mag komen moet het in beginsel 3 fases van klinische studies succesvol doorlopen: in fase I wordt het middel getest in gezonde vrijwilligers, in Fase II en III in patiënten.
3.3.14.
Begin 2002 is een klinische Fase I studie CS007 voorbereid voor het gebruik van desmopressine voor onder andere de indicatie nocturia. Het was de bedoeling dat de studie zou worden uitgevoerd met toepassing van de orodispersibele tablet. In het concept-protocol van april 2002 (productie 24 Ferring) is vermeld:
[vertrouwelijke informatie].
3.3.15.
Voor de productie van de orodispersibele desmopressine-tabletten werd door Ferring gekozen voor de door [G] ontwikkelde Zydis-technologie (een smelttablet), waarvoor [G] op 7 april 2000 een PCT-octrooiaanvrage heeft gedaan (WO 117) . De bedoeling was dat CS007 zou worden uitgevoerd door toediening van desmopressine in Zydis form door middel van een smelttablet. Op dat moment was een desmopressine smelttablet met de gewenste lage doseringen echter nog niet beschikbaar.
3.3.16.
In mei 2002 is een presentatie voorbereid door [H] (hierna: [H] ) werkzaam bij de Ferring-groep bij het team van [B] over de achtergrond en het doel van CS007; hierbij hoorden de volgende slides (productie 25 Ferring):
[vertrouwelijke informatie].
en
[vertrouwelijke informatie].
3.3.17.
Op 31 mei 2002 schrijft [B] aan [geïntimeerde 2] (productie 29 Ferring):
[vertrouwelijke informatie].
These are:
[vertrouwelijke informatie].
Studie CS009 betrof intraveneuze toediening van lage doses desmopressine. CS009 is bij Covance in de VS uitgevoerd. [geïntimeerde 2] is betrokken geweest bij de voorbereiding en uitvoering van deze studie.
3.3.18.
Bij mail van 7 juni 2002 zendt [I] , werkzaam bij het team van [B] aan [geïntimeerde 2] , met onder anderen [A] en [B] in de cc: (productie 20 [geïntimeerde 2] ) een draft protocol for the proposed desmopressin i.v.low dose study en een list of assumptions that we made in connection with this first outline.
In het concept-protocol d.d. 6 juni 2002 is onder Assumptions to draft protocol (…) CS009 vermeld:
[vertrouwelijke informatie].
3.3.19.
Op (een van de versies van) het concept-protocol heeft [geïntimeerde 2] vervolgens aantekeningen gemaakt. Hij heeft een aantal wijzigingen voorgesteld in het concept-protocol van CS009 (productie 32 Ferring): de doses werden uitgedrukt in ng/kg in plaats van absolute getallen en het aantal te testen doses werd teruggebracht van vijf (10, 20, 40, 80 en 160 µg bij sublinguale toediening /30, 60,125, 250 en 500 ng I.V.) naar de drie laagste doses (van 0.45, 0.9 en 1.8 ng/kg). Voorts werd [geïntimeerde 2] als “Sponsor representative” vermeld.
3.3.20.
[geïntimeerde 2] heeft blijkens zijn Consulting Statements en tijdschrijflijsten (productie 25B [geïntimeerde 2] ) 56 uur in juni 2002 en 47,5 uur in juli 2002 geschreven en gedeclareerd voor “(IV Desmo/) Newmin Program”.
3.3.21.
Tijdens een medical directors bijeenkomst in Kopenhagen op 14 juni 2002 heeft [A] een presentatie gehouden waarbij de resultaten van klinische studies en analyse van nieuwe gegevens werden toegelicht (productie 7 Ferring). Daarbij werd de volgende grafiek, gebaseerd op de data-analyse van de studie naar het anti-diuretisch effect van drie verschillende doseringen van 0,1, 0,2 en 0,4 mg (slide 13 van de presentatie, opgenomen in punt 51 ID) getoond.
[vertrouwelijke informatie].
Voorts werd de in overweging 3.3.12 afgedrukte slide (als slide 14) getoond.
[vertrouwelijke informatie].
3.3.22.
In de periode april tot augustus 2002 is een Investigator’s Brochure (hierna ook: IB), waarvan de definitieve versie dateert van 1 augustus 2002 en is “approved by [A] ” (productie 8 Ferring deels en punten 60- 61 ID), voorbereid en opgesteld. Een IB is een voorwaarde voor het uitvoeren van klinische studies. Deze wordt ter beschikking gesteld aan personen die betrokken zijn bij de uitvoering van de gelande klinische studies.
In deze IB is vermeld:
[vertrouwelijke informatie].
3.3.23
De studie CS009 is in september 2002 uitgevoerd. De test bevestigde het meetbare effect van lage doses desmopressin.
3.3.24.
Op 25 september 2002 werd het protocol voor studie CS007a gefinaliseerd, waarbij doses van 10, 20 en 40 µg zouden worden getest met een sublinguale tablet. Deze doses waren ook genoemd in [B] eerdere protocol voor de studie CS007 van april 2001.
3.3.25.
In mei 2002 is door Ferring een Britse provisionele octrooiaanvrage ingediend, met nummer 0210397 (hierna: GB 397). Op basis daarvan heeft Ferring in september 2002 een PCT-aanvrage ingediend, die is gepubliceerd onder nummer 2003/094885 (hierna: WO 885), met inroeping van de Britse prioriteitsdatum. Na correspondentie tussen [C] en de octrooigemachtigde van Ferring, [J] (hierna: [J] ) worden [… 1] , [B] , [… 2] , [C] , [E] en [geïntimeerde 2] als uitvinders in de PCT-aanvrage WO 885 genoemd. [J] schrijft daarover in een e-mail van 19 september 2002 (productie 38 [geïntimeerde 2] ):
“ (…)
[B] analyzed existing Ferring data and showed that lower doses than had previously been administered orally should be feasible. Such low doses are contemplated in this invention.
(…)
[E] and [geïntimeerde 2] jointly decided that sublingual/transmucosal absorption was the route of choice”.
De WO 885 is vervolgens ingetrokken.
3.3.26.
In 2003 heeft Ferring een gewijzigde PCT-aanvrage ingediend, die is gepubliceerd onder nummer 2003/094886 (WO 886), eveneens met inroeping van de Britse prioriteitsdatum. Ferring is houdster van het Europese octrooi 1.501 534 (hierna: EP 534) voor desmopressin in an orodispersible dosage form, verleend op de internationale aanvraag WO 886. Ook dit octrooi roept prioriteit in van 7 mei 2002 op basis van GB 397. De eerste drie conclusies van EP 534 (productie 61D Ferring) luiden in de oorspronkelijke Engelse tekst:
1. An orodispersible pharmaceutical dosage form of desmopressin acetate which
disintegrates in the mouth within 10 seconds.
2. The dosage form as claimed in claim I which is an orodispersible solid pharmaceutical
dosage form.
3. The dosage form as claimed in claim 1 or 2 which is adapted for sublingual
administration.
In de EP 534 zijn [geïntimeerde 2] en [E] niet als uitvinders genoemd.
3.4.
Overige feiten vanaf november 2002
3.4.1.
In november 2002 verzocht het hoofd klinische research and development bij Ferring, dr [K] (hierna: [K] ) aan [geïntimeerde 2] zijn rechten met betrekking tot eventuele uitvindingen over te dragen aan Ferring. [geïntimeerde 2] heeft geweigerd hieraan mee te werken. Hierna is de consultancyovereenkomst met [geïntimeerde 2] met onmiddellijke ingang beëindigd op 7 november 2002.
3.4.2.
In 2003 en 2004 is tussen de advocaat van [geïntimeerde 2] , [L] (hierna: [L] ) en de [functienaam 3] van Ferring, [M] (hierna: [M] ) gecorrespondeerd (productie 12 [geïntimeerde 2] ).
3.4.3.
Op 9 april 2003 schrijft [M] aan [L] (productie 12k [geïntimeerde 2] ):
[vertrouwelijke informatie].
3.4.4.
Op 17 april 2003 schrijft [L] in een e-mail aan [M] (productie 12m [geïntimeerde 2] ):
[vertrouwelijke informatie].
Dr.
[vertrouwelijke informatie].
3.4.5.
In een brief van 29 april 2003 (productie 12o [geïntimeerde 2] ) schrijft [M] als reactie op voormelde brief:
[vertrouwelijke informatie].
3.4.6.
In een brief van 9 december 2004 schrijft [M] aan [L] (productie 12t [geïntimeerde 2] ):
[vertrouwelijke informatie].
Voormelde PCT/US-aanvrage is later ingetrokken.
3.4.7.
Op 14 december 2004 schrijft [L] aan [M] per fax (productie 12u [geïntimeerde 2] ):
[vertrouwelijke informatie].
3.4.8.
In een tweede fax van diezelfde datum (productie 12v Reprise) schrijft [L] aan [M] :
[vertrouwelijke informatie].
3.4.9.
In 2008/2009 heeft Ferring octrooi aangevraagd voor een low dose uitvinding met [A] als uitvinder nadat zij Fase III klinische studies daarnaar had verricht in nocturia patiënten in 2007.
3.4.10.
In 2017 heeft [geïntimeerde 2] c.s. voor een desmopressine neusspray een marktvergunning verkregen (vergelijk productie 93 Ferring). Dit product is daarna in Amerika onder de naam Noctiva op de markt gekomen. [geïntimeerde 2] c.s. brengt geen product buiten de Verenigde Staten op de markt.
4. Andere procedures tussen partijen
4.1.
De NL-procedure over de EP 1 501 534 (hierna: EP534)
4.1.1.
[geïntimeerde 2] c.s en twee andere Allergan-vennootschappen hebben in een procedure voor de rechtbank Den Haag een verklaring voor recht gevorderd dat aan hun de aanspraak toekomt op het aandeel in EP 534 (verleend op de WO 886) dat wordt gekenmerkt door de sublinguale toediening van desmopressine, in het bijzonder het aandeel in EP 534 bestaande uit conclusie 3 en daarvan afhankelijke conclusies, met daarmee samenhangende vorderingen.
4.1.2.
De rechtbank heeft bij vonnis van 13 juni 2012 het gevorderde afgewezen (producties 13 en 61 D Ferring). Zij heeft overwogen:
“4.1.1. Volgens artikel 78 ROW kan een octrooi geheel, gedeeltelijk of wat betreft een
aandeel daarin worden opgeëist door degene die krachtens artikel 11,12 of 13 dan wel,
indien het een Europees octrooi betreft, krachtens artikel 60, eerste lid, van het Europees
Octrooiverdrag aanspraak of mede aanspraak heeft op dat octrooi.
4.1.2.
Naar de rechtbank begrijpt vordert Reprise c.s. dat aan haar de exclusieve rechten
op de in EP 534 geclaimde materie worden toegekend, voor zover dit omvat de maatregel
van sublinguale toediening van desmopressine. Zij vordert derhalve uitdrukkelijk geen
opeising van een aandeel in de geoctrooieerde materie, wat zou leiden tot een gezamenlijk
aan Ferring en Reprise c.s. toekomend recht, maar een gedeeltelijke opeising van de
geoctrooieerde materie. Zulks heeft Reprise c.s. ter zitting in tweede termijn ook nog
uitdrukkelijk gesteld.
4.1.3.
Reprise c.s. erkent dat de orodispersible doseringsvorm van desmopressine, zoals
geclaimd in conclusie 1 van het octrooi, als zodanig door Ferring is ontwikkeld en aan haar
toekomt. Deze materie maakt echter deel uit van alle conclusies van het octrooi en met name
ook van de conclusies 3,16 en 17 (en daarvan afhankelijke conclusies) die tevens de door
Reprise c.s. geclaimde materie bevatten. De vorderingen van Reprise c.s. komen er dus op
neer dat deze conclusies zouden moeten worden gesplitst in materie die aan Reprise c.s.
toebehoort en materie die aan Ferring toebehoort. Een dergelijke gedeeltelijke opeising is
echter niet mogelijk omdat voor uitsluitend de door Reprise c.s. geclaimde materie - de
sublinguale toediening van desmopressine - geen octrooibescherming is verleend, maar
slechts voor een combinatie van maatregelen die deels van Reprise c.s. en deels van Ferring
afkomstig zouden zijn. Ook voor zover Reprise c.s. aan haar vorderingen het gestelde
onrechtmatig handelen van Ferring ten grondslag legt, kan dit niet leiden tot toekenning van
rechten op het octrooi in de door Reprise c.s. gevorderde vorm. Al om deze reden kunnen de
vorderingen 1 tot en met 9 niet worden toegewezen voor zover die vorderingen zien op het
Nederlandse deel van EP 534.
4.1.3.
[geïntimeerde 2] c.s. heeft hoger beroep ingesteld en een memorie van grieven genomen. De procedure is aangehouden met het oog op de hierna te vermelden procedure in de Verenigde Staten.
4.2.
De US procedure over de US-octrooien 203, 321 en 761 (conventie/claim) en de US-octrooien 429 en 654 (reconventie/counterclaim)
4.2.1.
Bij dagvaardingen van 5 en/of 6 april 2012 heeft Ferring tezamen met twee andere Ferring vennootschappen in de Verenigde Staten voor de The United States District Court for the Southern District of New York (hierna: SDNY of de Amerikaanse rechter) in een procedure tegen [geïntimeerde 2] c.s., een aantal andere Allergan- en Serenity-vennootschappen en [E] “correction of inventership” van de Amerikaanse octrooien US 7, 405, 203 (hierna: US 203), US 7,579,321 (hierna: US 321) – en US 7, 799,761 (hierna: US 761) betreffende “Pharmaceutical Compositions Including Low dosages of desmopressin”, issued in juli 2008, augustus 2009 en september 2010, gevorderd (productie 15 [geïntimeerde 2] ). Deze octrooien komen voort uit de PCT aanvrage WO 153. Daarnaast stelde Ferring c.s diverse andere vorderingen in. Zij beriep zich op patent laws of the United States en op diverse andere algemene civielrechtelijke grondslagen.
4.2.2.
Als tegenvordering hebben Reprise c.s. “correction of inventorship” gevorderd van de octrooien 7,560,429 (hierna: US 429) – en 7,947,654 (hierna: US 654) betreffende een “Orodispersible solid pharmaceutical dosage form of desmopressin acetate” (vergelijk productie 98 Ferring: order SDNY).
4.2.3.
Bij uitspraken van 19 maart 2013 en 31 augustus 2015 (in conventie) is, kort gezegd, beslist dat Ferring “equitably estopped” is voor wat betreft haar opeisingsvorderingen (productie 94 [geïntimeerde 2] ). Ferring is tegen deze beslissing in beroep gegaan.
4.2.4.
De procedure is voortgezet voor wat betreft de counterclaim. In februari 2018 heeft het eerste deel van de procedure plaatsgevonden, waarbij de Amerikaanse advocaat van [geïntimeerde 2] c.s., Jim Sottile, een opening statement heeft gegeven. Voorts hebben toen depositions (voor-verhoren) plaatsgevonden en zijn direct testimonies (verklaringen op vragen van de eigen advocaat) afgelegd (waarvan de transcripts zijn overgelegd als productie 35 [geïntimeerde 2] ). Vervolgens heeft in juli 2019 het tweede deel van de procedure plaatsgevonden. Toen heeft de cross-examination en redirect plaatsgevonden van [geïntimeerde 2] , [E] en [A] (waarvan de transcripts zijn overgelegd als producties 100, 101 en 102 Ferring).
Bij Order van 27 september 2019 (productie 98 Ferring) heeft de SDNY de tegenvorderingen van [geïntimeerde 2] c.s. en de andere eisers in reconventie afgewezen.
4.2.5.
[geïntimeerde 2] heeft blijkens de order van United States Court of Appeals for the Federal Circuit van 12 december 2019 (productie 90 Ferring) haar beroep tegen het vonnis van 27 september 2019 ingetrokken.
5. De vorderingen en de verweren
5.1.
Ferring vordert, na wijziging van eis, in de zaak 1, kort gezegd, dat het hof, de bestreden vonnissen vernietigt en voor zover mogelijk uitvoerbaar bij voorraad:
Primair
- a.
verklaart voor recht dat aan Ferring de aanspraak toekomt op (verlening van een octrooi op) EP 419, de divisionals, WO 707 en de nationale aanvragen;
- b.
Reprise gebiedt EP 419, de divisionals, WO 707 en de nationale aanvragen aan Ferring over te dragen;
- c.
bepaalt dat het vonnis dezelfde kracht heeft als een in wettige vorm opgemaakte akte tot overdracht;
- d.
verklaart voor recht dat [A] de uitvinder is van het onderwerp van EP 419, de divisionals, WO 707 en de nationale aanvragen;
- e.
verklaart voor recht dat [geïntimeerde 2] geen uitvinder is van het onderwerp van EP 419, de divisionals, WO 707 en de nationale aanvragen;
- f.
[geïntimeerde 2] gebiedt alle benodigde medewerking te verlenen aan de registratie van [A] als uitvinder van EP 419, de divisionals, WO 707 en de nationale aanvragen;
- g.
verklaart voor recht dat [geïntimeerde 2] en Reprise (of Allergan) geen rechthebbende zijn op EP 419, de divisionals, WO 707 en de nationale aanvragen;
subsidiair ten aanzien van de vordering sub d (met betrekking tot uitvinderschap)
verklaart voor recht dat [A] en [B] mede-uitvinders zijn van het onderwerp van EP 419 en de divisionals;
meer subsidiar en uiterst subsidiar
- i.
verklaart voor recht dat aan Ferring de aanspraak toekomt op een gedeelte van, althans een aandeel in (verlening van een octrooi op) EP 419, de divisionals, WO 707 en de nationale aanvragen;
- ii.
Reprise gebiedt het betreffende gedeelte van, althans aandeel in EP 419, de divisionals, WO 707 en de nationale aanvragen aan Ferring over te dragen;
- iii.
bepaalt dat het vonnis dezelfde kracht heeft als een in wettige vorm opgemaakte akte tot overdracht;
- iv.
verklaart voor recht dat [A] mede-uitvinder is van het onderwerp van EP 419 en de divisionals, althans dat [A] en [B] mede-uitvinders daarvan zijn;
en voorts primair en (meer) subsidiair
Reprise c.s. hoofdelijk veroordeelt in de kosten van de procedure, te begroten op de voet van artikel 1019h Rv, vermeerderd met nakosten en wettelijke rente.
5.2.
In de zaak 2 heeft Ferring dezelfde vorderingen voorwaardelijk ingesteld, met dien verstande dat bij de vorderingen beschreven onder (b) en (j) Allergan in plaats van Reprise gelezen dient te worden. De vorderingen in deze zaak zijn ingesteld voor zover (kort samengevat) (i) Allergan geacht wordt de geregistreerde aanvrager te zijn van (één of meer van) de in geschil zijnde octrooiaanvragen en/of (ii) Allergan geacht wordt de rechtsopvolger van Reprise te zijn en/of (iii) (a) het hof van oordeel zou zijn dat Allergan niet gebonden is aan een uitspraak in de zaak 1 of (b) het EOB relevant zou achten dat een procedure aanhangig is tegen Allergan en/of (c) Ferring in die procedure niet-ontvankelijk zou worden verklaard.
5.3
Ferring legt aan deze vorderingen het volgende ten grondslag. De uitvinding waarvoor in EP 419, de divisionals en de niet-Europese aanvragen octrooirechten zijn aangevraagd of verkregen, is niet door [geïntimeerde 2] gedaan, maar door [A] . De uitvinding betreft een zogenaamd ‘low-dose concept’ dat [A] heeft uitgevonden en vanaf begin 2000 presenteerde binnen de Ferringgroep. [geïntimeerde 2] heeft de kennis van het low-dose concept aan [A] ontleend in de periode dat hij als consultant werkzaamheden verrichtte voor Ferring Pharmaceuticals Inc. en heeft na de beëindiging van die werkzaamheden WO 707 aangevraagd. Subsidiair stelt Ferring dat de uitvinding is gedaan door en ontleend aan [A] en [B] gezamenlijk. De rechten van [A] en [B] komen toe aan Ferring. Op grond van artikel 60 jo. 61 EOV2.is niet Reprise, [geïntimeerde 2] of Allergan, maar Ferring gerechtigd tot (de aanvrage voor) EP 419 en de divisionals. Op dezelfde feitelijke gronden maakt Ferring aanspraak op WO 707 en de nationale aanvragen naar het toepasselijke nationale recht.
5.4.
[geïntimeerde 2] c.s. heeft onder meer de volgende verweren (deels slechts in eerste aanleg) gevoerd:
- 1.
[geïntimeerde 2] is de uitvinder van het ( [geïntimeerde 2] ) low dose concept, inhoudende dat hyponatriëmie wordt veroorzaakt door te grote hoeveelheden desmopressine in het bloed en dat een veel lagere dosering de urineproductie evengoed kan remmen maar voor een kortere duur gelijk aan of korter dan de slaapperiode, als hierna nader omschreven;
- 2.
de uitvinding van [geïntimeerde 2] bestaat uit twee aspecten: het low dose concept en de toediening via subcutane (onder de huid), transmucosale (via een slijmvies), met inbegrip van sublinguale (onder de tong), transdermale (via de huid) en intradermale (in de bovenste laag van de huid) afgifteroutes, in het bijzonder sublinguale toediening, waardoor de bio beschikbaarheid zou worden verhoogd, waardoor een low dose desmopressine effectief en veilig kan worden gebruikt;
- 3.
Ferring heeft haar rechten verwerkt;
- 4.
er is geen grond voor opeising van de nationale, niet-Europese octrooien;
- 5.
diverse “formele” verweren: het vorderingsrecht van Ferring is verjaard, Ferring is niet de rechthebbende en Ferring heeft de verkeerde personen gedagvaard.
5.5.
In hoger beroep heeft Ferring haar eis vermeerderd met meer subsidiaire vorderingen.
Daaraan legt zij ten grondslag dat aan haar als opdrachtgever/werkgever van [geïntimeerde 2] en [E] de octrooirechten toekomen.
6. De beslissing van de rechtbank
De rechtbank heeft het gevorderde afgewezen. Zij heeft daartoe, kort gezegd, overwogen
dat bij de beoordeling van de voor opeising relevante materie van de aanvrage niet kan worden uitgegaan van de tekst van het Druckexemplar (productie 3.29 Ferring), waarin de versie van die aanvrage is opgenomen waarop het EOB bereid is octrooi te verlenen, maar van de conclusies en beschrijving zoals oorspronkelijk opgenomen in WO 707;
dat uit die oorspronkelijke beschrijving blijkt dat de in WO 707 geopenbaarde uitvinding twee aspecten heeft, namelijk:
a. een farmaceutisch preparaat met een dosering van 0,5 ng tot 20 µg desmopressine – hierna ook: het eerste aspect – en
b. een farmaceutische samenstelling die desmopressine omvat, waarbij die samenstelling een steady plasma/serum desmopressine concentratie in het bereik van 0,1 pg/ml tot 10 pg/ml creëert – hierna ook: het tweede aspect –;
3. dat [A] niet kan worden aangemerkt als uitvinder van het eerste aspect omdat niet kan worden aangenomen dat [A] met zijn low dose concept tevens het oog heeft gehad op doseringen tussen de 0,5 ng tot 20 µg en de rechtbank niet toekomt aan het door Ferring aangeboden getuigenbewijs nu Ferring het tegendeel onvoldoende heeft onderbouwd;
4. dat de sublinguale toedieningsvorm verklaart waarom de dosering die geclaimd wordt zoveel lager ligt dan de tot dan toe gebruikelijke doseringen en [A] evenmin kan worden aangemerkt als uitvinder van het tweede aspect;
5. dat de subsidiaire stelling van Ferring dat [B] uitvinder is van de in de WO 707 en EP 419 vervatte materie van de hand wordt gewezen;
6. dat de meer subsidiaire stelling van Ferring dat zij ( [A] en [B] ) uitvinder zijn van een gedeelte van EP 419 faalt, nu [A] en [B] niet als mede-uitvinder of uitvinder van een deel van de materie van WO 707 kunnen worden aangemerkt.
Beoordeling in hoger beroep
7. De grieven
7.1.
In de memorie van grieven – hierna ook: MvG – heeft Ferring 26 grieven (genummerd 1 tot en met 18, waarbij grief 16 bestaat uit 4 sub-grieven en grief 17 uit 6 sub-grieven) tegen het vonnis aangevoerd en (de grondslag van) haar eis gewijzigd.
7.2.
De grieven 9 (deels), 16A, 16B en 16C richten zich tegen de feitenvaststelling door de rechtbank in de overwegingen 3.4, 3.12, 3.15, 3.19 en 3.22 van het bestreden eindvonnis. Het hof zal evenals de rechtbank uitgaan van de door grief 16B bestreden feitenvaststelling met betrekking tot de overdracht van de octrooiaanvragen door [geïntimeerde 2] aan Reprise in 2007 en van Reprise aan Allergan in 2011 daar Reprise c.s. dat gesteld heeft en ook Ferring dat aanvankelijk heeft gesteld met een beroep op en onder overlegging van de desbetreffende in het register van het EOB opgenomen aktes van overdracht (productie 3.10 en 3.35 (in zaak 2) Ferring) en deze overdrachten (ook later) niet gemotiveerd heeft bestreden. De feitenvaststelling in de overwegingen 3.4 en 3.19, waartegen grieven 16A en 9 zich richten, wordt op zichzelf niet bestreden. De bezwaren richten zich tegen de onvolledigheid daarvan of de conclusies die de rechtbank daaruit trekt of lijkt te trekken. In zoverre falen deze grieven. Het hof heeft met de in de grieven 16A en 16 C neergelegde bezwaren van Ferring rekening gehouden bij zijn feitenvaststelling en zal het in grief 9 neergelegde bezwaar hierna behandelen. De grieven kunnen op zichzelf niet tot vernietiging leiden.
7.3.
Met grief 15 verwijt Ferring de rechtbank in rechtsoverwegingen 6.24 en 6.29 van het bestreden vonnis te hebben overwogen dat tussen partijen vast staat dat het idee van de sublinguale toedieningsvorm van [geïntimeerde 2] afkomstig is en dat gesteld noch gebleken is dat Ferring de combinatie van het doseringsbereik en een sublinguale toedieningsvorm heeft uitgevonden. Ferring betwist dat [geïntimeerde 2] de uitvinder van de sublinguale toedieningsvorm is. Vaststaat dat tussen partijen in Nederland en de Verenigde Staten procedures aanhangig zijn of waren die juist gaan over de vraag wie de uitvinder de sublinguale toepassing is en waarin Ferring stelt dat werknemers van Ferring het low dose concept en de sublinguale toedieningsvorm hebben uitgevonden. Gelet op gemotiveerde betwisting door Ferring kan niet als vaststaand worden aangenomen dat het idee van de sublinguale toedieningsvorm van hem afkomstig is en dat voormelde combinatie niet door (werknemers van) Ferring is uitgevonden. De grief slaagt derhalve, maar kan op zichzelf niet tot vernietiging leiden.
7.4.
De grieven 17D en 17E richten zich tegen een aantal processuele beslissingen van de rechtbank, zoals het niet verlenen van een akte van niet-dienen, het verlenen van uitstel voor het nemen van de conclusie van antwoord aan [geïntimeerde 2] c.s., het toelaten van door [geïntimeerde 2] c.s. kort voor het pleidooi ingediende nieuwe stukken en tijdens het pleidooi aangevoerde nieuwe stellingen. Ook deze grieven falen, althans kunnen niet tot vernietiging leiden nu tegen deze beslissingen van de rechtbank geen beroep open staat (anders dan tegen het wel verlenen van een akte van niet-dienen) en/of [geïntimeerde 2] c.s. bij de grieven geen belang heeft. De verweren die [geïntimeerde 2] in eerste aanleg voerde, voert zij ook in hoger beroep en Ferring heeft in hoger beroep voldoende mogelijkheid gehad alsnog op bedoelde stukken en stellingen te reageren. Overigens deelt het hof het oordeel van de rechtbank in het tussenvonnis over het verlenen van uitstel voor het nemen van de conclusie van antwoord.
7.5.
Grieven 1 tot en met 5, 7 tot en met 14, 16D, 17 A – C en 18 (hierna ook aan te duiden als de hoofdgrieven) richten zich tegen afwijzing van de primaire en subsidiaire vorderingen van Ferring (kort gezegd dat aan Ferring de aanspraak toekomt op de octrooiaanvragen) en de daarvoor gegeven motivering. De grieven 6 en 18 (voorts) richten zich tegen afwijzing van de (meer) subsidiaire vorderingen (kort gezegd dat aan Ferring de aanspraak toekomt op een gedeelte van en/of aandeel in de octrooiaanvragen) en de daarvoor gegeven motivering.
7.6.
Grief 18 richt zich voorts tegen de veroordeling van Ferring in de proceskosten. Grief 17F richt zich tegen het oordeel van de rechtbank dat artikel 1019h Rv niet van toepassing is op de onderhavige procedure.
8. Uitstel van de uitspraak en heropening van het debat
8.1.
Nadat na de zitting van 13 september 2018 arrest was bepaald heeft Ferring per e-mail van 18 oktober 2019 verzocht het arrest aan te houden en de zaak naar de rol te verwijzen teneinde partijen de gelegenheid te geven zich uit te laten over doorslaggevende “nieuwe feiten” in de vorm van een zeer recente ontwikkeling in een aanverwante procedure. [geïntimeerde 2] c.s. heeft zich daartegen verzet. Wat deze nieuwe feiten meer concreet inhielden heeft Ferring in zijn bericht niet medegedeeld. In dit verband wijst het hof erop dat het een advocaat op grond van de artikel 21, lid 3 van de Gedragsregels advocatuur niet geoorloofd is zich zonder toestemming van de wederpartij tot de rechter te wenden nadat de uitspraak is bepaald. Het hof heeft vervolgens bij tussenarrest van 29 oktober 2019 een meervoudige comparitie van partijen bevolen om deze kwestie met partijen te bespreken. Daarmee heeft het hof de mogelijkheid willen creëren om te kunnen beoordelen of hier sprake was van zodanige bijzondere omstandigheden (als bedoeld in artikel 1.18 (artikel 1.15 oud)) van het landelijk procesreglement voor civiele dagvaardingszaken bij de gerechtshoven (hierna: het reglement) om af te wijken van het bepaalde in artikel 5.5 van het reglement (waarin is bepaald dat het hof geen kennis neemt van berichten van een partij nadat arrest is bepaald) en dus van voldoende klemmende redenen om de uitspraak, ook gelet op artikel 229 Rv aan te houden.3.Deze comparitie heeft plaatsgevonden op 25 februari 2020 (hierna ook: de eerste comparitie)
8.2.
Tijdens de eerste comparitie en uit de daarvoor overgelegde akte van Ferring bleek dat de recente ontwikkelingen de volgende waren:
- -
het vonnis van de Amerikaanse rechter van 27 september 2019 (hierna ook: het Amerikaanse vonnis) (productie 89 Ferring);
- -
de intrekking door [geïntimeerde 2] c.s. van het aanvankelijk ingestelde hoger beroep tegen dit vonnis van 12 december 2019 (productie 99 Ferring);
- -
de transcripts van de cross-examination en redirect van [geïntimeerde 2] , [E] en [A] (producties 100-102 Ferring).
8.3.
Vervolgens heeft het hof partijen in de gelegenheid gesteld zich hierover uit te laten bij aktes en tijdens een tweede meervoudige comparitie, die heeft plaatsgevonden op 1 juli 2020. Het hof heeft (dus) aangenomen dat sprake was van bijzondere omstandigheden en klemmende redenen als hiervoor bedoeld.
8.4.
Bij voormelde beslissingen heeft het hof in aanmerking genomen dat beide partijen zich herhaaldelijk op de (verklaringen van diverse betrokkenen in de) Amerikaanse procedure hebben beroepen. [geïntimeerde 2] c.s. heeft zich in de memorie van antwoord zeer uitvoerig op deze procedure en met name op de verklaringen (depositions) van [geïntimeerde 2] en [E] beroepen teneinde haar verweren in deze procedure te onderbouwen. Zij heeft de openingstatement van mr. Sottile, advocaat van [geïntimeerde 2] c.s. in de Amerikaanse procedure zelfs in haar memorie van antwoord geïntegreerd (pag. 20-36 MvA). Ook heeft zij zich herhaaldelijk beroepen op hetgeen [geïntimeerde 2] , [E] en [A] in de Amerikaanse procedure hebben verklaard. Voorts heeft [geïntimeerde 2] c.s. zowel in de Amerikaanse procedure in reconventie als in deze procedure de uitvinding van de sublinguale toedieningsvorm verbonden met de uitvinding van het low dose concept en gesteld dat [geïntimeerde 2] op (ongeveer) dezelfde momenten zowel de sublinguale toedieningsmethode als het low dose concept heeft bedacht (hierna ook: het Eureka-moment), deze uitvindingen aan/met [E] heeft (mee)gedeeld en vervolgens in augustus 2001 aan/met Ferring heeft (mee)gedeeld. In zoverre zijn de verklaringen van [geïntimeerde 2] en [E] en het oordeel van de Amerikaanse rechter over (de betrouwbaarheid van) deze verklaringen van belang voor de onderhavige procedure. Dat de Amerikaanse procedure (in reconventie) over andere octrooien en in het bijzonder over de sublinguale toedieningsvorm zou gaan en dat die zaak beoordeeld is naar Amerikaans recht kan daaraan niet voldoende afdoen. [geïntimeerde 2] c.s. heeft zelf in de memorie van antwoord gesteld dat de feiten en onderliggende stukken waarover het debat in Amerika gaat voor een belangrijk deel ook in de Nederlandse procedure aan de orde zijn. Vanaf 2019 stelt [geïntimeerde 2] c.s., in strijd met zijn eerdere stellingen, dat de stukken uit de Amerikaanse procedure niet van belang zijn voor deze procedure. Op grond van het bovenstaande verwerpt het hof deze stelling.
8.5.
Het hof kan aan deze stukken (voor zover relevant) bewijs ontlenen en/of deze anderszins aan zijn beslissing ten grondslag leggen. De rechter komt in dat verband een ruime beoordelingsvrijheid toe. In dit verband overweegt het hof dat uit het procesdossier van de Amerikaanse procedure kan worden afgeleid dat de Amerikaanse procedure dezelfde soort processuele waarborgen kent als de Nederlandse procedure en dat de getuigen [A] , [geïntimeerde 2] en [E] zeer uitvoerig zijn gehoord over in deze zaak relevante stellingen (zoals de vraag of [geïntimeerde 2] uitvindingen heeft (mee)gedeeld aan/ met Ferring) op een intensievere wijze dan in Nederland gebruikelijk is.
9. Strijd met artikel 21 Rv.
9.1.
Partijen verwijten elkaar over en weer te hebben gehandeld in strijd met artikel 21 Rv.
9.2.
[geïntimeerde 2] c.s. heeft Ferring verweten op diverse punten in strijd met artikel 21 Rv (en 85 Rv en 111 Rv, waarop zij in beroep niet meer is teruggekomen) te hebben gehandeld door niet alle relevante stukken volledig over te leggen en verbinden daaraan de conclusie dat stellingen en/of producties van de wederpartij buiten beschouwing moeten blijven en/ of aan Ferring andere procedurele sancties moeten worden opgelegd.
9.3.
Het hof verwerpt dit verweer. Een partij is niet gehouden alle mogelijk relevante stukken volledig over te leggen. Het gaat om de vraag of een partij bewust (bijvoorbeeld door een zodanige selectie van stukken over te leggen waardoor hij) een verkeerd beeld schetst met de bedoeling de rechter op het verkeerde been te zetten. [geïntimeerde 2] heeft niet concreet aangegeven op grond waarvan daarvan sprake zou zijn. Wat betreft het beroep op artikel 85 Rv heeft [geïntimeerde 2] c.s. evenmin onderbouwd dat Ferring zich zou hebben beroepen op stukken die zij niet heeft overgelegd. Als zij zich beroept op een gedeelte van een omvangrijker document verplicht artikel 85 Rv haar niet dat volledige document over te leggen, tenzij daarmee in strijd met artikel 21 Rv. gehandeld zou worden. Dat [geïntimeerde 2] c.s. niet de volledige Chilworth-presentatie uit 2002 heeft overgelegd kwalificeert niet als een handelen in strijd met voormelde artikelen. Ferring heeft zich beroepen op de slides die zij relevant achtte, waarna vervolgens [geïntimeerde 2] c.s. (die ook over deze presentatie beschikte en deze als productie 98 heeft overgelegd) zich heeft beroepen op de slide die hij relevant achtte. Dat geldt ook voor de verschillende conclusies die partijen uit dezelfde stukken trekken. Overigens heeft Ferring nog onbetwist
aangevoerd dat zij aanvankelijk beperkt was in het volledig overleggen van vertrouwelijke documenten omdat [geïntimeerde 2] c.s. niet wilde instemmen met een vertrouwelijkheidsregime en dat zij dat na instemming door [geïntimeerde 2] c.s. met en oplegging door het hof van het vertrouwelijkheidsregime alsnog heeft gedaan.
9.4.
Voor het eerst in haar akte april 2020 vordert Ferring (subsidiair) vergoeding van haar daadwerkelijke proceskosten wegens schending van artikel 21 Rv door [geïntimeerde 2] c.s. op grond van onrechtmatige daad en misbruik van procesrecht, gelet op de structureel onware en evident innerlijk tegenstrijdige stellingen van [geïntimeerde 2] c.s.
9.5.
[geïntimeerde 2] c.s. heeft zich erop beroepen dat deze vordering als strijdig met de twee-conclusie-regel buiten beschouwing moet worden gelaten. Het hof acht dit juist en zal deze vordering buiten beschouwing laten.
9.6.
Zowel het beroep van [geïntimeerde 2] c.s. als het beroep van Ferring op artikel 21 Rv. faalt derhalve.
10. Behandeling van de hoofdgrieven: wat is de uitvinding ?
10.1.
Het recht op (de aanvraag van) een Europees octrooi komt toe aan de uitvinder (of zijn rechtsopvolger of zijn werkgever).
10.2.
Om te beoordelen of een beroep op opeising kan slagen moet allereerst worden bepaald welke uitvinding de aanvrage inhoudt/ wat de materie of het onderwerp van de octrooiaanvrage is. Het hof is van oordeel dat het daarbij gaat om (de essentie van) de uitvinding (het inventieve concept/ het hart van de uitvinding) en dat daarvoor de formulering van de conclusies in de aanvrage niet beslissend is. Die geven immers aan welk monopolie op de uitvinding wordt geclaimd en dat kan beperkter zijn dan de uitvinding. De uitvinder die op grond van artikel 61, lid 1, sub a EOV de aanvrage overneemt en kan voortzetten en wijzigen, is aan die formulering niet gebonden, met dien verstande dat de vrijheid wordt begrensd door het in de oorspronkelijke aanvrage afgebakende bereik van de uitvinding. Die formulering kan wel van belang zijn om vast te stellen wat de uitvinding is.
10.3.
Om te bepalen wat de daarin gelegen (octrooieerbare) uitvinding is, is in casu ook de “verleningsgeschiedenis” van EP 419 en de aanvraag die het EOB voornemens is te verlenen van belang, zoals neergelegd in het Druckexemplar (productie 3.29 Ferring).
10.4.
Ferring stelt dat de materie/ het onderwerp (door Ferring ook aangeduid als het Concept) van de octrooiaanvrage, die het EOB van plan is te verlenen slechts het “Low dose concept” is. Dit concept houdt volgens haar in dat met lagere doseringen desmopressine en (daardoor) lagere concentraties in het bloed bij patiënten met nocturia een adequate antidiuretische werking kan worden bereikt met een kortere werkingsduur (van 4 tot 6 uur, althans niet langer dan noodzakelijk gedurende de nacht), waardoor de bijwerking hyponatriëmie mogelijk wordt voorkomen. De bij de toenmalige standaarddoseringen voorkomende ongewenste bijwerkingen, waaronder met name een hoge hyponatriëmie-incidentie werden veroorzaakt door onnodig hoge doseringen die resulteerden in een excessieve (langer dan noodzakelijke) werkingsduur met hyponatriëmie tot gevolg, terwijl lagere doseringen de voorkeur verdienen nu zij hetzelfde gewenste effect met een kortere werkingsduur opleveren. Meer dan voormeld low dose concept houdt de uitvinding niet in. Noch (de) doseringen, noch (de) toedieningsvormen maken onderdeel uit van de geclaimde uitvinding, aldus Ferring.
10.5.
[geïntimeerde 2] c.s heeft (primair) gesteld dat de uitvinding bestaat uit twee aspecten. Namelijk toediening van veel lagere doseringen desmopressine en toediening via bepaalde toedieningsvormen. Dat (een) bepaalde toedieningsvorm(en) een essentieel aspect van de uitvinding is zou blijken uit (de koppeling tussen) de hoogte van de in de aanvankelijke conclusies genoemde doseringen en plasmaconcentraties, nu deze plasmaconcentraties met deze doseringen slechts door bepaalde toedieningsvormen (met name de sublinguale toedieningsvorm) bereikt kunnen worden vanwege de hogere bio beschikbaarheid van die toedieningsvormen. Bovendien zou uit het woord “steady” in de conclusie blijken dat het gebruik van (een) bepaalde toedieningsvorm(en) essentieel is vanwege de mindere variabiliteit daarvan.
10.6.
De rechtbank heeft, kort gezegd, geoordeeld dat zowel de specifieke lage doseringen als de sublinguale toediening essentiële aspecten zijn van de uitvinding. Zij baseert dit laatste op de koppeling tussen de aanvankelijk genoemde lage doseringen en de daardoor veroorzaakte lage plasmaconcentraties (die slechts te bereiken zouden zijn als de sublinguale toedieningsvorm wordt gebruikt vanwege de betere bio beschikbaarheid daarvan dan van de orale tablet) en het gebruik van het woord “steady” in de conclusies, overwegende dat de sublinguale toedieningsvorm minder variabel is.
10.7.
Ferring verwijt de rechtbank in haar hoofdgrieven dat zij er aan voorbij is gegaan dat de uitvinding van de octrooiaanvrage, die het EOB van plan is te verlenen, slechts het “Low dose concept” inhoudt en dat zij ten onrechte (beslissende) waarde heeft toegekend aan de oorspronkelijke conclusies van WO 707 en niet naar het inventieve concept heeft gekeken.
10.8.
In de beschrijving van de aanvraag, met name in de “DETAILED DISCRIPTION OF THE INVENTION” worden in feite twee (vermeende) uitvindingen genoemd:
- -
de sublinguale toediening die een hogere bio beschikbaarheid heeft dan de orale tablet, waardoor met lagere doseringen kan worden volstaan;
- -
dat (veel) lagere doses en lagere plasma concentraties desmopressine voldoende effectief zijn, welke lagere plasma concentraties (aldus de toelichting onder het kopje Low dosage Analysis and Applications) kunnen worden bereikt bij elke toedieningsvorm.
10.9.
Uit de verleningsgeschiedenis blijkt dat de uitvinding (juist) niet beperkt is tot bepaalde doseringen of een (enige) toedieningsvorm. In de PCT-fase heeft [geïntimeerde 2] op 19 november 2004 de 18 conclusies van de oorspronkelijk aanvrage vervangen door 20 nieuwe conclusies, waarbij de conclusie 1 en 8 werden samengevoegd (productie 3.01 Ferring). Daarbij werd in conclusie 1 een koppeling gemaakt tussen de dosering in de farmaceutische samenstelling en de genoemde lage plasmaconcentraties. Vervolgens zijn de conclusies wederom gewijzigd in mei 2006 (productie 3.04 Ferring) en in oktober 2007 (productie 3.08 Ferring). In de laatste wijziging werd conclusie 1 beperkt door toevoeging van een aantal toedieningsvormen. Vervolgens zijn zowel de doseringen als de toedieningsvormen uit de conclusies geschrapt, zodat deze geen onderdeel van de (octrooieerbare) uitvinding uitmaken. Dat is ook door [geïntimeerde 2] in de verleningsprocedure erkend. [F] schreef namens [geïntimeerde 2] op 12 juni 2009 immers aan de examiner “that the invention as now defined in the amended claims is not predicated on the patentability of any particular dosage form, delivery vehicle or drug formulation per se, but rather is based (at least in part) on the discovery that very low doses of desmopressin can be used to effect antidiuresis without inducing lifethreatening hyponatraemia (…) .
In such circumstances, it is submitted that the recited plasma/serum concentrations are in fact “essential features” of the invention as now claimed, since the core of the invention lies in the discovery of the utility of very low desmopressin doses and not in the discovery of any surprisingly effective delivery vehicle or drug formulation per se” .
Het woord “steady” is wel in de conclusies blijven staan.
10.10.
Op grond van het bovenstaande is het hof van oordeel dat de in de aanvankelijke conclusies van de aanvrage genoemde specifieke lagere doseringen geen onderdeel van de (octrooieerbare) uitvinding uitmaken en de beperking daartoe in de aanvankelijke conclusies niet aan Ferring kan worden tegengeworpen. Haar stelling dat dat wel zo is lijkt [geïntimeerde 2] c.s. ook niet langer te handhaven. In zijn laatste akte 2020 stelt [geïntimeerde 2] c.s. zelf dat de EP 419 niet over doseringen, maar over plasmaconcentraties gaat en dat de dosering volgt uit de uitvinding van EP 419 en de toepassing daarvan en niet andersom (pagina’s 8 en 9 van deze akte).
Dat de doseringen geen onderdeel zijn van de onderhavige uitvinding brengt mee dat ook niet uit een koppeling van die specifieke lage doseringen met de in de conclusies genoemde lage plasmaconcentraties kan worden afgeleid dat (een) bepaalde toedieningsvorm(en) vanwege de (betere) bio beschikbaarheid daarvan een aspect van de uitvinding is/zijn. Evenmin kan aan Ferring worden tegengeworpen dat [geïntimeerde 2] de uitvinding aanvankelijk heeft beperkt door in de conclusies toedieningswijzen op te nemen. Dat geldt ook voor het opnemen van een tabel in de beschrijving van de oorspronkelijke aanvrage, waarin diverse toedieningsvormen zijn opgenomen, waarbij de orale tablet ontbreekt. Al deze elementen maken, ook volgens [geïntimeerde 2] c.s., geen onderdeel uit van de (octrooieerbare) uitvinding waar het hier om gaat.
10.11.
In de conclusies, waarop het EOB van plan is octrooi te verlenen, zijn de woorden “The delivery of said composition to establish a steady plasma/serum desmopressin concentration” vermeld. [geïntimeerde 2] c.s. beroept zich op het gebruik van de woorden ‘delivery’ en ‘steady’ en stelt dat dit consequenties heeft voor de toedieningsvormen. [geïntimeerde 2] c.s’ stellingen over de betekenis van deze woorden en het belang van de toedieningsvormen bij het bepalen van de inhoud van de uitvinding zijn in de loop van de procedure gewisseld, althans verschoven. In eerste aanleg stelde hij aanvankelijk dat dat het ging om subcutane, transmucosale (met inbegrip en in het bijzonder sublinguale, buccale en intranasale) transdermale en intradermale afgifteroutes, in het bijzonder sublinguaal, omdat daardoor de bio beschikbaarheid wordt verhoogd en de variabiliteit wordt verkleind (zie onder andere punten 18 en 28 ev. CvA en 23 CvD). Bij pleidooi in eerste aanleg beriep hij zich voor het eerst op het woord ‘steady’ en stelde hij (zie punten 36 ev. pleitnota e.a.) dat ‘steady’ stabiel (met minder variabiliteit) betekent en dat dit meebrengt dat het moet gaan om een zodanige ‘delivery’ dat een stabiele concentratie desmopressine in het bloed wordt bereikt in het geclaimde bereik, die ervoor zorgt dat desmopressine effectief is gedurende een periode van 4-6 uur en dat een aantal toedieningsroutes in concreto is gespecificeerd, waarmee desmopressine met zo min mogelijk variatie kan worden toegediend, namelijk via subcutane, transmucosale (met inbegrip en in het bijzonder sublinguale, buccale en intranasale) transsdermale en intradermale afgifte. Bij memorie van antwoord stelde hij dat voor een redelijke uitleg van de woorden ‘delivery’ en ‘steady plasma concentration’ moet worden uitgegaan van (de samenhang tussen) alle aspecten en dat (daarom) een sublinguale (of anderszins transmucosale) route moet worden gekozen, dat zowel de (specifieke) toedieningsvorm als de gerealiseerde variabiliteit van belang is voor het uiteindelijk effect (punten 5.27, 5.33, 5.45 MvA). Bij pleidooi in hoger beroep stelt hij dat “steady” vertaald moet worden met daadwerkelijk effectief en dat de delivery op zodanige manier moet geschieden (bijvoorbeeld, maar niet beperkt tot transmucosaal/sublinguaal) dat de geclaimde range plasmaconcentraties daadwerkelijk effectief wordt bereikt gedurende de benodigde tijd en niet langer. Hij stelt dat de uitvinding weliswaar niet beperkt is tot één of meerdere specifieke toedieningsvormen, maar dat er toedieningsvormen zijn die niet geschikt zijn voor de uitvinding, met name de conventionele orale tablet, die ook niet vermeld is in de in de aanvrage afgebeelde tabel “routes of administration” (zie hiervoor overweging 3.2.5).
10.12.
De aanvankelijke stelling van [geïntimeerde 2] c.s. dat steady stabiel betekent en dat het (dus) moet gaan om een toedieningsvorm die stabieler is en (dus) een lagere variabiliteit heeft dan de orale tablet en dat dat geldt voor de sublinguale (en andere transmucosale) toedieningsvorm(en), heeft Ferring gemotiveerd bestreden. Zij heeft daartoe, met een beroep op de verklaringen van [E] van 17 februari 2015 (prod 80 Ferring) en van [N] van 6-7 augustus 2015 (productie 85 Ferring) in de procedure bij de DSNY, gesteld dat steady geen specifieke farmacokinetische betekenis heeft en niet gerelateerd is aan een speciale doseringsvorm, die minder variabel is dan de gebruikelijke orale tablet.Voorts heeft zij, met een beroep op onder andere de in het Danhof rapport genoemde resultaten van de bio equivalentie studie CS019 (productie 77 Ferring), aanvullende deskundigenrapporten van Danhoff van 27 augustus 2018 (producties 90 en 91) en de e-mail van [geïntimeerde 2] aan ene [… 3] van 20 maart 2009, waarin hij erkent dat orodispersible toedieningsvorm niet minder variabel is dan de orale tablet (“(…) the mimirin melt had low BA and at least as much variability as the high dose desmopressin oral tablet (…) the average peaks would infringe on our IP” (productie 77k Ferring), gemotiveerd betwist dat een neusspray of een sublinguale doseringsvorm minder variabel is dan een orale tablet (zie punten 71-75 MvG). Zij stelt onder verwijzing naar de FDA Summery review for regulatory action en pagina’s uit het US-label Noctiva betreffende de neusspay van Reprise en Allergan, Noctiva (productie 92 en 93 Ferring) dat de neusspray van [geïntimeerde 2] c.s. bijzonder variabel is. Een en ander heeft [geïntimeerde 2] c.s. niet gemotiveerd betwist. Op grond daarvan is het hof van oordeel dat het gebruik van het woord ‘steady’ in de conclusies geen reden is om aan te nemen dat de sublinguale (of een andere transmucosale) toedieningsvorm vanwege (mindere) variabiliteit daarvan een aspect van de uitvinding is.
10.13.
[geïntimeerde 2] c.s lijkt zijn aanvankelijke stellingen over de betekenis van de woorden ‘delivery’ en ‘steady’ in hoger beroep, in ieder geval bij pleidooi niet langer te handhaven.
Hij heeft in beroep immers gesteld dat irrelevant is als er transmucosale doseringsvormen zouden zijn die variabel(er, begrijpt het hof) zijn, dat het onderwerp van de uitvinding beoordeeld moet worden in de context en dat voor een redelijke uitleg moet worden uitgegaan van (de samenhang tussen) alle aspecten. Hoe uit (de samenhang van) de context blijkt dat ‘steady’ impliceert dat sprake is van sublinguale toediening of een andere toediening dan per orale tablet onderbouwt [geïntimeerde 2] c.s. niet. De aanvragen bevatten ook geen data waaruit zou blijken dat sommige toedieningsvormen wel en andere toedieningsvormen niet geschikt zouden zijn om de gewenste plasmaconcentraties te bereiken. Er wordt uitsluitend melding gemaakt van de resultaten van een studie waarbij desmopressine intraveneus is toegediend. Bij pleidooi in hoger beroep stelt zij voor het eerst dat het woord ‘steady’ staat voor ‘daadwerkelijk effectief/ effectief gedurende de gewenste periode’ en dat dat niet bereikt kan worden bij orale toediening.
10.14.
Ferring heeft bezwaar gemaakt tegen deze nieuwe stelling/ dit nieuwe verweer.
Het hof honoreert dit bezwaar en laat deze stelling/ dit verweer als in strijd met de twee-conclusie-regel buiten beschouwing. Voor het geval deze stelling wel in aanmerking zou moeten worden genomen omdat uit de memorie van antwoord (van 136 pagina’s) gedestilleerd zou kunnen worden dat Reprise c.s dit al eerder heeft gesteld, verwerpt het hof die stelling als onvoldoende onderbouwd in het licht van haar eerdere stelling dat nu juist de mindere variabiliteit van de sublinguale toediening de reden is waarom deze toedieningsvorm wèl en de orale tablet niet geschikt is, terwijl zij de stelling van Ferring dat de sublinguale toediening niet minder variabel is dan de orale tablet niet gemotiveerd heeft betwist. Waarom dan toch de orale tablet niet effectief gedurende (uitsluitend) de gewenste periode zou kunnen zijn valt, zonder nadere toelichting die ontbreekt, niet in te zien.
10.15.
Het bovenstaande brengt mee dat naar het oordeel van het hof noch doseringen, noch toedieningsvormen aspecten van de in de aanvrage gelegen uitvinding zijn en de hoofdgrieven in zoverre slagen. Het hof gaat er dan ook vanuit dat de vereiste lage plasmaconcentraties ook het resultaat kunnen zijn van toediening via andere toedieningsvormen van zowel lagere doseringen (bijvoorbeeld bij intraveneuze toediening) als hogere doseringen (bijvoorbeeld bij toediening via een orale tablet) dan bij sublinguale toediening.
10.16.
Hiermee resteert als uitvinding slechts het (tweede) aspect van de in rov. 3.2.4 en 10.8 vermelde beschrijving van de in de WO 707 vermelde uitvinding, inhoudende dat het essentiële anti-diuretische effect teweeg kan worden gebracht bij aanzienlijk lagere plasma/serumconcentraties desmopressine in het bloed dan aanvankelijk voorzien ofwel that low doses and plasma/plasma/serum levels of desmopressin are pharmacologically active and can achieve desired therapeutic efficacy. (productie 3.1 Ferring, pagina’s 4-5 en 36). Zoals [F] in zijn voormelde brief aan de examiner schreef: the core of the invention lies in the discovery of the utility of very low desmopressin doses.
10.17.
Thans dient de vraag beantwoord te worden wat díé uitvinding inhoudt, met name de vraag of de in de conclusie genoemde range of from 0,1 picograms to about 10,0 picograms desmopressin per ml plasma/serum daarvan deel uitmaakt.
10.18.
Ferring stelt primair dat de uitvinding vervat in EP 419 en de andere aanvragen is gelegen in lage doseringen van desmopressine resulterend in lage plasmaconcentraties die werkzaam zijn gedurende een korte periode, waarmee mogelijk het probleem van hyponatriëmie verminderd kan worden (door haar aangeduid als “het Low Dose Concept”) en niets anders. De in de conclusie genoemde range of from 0,1 picograms to about 10,0 picograms desmopressin per ml plasma/serum maakt daarvan geen deel uit. EP 419 leert niets anders over de genoemde plasmaconcentraties dan dat dit de gewenste range zou zijn. Waarom dit zo is wordt niet duidelijk, aldus Ferring. Subsidiair stelt Ferring dat als de range toch onderdeel uitmaakt van de uitvinding de uitvinding is gedaan door [A] en [B] tezamen.
10.19.
[geïntimeerde 2] c.s. stelt (subsidiair, voor het geval de rechter hem niet volgt in zijn stelling dat doseringen en/of toedieningsvormen onderdeel van de uitvinding uitmaken) dat het onderwerp van de aanvraag /de aanspraak op (de verlening van) de octrooiaanvrage niet slechts het (een abstract of vaag) low dose concept is, maar een concrete technische leer waarbij sprake is van zodanig lage doseringen to establish a steady plasma/serum desmopressin concentration in the range of from 0,1 picograms to about 10,0 picograms desmopressin per ml plasma/serum, zoals geclaimd in EP 419. Ook de divisionals bevatten materie (en conclusies) waarin deze concrete technische leer is neergelegd. Die technische leer omvat ook de (resultaten van de) uitgevoerde klinische studie die in de aanvrage is opgenomen als voorbeeld 8.
10.20.
Dit standpunt wordt door [geïntimeerde 2] c.s. in eerste aanleg uitdrukkelijk ingenomen met name
in punten 99-103 CvA (het onderwerp van de aanvrage is in ieder geval ook een bereik van concentraties), 21-22 CvD (het eerste aspect van de uitvinding van [geïntimeerde 2] wordt gedekt door de huidige conclusies 1 en 2 van EP 419), 35-36 pleitaantekeningen (de term ‘low dose’ an sich dekt de lading onvoldoende (…) omdat de ‘dosis’ van een geneesmiddel pas wat zegt als bekend is hoeveel van dat geneesmiddel daadwerkelijk in het bloed komt; de uitvinding betreft de delivery van desmopressine zodanig dat een “steady plasma /serum desmopressin concentration” in het bereik van 0,1-10 pg/ml wordt verwezenlijkt; er moet een voorspelbare, lage desmopressine concentratie worden bereikt).
In hoger beroep, nadat Ferring een verklaring van [geïntimeerde 2] in de Amerikaanse procedure had overgelegd, waarin [geïntimeerde 2] erkent dat hij geen plasmagehaltes heeft genoemd aan Ferring in augustus 2001, lijkt [geïntimeerde 2] c.s.’ standpunt enigszins te verschuiven met zijn stelling dat het low dose aspect van de uitvinding het inzicht is “of using much lower doses of desmopressin to produce much lower blood levels to achieve the desired antidiuretic effect for a controlled peroid of time, thereby limiting the duration of antidiuresis and avoiding hyponatremia” en dat de concrete plasmaconcentraties een logisch en dwingend uitvloeisel zijn van dat inzicht, welke plasmagehaltes je (ook toen al) op basis van openbare bronnen kon berekenen. Hij handhaaft evenwel zijn stelling dat de range met een maximum ongeveer 10,0 pg/mL plasma/serum deel uitmaakt van de uitvinding. Vergelijk onder meer punten 1.18 en 1.19 MvA (waarbij Ferring wordt verweten dat zij in het midden laat wat met lage dosering wordt bedoeld en de reikwijdte vaag blijft), pagina 33 MvA (“Dr [geïntimeerde 2] is the one who conceived that blood concentrations of desmopressin were much lower than resulted from Ferring’s existing oral tablets that we talked about in the range of single-digit picograms per milliliter of desmopressin in the blood would be effective”), pagina’s 51-52, 57, 94, 103 en 105 MvA ( [geïntimeerde 2] heeft het, anders dan [A] , over waarden tot 10 pg/ml; niet blijkt dat [A] en [B] zich realiseerden dat een maximum plasmaconcentratie van minder dan 10 pg/ml een succesvolle behandeling zou kunnen opleveren en zaten niet in voldoende concrete vorm op het spoor van [geïntimeerde 2] low dose concept), pagina 12 van zijn pleitnota (dat [geïntimeerde 2] tijdens zijn depositions heeft verklaard dat hij niet in augustus 2001 de precieze plasmaconcentraties (aan de medewerkers van Ferring) vertelde betekent niet dat [geïntimeerde 2] de uitvinding niet had gedaan, omdat de concrete plasmaconcentraties een logisch en dwingend uitvloeisel was van het inzicht dat de concentraties much lower moesten zijn, namelijk ‘down into the very low single digit picogram per ml blood concentrations’4.) en pagina 8 en 9 van zijn akte 2020 (in deze Nederlandse procedure gaat om (steady lage) plasma-concentraties, die staan in de beschrijving en in de claims).
10.21.
Het hof is, met [geïntimeerde 2] c.s., van oordeel dat de in de WO 707 neergelegde uitvinding is gelegen in lage plasmaconcentraties, maar wel beperkt is tot (lage) bloedplasmaconcentraties onder ongeveer 10 pg/mL (waarbij nog een adequate antidiurese bewerkstelligd wordt voor de benodigde tijd, terwijl het risico van hyponatriëmie door een langere werkingsduur door een hogere plasmaconcentatie zoveel mogelijk wordt vermeden). De uitvinding vereist het besef dat er een, zich binnen een bepaalde range bevindende plasmaconcentratie bestaat waarbij een effectieve antidiuretische werking optreedt die niet langer aanhoudt dan de benodigde tijd gedurende de nacht en dat een hogere plasmaconcentratie (door uiteraard een hogere dosering) niet effectiever werkt maar slechts een langere werking heeft en daarmee de kans op hyponatriëmie verhoogt. In conclusie 8 van de aanvraag WO 707 en conclusie 1 van het Druckexemplar) wordt een range van about 0.1 picograms desmopressin per mL plasma/serum to about 10.0 picogram desmopressin per mL plasma/serum, dus van maximaal 10 pg/mL genoemd en ook in de beschrijving van zowel in de WO 707 (“The present inventor has found that doses and plasma/plasma/serum concentrations of desmopressin which are from 5 to 40% of the current recommended doses and resulting plasma/plasma/serum levels are therapeutically effective, and in some cases safer..” ) wordt naar een maximale plasmaconcentratie verwezen. Het gaat er om dat de door toediening van desmopressine veroorzaakte plasmaconcentratie zo laag mogelijk is om hyponatriëmie (zoveel mogelijk) te voorkomen, maar nog wel hoog genoeg om een adequate (in termen van osmolality (toegenomen urine concentratie) meetbare) antidiurese te bewerkstelligen. Het moet gaan om een plasmaconcentratie die niet hoger is dan het genoemde maximum. In de WO 707 wordt ter onderbouwing daarvan ook verwezen naar studies. In punt 38 van de ID (in zaak 2) stelt Ferring zelf dat het Druckexemplar van EP 419 een bereik van concentraties in het bloed van patiënten benoemt (pagina 23 van productie 3.29 Ferring) en daarmee het onderwerp is opgeëist op een manier die met elke methode van toediening gerealiseerd kan worden. Het hof is van oordeel dat voor de uitvinding nodig maar ook voldoende is het besef dat er zo’n concrete range is en dat het maximum daarvan niet hoger ligt dan ongeveer 10 pg/mL (hierna ook aan te duiden als het concrete low dose-low plasma concept). Het gaat daarbij om het maximum van die range omdat voorheen doseringen werden gegeven die leidde tot veel hogere plasmaconcentraties en de uitvinding nu juist is dat met veel lagere plasmaconcentraties kon worden volstaan voor een effectieve antidiuretische werking met minder risico op hyponatriëmie. Partijen spreken in dit verband ook over een single digit picogram per mL bloed concentratie/plasma concentratie als de concrete uitvinding (vergelijk bijvoorbeeld de verklaring van [geïntimeerde 2] in de Amerikaanse procedure (productie 35 [geïntimeerde 2] c.s. pagina 54-55) en pagina 27 pleitnotities Ferring in hoger beroep).
10.22.
Het enkele idee van lagere doses vanwege de potentie van desmopressine was al bekend in de prior art. [A] hield daarover zelf onder meer een openbare lezing op de ICCS-conferentie in 1999 in Denver. Het hof verwijst ook naar overweging 138 van het Amerikaanse vonnis: “The idea of low doses based on potency of desmopressin was known in the prior art through the Hammer and Williams references and [A] ’s articles and presentations prior to 2001.”
10.23.
Ook [A] is blijkens zijn verklaring van 13 december 2013 (productie 49 Ferring, punten 12 en 13) van oordeel dat in de aanvragen een low dose-concept met een concreet maximum is neergelegd. Hij verklaart:
[vertrouwelijke informatie].
11. Behandeling van de hoofdgrieven: wie is/zijn uitvinder(s)?
11.1.
Thans dient de vraag beantwoord te worden wie de uitvinder is of uitvinders zijn van het concrete low dose-low plasma concept. Bij de beoordeling van de stellingen van partijen is van belang een onderscheid te maken tussen twee uitvindingen, althans ontwikkelingen die in periode vanaf ongeveer 1998/1999 naast elkaar deels tegelijkertijd aan de orde zijn geweest, namelijk
- -
het concrete low dose-low plasma concept als hiervoor omschreven dat losstaat van de wijze van toediening, waarop de in het geding zijnde octrooien en de WO 153, US 203, US 321 en US 761 betrekking hebben, door Ferring aangeduid als de Low Dose workstream;
- -
de vervanging van de orale tablet door een sublinguale toediening, waarvoor Ferring octrooi heeft aangevraagd en [geïntimeerde 2] c.s (al dan niet tezamen met andere vennootschappen) in Nederland en de Verenigde Staten vorderingen tot opeising/correction of inventorship heeft ingesteld, door Ferring aangeduid als de ODDF (orodispersible of orodispergeerbare doseringsvorm) workstream.
11.2.
De sublinguale toediening is niet het onderwerp van de EP 419 en de andere in deze procedure aan de orde zijnde aanvragen. Niettemin is ook voor deze procedure van belang te onderkennen dat de sublinguale toediening (naast het voordeel dat een sublinguale tablet niet met water hoeft te worden ingenomen) het voordeel heeft dat door de betere bio beschikbaarheid ten opzichte van de orale tablet volstaan kan worden met een lagere dosering om eenzelfde bloedplasma concentratie te bereiken. Dit brengt mee dat wanneer in deze procedure gesproken wordt over low dose onderscheid gemaakt moet worden tussen low dose door de sublinguale toediening (hierna ook aan te duiden als low dose door sublinguaal), die geen onderwerp van de EP 419 en deze procedure is, en het concrete low dose-low plasma-concept. Dit geldt te meer nu [geïntimeerde 2] c.s. stelt dat [geïntimeerde 2] ook de sublinguale toediening heeft bedacht en in augustus 2001 zijn ideeën daarover en over de onderhavige uitvinding heeft gedeeld met Ferring. Daar waar gesteld wordt dat hij in of met betrekking tot die periode spreekt over low dose kan dit dus ook slechts betrekking hebben op low dose door sublinguaal.
11.3.
In het vonnis van de rechtbank Den Haag van 13 juni 2012 (over de opeising door [geïntimeerde 2] c.s. betreffende de EP 543) wordt hetzelfde onderscheid gemaakt bij de weergave van de stellingen van [geïntimeerde 2] c.s. (in dat vonnis aangeduid als Reprise c.s.):
3.1.1.
EP 534 claimt en beschrijft materie die is uitgevonden door [geïntimeerde 2] . Het betreft
voor zover thans van belang de in conclusie 3 geclaimde sublinguale toediening. De
uitvinding van [geïntimeerde 2] biedt een oplossing voor het hyponatremieprobleem. [geïntimeerde 2] realiseerde zich dat hyponatremie werd veroorzaakt door een grote hoeveelheid desmopressine in het bloed. De door [geïntimeerde 2] gevonden oplossing is dat de toediening van desmopressine onder de tong (‘sublinguaal”) de biobeschikbaarheid vergroot en de variabiliteit vermindert van de hoeveelheid desmopressine die uiteindelijk in de bloedstroom terechtkomt. Dit vormt een verbetering ten opzichte van orale toediening.
…
3.15.
In de verleningsprocedure van EP534 heeft Ferring de inventiviteit van de uitvinding onderbouwd met een verwijzing naar de sublinguale toediening en de dientengevolge verhoogde biobeschikbaarheid.
…
3.2.
. Reprise c.s. heeft zich aanvankelijk op het standpunt gesteld dat het octrooi ook
een 'low dose’ concept beschrijft en dat dit concept eveneens is uitgevonden door [geïntimeerde 2] ,
maar ter zitting heeft zij medegedeeld dat aspect niet langer aan haar vorderingen ten grondslag te leggen. (…)
11.4.
Ferring stelt dat [A] het onderwerp van de in dit geding aan de orde zijnde octrooiaanvragen al in 1999, althans voor 2002 heeft bedacht en gepresenteerd, althans dat [A] en/of [B] dit hebben bedacht en gepresenteerd en dat [geïntimeerde 2] de kennis daarvan heeft ontleend aan werknemers van de Ferring-groep en daarmee de WO 707 heeft aangevraagd.
11.5.
Ferring beroept zich ter onderbouwing van haar stelling dat [A] , althans [A] en [B] de uitvinding hebben gedaan op onder meer de volgende stukken en omstandigheden:
het onderzoeksrapport van klinische studie 45A07-39 van 16 december 1999 op grond waarvan [A] en [B] al wisten dat plasmaconcentraties van minder dan 5 pg/mL voldoende zijn voor een antidiuretisch effect gedurende de gewenste tijd van 6 uur (productie 77C Ferring), genoemd in het rapport van prof. Danhof op pagina 34 ev. (productie 77 Ferring);
de Minirin Rollover presentatie van [A] binnen Ferring van begin en/of oktober 2000 (producties 16, 49, bijlage 4 en 66 Ferring), naar aanleiding van de studie 45A07-39, waaruit blijkt dat [A] inzag dat een plasmaconcentratie van 3 pg/mL nog steeds relevant antidiuretisch effect opleverde en dat er praktisch geen verschil in antidiuretische werking zat tussen een (door een I.V. dosering veroorzaakte) hogere plasmaconcentratie en een (door een 200 mcg per oral tablet) veroorzaakte lagere plasmaconcentratie en dat de hogere plasmaconcentratie alleen leidde tot een langere werkingsduur, waarbij de volgende slide werd getoond:

het circuleren binnen Ferring van een power point presentatie en speaking notes van [A] in maart 2000 (productie 67 Ferring), waarin werd gemeld dat bij een plasmaconcentratie van 3 pg/ml nog sprake was van de gewenste urineconcentratie (de voorziene en later op de markt gebrachte tabletten van 100 mg, 200 mg en 400 mg resulteerden in een hogere plasmaconcentratie, hof); slide 12 toonde de volgende afbeelding
met de volgende toelichting :
[vertrouwelijke informatie].
het verzoek in oktober 2000 van [B] aan EMF om een voorstel te doen voor de kosten van het uitvoeren van een analyse van bestaande data met behulp van computer technologie (productie 69 Ferring) en de bespreking door [B] en zijn PK/PD team over het testen van het low dose concept door analyse door EMF (productie 68 Ferring), hetgeen resulteerde in een opdracht voor een onderzoek aan EMF in het najaar van 2001 (zie ook hierna onder j);
de notulen van een bespreking van 23 oktober 2000 van [A] en [B] over voormelde studie, waarin sprake is van “longer time of action of desmopressin predisposes hyponatremia” (productie 77F Fering);
het rapport van [A] en [B] van december 2000 (productie 49, annex 5 Ferring), waarin werd geconcludeerd dat hogere doses van desmopressine en daarmee hogere plasmaconcentraties resulteren in een langere werking en “not neccesarely more antidiuretic effects (in terms of urine production or urine osmolality changes)” in het rapport is ook vermeld:
[vertrouwelijke informatie].
de oprichting van de Hyponatremia Task Force eind 2000;
het rapport van [A] van februari 2001 (productie 70 Ferring), waarin is vermeld:
[vertrouwelijke informatie].
en
[vertrouwelijke informatie].
Het Hyponatremia Task Force rapport van 29 mei 2001, zoals hiervoor vermeld (productie 17 Ferring);
De opdracht aan EMF voor het onderzoek Desnoc11: PK/PD analyse van fase I tot en met fase III studieresultaten van behandeling van gezonde vrijwilligers en patiënten met desmopressin in het najaar van 2001 (zie hiervoor onder d), welk onderzoek aanving op 27 september 2001 en leidde tot de rapportages van 19 februari en 6 mei 2002 (producties 71 en 21 Ferring);
Voormelde e-mail van [C] van 18 maart 2002 (productie 22 Ferring) met voorstellen over studies met lage doseringen, waarin (veel) lagere doseringen worden genoemd dan de destijds voorgeschreven orale tablet met als laagste dosering 0,1 mg/100 µg;
Het rapport van 22 maart 2002 “Summary of pharmacokinetics/pharmacodynamics of desmopressin administered either via the marketed tablet or via the NEWMIN – a new orodispersible formulation door het PK/PD-team ( [B] en [O] (productie 72 Ferring)) naar aanleiding van de EMF/Desnoc 11-studie, waarin wordt geconcludeerd dat een maximaal antidiuretisch effect al bij een plasmaconcentratie van 1,5-2 pg/ml wordt verwacht, [vertrouwelijke informatie] en geconcludeerd wordt dat vervolgstudies naar lage doseringen en lage bloedplasmaconcentraties in nocturnia-patiënten moet worden onderzocht [vertrouwelijke informatie. (dit is lager dan 100 µg Minirin tablet die, begrijpt het hof, ongeveer bio-equivalent is aan 60 µg sublinguaal); gesteld wordt dat zelfs een 20 µg Minirin melt/NEWMIN (de sublinguale tablet van Ferring) zou resulteren in de voor het maximaal antidiuretisch effect beoogde plasmaconcentratie van 1,5 pg/ml: [vertrouwelijke informatie].
een Ferring-(draft)rapport van 24/26 maart 2002 (productie 73 Ferring) “draft justification for part B-status”, based om the input of TS ( [B] )/LSG and JPN ( [A] ) dat behalve over de betere bio beschikbaarheid van de orodisperibele tablet, waardoor de dosering lager kan zijn dan de Minirin tablet, gaat over de daarvan losstaande mogelijkheid van lagere doseringen. Daarin is vermeld:
[vertrouwelijke informatie].
de Chilworth presentatie van april 2002, deels overgelegd als annex 6 bij de verklaring van [A] (productie 49; de volledige Chilworth presentatie is overgelegd als productie 98 [geïntimeerde 2] );
Het EMF Desnoc11-rapport van mei 2002 (productie 21 Ferring), waarin de conclusie wordt getrokken dat [vertrouwelijke informatie] bij welke studie [geïntimeerde 2] niet betrokken was;
Het concept protocol voor klinische studies CS007 van april 2002 (productie 24 Ferring) naar onder andere low dose desmopressine, waarbij getest zou worden met de orodispergeerbare nieuwe doseringsvorm en ook onderzoek zou worden gedaan naar lage doseringen resulterend in lage plasmaconcentraties. [B] werd genoemd als sponsor. De bedoeling was fase I (met gezonde proefpersonen) en Fase II (met patiënten) studies te doen. De Fase I studie CS007 zou worden uitgevoerd met onder meer 10, 20 en 40 (en 80 en 160) µg orodisperible tablet en was er op gericht zowel de verbeterde bio beschikbaarheid van de orodisperible toedieningsvorm als de antidiuretische effecten bij lage plasmaconcentraties (en dus lage doseringen) te testen, zoals blijkt uit het hiervoor afgebeelde deel van het concept-protocol van april 2007. Waarin voorts is vermeld:
[vertrouwelijke informatie].
Bij dit protocol was [geïntimeerde 2] niet betrokken. Voor de Fase II studie met Nocturia-patiënten werd gedacht aan doseringen van 20 en 40, 80, 120 en 190 µg, aldus de mail van 18 maart 2002 van [C] (productie 22 Ferring);
De power point presentatie van mei 2002 over de achtergrond en het doel van CS007 (productie 25 Ferring), waarin is vermeld dat Newmin doses van 10, 20, 40 , 80 en 160 µg getest zullen worden.
Op slide 2 is vermeld:
[vertrouwelijke informatie].
Op slide 6 is vermeld:
[vertrouwelijke informatie].
.
De mail van [B] aan [geïntimeerde 2] van 31 mei 2002 (productie 29 Ferring) over de I.V.-studie naar lage doseringen in plaats van de studie naar lage doseringen door sublinguale toediening;
Het hiervoor deels afgebeelde, door (een medewerker van) [B] opgestelde protocol voor de Fase I studie CS009 van 6 juni 2002 (producties 30 Ferring en 20 [geïntimeerde 2] ) die de CS007-sudie moest vervangen en waarbij de sublinguale toediening werd vervangen door een I.V. toediening van doses van 30, 60, 125 (ongeveer gelijk aan 40 µg orodispersibele dosis), 250 en 500 ng omdat de orodipengeerbare tabletten met de te testen lage doseringen niet tijdig voorhanden waren. Hierin is voorts vermeld:
[vertrouwelijke informatie].
De hiervoor genoemde presentatie van [A] van 14 juni 2002 (productie 7 Ferring), waarbij de in overweging 3.3.11 vermelde slide met conclusies wordt getoond;
De uitvoering van CS009 in de Verenigde Staten van 10-15 september 2002 in opdracht van Ferring, waaruit bleek dat toediening van lage doseringen, resulterend in lage plasmaconcentratie een relevant antidiuretisch effect hadden in gezonde vrijwilligers (bij de uitvoering waarvan [geïntimeerde 2] namens Fering was betrokken);
De Investigators Brochure (IB) van augustus 2002 als basis voor de fase II en III studies (productie 8 Ferring);
11.6.
Ter onderbouwing van haar stelling dat [geïntimeerde 2] de uitvinding aan Ferring heeft ontleend, stelt Ferring dat [geïntimeerde 2] in verband met zijn werkzaamheden voor Ferring beschikte over (vertrouwelijke) informatie van Ferring over (onderzoek naar) desmopressine, hyponatriëmie en Nocturia
- -
door de betrokkenheid van [geïntimeerde 2] en [E] vanaf 2001 bij het “regulatory file” voor de verkrijging van een marktvergunning voor de Minirin tablet in de VS;
- -
doordat hij stukken ontving over (voorgenomen) studies naar lage doseringen, zoals blijkt uit de mails van 18 maart 2002 van [C] (productie 22 Ferring) en de mail van [B] van 31 mei 2002 (productie 29 Ferring);
- -
dat hij betrokken was bij de voorbereiding en de uitvoering van de CS009 studie in de periode van juni tot en met september 2002;
- -
als lid van de RDMC.
[geïntimeerde 2] c.s. heeft op zichzelf niet betwist dat [geïntimeerde 2] om voormelde redenen beschikte over deze (vertrouwelijke) informatie.
11.7.
[geïntimeerde 2] c.s. heeft betwist dat [A] al dan niet tezamen met [B] een low dose concept, laat staan het concrete low dose-low plasma concept heeft bedacht, althans voor eind augustus 2001 heeft bedacht. Hij stelt dat [A] en [B] het concept van [geïntimeerde 2] hebben overgenomen nadat hij dit in augustus 2001 aan medewerkers van de Ferring-groep heeft geopenbaard.
11.8
Het hof zal eerst de vraag beantwoorden of uit voormelde stukken en omstandigheden valt af te leiden dat [A] en/of [B] tot de in de aanvragen gelegen uitvinding, het concrete low dose-low plasma concept, zijn gekomen en zo ja wanneer. Bij een bevestigend antwoord op die vraag zal het hof ingaan op de stelling van [geïntimeerde 2] c.s., dat [geïntimeerde 2] al dan niet daarvoor, het concept aan medewerkers van Ferring heeft geopenbaard.
11.9.
[geïntimeerde 2] c.s. stelt dat met de aannames dat lagere doses dan de conventionele tablet ook voldoende kunnen zijn om effectief te zijn en dat hoge plasmaconcentraties niet moeten worden overschat de uitvinding nog lang niet voorhanden is en dat dit ook de stand van zaken was in de prior art. Zij stelt dat in stukken waarop Ferring zich beroept hooguit wordt gesproken over het low dose concept in algemene zin en dat dat onvoldoende is. Zij beroept zich op de verklaring van [A] in de Amerikaanse procedure, waarin hij zou erkennen dat hij in ieder geval geen concrete concentraties heeft uitgevonden. Pas in de IB van 2002 wordt over een concreet plasmaconcentratie gesproken van 1,5 pg/ml, aldus [geïntimeerde 2] c.s.
11.10.
Het hof is, met [geïntimeerde 2] c.s. van oordeel dat de uitvinding het besef vereist dat er een, zich binnen een bepaalde concrete range bevindende plasmaconcentratie bestaat met een maximum 10 pg/mL, waarbij een effectieve antidiuretische werking optreedt die niet langer aanhoudt dan de benodigde tijd gedurende de nacht en dat een hogere plasmaconcentratie (door uiteraard een hogere dosering) slechts een langere werking en daarmee een verhoging van de kans op hyponatriemie tot gevolg heeft. Ferring zal dan ook moeten bewijzen dat zij het concrete low dose-low plasma concept heeft uitgevonden.
11.11.
Het hof is van oordeel dat uit de stukken en omstandigheden waarop Ferring zich beroept niet valt af te leiden dat [A] (en/of [B] ) voor 2002 de mogelijkheid hebben overwogen om in het algemeen bij Nocturia patiënten te volstaan met doses, die leiden tot plasmaconcentraties van maximaal 10 pg/mL om een effectieve anti-diurese te bereiken met minder risico op hyponatriëmie. Nergens wordt voor maart 2002 overwogen met zulke lage doses of doses onder 100 mcg orale tablet te volstaan. [A] heeft voor maart 2002 wel aangegeven te twijfelen over effectiviteit van hogere doseringen dan 100 µg of hogere doses in het algemeen, maar verder gaat hij niet. Elementen van de uitvinding zijn wel te herkennen in de stukken voor 2002, maar het besef dat er sprake kan zijn van een plasmaconcentratie in een concrete range tot maximaal 10 pg/mL blijkt daaruit niet. In studies en presentaties van [A] uit die periode wordt weliswaar geconcludeerd dat [vertrouwelijke informatie] maar dit is iets anders dan het idee om in zijn algemeenheid te volstaan met doses die resulteren in een plasmaconcentratie onder 10 pg/mL om een effectieve diurese bij nocturia-patiënten voor slechts de benodigde periode gedurende de nacht te bereiken. Bovendien heeft Ferring niet gemotiveerd betwist de met het rapport van [N] onderbouwde stelling van [geïntimeerde 2] c.s dat de studie 45A07-39, kort gezegd, te onnauwkeurig was om op grond daarvan specifieke plasmaconcentraties te bepalen die voldoende antidiuretische effect zouden hebben. Dat blijkt overigens ook uit de omstandigheid dat beide partijen andere door de orale tablet veroorzaakte plasmaconcentraties noemen dan die kennelijk uit deze studie volgden, zoals de daaruit getrokken conclusie [vertrouwelijke informatie]. In het rapport van [A] van februari 2001 (dat een addendum is bij de aanvraag voor een marktvergunning voor Minirin) is vermeld dat [vertrouwelijke informatie]. In de octrooiaanvrage worden ook hogere plasmaconcentraties genoemd bij deze dosering. Ook uit de overgelegde verklaring van [A] (producties 49 en 78 Ferring) en zijn verklaring in de Amerikaanse procedure valt niet af te leiden dat hij aan concrete getallen of een range van maximaal 10pg/mL heeft gedacht (vrgl. pag. 12 en 13 pleitnotities [geïntimeerde 2] c.s in beroep) of dat hij het concrete low dose-low plasma concept heeft bedacht of geopenbaard voor 2002.
11.12.
Dat [A] in mei 2001 nog niet dacht aan het concrete low dose-low plasma concept kan bovendien worden afgeleid uit het Hyponatremia Task Force rapport van 29 mei 2001 (productie 17 Ferring).
[vertrouwelijke informatie].
11.13.
Voorts heeft [geïntimeerde 2] c.s. er nog op gewezen dat als voormelde uitingen van [A] voldoende zouden zijn om aan te nemen dat [A] de uitvinding heeft gedaan, hij deze al publiek openbaar heeft gemaakt tijdens een lezing op een ICCS-conferentie in 1999 in Denver, hetgeen aan octrooiverlening in de weg zou staan en (dus) niet voor de hand ligt als hij (toen) werkelijk zou menen dat dit een uitvinding zou zijn.
11.14.
Het hof merkt ten slotte nog op dat Ferring in de inleidende dagvaarding haar stelling dat [A] de bedenker was van het low dose concept uitsluitend baseerde op de presentatie van 14 juni 2002 en de IB uit 2002.
11.15.
Het hof is op grond van het bovenstaande van oordeel dat Ferring haar stelling dat [A] (en/of [B] ) de uitvinding (het concrete low dose-low plasma concept) voor 2002 heeft gedaan niet voldoende heeft onderbouwd.
11.16.
In de hiervoor genoemde stukken vanaf maart 2002, zoals het Pharmacokinetic rapport van 22 maart 2002 van het PK/PD-team van [B] (productie 72 Ferring) en de door (het team van) [B] opgestelde protocollen van de CS007 en de CS009 en de IB is naar het oordeel van het hof het concrete low dose-low plasma concept wel aan de orde. In de stukken zijn alle elementen van de uitvinding terug te vinden. Allereerst is in het protocol van de CS007 vermeld dat Ferring lage doses van 10, 20 en 40 µg wil testen. Weliswaar gaat het hier om sublinguale toediening, die een hogere bio beschikbaarheid heeft dan de orale tablet, maar uit de stukken en de stellingen van partijen volgt dat deze drie doses resulteren in (aanzienlijk) lagere plasma concentraties dan de 100 µg orale tablet en in ieder geval tot een plasmaconcentratie onder 10 pg/mL. [geïntimeerde 2] was bij (het opstellen van) dat protocol niet betrokken. Voorts valt uit die stukken ook het besef af te leiden dat er een ideaal bloedplasmaconcentratie binnen een bepaalde concrete range met een maximale plasmaconcentratie bestaat, waarbij desmopressine effectief is voor de benodigde tijd gedurende de nacht en niet langer. De CS007 had tot doel die range, althans dat maximum te bevestigen.
11.17.
De stelling van [geïntimeerde 2] c.s, in navolging van [N] , dat de CS007 studie niet diende om het inventief concept te onderzoeken maar alleen maar om een vollediger beeld te krijgen van de gehele dose-response curve, overtuigt niet, althans sluit niet uit dat tevens en met name de lagere doseringen werden onderzocht, waarvoor geen reden was geweest als Ferring dat niet wilde onderzoeken om voormelde reden. In zijn presentatie van 14 juni 2002 (productie 7 Ferring) geeft [A] aan dat[vertrouwelijke informatie]. Hierin zijn de elementen van de uitvinding terug te vinden: door een lagere dosering dan 100 µg en dus een lagere plasmaconcentratie kon een effectieve anti-diurese worden bereikt met een kortere werkingsduur. Uit de IB die in de periode van april tot augustus 2002 werd opgesteld blijkt dit ook. Ten slotte bevestigden de resultaten van de in opdracht van Ferring uitgevoerde studie CS009 het vermoeden dat volstaan kon worden met doseringen van minder dan 10 pg/mL.
Het verweer van [geïntimeerde 2] c.s. dat [geïntimeerde 2] in een e-mail correspondentie van 31 juli/ 1 augustus 2002 (productie 18 [geïntimeerde 2] en 33 Ferring) aan [A] (de technische details van) de uitvinding nog moest uitleggen overtuigt ook niet. Ferring heeft uitgelegd dat [A] niet gelukkig was met de door [geïntimeerde 2] aangebrachte wijzigingen op het protocol CS009 omdat hij in het gehele studietraject, waar Ferring toen mee bezig was, waarbij ook de sublinguale Newmin tablet werd onderzocht, dezelfde maatstaven of eindpunten wilde hanteren en [A] en [B] (en [H] uit het team van [B] ) in dat kader liever niet alleen maar wilde uitgaan van nieuwe eindpunten/ lage doseringen. Ook waren zij bang dat de beperking van de studie minder bruikbare resultaten zou opleveren. Het hof verwijst naar de door Ferring aangehaalde correspondentie in punten 74- 80 van de conclusie van repliek. Uit deze mailwisseling blijkt niet dat [geïntimeerde 2] Ferring nog moest uitleggen waar de uitvinding om ging. [geïntimeerde 2] schrijft in de door hem (deels) aangehaalde mail dan ook dat hij weliswaar wijzigingen in het protocol heeft aangebracht, maar dat hij niet denkt any changes were made in the pharmacological variables or endpoints.
Ook de stelling van [geïntimeerde 2] c.s dat uit de presentatie van [A] bij de Chilworth meeting op 15/16 april 2002 (volledig overgelegd als productie 98 [geïntimeerde 2] ) zou blijken (uit slide 23) dat [A] aan andere oplossingen dacht voor het hyponatriëmie-probleem, zoals [vertrouwelijke informatie] doet aan het bovenstaande niet af. Daaruit blijkt hooguit dat [A] ook verschillende alternatieve oplossingen overwoog.
11.18.
Het hof is van oordeel dat uit de hiervoor genoemde stukken en omstandigheden en de logische opeenvolging van de daaruit blijkende ontwikkelingen binnen Ferring valt af te leiden dat [B] en [A] het concrete low dose-low plasma concept hebben bedacht en geopenbaard vanaf maart 2002 en zij dus als uitvinders daarvan moeten worden aangemerkt.
Dit is slechts anders als [geïntimeerde 2] (al daarvoor) de uitvinding aan hen zou hebben geopenbaard en zij deze zouden hebben ontleend aan [geïntimeerde 2] , zoals [geïntimeerde 2] c.s. stelt.
11.19.
Ter onderbouwing van zijn stelling/verweer dat Ferring de uitvinding aan [geïntimeerde 2] heeft ontleend voert [geïntimeerde 2] c.s. aan
dat [geïntimeerde 2] aan/met een team van Ferring-wetenschappers in Kopenhagen op 28 en/of 29 augustus 2001 zijn uitvinding heeft (mee)gedeeld;
dat [geïntimeerde 2] in mei/juni 2002 de studie CS009 ontwierp, waarbij de effectiviteit van lage doses werd getest, en dat deze studie onder zijn supervisie werd uitgevoerd bij Covance in de VS.
Ad a: heeft [geïntimeerde 2] de uitvinding gedeeld met Ferring eind augustus 2001?
11.20.
Ferring heeft gemotiveerd betwist dat [geïntimeerde 2] aan medewerkers van de Ferring-groep een low dose, laat staan het concrete low dose-low plasma concept heeft geopenbaard in augustus 2001. Zij stelt dat [geïntimeerde 2] in 2001 niet betrokken was bij de R&D betreffende Desmopressine, maar slechts bij de regulatory in de VS betreffende Ferring-producten (in verband met het krijgen van marktvergunningen in de VS) en bij andere producten, met name bij het R&D traject van Degarelix (een product gericht op behandeling van prostaatkanker). Zij stelt dat de verklaringen van [geïntimeerde 2] en [E] onbetrouwbaar zijn en heeft zich in dit verband beroepen op het oordeel van de Amerikaanse rechter (SDNY) in de Amerikaanse procedure, die de verklaringen van [geïntimeerde 2] en [E] over onder meer deze mededelingen oordeelde “to be lacking in credibility”. Zij stelt dat de stellingen van [geïntimeerde 2] c.s. bovendien niet meer inhouden dan dat [geïntimeerde 2] iets gezegd zou hebben over low doses, wat Ferring allang wist en niets nieuws was en dat hij niet stelt iets te hebben gezegd over concrete plasmagehaltes zodat hij in ieder geval toen, ook volgens zijn eigen verklaringen, niet de onderhavige uitvinding deelde.
11.21.
Hiervoor heeft het hof geoordeeld dat de uitvinding het concrete low dose-low plasma concept inhield en (dus) het besef vereiste dat er een bepaalde concrete range van maximaal 10 pg/mL plasmaconcentratie is waarbij een effectieve antidiuretische werking optreedt die niet langer aanhoudt dan de benodigde tijd gedurende de nacht en dat een hogere plasmaconcentratie (door uiteraard een hogere dosering) een langere werking en daarmee een verhoging van de kans op hyponatriëmie tot gevolg heeft.
[geïntimeerde 2] c.s stelt zelf ook (vergelijk hiervoor rechtsoverwegingen 10.19- 20) dat de uitvinding dit inhoudt, dat het concept is uitgewerkt in een concrete technische leer en het onderwerp van de aanvrage ook het bereik van concentraties is, zoals uiteindelijk neergelegd in conclusies van EP 419, dat met de aanname dat lagere doses dan de conventionele tablet ook voldoende kunnen zijn om effectief te zijn de uitvinding nog lang niet voorhanden is en dat dit ook de stand van zaken was in de prior art. Ook Ferring meent kennelijk, met het citeren van het oordeel van de SDNY onder 138 in zijn akte februari 2020 (pag. 9), dat het idee van een lagere doses vanwege de potentie van desmopressine behoorde tot de stand van de techniek.
11.22.
Het hof is van oordeel dat van [geïntimeerde 2] c.s. in het licht van het bovenstaande verlangd mag worden dat hij zijn verweer/stelling (partijen twisten over de vragen of dit een bevrijdend verweer is en wie de bewijslast draagt; zie punt 57 pleitnota Ferring hb) dat [geïntimeerde 2] de uitvinding met Ferring deelde in augustus 2001voldoende concreet onderbouwt, in die zin dat hij aangeeft dat [geïntimeerde 2] voormelde (ook naar het oordeel van [geïntimeerde 2] c.s.) essentiële elementen van het concrete low dose-low plasma toen heeft medegedeeld.
11.23.
Deze concretisering is te meer van belang nu [geïntimeerde 2] c.s. stelt dat [geïntimeerde 2] op hetzelfde moment zijn uitvinding betreffende de sublinguale toediening heeft gedeeld (wat Ferring ook betwist), welke uitvinding ook het voordeel heeft dat volstaan kan worden met een lagere doses vanwege de betere bio beschikbaarheid. Dat [geïntimeerde 2] c.s. en [geïntimeerde 2] in zijn verklaringen ook spreken over “ [geïntimeerde 2] / zijn low dose concept” als het low dose voordeel van sublinguale toediening wordt bedoeld, blijkt onder meer uit de stellingen van [geïntimeerde 2] c.s. omtrent het overleg tussen Ferring, octrooigemachtigde [J] en [geïntimeerde 2] over de vermelding van [geïntimeerde 2] als (mede)uitvinder van de GB 397 (betreffende sublinguale toediening) en verklaringen van [geïntimeerde 2] en [E]5..
11.24.
Als de stelling van [geïntimeerde 2] c.s. concreet niet meer inhoudt dan dat [geïntimeerde 2] tijdens deze bespreking(en) iets gezegd heeft over lagere doseringen en hyponatriëmie is dat onvoldoende om aan te nemen dat hij de onderhavige uitvinding heeft (mede)gedeeld.
11.25.
Die concrete onderbouwing ontbreekt. Nergens stelt [geïntimeerde 2] c.s. concreet dat [geïntimeerde 2] in augustus 2001 aan medewerkers van Ferring heeft medegedeeld dat hij zich realiseerde dat de werking van desmopressine zodanig is dat bij een plasmaconcentratie in een bepaalde range tot maximaal 10 pg/mL het anti-diuretisch effect voldoende is gedurende de benodigde tijd in de nacht en aldus het risico op hyponatriëmie wordt verminderd.
11.26.
In de conclusie van antwoord stelt [geïntimeerde 2] c.s. hieromtrent:
“26. In augustus 2001 presenteerde [geïntimeerde 2] op verzoek van [E] zijn uitvinding aan een team van Ferring-wetenschappers in Kopenhagen die specialisten op het gebied van de ontwikkeling van geneesmiddelen waren. Hij legde aan de Ferring-wetenschappers (onder meer) uit dat om de Hyponatremie bijwerking te voorkomen desmopressine in een lage dosering moest worden toegediend.
27. [E] was ook aanwezig bij deze bespreking. In een intern Ferring
memorandum van [E] aan de bedrijfsjurist van Ferring, mevr. [M] , uit
2003, refereert [E] aan de bijeenkomst (Productie 7, blz. 1 onder "overview"):
" [geïntimeerde 2] and I attended a meeting concerning the new formulation programs in Copenhagen on August 30, 2001. Efforts to define a clinical study protocol and obtain dosage forms to evaluate whether the sublingual route of administration might offer any advantages were initiated shortly after that meeting. Evaluation of lower dose issue was
also undertaken as a second priority. After these initial discussion, other meetings to define the operational details needed to evaluate the concepts occurred later."
11.27.
[geïntimeerde 2] c.s heeft een verklaring van [geïntimeerde 2] van 20 juli 2012 (productie 16 [geïntimeerde 2] ) overgelegd. Daarin verklaart hij over zijn mededeling aan medewerkers van Ferring in augustus niet meer dan:
In August of 2001, I shared my inventions with others within Ferring. I do not recall Ferring's Dr. [A] attending either of the meetings 1 had in Copenhagen in August 2001 (punt 22).
11.28.
In de conclusie van dupliek stelt [geïntimeerde 2] c.s:
[geïntimeerde 2] , een externe consultant uit de VS, doet een uitvinding en deelt zijn oplossing voor de hyponatriëmie problemen in de zomer van 2001 met research director [E] . Vervolgens instrueert [E] de mensen die binnen Ferring zijn betrokken bij het bestaande ontwikkelingsprogramma met betrekking tot desmopressine om de uitvinding van [geïntimeerde 2] te implementeren (hetgeen bijvoorbeeld ook volgt uit het door Ferring als Productie 23 overgelegde memorandum van [E] aan [A] d.d. 4 januari 2002, dat aantoont dat
[E] aan [A] verzocht om de leiding te nemen in de voorbereiding van
een "pre-meeting package" voor een FDA meeting).
De verklaring van [E] in voormeld memorandum van 2003 en de CS004 gaan echter niet over de onderhavige uitvinding. Daarin wordt slechts gesproken over (studies met betrekking tot) de sublinguale toediening en over stukken (met betrekking tot de sublinguale toediening) voor een FDA-meeting.
11.29.
Ook de verklaring van [geïntimeerde 2] in zijn memorandum van 14 mei 2002 betreffende Inventorship on Ferring (productie 38 Ferring) gaat over de sublinguale toediening en niet over de onderhavige uitvinding. Hij verklaart dat hij tijdens de meeting (die volgens die verklaring in november 2001 zou hebben plaatsgevonden, een datum die hij in zijn latere verklaringen wijzigt) duidelijk heeft gemaakt dat sublinguale toediening mogelijk was hetgeen het voordeel had dat volstaan kon worden met a lower administered dose might avoid some of the safety issues observed in elderly patients with the oral tablet, terwijl de leden van het projectteam reiterated their long held belief that Zydis was an oral dosage form which they had and still expected to be pharmacokinetically bioequivalent to the existing, marketed desmopressin tablet.”
11.30.
In de memorie van antwoord is op pagina’s 20 tot en met 36 een deel van het transcript van de openingstatement van mr. Jim Sottile als vertegenwoordiger van [geïntimeerde 2] c.s. van 21 februari 2018 in de Amerikaanse procedure opgenomen (productie 35 [geïntimeerde 2] ). Zijn statement gaat eerst (uitsluitend) over de ideeën van [geïntimeerde 2] over sublinguale toediening en de voordelen daarvan. Pas daarna zegt Sottile iets over een low dose concept:“Once the results from that first study [de CS004, hof] were in, Ferring then proceeded to test [geïntimeerde 2] 's other new concept, that you didn't need anywhere near as much desmopressin being administered and reaching the blood stream in order to be therapeutically effective to help patients, particularly for the new adult nocturia condition where you wanted a shorter duration of action (…) The second concept got tested in another study conducted at Ferring called CS009”(pagina 29 MvA).
Er staat niet dat [geïntimeerde 2] dit concept, laat staan het concrete low dose-low plasma concept heeft medegedeeld aan medewerkers van Ferring tijdens een bijeenkomst in augustus 2001.
11.31.
Voorts stelt [geïntimeerde 2] c.s. in de memorie van antwoord (pag. 41-42) over de bespreking in augustus 2001 dat [geïntimeerde 2] toen aan onderzoekers van Ferring heeft uitgelegd dat een verbeterde biobeschikbaarheid van desmopressine bij lagere doseringen een oplossing zou kunnen bieden, waarbij uit een verklaring van [geïntimeerde 2] van 26 juli 2011 (productie 16, annex 2 [geïntimeerde 2] ) wordt geciteerd:
[E] then arranged for me to travel to Copenhagen near the end of August 2001 to present my concepts to Ferring scientists and drug developers. I attended a meeting in Copenhagen on August 30, 2001 (deze datum wordt in latere verklaringen gewijzigd) where 1 presented my ideas in detail to the attending desmopressin project team members and [E] . 1 can not recall all the details of the meeting but I do specifically recall that we had a vigorous scientific discussion concerning the etiology of hyponatremia and the pharmacokinetics of desmopressin. (…) I encountered scepticism regarding my hypothesis that the duration of antidiuretic response was related to the dose that actually reached the blood stream and that a lower dose would not diminish significantly the antidiuretic effect itself but rather shorten its duration. The project team members and I were questioned by [E] concerning the dose response issue and the dose response issue and the pharmacodynamic effects and I explained my concepts to them.
Weliswaar zou uit deze verklaring (indirect) kunnen worden afgeleid dat gesproken is over belangrijke elementen van het concrete low dose-low plasma concept (maar dan ook nog niet over het maximale plasmagehalte van 10 pg/mL), maar juist op dit punt heeft [geïntimeerde 2] zijn verklaring herzien in de hiervoor (in rechtsoverweging 11.27) genoemde verklaring van 20 juli 2012. Daar volstaat hij met de hiervoor twee aangehaalde “inhoudsloze” zinnen en vervangt hij 30 augustus 2001 door eind augustus 2001. Nu een verklaring voor deze wijziging ontbreekt (terwijl de verklaring verder grotendeels vrijwel gelijkluidend is) gaat het hof aan de eerdere verklaring van 26 juli 2011 in zoverre voorbij.
In dit verband stelt [geïntimeerde 2] c.s. ook nog dat [E] bevestigt dat [geïntimeerde 2] op 28 of 29 augustus 2001 zijn ideeën met betrekking tot lage dosering, sublinguale toediening en het voorkomen van hyponatriëmie presenteerde aan onderzoekers van Ferring onder verwijzing naar een verklaring van [E] van 9 januari 2012, (productie 22 [geïntimeerde 2] ):
19. At my urging [geïntimeerde 2] and I travelled to Copenhagen and on the week of August 27. [geïntimeerde 2] presented his low dose, sublingual, and hyponatremia avoidance concepts to Ferring scientists, including [B] on either the 28th or29th, (…)
I questioned [geïntimeerde 2] and [B] concerning the dose response issues and the pharmacodynamic aspects of desmopressin, and we had a discussion concerning hyponatremia and its causes.
Ook hieruit blijkt niet dat het concrete low dose-low plasma concept werd gepresenteerd.
11.32.
Ten slotte heeft [geïntimeerde 2] in zijn verklaring bij de Amerikaanse rechter in februari 2015 (productie 79 Ferring) erkend dat hij in augustus 2001 geen plasmaconcentraties heeft genoemd aan medewerkers van Ferring (vergelijk de akte Ferring 2016, pagina 47) en de reactie daarop van [geïntimeerde 2] c.s op pagina 12 van zijn pleidooi in hoger beroep.
11.33.
Uit de eigen stellingen van [geïntimeerde 2] c.s. kan dan ook niet worden afgeleid dat [geïntimeerde 2] in augustus 2001 meer heeft (mede)gedeeld dan hetgeen Ferring al wist. In ieder geval heeft [geïntimeerde 2] c.s. niet concreet onderbouwd dat [geïntimeerde 2] in augustus 2001 aan medewerkers van Ferring (de essentiële elementen van) de uitvinding, het concrete low dose-low plasma concept (de concrete range van het plasmaconcentratie) heeft meegedeeld. Al om die reden gaat het hof aan dit verweer/deze stelling voorbij.
11.34.
Voor zover ervan moet worden uitgegaan (dat [geïntimeerde 2] c.s. (ook) heeft bedoeld te stellen)
dat de uitvinding en de door [geïntimeerde 2] gestelde mededeling in augustus 2001 die concrete range (impliciet) inhield omdat je die kon terugrekenen6.en/of
dat de uitvinding geen concrete range inhield
doet dat aan het bovenstaande niet af. Al de elementen die [geïntimeerde 2] volgens de stellingen van [geïntimeerde 2] c.s. en de genoemde verklaringen van [geïntimeerde 2] en [E] heeft verteld in augustus 2001 had [A] toen ook al bedacht, genoemd en gecombineerd voor eind augustus 2001. Dat blijkt uit de hiervoor in ro. 11.5, a tot en met i, en in het bijzonder e tot en met h (die door [geïntimeerde 2] c.s. niet gemotiveerd zijn betwist) genoemde stukken en omstandigheden.
[A] heeft toen geen concrete plasmaconcentraties genoemd maar als [geïntimeerde 2] die kon berekenen op grond van bekende gegevens in de published literature kon Ferring dat ook. Overigens stelt [geïntimeerde 2] c.s. zelf dat de testen destijds te ongevoelig waren om dit te berekenen (punten 5.56 en 5.57 MvA).
11.35.
Voor zover het bovenstaande niet voldoende zou zijn om dit verweer/deze stelling buiten beschouwing te laten, gaat het hof aan de stelling van [geïntimeerde 2] c.s. dat [geïntimeerde 2] de uitvinding heeft (mee)gedeeld aan/met medewerkers van Ferring als onvoldoende onderbouwd voorbij omdat de verklaringen van [geïntimeerde 2] en [E] over het vermeende (mede)delen van de uitvinding door [geïntimeerde 2] aan/met Ferring herhaaldelijk tegenstrijdig en/of aantoonbaar onjuist zijn (en daardoor niet betrouwbaar overkomen), terwijl [geïntimeerde 2] c.s. daarvoor geen afdoende verklaring geeft, en bovendien ook geen stukken uit de desbetreffende periode over legt, die het standpunt van [geïntimeerde 2] c.s ondersteunen.
11.36.
In dit verband wijst het hof erop:
- -
dat [geïntimeerde 2] in een memorandum van 14 mei 2002 betreffende “Inventorship on Ferring case” (productie 38 Ferring) verklaart dat hij en [E] zich begin november 2001 realiseerden dat de Zydis tablet, anders dan waarvan Ferring tot dan toe uitging, ook sublinguaal kon worden toegediend en dat dat als voordeel had dat volstaan kon worden met lagere doseringen en dat hij tijdens een meeting op 12 of 13 november 2001 in Kopenhagen met “representatives of the Zydis project team and other senior managers, (…)” duidelijk heeft gemaakt dat sublinguale toediening mogelijk was hetgeen voordeel had dat volstaan kon worden met “a lower administered dose might avoid some of the safety issues observed in elderly patients with the oral tablet”;
- -
dat zijn advocaat [L] in een brief van 27 december 2002 (productie 12g [geïntimeerde 2] ) stelt dat [geïntimeerde 2] zich had vergist en dat ging om “a meeting in Copenhagen in the last week of august at a Newmin Project team meeting”, welke meeting, naar Ferring onbetwist heeft gesteld op 30 augustus 2001 plaatsvond;
- -
dat [E] in een memorandum van 14 januari 2003 (productie 7 [geïntimeerde 2] ) aan [M] van Ferring, schrijft dat de bijeenkomst, waar ook [geïntimeerde 2] bij was, plaatsvond op 30 augustus 2001;
- -
dat [geïntimeerde 2] in een verklaring van 26 juli 2011 verklaart dat de bespreking op 30 augustus 2001 plaatsvond;
- -
dat [geïntimeerde 2] in zijn verklaringen van 9 januari 2012 verklaart dat het ging om meetings op 28 en 29 augustus 2001 en niet op 30 augustus 2001(productie 16, annex 3 [geïntimeerde 2] );
- -
dat [geïntimeerde 2] c.s. in de incidentele conclusie ex 843a in deze procedure van 1 februari 2012 stelt dat gedurende een projectteambijeenkomst op 30 augustus 2001 [geïntimeerde 2] ’s vinding werd besproken, waarbij een uitdraai uit de elektronische kalender van [E] wordt overgelegd, waaruit blijkt dat [E] is uitgenodigd voor een meeting over het NEWMIN project op 30 augustus 2001;
- -
dat [geïntimeerde 2] in zijn verklaring van 20 juli 2012 verklaart dat hij in augustus 2001 zijn uitvindingen deelde met medewerkers van Ferring;
- -
dat [geïntimeerde 2] c.s. thans in deze procedure stelt dat hij zijn uitvindingen op 28 en/of 29 augustus 2001 presenteerde aan medewerkers van Ferring;
- -
dat [geïntimeerde 2] in zijn memorandum van 20 juli 2012 (punt 22) heeft verklaard dat [A] niet aanwezig was bij de meeting waar hij zijn uitvindingen openbaarde of enige andere meeting in augustus 2001 en dat hij [A] daarvoor ook nooit ontmoet heeft,althans hij zich dat niet herinnert;
- -
dat [geïntimeerde 2] c.s. bij conclusie van dupliek stelt dat [geïntimeerde 2] op 28 augustus 2001 besprekingen heeft gevoerd over het Degarelix project, met onder meer [A] .
Als verklaring voor het noemen van verschillende data stelt [geïntimeerde 2] c.s. slechts dat [geïntimeerde 2] zich heeft vergist, stellende dat de stempels uit zijn paspoort bewijzen (sic) dat het noemen van de datum 30 augustus 2001 door [geïntimeerde 2] een vergissing was, omdat daaruit blijkt dat hij Denemarken al op 29 augustus 2001 had verlaten. Dat is geen afdoende verklaring; zeker niet voor zijn eerdere verklaring dat de meeting in november 2001 plaatsvond.
11.37.
Voorts ontbreekt elke, althans voldoende (overtuigende) contemporaine documentatie van de betrokkenheid van [geïntimeerde 2] bij de R&D betreffende desmopressine en nocturia voor juni 2002, toen Ferring het concrete low dose-low plasma concept al had bedacht.
11.38.
[geïntimeerde 2] c.s. beroept zich op (aan [E] als toenmalige werknemer van de Ferring-groep gerichte) facturen van [geïntimeerde 2] en de daarbij gevoegde door hem opgestelde tijdlijsten (productie 25 [geïntimeerde 2] ), waarop is vermeld dat hij op 28 en 29 augustus 2001 in totaal 1,5 uur heeft besteed aan “Desmopressin Nocturia Program”, op de verklaring van [geïntimeerde 2] in het memorandum van 14 mei 2002 (productie 38 Ferring) en de presentatie van [E] van 11 oktober 2001 voor de board van Ferring (productie 23a [geïntimeerde 2] ).
Deze facturen en tijdlijsten, de verklaring en de presentatie doen niet, althans onvoldoende af aan het oordeel van het hof dat [geïntimeerde 2] c.s. zijn stelling dat [geïntimeerde 2] de onderhavige uitvinding aan/met Ferring in augustus 2001 heeft (mede)gedeeld onvoldoende heeft onderbouwd. Integendeel, de verklaring van [geïntimeerde 2] , die overigens niet uit de relevante periode dateert, heeft slechts betrekking op (mededeling aan Ferring van) de sublinguale toediening en het daaruit voortvloeiende voordeel dat volstaan kon worden met een lagere dosering. Daaruit blijkt niet (voldoende duidelijk) dat zij ook betrekking heeft op ((mede)deling van) de voordelen van lagere plasmaconcentraties, laat staan op het concrete low dose-low plasma concept. Weliswaar wordt er gesproken over lagere doseringen en veiligheid voor oudere patiënten, maar ook de sublinguale toepassing heeft (door de betere biobeschikbaarheid) een lagere dosering, terwijl die toediening al veiliger is doordat de sublinguale tablet (onder de tong) zonder water kan worden ingenomen. Ook de presentatie van [E] gaat over de sublinguale toedieningsvorm. Uit de tijdlijsten die door [geïntimeerde 2] zelf zijn opgesteld en waarvan Ferring de authenticiteit betwist (in welk verband opvallend is dat [geïntimeerde 2] in het door haar ingestelde incident ex artikel 843a Rv aanvankelijk overlegging van deze facturen en tijdlijsten vorderde, maar die vordering later introk, kennelijk omdat hij die zelf alsnog kon produceren) kan niet worden afgeleid dat de 1,5 uur die daarop vermeld is zou zijn besteed aan het (mede)delen van een low dose-low plasma concept in augustus 2001. Uit de voormelde verklaringen van [geïntimeerde 2] en [E] kan hooguit worden afgeleid dat de tijd besteed is aan werkzaamheden met betrekking tot de sublinguale toedieningsvorm. Bovendien heeft Ferring onbetwist gesteld dat [geïntimeerde 2] in de desbetreffende periode betrokken was bij de regulatory in verband met het verkrijgen van een marktvergunning voor de Minirin tablet in de VS, waarop de bestede tijd ook betrekking kan hebben gehad (vergl. Punten 141-142 MvG en productie 74B Ferring). Ten slotte verklaart [geïntimeerde 2] in dit memorandum dat mededeling aan Ferring (over de sublinguale toediening) is gedaan in november 2001.
11.39.
Het bovenstaande wordt bevestigd door het oordeel van de Amerikaanse rechter. Die kwam, nadat [geïntimeerde 2] en [E] in die procedure zeer uitvoerig als getuigen waren gehoord, tot het oordeel dat de verklaringen van [geïntimeerde 2] en [E] , in het bijzonder over het (mee)delen van zijn uitvindingen aan/met Ferring in augustus 2001, ongeloofwaardig waren.
De Amerikaanse rechter overweegt in rechtsoverweging 89 e.v.van het Amerikaanse vonnis:
Findings on [geïntimeerde 2] and [E] ’s Credibility
89. The court finds that [E] ’s testimony was not credible insofar as it related to the claim that [geïntimeerde 2] was a co-inventor7.. [E] has a material interest in the outcome of this suit. He owns an 18% stake in Reprise, which has a 10% ownership interest in Serenity.(…) He admits he “stand(s) to benefit from any of the benefits that accrue through the intellectual property held by [geïntimeerde 2] ” in this case. (…) He was named as inventor and then was removed as inventor along with [geïntimeerde 2] 8.(..) He knowingly embraced his status as an inventor but later switched postures and claimed that [geïntimeerde 2] was the sole inventor.
90. Evidence cited by [E] in his direct testimony does not support his statement (…) [E] later admitted that.
91. The court also finds that [geïntimeerde 2] ’s testimony was not credible insofar as it is related to his claim of co-inventorship. Notably, after he was terminated and hired a lawyer, he changed the date of his invention from November 2001 to August 2001 and claimed that he alone without input of [E] conceived of the invention. (…)
92. On October 21, 2002, prior to leaving his position at Ferring, [geïntimeerde 2] established his own consultancy “CNF Pharma”(…) [geïntimeerde 2] claimed at trial that “CNF” stands for “ [D] and [geïntimeerde 2] ” and “ [E] was never part of CNF Pharma”(…) [E] testified that he “ha(s)n’t seen the paperwork, but (he) think(s) (CNF) stands for [D] and [geïntimeerde 2] ”(…) [E] also testified that he “do(es)’t know anything at all about the workings of CNF. Never did”(…)
93. The court discredits the testimony of [geïntimeerde 2] and in [E] and concludes that CNF stood for [D] , [E] and [geïntimeerde 2] . CNF was created in October 2002 while [D] , [E] and [geïntimeerde 2] continued working for Ferring (…) [D] and [geïntimeerde 2] were consultants but [E] was a senior employee who owned a fiduciary duty to Ferring”.
(…)
111. As a threshold matter, Serenity an Reprise’s claims to co-inventorship depend on the subject matter communicated by [geïntimeerde 2] to members of Ferring in and around the meeting in Copenhagen in August 2001. They cannot demonstrate by clear and convincing evidence that [geïntimeerde 2] communicated the inventive concepts of a sublingual route of administration or effective lower doses.
(…)
113. Serenity and Reprise’s primary evidence is [geïntimeerde 2] and [E] ’s testimony related to the events in het summer of 2001. The court finds the testimony of [geïntimeerde 2] and [E] to be lacking in credibility insofar as it relates to [geïntimeerde 2] ’s inventorship claim.
De omstandigheid dat de onder ede afgelegde verklaringen van [geïntimeerde 2] en [E] naar het oordeel van de Amerikaanse rechter ongeloofwaardig zijn roept ook bij dit hof twijfel op over de betrouwbaarheid van hun verklaringen, op grond waarvan van [geïntimeerde 2] c.s. gevergd mag worden dat hij een afdoende verklaring geeft voor voormelde wijzigingen in de verklaringen van [geïntimeerde 2] en [E] . Dat heeft hij niet gedaan.
Ad b. Heeft [geïntimeerde 2] in mei/juni 2002 de studie CS009 ontworpen?
11.40.
[geïntimeerde 2] c.s stelt zelf dat de uitvinding gelegen zou zijn in de concrete range blijkend uit CS009/de daaraan vrijwel gelijk zijnde CNF-studie en het daaruit volgende voorbeeld 8 in de aanvragen. Naar het oordeel van het hof was sprake van de uitvinding toen werd besloten doseringen te testen (waarvan bekend was dat) die resulteerden in plasmaconcentraties van niet meer dan 10 pg/mL. In ieder geval was het besef vereist dat zodanige plasmaconcentraties nog een effectieve antidiuretische werking konden hebben voor de vereiste tijd. Zoals hiervoor overwogen blijkt van dat besef bij Ferring toen zij besloot doseringen te testen die tot dit soort lage plasmaconcentraties leiden. De resultaten van de CS009 bevestigden dat.
11.41.
[geïntimeerde 2] c.s. stelt dat [geïntimeerde 2] in mei/juni 2002, toen hij werkzaam was voor Ferring (het protocol voor) CS009 ontwierp en dat CS009 in september 2002 onder zijn supervisie werd uitgevoerd bij Covance in de VS Daarmee wil hij kennelijk betogen dat het idee om doseringen te testen die leiden tot zodanig lage plasmaconcentraties van hem afkomstig was en dat de resultaten van die testen aan hem “toekomen”. Ter onderbouwing van deze stelling beroept [geïntimeerde 2] c.s. zich op de door [geïntimeerde 2] en [E] in de US-procedure afgelegde verklaringen en de door [geïntimeerde 2] gemaakte aantekeningen op en voorgestelde wijzigingen van het concept-protocol van CS009. Diverse concepten vanaf de versie van 6 juni 2002 tot de final version van 2 augustus 2002, zijn met en zonder de aanpassingen (deels en/of volledig) overgelegd (als producties 20, 26-28 [geïntimeerde 2] en 8, 9, 30 en 32 Ferring).
11.42.
Op grond van hetgeen hierna wordt overwogen verwerpt het hof deze stelling, althans gaat het daaraan als onvoldoende onderbouwd voorbij. Vast staat dat [geïntimeerde 2] betrokken is geweest bij de uitvoering van de CS009 in de VS in opdracht van Ferring. Ook heeft hij opmerkingen gemaakt op en wijzigingen voorgesteld van het concept protocol van Ferring voor deze studie. Niet blijkt echter dat hij deze studie heeft ontworpen of bedacht. Integendeel, in de CS009 werden lage doseringen (middels I.V. toediening) genoemd die zouden leiden tot dezelfde lage plasmaconcentratie als de doseringen (middels sublinguale toediening) genoemd in de mail van [C] van 18 maart 2002 (zie hiervoor overweging 3.3.11) en in het protocol van CS007 van april 2002 (zie hiervoor overweging 3.3.14).
11.43.
Het protocol, de lage doseringen en overige data van de CS009 waren gebaseerd op (het protocol van) de CS007, een low dose-low plasma studie met de sublinguale tablet van Zydis. Omdat de sublinguale tablet met de te testen lage doseringen nog niet voorhanden was werd besloten deze testen uit te voeren middels I.V. toediening. Doordat de bio beschikbaarheid van I.V.-toediening uiteraard veel hoger is dan van sublinguale toediening werden veel lagere doses genoemd in de CS009; het ging om doses die naar verwachting tot ongeveer dezelfde plasmaconcentraties leidden en die wat betreft de drie laagste doses gelegen waren onder de plasmaconcentraties bij toediening van de 100 µg orale tablet.
11.44.
Dat de CS009 was gebaseerd op de CS007 blijkt ook uit de “assumptions to draft protocol” bij het concept-protocol CS009 van 6 juni 2002, die op 7 juni 2002 (productie 20 [geïntimeerde 2] ) aan [geïntimeerde 2] werd gezonden. Daarin is vermeld: “The tekst in the draft is copied from the low dose tablet protocol”. De onderbouwde stelling van Ferring dat het CS007-protocol is ontworpen door [B] en dat [geïntimeerde 2] daarbij niet betrokken was, heeft [geïntimeerde 2] c.s. niet gemotiveerd betwist. In zijn e-mail van 31 mei 2002 (productie 29 Ferring) heeft [B] aan [geïntimeerde 2] geschreven dat zijn team een opzet zal maken voor CS009 en die opzet aan [geïntimeerde 2] zal doorsturen. Bij mail van 7 juni 2002 zendt Hanssen (van het team van [B] ) het eerste concept van het protocol naar [geïntimeerde 2] .
11.45.
Uit de diverse overgelegde concept-protocollen blijkt dat [geïntimeerde 2] daarop aantekeningen heeft gemaakt en dat hij wijzigingen heeft voorgesteld. Zo heeft hij onder meer voorgesteld de twee hoogste doses te schrappen, die in de final version ook niet meer voorkomen. Ook is de naam van [B] als sponsor geschrapt. In zijn verklaring in de procedure bij het Japanse octrooibureau verklaarde [geïntimeerde 2] dat in de versie van 12 juli 2012 nog de naam van [B] was vermeld als een van de ondertekenaars / “sponsor’s responsible”, maar zijn naam in latere versies is verwijderd (productie 40 Ferring, par 43 en 44). Uit de overgelegde versie van 24 juni 2002 blijkt dat ook. Dat de opmerkingen en wijzigingen tot enige relevante wijziging of nieuwe ideeën of data hebben geleid is niet onderbouwd gesteld.
11.46.
Het hof gaat er derhalve van uit dat het idee, het protocol en de data voor de CS009 van Ferring afkomstig waren en dat [geïntimeerde 2] daaraan geen voor de uitvindersvraag relevante bijdrage heeft geleverd.
11.47.
Ook dit oordeel wordt ondersteund door het oordeel van de Amerikaanse rechter in het Amerikaanse vonnis:
“71 [geïntimeerde 2] marked up the CS009 draft with several calculations that did not change the specific level of doses but converted their measurements (…). He also proposed eliminating the two top doses (…) He admitted that “going from five doses to three doses does not generate any data that would not have been available from the original five-dose study” (…)”.
11.48.
Op grond van het bovenstaande is het hof van oordeel dat het verweer/de stelling van [geïntimeerde 2] c.s. dat Ferring de uitvinding aan [geïntimeerde 2] “ontleend” heeft faalt en dat [B] en [A] het concrete low dose-low plasma concept, los van [geïntimeerde 2] , hebben bedacht en geopenbaard vanaf maart 2002 en zij dus als uitvinders daarvan moeten worden aangemerkt.
11.49.
Subsidiair betwist [geïntimeerde 2] c.s. dat [geïntimeerde 2] de uitvinding aan Ferring heeft ontleend, stellende dat [geïntimeerde 2] de uitvinding los van Ferring heeft bedacht en dat vordering tot opeising faalt op grond van het first to file beginsel. Daartoe stelt hij:
dat [geïntimeerde 2] zijn uitvinding in de zomer van 2001 heeft bedacht en medegedeeld aan [E] waarbij zij zich beroept op verklaringen van [geïntimeerde 2] en [E] ;
dat de in de aanvraag genoemde CNF-studie de basis is voor zijn octrooiaanvrage.
11.50.
[geïntimeerde 2] c.s. stelt dat [geïntimeerde 2] de in de aanvrage genoemde klinische studie voor eigen rekening heeft uitgevoerd in de zomer 2003, eveneens bij Covance in opdracht van CNF, het in oktober 2002 opgerichte bedrijf van onder andere [D] en [geïntimeerde 2] (vrgl. productie 42 Ferring).
11.51.
Ferring heeft allereerst betwist dat de studie is verricht, althans is verricht voor de indiening van de octrooiaanvraag op 10 november 2003, stellende dat het rapport van de CNF-studie dateert van november 2006 (productie 19B [geïntimeerde 2] ).
Voorts heeft Ferring gesteld dat dat de CNF-studie een herhaling was van de CS009, die Ferring liet uitvoeren in 2002, dat [geïntimeerde 2] het idee, het protocol en de data voor de CNF- studie heeft ontleend aan Ferring en dat al op die grond de rechten op de uitvinding aan Ferring toekomen. Het gaat om een fase I klinische studie waarin gezonde overhydrated vrijwilligers intraveneus desmopressine toegediend kregen van 0,5 ng/kg, 1,0 ng/kg en 2,0 ng/kg, dat resulteerde in een relevant antidiuretisch effect. Op het overgelegde final protocol van de CNF-studie is de datum 30 juni 2003 vermeld; op het overgelegde rapport is de datum 9 november 2006 vermeld (producties 19A en B [geïntimeerde 2] ).
11.52.
[geïntimeerde 2] erkent, althans betwist niet dat CS009 en de CNF-studie vrijwel gelijk (subtantially similar) zijn en dat blijkt ook uit de vergelijking van het protocol voor de CNF studie van juni 2003 en het protocol van de CS009 van 2 augustus 2002.
11.53.
Gelet op de overeenstemming tussen (de protocollen van) de CNF-studie en de CS009 en de omstandigheid dat [geïntimeerde 2] in opdracht van Ferring in 2002 bij de uitvoering en de voorbereiding van de CS009 betrokken was, is het hof van oordeel dat [geïntimeerde 2] het idee, het protocol en de data voor de CNF-studie heeft ontleend aan Ferring.
11.54.
Het hof is van oordeel dat het idee, de data voor en de resultaten van de studies een essentieel onderdeel zijn van de uitvinding omdat daardoor de range en het maximum daarvan worden bepaald en onderbouwd, waarbij desmopressine nog effectief is maar niet langer werkt dan noodzakelijk.
11.55.
Op grond van de omstandigheden
- -
dat [A] en/of [B] het concrete low dose – low plasma concept hebben bedacht, zonder dat [geïntimeerde 2] daarbij betrokken was,
- -
dat het idee, het protocol en de data voor de CS009 afkomstig waren van [B] (en zijn team) voordat [geïntimeerde 2] bij de CS009 betrokken werd;
- -
dat [geïntimeerde 2] op grond van de in rechtsoverweging 11.6 genoemde omstandigheden op de hoogte was van de daar genoemde (vertrouwelijke) informatie van Ferring vanaf 2001;
- -
dat [geïntimeerde 2] in ieder geval het idee, het protocol en de data voor (en de resultaten van) de vermeende CNF-studie aan Ferring heeft ontleend en dit een essentieel onderdeel was van de uitvinding en de octrooiaanvrage is;
is het hof van oordeel dat [geïntimeerde 2] de uitvinding heeft ontleend aan Ferring en zonder ontlening geen geldig octrooi had kunnen aanvragen.
11.56.
Hieraan kan de stelling van [geïntimeerde 2] c.s. dat [geïntimeerde 2] in de zomer van 2001 al een low dose concept had bedacht en gedeeld met [E] niet afdoen, nu hij (in ieder geval) het idee, het protocol en de data voor (en de resultaten van) de vermeende CNF-studie, die essentieel waren voor de uitvinding en zijn octrooiaanvraag, aan Ferring heeft ontleend.
11.57.
Voor zover toch relevant zou zijn of [geïntimeerde 2] al een low dose concept bedacht en (mede)deelde aan/met [E] in de zomer van 2001, geldt het volgende. Het hof is van oordeel dat [geïntimeerde 2] c.s. zijn stelling dat hij de uitvinding heeft (mede)gedeeld aan/met Ferring in augustus 2001 onvoldoende heeft onderbouwd; hetzelfde geldt voor de stelling van [geïntimeerde 2] c.s. dat [geïntimeerde 2] het concrete low dose-low plasma concept in de zomer van 2001 bedacht en aan/met [E] heeft (mede)gedeeld. Immers heeft [geïntimeerde 2] , naar Ferring onbetwist heeft gesteld, tijdens de depositions in de Amerikaanse procedure onder ede erkend dat hij pas op zijn vroegst vanaf juni 2002 concrete getallen genoemd heeft. Dat was nadat Ferring al in maart, april (in het concept-protocol van de CS007) en begin juni 2002 (in het concept-protocol van CS009) concrete lage doseringen had genoemd, waarvan [geïntimeerde 2] op de hoogte was door de in rechtsoverweging 11.6 genoemde omstandigheden. Uit de verklaring van [geïntimeerde 2] tijdens die depositions dat je tot de conclusie kon komen dat “very low single digit picogram per ml blood concentrations” voldoende zouden zijn door terug te rekenen vanaf de toen bekende “half lives from the peak blood levels” kan niet worden afgeleid dat hij daaraan gedacht heeft en dit aan [E] heeft medegedeeld. Dat verklaart hij ook niet. Bovendien stelt [geïntimeerde 2] c.s. zelf dat de toen bekende waarden helemaal niet betrouwbaar waren omdat die toen nog niet voldoende nauwkeurig vastgesteld konden worden. Dat was pas mogelijk toen de (vertrouwelijke) resultaten van de EMF/Desnoc11 studie er waren en dat was pas in februari en mei 2002 (vergelijk hiervoor (rechts)overwegingen 3.3.10 en 11.5 onder d, j en o). Het had op de weg van [geïntimeerde 2] c.s. gelegen om uit te leggen hoe [geïntimeerde 2] al in de zomer van 2001 tot de (betrouwbare) conclusie had kunnen komen, laat staan kwam dat “very low single digit picogram per ml blood concentrations” voldoende zouden zijn. Nu hij dat heeft nagelaten heeft hij ook deze stelling onvoldoende onderbouwd.
11.58.
Ten slotte geldt ook hier dat er relevante tegenstrijdigheden zijn in de verklaringen van [geïntimeerde 2] , met name wat betreft het tijdstip waarop hij zijn uitvinding zou hebben bedacht en aan/ met [E] zou hebben (mee)gedeeld, waarvoor hij geen afdoende verklaring geeft. Ook op dit punt acht de Amerikaanse rechter [geïntimeerde 2] ’s verklaring onbetrouwbaar (zie rechtsoverweging 11.39 hiervoor). Op zichzelf is dit al voldoende reden om aan de stelling van [geïntimeerde 2] c.s. dat [geïntimeerde 2] de uitvinding in de zomer van 2001 heeft bedacht als onvoldoende onderbouwd voorbij te gaan.
11.59.
Nu de verweren van [geïntimeerde 2] c.s. reeds falen wegens onvoldoende onderbouwing, komt het hof niet toe aan bewijslevering en gaat het aan de bewijsaanbiedingen voorbij.
11.60.
Op grond van het bovenstaande slagen de hoofdgrieven in zoverre dat het hof, anders dan de rechtbank, van oordeel is dat [A] en [B] mede-uitvinders zijn van de in de onderhavige aanvragen gelegen uitvinding. Voor zover de grieven zich richten tegen de afwijzing van de primair gevorderde verklaring voor recht dat slechts [A] de uitvinder is, falen de grieven. De grieven 6 en 18, voor zover gericht tegen de afwijzing van de meer subsidiaire vorderingen behoeven geen behandeling.
12. Rechtsverwerking ?
12.1.
In de inleidende dagvaarding stelt Ferring dat zij in februari 2011 ontdekte dat het EOB de intentie had een octrooi te verlenen op de aanvraag EP 419. In haar akte 2018 stelt Ferring dat eind 2009 de WO 707 opkwam tijdens de verleningsprocedure van een door Ferring ingediende octrooifamilie betreffende een low dose uitvinding en dat Ferring in februari 2011 reageerde op communicatie van het EOB en ook op de WO 707. Ferring is op 28 maart 2011 de opeisingsprocedure gestart tegen [geïntimeerde 2] en Reprise. Op 9 september 2011 heeft Ferring ook tegen Allergan voorwaardelijke opeisingsvorderingen ingesteld voor het geval dat, kort gezegd, Allergan werd geacht aanvrager en/of rechthebbende te zijn.
12.2.
[geïntimeerde 2] c.s. beroept zich op rechtsverwerking onder verwijzing naar de hiervoor in overweging 3.4.2 ev. gevoerde correspondentie. Hij stelt dat daaruit blijkt dat Ferring in ieder geval sinds april 2003, althans december 2004 wist dat [geïntimeerde 2] octrooi had aangevraagd voor de onderhavige uitvinding. Zij stelt voorts dat de EP 419 op 26 mei 2005 is gepubliceerd, zodat Ferring, afgezien van haar subjectieve wetenschap, in ieder geval vanaf die datum van het bestaan van EP 419 op de hoogte was of kon zijn.
12.3.
Ter onderbouwing van zijn beroep op rechtsverwerking stelt [geïntimeerde 2] c.s. dat [geïntimeerde 2] na december 2004 niets meer gehoord heeft van Ferring, dat hij er vervolgens, gelet op de daaraan voorafgaande correspondentie tussen [L] en [M] , gerechtvaardigd op heeft vertrouwd dat Ferring geen actie zou ondernemen en geen aanspraak meer zou trachten geldend te maken en dat zijn positie onredelijk verzwaard of benadeeld zou worden als Ferring haar aanspraak alsnog geldend zou maken. [geïntimeerde 2] c.s. stelt dat toewijzing van de vordering voor hem onredelijke en disproportionele gevolgen zou hebben doordat door [geïntimeerde 2] c.s., althans door Allergan en Serenity in periode tussen 2003, althans 2005 en 2011 en daarna veel kosten zijn gemaakt in verband met de ontwikkeling van een farmaceutisch product en dat toewijzing de nodige gevolgen zal hebben voor de deal tussen Reprise en Allergan.
12.4.
Ferring heeft gemotiveerd betwist dat sprake is van rechtsverwerking, stellende dat er in casu uitsluitend sprake is van tijdsverloop, hetgeen onvoldoende is om rechtsverwerking aan te nemen. Zij betwist
- -
dat zij op de hoogte was van de WO 707 en de EP 419 voor 2011, althans 2009;
- -
dat sprake is van gerechtvaardigd vertrouwen bij [geïntimeerde 2] ;
- -
dat sprake is van bijzondere omstandigheden;
- -
dat [geïntimeerde 2] onredelijk bezwaard of benadeeld is.
Zij stelt voorts dat de voor een geslaagd beroep op rechtsverwerking benodigde goede trouw bij [geïntimeerde 2] ontbreekt.
12.5.
Ter onderbouwing van het ontbreken van goede trouw en gerechtvaardigd vertrouwen aan de zijde van [geïntimeerde 2] stelt Ferring dat de correspondentie uit 2003 en 2004 waarop [geïntimeerde 2] zich beroept ging over de PCT/US 2003/014463, die later is ingetrokken en de PCT/ US 2004/0138098, die uitsluitend in de Verenigde Staten is doorgezet (de Amerikaanse octrooifamilie) en niet over de in dit geding aan de orde zijnde EP 419 en de daaraan ten grondslag liggende WO 707, die niet is doorgezet in de Verenigde Staten. De WO 707 leidde tot octrooiaanvragen op de kernmarkten voor Ferring, waaronder haar Europese thuismarkt. Zij verwijt [geïntimeerde 2] deze octrooiaanvragen (bewust) te hebben verzwegen.
12.6.
Voorts stelt zij dat uit die correspondentie uit 2003/2004 juist blijkt dat Ferring bezwaar had tegen de Amerikaanse octrooiaanvrage over lage doseringen (in het algemeen, los van de sublinguale toedieningsvorm). [geïntimeerde 2] gaf in 2003 aan slechts de lage dosering door sublinguale toediening te willen octrooieren, nadat Ferring in de brief van [M] van 9 april 2003 had aangegeven daarvan zelf af te zien (omdat dit volgens haar niet octrooieerbaar was). Toen Ferring bleek van de PCT/US 2003/014463 voor “Pharmaceutical composition including low dosages of desmopressin”, heeft [M] in haar brief van december 2004 namens Ferring aangegeven dat [geïntimeerde 2] op die uitvinding geen recht heeft en dat hij voorts bij zijn aanvrage gebruik heeft gemaakt van vertrouwelijke informatie van Ferring. Zij heeft aangekondigd dat zij daartegen actie zal ondernemen als [geïntimeerde 2] niet met een “satisfactory explanation” komt.
12.7.
Het hof stelt het volgende voorop. Om rechtsverwerking te kunnen aannemen is nodig dat de rechthebbende zich heeft gedragen op een wijze die naar maatstaven van redelijkheid en billijkheid onverenigbaar is met het geldend maken van zijn recht of bevoegdheid. Enkel tijdsverloop is, ook naar het oordeel van partijen, daarvoor onvoldoende en leidt niet tot rechtsverwerking. Er moet sprake zijn van bijzondere omstandigheden op grond waarvan bij de wederpartij het gerechtvaardigd vertrouwen is gewekt dat de rechthebbende zijn aanspraak niet meer geldend zal maken of waardoor de positie van de wederpartij onredelijk verzwaard of benadeeld zou worden indien het recht of de bevoegdheid alsnog geldend wordt gemaakt. Tijdsverloop kan wel als een van de relevante omstandigheden meewegen bij de beoordeling van de vraag of de rechthebbende zich heeft gedragen op een wijze die naar maatstaven van redelijkheid en billijkheid onverenigbaar is met het geldend maken van zijn recht of bevoegdheid. Benadeling van de wederpartij kan aanwezig zijn indien door het tijdsverloop bewijsmateriaal voor de schuldenaar verloren is gegaan of indien het alsnog geldend maken van het recht voor de schuldenaar tot kosten leidt die hij niet meer aan derden kan doorberekenen.
12.8.
Het hof is met Ferring van oordeel dat [geïntimeerde 2] onvoldoende heeft onderbouwd dat [geïntimeerde 2] gerechtvaardigd heeft vertrouwd dat Ferring haar recht tot opeising van de aanvrage EP 419 niet meer geldend zou maken nu in de correspondentie uit 2003 en 2004 waarop [geïntimeerde 2] zich beroept, geen melding wordt gemaakt van de (voorgenomen) EP 419 en de daaraan ten grondslag liggende WO 707 van 10 november 2003. Hoewel [L] in zijn tweede fax van 14 december 2004 “in the interest of completeness” melding maakt van de US-aanvraag, gepubliceerd onder no. 2004/0138098 van 15 juli 2004, wordt, al dan niet bewust, gezwegen over de WO 707 en de (voorgenomen) EP 419. Uit die correspondentie kan dus niet worden afgeleid dat Ferring geen aanspraak zou maken op de EP 419 of andere van de WO 707 afgeleide aanvragen. [geïntimeerde 2] kon daarop dan ook niet (gerechtvaardigd) vertrouwen.
12.9.
Overigens is het hof, met Ferring, van oordeel dat in beginsel een schuldeiser zijn recht niet verwerkt door enkel niet te reageren op een brief waarin de schuldenaar opmerkt dat hij erop vertrouwt “that this response will put the matter to rest” of “that we will not have to pursue this issue any further”. Dat geldt te meer als die schuldeiser eerst heeft aangegeven van oordeel te zijn dat de schuldenaar handelt in strijd met zijn rechten.
12.10.
Weliswaar heeft [M] in haar brief aan [L] van 9 december 2004 geschreven dat Ferring actie zal ondernemen als zij niet binnen 14 dagen een volledig en bevredigend antwoord krijgt, maar wanneer zij die actie zal ondernemen staat er niet. Bovendien wekken de op die brief volgende reacties van [L] van 14 december 2004 de indruk dat [geïntimeerde 2] met zijn aanvraag slechts bescherming zoekt voor de lage dosering door sublinguale toediening (door de hogere biobeschikbaarheid), de kwestie waarover, zoals Ferring terecht stelt, partijen in 2003 correspondeerden. [L] schrijft immers de door [M] “expressed surprise” niet te begrijpen omdat [geïntimeerde 2] toch al in 2003 heeft aangegeven van plan te zijn octrooibescherming covering the sub-lingual administration route and the associated low dosage possibilities enabled by same te verkrijgen. Dat [geïntimeerde 2] meent dat het octrooi (ook) het concrete low dose-low plasma concept, afgezien van de wijze van toediening, beschermt en dat hij (ook) daarop rechthebbende is en aanspraak wil maken stelt hij niet, althans niet voldoende duidelijk. Daarover zegt [L] niets in zijn brieven. Ook daarom kan [geïntimeerde 2] er door die correspondentie niet gerechtvaardigd op hebben vertrouwd dat Ferring zijn recht op (de aanvraag van) deze uitvinding niet meer geldend zou maken. Het hof wijst erop dat [geïntimeerde 2] in dit verband als de bij uitstek deskundige partij moet worden aangemerkt. Van hem mocht dan ook verwacht worden dat hij duidelijk zou aangeven dat het octrooi (ook) het concrete low dose-low plasma concept inhield en niet alleen het voordeel dat bij sublinguale toediening volstaan kan worden met een low dosage.
12.11
Ferring heeft voorts betwist dat sprake is van onredelijke benadeling doordat zij niet eerder aanspraak heeft gemaakt op de WO 707 en EP 419. Zij betwist dat [geïntimeerde 2] c.s. kosten heeft gemaakt, althans kosten heeft gemaakt voor de inleidende dagvaarding van 2011 in het vertrouwen dat Ferring geen aanspraak zou maken op de onderhavige octrooien. Zij stelt dat het door [geïntimeerde 2] gestelde nadeel niet is onderbouwd. Zij betwist dat [geïntimeerde 2] c.s. een farmaceutisch product heeft ontwikkeld, althans een farmaceutisch product dat onder de bescherming van de onderhavige octrooien valt (en dat [geïntimeerde 2] c.s. dit zelfs niet stelt) en dat de in dit geding zijnde octrooiaanvragen voor [geïntimeerde 2] c.s. waarde hebben voor enig eigen product. Weliswaar heeft Allergan in de Verenigde Staten kosten gemaakt voor een farmaceutisch product (dat onder de naam Noctiva op de markt zou zijn gebracht), maar van enig product buiten de Verenigde Staten is geen sprake, een en ander aldus Ferring.
12.13.
[geïntimeerde 2] c.s. heeft, met een beroep op de twee-conclusie-regel, bezwaar gemaakt tegen dit laatste verweer tegen zijn beroep op rechtsverwerking, stellende dat dit voor het eerst is aangevoerd bij pleidooi in hoger beroep. Het hof verwerpt dit bezwaar. Al bij conclusie van repliek (punt 163 ev.) heeft Ferring betwist dat sprake is van onredelijke benadeling en in het bijzonder dat het “vermeende” in ontwikkeling zijnde farmaceutische product van [geïntimeerde 2] c.s. onder de bescherming van het opgeëiste octrooi valt.
12.14.
Het hof is van oordeel dat [geïntimeerde 2] c.s. niet heeft onderbouwd dat zij (onredelijk) is bezwaard of nadeel heeft geleden doordat Ferring niet eerder dan in maart 2011 de octrooiaanvrage heeft opgeëist. Zo [geïntimeerde 2] c.s. al kosten heeft gemaakt in verband met een te ontwikkelen product gaat het niet om een product, dat onder de bescherming van de onderhavige octrooien valt nu deze octrooien geen bescherming bieden in de Verenigde Staten en hooguit sprake is van een product in de Verenigde Staten.
12.15.
Tot slot blijkt uit hetgeen hiervoor is overwogen over de ontlening door [geïntimeerde 2] aan Ferring van de in de aanvrage neergelegde materie en de daarvoor benodigde kennis dat de voor een beroep op rechtsverwerking vereiste goede trouw bij [geïntimeerde 2] ontbrak.
12.16.
Op grond van het bovenstaande verwerpt het hof het beroep op rechtsverwerking
13. Verjaring?
13.1.
[geïntimeerde 2] c.s. heeft zich voorts in eerste aanleg beroepen op verjaring van de onderhavige vorderingen op grond van artikel 78, lid 7 ROW. Op grond van dat artikellid verjaart de vordering tot opeising van een verleend octrooi vijf jaar na vermelding van de verlening ervan. Daar Ferring een Europese octrooiaanvrage opeist, geldt, aansluiting zoekend bij de regeling van artikel 78, lid 7 ROW, dat de verjaringstermijn is gaan lopen op de datum van publicatie van de aanvraag, derhalve op 26 mei 2005, zodat de vordering verjaard was na 26 mei 2011, aldus [geïntimeerde 2] c.s.
13.2.
Ferring heeft dit beroep op verjaring gemotiveerd bestreden, daartoe stellende
- -
dat (de termijn van) artikel 78, lid 7 ROW niet van toepassing is, omdat die bepaling alleen geldt voor verleende octrooien en er ook overigens geen wettelijke basis is voor verjaring;
- -
dat de EP 419 pas op 16 augustus 2006 is gepubliceerd en zij op 28 maart 2011 heeft gedagvaard, waardoor een eventuele verjaringstermijn van vijf jaar tijdig is gestuit.
13.3.
Het hof is, met Ferring, van oordeel dat (de verjaringstermijn van) artikel 78, lid 7 ROW niet van toepassing is op de vordering tot opeising van een octrooiaanvraag. Dat staat er niet en voor analoge toepassing van een verjaringstermijn is geen plaats. Bovendien zou toepassing van die termijn de vreemde consequentie hebben dat een vordering tot opeising van een verleend octrooi nog mogelijk zou zijn nadat de vordering tot opeising van de octrooiaanvrage is verjaard.
13.4.
Wat betreft de datum van publicatie heeft Ferring gewezen op de notification van het EOB van 19 juli 2006 (productie 3.6 Ferring), waarin is vermeld dat “The bibliographic data of the above-mentioned Euro-PCT application will be published on 16.08.06 in Section I.1 of the European Patent Bulletin. The European publication number is 1689419. Daaruit blijkt, aldus Ferring, dat de aanvrage pas op 16 augustus 2006 is gepubliceerd.
13.5.
[geïntimeerde 2] c.s. heeft over de publicatiedatum gesteld dat het octrooi op grond van artikel 93, lid 1, onder a EOV binnen 18 maanden moet worden gepubliceerd. Voorts heeft hij een schermafdruk van het Europees octrooiregister in zijn conclusie van dupliek (pagina 31) opgenomen waarin enerzijds is vermeld application with search report en Date 26.05.2005 over WO 707 en application with search report en Date 16.08.2006 over EP 419 en anderzijds onderaan de pagina is vermeld: The application has been published by WIPO (…) on 26.05.2005.
13.6.
De stelling van [geïntimeerde 2] c.s. dat de EP 419 binnen 18 maanden na de indieningsdatum van de WO 707, 10 november 2003, moest worden gepubliceerd miskent dat de PCT (Patent Cooperation Treaty) slechts de mogelijkheid biedt om via een centrale procedure octrooiaanvragen bij alle aangesloten landen of regio’s te doen en de aanvrager binnen 30 maanden na de PCT-aanvrage moet kiezen waar hij de octrooibescherming wenst en aldaar de aanvraag voor die gebieden wordt voortgezet. Het is dus onmogelijk om te eisen dat een Europese octrooiaanvrage die een voortzetting is van een PCT-aanvrage binnen 18 maanden na de indieningsdatum van de PCT-aanvrage moet worden gepubliceerd. Dan is vaak nog helemaal niet duidelijk waar de PCT-aanvrage wordt voortgezet. Artikel 93, lid 1 EOV ziet niet op de indieningsdatum van de aan een Europees octrooi ten grondslag liggende PCT-aanvrage.
13.7.
Uit voormelde schermafdruk blijkt ook niet dat de EP 419 op 26 mei 2005 is gepubliceerd. Zonder nadere toelichting, die ontbreekt en ook gelet op het bovenstaande, lijkt de opmerking dat de aanvraag is gepubliceerd bij de WIPO op 26 mei 2005 slechts betrekking te hebben op de WO 707 en niet op de EP 419, terwijl de tekst als datum (van de application) van de EP 419 juist 16 augustus 2006 vermeldt.
13.8.
Het hof gaat er dan ook van uit dat de publicatiedatum van de EP 419 16 augustus 2006 is, althans acht onvoldoende onderbouwd dat de EP 419 (ook) op 26 mei 2005 is gepubliceerd. Ook om die reden faalt het beroep op verjaring.
14. Divisionals en niet-Europese aanvragen
14.1
In eerste aanleg heeft [geïntimeerde 2] c.s. in de conclusie van antwoord betwist dat Ferring aanspraak op de afgesplitste aanvragen (de divisionals) en de nationale/ niet-Europese aanvragen/equivalenten kan maken, niet alleen op grond van de hiervoor behandelde verweren, maar ook omdat Ferring niet heeft onderbouwd op grond waarvan (wat betreft de buitenlandse aanvragen naar het recht van die aanvragen) haar vorderingen met betrekking tot deze divisionals en niet-Europese aanvragen toewijsbaar zouden zijn.
14.2
Bij repliek heeft Ferring per niet-Europees land (Australië, Canada, China en Japan) aangegeven hoe de octrooiaanvrage luidt en op grond waarvan zij naar het recht van het desbetreffende land de niet-Europese octrooiaanvragen kan opeisen. Deze stellingen komen erop neer dat de juridische en feitelijke situatie met betrekking tot die aanvragen niet relevant verschilt van die van de EP419. [geïntimeerde 2] c.s. heeft dit niet weersproken en heeft vervolgens volstaan met verwijzing naar zijn verweren tegen de opeising van de EP 419. Het hof gaat dan ook uit van de feitelijke situatie als door Ferring aangegeven. Voorts is het hof van oordeel dat de in het geding zijnde niet-Europese octrooiaanvragen kunnen worden opgeëist op de door Ferring aangegeven juridische gronden, die voor zover hier van belang, niet relevant afwijken van de gronden waarop de EP 419 kan worden opgeëist. Dit verweer wordt dan ook verworpen.
14.3.
In de conclusie van repliek heeft Ferring aangegeven dat in de divisionals dezelfde uitvindingsgedachte is neergelegd als in de EP 419, maar deze (nog) niet zijn beperkt tot Nocturia, maar ook nog gelden voor PNE en DI. Dit berust op hetzelfde low dose-low plasma concept en is getest door Ferring in de CS006 en CS008, aldus Ferring. Vervolgens heeft [geïntimeerde 2] c.s. ook geen aparte verweren meer gevoerd tegen de vorderingen die betrekking hebben op de divisionals en volstaan met verwijzing naar haar verweren tegen de opeising van EP 419. Ook gelet daarop, gaat het hof uit van de juistheid van de stellingen van Ferring.
14.4.
Op grond van het bovenstaande faalt dit verweer en kan Ferring ook de divisionals en de niet-Europese aanvragen opeisen.
15. Ferring recht- en belanghebbende?
15.1.
[geïntimeerde 2] c.s. heeft in eerste aanleg betwist dat Ferring recht- en/of belanghebbende is omdat zij “nergens bij betrokken geweest” is en “in de onderhavige procedure niets heeft te zoeken”. Hij stelt daartoe dat er geen relatie heeft bestaan tussen [A] en [B] en Ferring. Ferring moet daarom niet-ontvankelijk worden verklaard in haar vorderingen, aldus [geïntimeerde 2] c.s.
15.2.
Ferring heeft gesteld dat [A] en [B] in de relevante periode (waarin het concrete low dose-low plasma concept werd uitgevonden) in dienst waren van Ferring Pharmaceuticals A/S (hierna: Ferring A/S) op basis van arbeidsovereenkomsten, waarin is bepaald dat rechten op uitvindingen aan de werkgever toekomen. Ferring heeft de arbeidsovereenkomsten overgelegd (producties 44 en 47 Ferring). Ferring stelt voorts dat [A] en [B] daarnaast voor zover nodig hun rechten nogmaals hebben overgedragen (producties 45 en 75 Ferring) en dat door andere Ferring-vennootschappen (waaronder Ferring A/S) bij akte van 25 maart 2011 met de titel DEED OF TRANSFER OF ENTITLEMENT TO RIGHTS PERTAINING TO THE SUBJECT MATTER OF EUROPEAN PATENT APPLICATION 03 781 836 AND ITS DIVISIONAL APPLICATIONS, AUSTRALIAN PATENT APPLICATION AU20030287591, CANADIAN PATENT APPLICATION CA20032545194, CHINESE PATENT APPLICATION CN20038110675, JAPANESE PATENT APPLICATION JP20050510644T AND THE UNDERLYING PCT APPLICATION PCT/US2003/035662 WHICH IS PUBLISHED AS WO 2005/046707 (productie 46 Ferring) ook alle (eventuele) rechten met betrekking tot de onderhavige aanvragen aan Ferring zijn overgedragen.
15.3.
Dat de rechten op grond van de arbeidsovereenkomsten aan Ferring A/S toekomen heeft [geïntimeerde 2] c.s. niet gemotiveerd betwist, zodat het hof daarvan uitgaat. Hij betwist echter, met een beroep op artikel 3:83, lid 3 BW, dat naar Nederlands recht, dat op voormelde overeenkomst tussen de diverse Ferring-vennootschappen van toepassing is, aanspraken op Europese octrooien, PTC-aanvragen en niet-Europese octrooien kunnen worden overgedragen. Ferring heeft bij memorie van grieven, onder verwijzing naar voormelde aktes gesteld dat, voor zover [geïntimeerde 2] c.s. dit formele verweer gestand zou doen, zij erop wijst dat de relevante rechten vatbaar zijn voor overdracht op grond van artikel 60 EOV jo. artikel 64 ROW en artikel 11 lid 3 PCT jo. artikel 64 ROW en dat [A] en [B] Ferring het recht hebben gegeven de onderhavige opeisingsvorderingen in te stellen.
15.4.
[geïntimeerde 2] c.s. heeft hierop niet meer inhoudelijk gereageerd, zodat het hof ervan uitgaat dat hij dit verweer niet langer handhaaft. Voor zover daarover anders geoordeeld zou moeten worden, is het hof van oordeel dat op grond van artikel 60, lid 1 EOV moet worden aangenomen dat de aanspraken op een Europees octrooi overdraagbaar zijn en dit ook geldt voor de divisionals. Voor een Nederlandse octrooi is in artikel 64 ROW bepaald dat aanspraken op octrooien overdraagbaar zijn. De aanspraken op de niet-Europese octrooien zijn overdraagbaar op grond van met artikel 64 ROW overeenstemmende bepalingen in de desbetreffende wetgevingen. Ferring moet derhalve als rechthebbende worden aangemerkt.
15.5.
Het hof is overigens met Ferring van oordeel dat Ferring als entiteit aan wie de octrooirechten binnen de Ferring-groep (in ieder geval zullen) toekomen, als belanghebbende in de zin van art. 3:302 BW bij de gevorderde verklaringen voor recht kan worden aangemerkt.
15.6.
Dit niet-ontvankelijkheidsverweer faalt dan ook.
16. De juiste partijen gedagvaard? Belang bij veroordelingen tegen deze partijen?
16.1.
[geïntimeerde 2] c.s. heeft in eerste aanleg gesteld dat op grond van een in 2010 aangekondigde global agreement tussen de betrokkenen aan de zijde van [geïntimeerde 2] c.s. de rechten op alle aanvragen zijn overgedragen aan Allergan en daarvan bewijzen overgelegd (vergelijk het tussenvonnis van de rechtbank, de akte houdende overlegging productie van [geïntimeerde 2] c.s van 20 april 2012 en productie 9 en 17 [geïntimeerde 2] ) en dat Allergan (sedert 2011, begrijpt het hof) als aanvrager is vermeld. Op grond daarvan stelde zij dat Reprise en [geïntimeerde 2] niets over te dragen hebben en over de desbetreffende rechten geen zeggenschap hebben, zodat Ferring geen belang had bij haar vorderingen en de verkeerde partijen had gedagvaard. Ook Ferring ging er op grond van vermeldingen in de octrooiregisters van het EOB en de betreffende (nationale) octrooibureaus van uit dat in 2011 na het uitbrengen van de inleidende dagvaarding in zaak 1 (zodat zij in ieder geval wel ontvankelijk is, aldus Ferring), maar voor het uitbrengen van de inleidende dagvaarding in zaak 2 Allergan als aanvraagster van de EP 419, de divisionals, de Canadese en de Australische aanvragen stond vermeld en dat de rechten door Reprise waren overgedragen aan Allergan. Volgens de registers stond [geïntimeerde 2] nog steeds vermeld als aanvrager van de Chinese en Japanse aanvragen na de dagvaarding in zaak 2.
Vanwege de wijzigingen in de persoon van de aanvrager en de aktes van overdracht heeft Ferring zaak 2 tegen Allergan aanhangig gemaakt en in die zaak voorwaardelijk veroordeling van Allergan gevorderd.
16.2.
Bij memorie van antwoord heeft [geïntimeerde 2] c.s. gesteld dat Allergan zich in 2017 uit voormelde overeenkomst heeft teruggetrokken en zij sedertdien geen rechthebbende meer is en de hoedanigheid van aanvrager heeft verloren. Om die reden heeft Allergan verzocht als procespartij te worden geschrapt, althans concludeerde zij tot afwijzing van alle tegen haar gerichte vorderingen. Voorts stelt zij dat de vorderingen in zaak 2 moeten worden afgewezen omdat aan de voorwaarden waaronder die vorderingen zijn ingesteld (niet langer) is voldaan. Voorts stelt [geïntimeerde 2] c.s. dat Allergan de rechten (die zij thans stelt destijds te hebben verkregen van Serenity) heeft overgedragen en deze sinds 2017 aan Serenity toekomen. Het hof gaat ervan uit dat de stelling dat Allergan de rechten in 2010/2011 van Serenity heeft verkregen op een vergissing berust nu [geïntimeerde 2] c.s. steeds heeft gesteld en, naar Ferring onbetwist heeft gesteld, ook uit de registers van het EOB en andere octrooibureaus blijkt dat toentertijd de rechten op de aanvragen door Reprise aan Allergan zijn overgedragen en omtrent de positie van Serenity slechts werd gesteld dat zij recht en belang had zich in zaak 1 te voegen omdat zij licentieneemster was (vrgl. rechtsoverweging 4.1 van het tussenvonnis van 13 juni 2012). Ferring heeft evenwel niet betwist dat Allergaan haar rechten heeft overgedragen aan Serenity en Serenity dus thans rechthebbende is, zodat het hof daarvan uitgaat.
16.3.
Ferring heeft onbetwist gesteld (punt 262 MvG) dat Reprise (na een beslissing van de Legal Board of Appeal van het EOB met terugwerkende kracht, zie hiervoor overweging 3.1.9) gedurende de gehele periode van deze procedure als aanvrager staat vermeld in het register van het EOB. Het hof begrijpt, gelet op voormelde beslissing dat de overdracht aan Serenity ook geen gevolgen heeft gehad voor de vermelding van Reprise als aanvrager. [geïntimeerde 2] c.s. stelt dat ook niet.
16.4.
Op grond van het bovenstaande verwerpt het hof voormeld verweer, dat gebaseerd is op een inmiddels niet meer bestaande situatie. Daar Reprise blijkens het register van het EOB als aanvrager staat vermeld en [geïntimeerde 2] in de aanvragen is vermeld als uitvinder heeft en had Ferring in ieder geval belang bij de gevorderde verklaringen voor recht. Hieronder zal het hof ingaan op (de gevolgen voor) de afzonderlijke vorderingen.
16.5.
Het verzoek van Allergan om als procespartij te worden geschrapt wijst het hof af, nu dit naar Nederlands procesrecht niet mogelijk is.
17. De vorderingen
17.1.
In eerste aanleg heeft [geïntimeerde 2] c.s. de gevorderde bevelen tot overdracht en de daarmee samenhangende vordering om te bepalen dat het vonnis dezelfde kracht heeft als een akte tot overdracht bestreden. Hij stelt dat voor de vorderingen tot overdracht geen rechtsgrond bestaat en deze te vaag en te ruim zou zijn geformuleerd. Het EOV voorziet in de artikelen 60 en 61 juncto Regels (Implementing Regulations) 14-18 in een uitputtende regeling voor de opeising van een Europese octrooiaanvrage. Wat betreft de niet-Europese aanvragen heeft Ferring ook niet aangegeven op welke grondslag de vordering tot overdracht berust; zij heeft slechts gesteld dat zij aanspraak maakt op verlening van de betreffende octrooien, op grond waarvan een verklaring voor recht kan worden toegewezen, maar niet de gevorderde overdracht, een en ander aldus [geïntimeerde 2] c.s..
17.2.
Het hof is van oordeel dat Ferring niet heeft onderbouwd wat de grondslag is van haar vorderingen tot overdracht. Zij stelt over de Europese octrooiaanvrage slechts dat in de artikelen 60 en 61 EOV geenszins wordt geregeld dat Ferring geen overdrachtsvordering in een civiele procedure zou kunnen instellen, terwijl zij over de mogelijkheid en de grondslag van overdracht van de niet-Europese vorderingen niets stelt. Deze vorderingen komen al om die reden niet voor toewijzing in aanmerking.
Nu zij bovendien in zaak 1 vordert Reprise te bevelen de octrooiaanvragen over te dragen en in zaak 2 dit bevel aan Allergan op te leggen en het hof ervan uitgaat dat inmiddels Serenity rechthebbende is, kunnen ook om die reden de bevelen tot overdracht niet worden toegewezen. Dit geldt ook voor de daarmee samenhangende vordering om te bepalen dat het vonnis dezelfde kracht heeft als de akte. De bezwaren van [geïntimeerde 2] c.s. tegen de gevorderde dwangsommen en uitvoerbaarheid bij voorraad in verband met deze vorderingen behoeven geen bespreking.
17.3
Tegen de gevorderde verklaringen voor recht en de bevelen aan [geïntimeerde 2] om alle benodigde medewerking te verlenen die nodig is om te bewerkstelligen dat [A] en [B] geregistreerd staan als (mede-)uitvinders heeft [geïntimeerde 2] c.s. op zichzelf geen verweer gevoerd. Hij heeft wel bezwaren tegen de zijn inziens te ruime en vage formulering van het bevel, het ontbreken van een termijn en de hoogte van de gevorderde dwangsom.
[geïntimeerde 2] c.s. onderbouwt zijn bezwaren tegen de formulering van dit bevel niet. Het hof acht het bevel voldoende duidelijk. Het zal een termijn toevoegen en, omdat [geïntimeerde 2] een natuurlijk persoon is, de dwangsom (iets) matigen en maximeren als in het dictum aangegeven. Niettemin zal nog steeds een hoge dwangsom worden opgelegd. Daarvoor is plaats vanwege de houding van [geïntimeerde 2] in deze procedure en het financiële belang van de zaak.
17.4.
Ten slotte heeft [geïntimeerde 2] c.s. bezwaar gemaakt tegen uitvoerbaar bij voorraadverklaring van, begrijpt het hof, het bevel tot overdracht. Nu deze vordering wordt afgewezen hoeft het hof niet over de dit bezwaar te beslissen. Het hof volgt wel het betoog van [geïntimeerde 2] c.s. dat de gevorderde verklaringen voor recht naar hun aard niet voor uitvoerbaar bij voorraadverklaring in aanmerking komen. Nu geen onderbouwd verweer gevoerd is tegen de uitvoerbaar bij voorraadverklaring van de toe te wijzen bevelen aan [geïntimeerde 2] en de proceskostenveroordeling en Ferring daarbij belang heeft zullen deze uitvoerbaar bij voorraad worden verklaard.
18. Slotsom en proceskosten
In zaak 1
18.1.
Het bovenstaande brengt mee dat in zaak 1 het bestreden vonnis zal worden vernietigd en de gevorderde verklaringen voor recht (met betrekking tot het uitvinderschap: de subsidiair gevorderde verklaringen voor recht) en de gevorderde bevelen aan [geïntimeerde 2] zullen worden toegewezen. Nu geen apart bezwaar gemaakt is tegen de verklaring voor recht dat Ferring de aanspraak toekomt op de WO 707 zal deze, hoewel die inmiddels is omgezet in de andere octrooiaanvragen en dus is “uitgewerkt”, ook worden toegewezen. Nu ook geen bezwaar gemaakt is tegen de uitbreiding bij memorie van grieven van de gevorderde verklaring voor recht met betrekking tot de nationale aanvragen zal deze ook aldus worden toegewezen. De gevorderde bevelen tot overdracht en daarmee samenhangende vorderingen zullen worden afgewezen.
18.2.
[geïntimeerde 2] c.s. zal als de grotendeels in het ongelijk gestelde partij worden veroordeeld in de kosten van de eerste aanleg en het hoger beroep. In zoverre slaagt grief 18.
18.3.
Partijen twisten over de vraag of artikel 1019h Rv van toepassing is. [geïntimeerde 2] c.s. heeft zich, voor het eerst bij pleidooi in eerste aanleg, op het standpunt gesteld dat artikel 1019h Rv niet van toepassing is met een beroep op het arrest van het Hof van Justitie EU van 15 november 2012, ECLI:EU:C:2012:717 (Bericap/Plastinnova). De rechtbank heeft geoordeeld dat artikel 1019h Rv niet van toepassing is. Tegen dit oordeel richt zich grief 17E.
18.4.
Het hof is van oordeel dat deze procedure als een vooruitgeschoven inbreukverweer moet worden beschouwd9.nu [geïntimeerde 2] c.s. zich blijkens haar stelling bij het EOB
dat Ferrings product Minirin melt van 60µg onder de beschermingsomvang van de EP 419 valt, op het standpunt stelt dat Ferring inbreuk maakt op de EP 419. Dat het EOB geen inbreukzaken behandelt doet daar niet aan af. Dat [geïntimeerde 2] onderzocht of Ferrings producten inbreuk op de EP 419 zouden maken lijkt overigens ook te volgen uit de hiervoor in rechtsoverweging 10.12 geciteerde mail van [geïntimeerde 2] van 20 maart 2009, waarin hij schrijft “the average peaks (van de Minirin melt tablet) would infringe on our IP. In zoverre slaagt deze grief.
18.5.
Voorts heeft [geïntimeerde 2] c.s. bestreden dat de gevorderde kosten redelijk en evenredig zijn.
18.6.
Ferring vordert voor de kosten van haar advocaat in eerste aanleg een bedrag van € 1.518.527,00, stellende dat haar advocaten in totaal 3.320,6 uur hebben besteed. Zij heeft zich toen door drie advocaten laten bijstaan. In hoger beroep vordert zij aan kosten voor deze procedure € 1.189.530,50 (€ 1.073.249,50 + € 116.281,00), uitgaande van 2.889,9 + 308,6 uur. Zij heeft zich daar laten bijstaan door vier advocaten. Van de kosten besteed aan deze zaak na het pleidooi op 13 september 2018 heeft zij geen opgave overgelegd.
18.7.
Het hof is van oordeel dat de noodzaak voor Ferring om zich door drie of vier advocaten te laten bijstaan niet is gebleken en dat de gevorderde bedragen (daardoor) te hoog zijn. Het hof acht, hetgeen hierna over artikel 14 Hrl en artikel 1019h Rv wordt overwogen in aanmerking nemende, een bedrag voor de kosten van de advoca(a)t(en) van € 900.000,-- voor de eerste aanleg redelijk en evenredig.
18.8.
Per 1 september 2020 (arrestdatum) is de regeling Indicatietarieven in octrooizaken gerechtshof Den Haag (hierna: de Indicatietarieven) van kracht geworden. Volgens de Indicatietarieven is voor de categorie zeer complexe zaken een bedrag van ten hoogste € 250.000,- redelijk en evenredig te achten. De omstandigheid dat deze datum gelegen is na de aanvang van het hoger beroep en zelfs na de laatste proceshandeling in deze zaak, doet aan de toepasselijkheid daarvan niet af. Met de indicatietarieven wordt invulling gegeven aan wat redelijk en evenredig is te achten in de zin van artikel 1019h Rv en de Handhavingsrichtlijn. De redelijkheid en evenredigheid van de kosten was en blijft de maatstaf. Artikel 14 Hrl verzet zich niet tegen proceskostenvergoedingen die lager zijn dan de gemiddelde kosten of daadwerkelijk gemaakte kosten. Leidraad is dat een ‘significant en passend’ deel van de redelijke kosten die een partij daadwerkelijk heeft gemaakt voor vergoeding in aanmerking komt. Dat impliceert niet dat de verliezende partij noodzakelijkerwijs alle kosten van de andere partij moet vergoeden. Het hof merkt deze zaak aan als een zeer complexe zaak. Behalve uitleg van het octrooi, is sprake van een zeer uitvoerig feitelijk debat over gebeurtenissen op diverse plekken in de wereld gedurende een aantal jaren en is sprake van vele geproduceerde stukken. Voorts is er ook nog een aantal processuele en van de “hoofdzaak” losstaande verweren gevoerd. Zoals bepaald in paragraaf 7 onder b van de Indicatietarieven kunnen in bijzondere gevallen op basis van de specifieke kenmerken van het geval hogere bedragen dan het maximale indictietarief van de toepasselijke categorie worden toegewezen. Het hof acht dit in onderhavige zaak aangewezen. Daarbij acht het hof behalve voormelde omstandigheden van belang dat ook [geïntimeerde 2] c.s. in eerste aanleg aanvankelijk aanzienlijke kosten vorderde en dat [geïntimeerde 2] c.s. zijn verweer herhaaldelijk heeft gewijzigd, althans verschoven. Om die redenen acht het hof een bedrag aan proceskosten van € 450.000,- gelet op de bijzondere omstandigheden van deze zaak, redelijk en evenredig. Het hof zal dit bedrag toewijzen, vermeerderd met de verschotten. De kosten gemaakt voor de procedure bij het EOB (€ 218.617,00) komen, zonder nadere toelichting, die ontbreekt, niet voor vergoeding in deze procedure in aanmerking.
In zaak 2
18.9.
Daar de voorwaarden waaronder de vorderingen in zaak 2 zijn ingesteld niet zijn vervuld, zal het bestreden vonnis worden bekrachtigd. Nu de noodzaak van deze procedure en de afwijzing van de vorderingen een gevolg zijn van overeenkomsten waarbij [geïntimeerde 2] en Allergan betrokken waren, zullen zij worden veroordeeld in de kosten van het hoger beroep. Deze kosten zullen worden begroot op de kosten van de exploten van dagvaarding en het griffierecht. De kosten voor de advocaat zullen worden begroot op nihil. Voor deze procedure zijn geen extra advocatenkosten gemaakt daar dezelfde advocaten tegelijkertijd in beide zaken zijn opgetreden en de stellingen van Ferring in deze zaak gelijk zijn aan de stellingen in zaak 1.
In beide zaken
18.10.
In beide zaken zal Ferring niet-ontvankelijk worden verklaard in haar beroep tegen het tussenvonnis. Zij heeft één grief (17D) gericht tegen het tussenvonnis, namelijk tegen de beslissing dat de akte van niet-dienen is geweigerd en [geïntimeerde 2] c.s. een termijn is gegund voor de conclusie van antwoord. Tegen die beslissing staat geen hoger beroep open. Verder zijn geen grieven tegen het tussenvonnis gericht.
Beslissing
Het hof:
in beide zaken
verklaart Ferring niet-ontvankelijk in haar beroep tegen het tussenvonnis van 13 juni 2012;
in zaak 1.
voorts in de zaak met zaaknummer 200.156.630/02 (beroep van het vonnis in de zaak C/09/399700/HA ZA 11-2167)
vernietigt het tussen partijen gewezen vonnis van de rechtbank Den Haag van 12 maart 2014
en opnieuw rechtdoende,
a. verklaart voor recht dat aan Ferring de aanspraak toekomt op (verlening van een octrooi op de Europese octrooiaanvrage met nummer 03 781 836 zoals gepubliceerd onder)
EP 1 689 419;
verklaart voor recht dat aan Ferring de aanspraak toekomt op (verlening van een octrooi op) de Divisionals EP20110000464, EP20110000465, EP20110000466, EP20110000467 en EP20110000468;
verklaart voor recht dat aan Ferring de aanspraak toekomt op PCT aanvrage PCT/US2003/035662 die is gepubliceerd als WO 2005/046707, en bovendien op de van de PCT Afgeleide Nationale Aanvragen: Australisch Octrooi AU20030287591 dat is gepubliceerd als AU2003287591, Canadese Octrooi Aanvrage CA20032545194 die is gepubliceerd als CA2545194, Canadese Octrooi Aanvrage CA20032866501 die is gepubliceerd als CA 2 866 501, Japanse Octrooi Aanvrage JP20050510644T die is gepubliceerd (en verleend) als JP5596252, (nog niet gepubliceerde) Japanse Octrooi Aanvragen JP2014-131839 en JP2014-133867, Chinese Octrooi Aanvrage CN20038110675 die is gepubliceerd als CN1878563, Chinese Octrooi Aanvrage CN2011159599 die is gepubliceerd als CN102166 345, en Chinese Octrooi Aanvrage
CN20131116951 die is gepubliceerd als CN103212057;
Uitvinderschap Europese octrooiaanvragen
verklaart voor recht dat [A] en [B] mede-uitvinders zijn van het onderwerp van de onder a en b genoemde octrooiaanvragen;
verklaart voor recht dat [geïntimeerde 2] geen uitvinder is van het onderwerp van de onder a en b genoemde octrooiaanvragen;
gebiedt [geïntimeerde 2] binnen twee weken nadat daarom schriftelijk is verzocht alle benodigde handelingen te verrichten en medewerking te verstrekken die nodig is om te bewerkstelligen dat [A] en [B] en niet [geïntimeerde 2] geregistreerd staan als de mede-uitvinders van de onder a en b genoemde octrooiaanvragen, zulks op straffe van een dwangsom van EUR 20.000,- voor iedere overtreding van dit gebod, te vermeerderen met een dwangsom van EUR 5.000,- voor iedere dag of gedeelte van een dag dat deze overtreding voortduurt, met een maximum van EUR 4.000.000,-;
verklaart voor recht dat [A] en [B] mede-uitvinders zijn van het onderwerp van de onder c genoemde octrooi(en)(aanvragen);
verklaart voor recht dat [geïntimeerde 2] geen uitvinder is van het onderwerp van de onder c genoemde octrooi(en)(aanvragen);
gebiedt [geïntimeerde 2] binnen twee weken nadat daarom schriftelijk is verzocht alle benodigde handelingen te verrichten en medewerking te verstrekken die nodig is om te bewerkstelligen dat [A] en [B] en niet [geïntimeerde 2] geregistreerd staan als de mede-uitvinders van de onder c genoemde octrooiaanvragen, zulks op straffe van een dwangsom van EUR 20.000,- voor iedere overtreding van dit gebod, te vermeerderen met een dwangsom van EUR 5.000,- voor iedere dag of gedeelte van een dag dat deze overtreding voortduurt, met een maximum van EUR 4.000.000,-;
[geïntimeerde 2] en Reprise geen rechthebbende
verklaart voor recht dat [geïntimeerde 2] en Reprise geen rechthebbende zijn op de onder a, b en c genoemde octrooi(en)(aanvragen);
veroordeelt [geïntimeerde 2] c.s., hoofdelijk, des dat de een betalende de anderen bevrijd zullen zijn, in de kosten van het geding in eerste aanleg, tot op heden aan de zijde van Ferring te begroten op € 644,3010.aan verschotten en € 900.000,-- aan salaris voor de advocaat, te vermeerderen met de wettelijke rente als bedoeld in artikel 6:119 BW vanaf veertien dagen na de dag van de uitspraak van dit arrest.
wijst af het meer of anders gevorderde;
veroordeelt [geïntimeerde 2] c.s., hoofdelijk, des dat de een betalende de anderen bevrijd zullen zijn, in de kosten van het geding in hoger beroep, aan de zijde van Ferring tot op heden te begroten op € 860,52 aan verschotten en € 450.000,-- aan salaris voor de advocaat en € 157,-- aan nasalaris voor de advocaat, nog te verhogen met € 82,-- indien niet binnen 14 dagen na aanschrijving in der minne aan dit arrest is voldaan en vervolgens betekening van dit arrest heeft plaatsgevonden, en bepaalt dat de bedragen van € 860,52 en € 700.000,-- binnen 14 dagen na de dag van de uitspraak moeten zijn voldaan, bij gebreke waarvan deze bedragen worden vermeerderd met de wettelijke rente als bedoeld in artikel 6:119 BW vanaf het einde van genoemde termijn van 14 dagen;
verklaart voormelde bevelen en kostenveroordelingen uitvoerbaar bij voorraad;
In zaak 2
voorts in de zaak met zaaknummer 200.156.625/02 (beroep van het vonnis in de zaak C/09/409591/ HA ZA 11-2849)
bekrachtigt het tussen partijen gewezen vonnis van de rechtbank Den Haag van 12 maart 2014;
veroordeelt [geïntimeerde 2] c.s., hoofdelijk, des dat de een betalende de anderen bevrijd zullen zijn, in de kosten van het geding in hoger beroep, aan de zijde van Ferring te begroten op € 860,5211.aan verschotten en op nihil voor de kosten van de advocaat;
verklaart voormelde kostenveroordeling uitvoerbaar bij voorraad.
Dit arrest is gewezen door mrs. A.D. Kiers-Becking, M.Y Bonneur en M.P.J. Ruijpers; het is uitgesproken ter openbare terechtzitting van 22 februari 2022, in aanwezigheid van de griffier.
Voetnoten
Voetnoten Uitspraak 22‑02‑2022
Verdrag inzake de verlening van Europese octrooien (Europees Octrooiverdrag).
Vergl. HR 14 november 2008, ECLI:NL:HR:2008:BF0462.
Hij verklaart in de Amerikaanse procedure “So if you counted the half lives from the peak blood levels that were in the published literature, you could come to the conclusion that the drug desmopressin was still exerting an antidiuretic effect down into the very low single digit picogram per ml blood concentrations (…)”.
Zie punten 3.37-3.42 MvA, het memorandum van [geïntimeerde 2] van 14 mei 2002 (productie 38 Ferring), de verklaringen van [geïntimeerde 2] van 26 juli 2011 (productie 16, annex 2, [geïntimeerde 2] ) en 9 januari 2014, punt 10 (productie 31 [geïntimeerde 2] ) en de verklaring van [E] van 9 januari 2002, punten 21, 22 en 30 (productie 32 [geïntimeerde 2] ).
Zoals hij heeft verklaard in de Amerikaanse procedure, zie voetnoot 5 (zie productie 79 Ferring en pagina 12 van de pleitnota [geïntimeerde 2] c.s in hoger beroep).
In het vonnis bespreekt de rechter ook de (door de rechter verworpen) stellingen van [geïntimeerde 2] c.s. dat conceived of lower doses as claimed in the ‘654 patent en that [geïntimeerde 2] conceived of the general use of lower doses of desmopressin.
In de aanvraag van de GB 397, zie hiervoor overwegingen 3.3.25).
Als bedoeld in het arrest van Hof Den Haag 26 februari 2013, ECLI:NL:GHDHA:2013:BZ1902.
568,-- griffierecht en 76,30 dagvaarding
783,-- griffierecht en 77,52 dagvaarding.