Einde inhoudsopgave
Verordening (EG) Nr. 152/2009 tot vaststelling van de bemonsterings- en analysemethoden voor de officiële controle van diervoeders
Bijlage III Analysemethoden ter controle van de samenstelling van voedermiddelen en mengvoeders
Geldend
Geldend vanaf 04-04-2024
- Bronpublicatie:
29-02-2024, PbEU L 2024, 2024/771 (uitgifte: 15-03-2024, regelingnummer: 2024/771)
- Inwerkingtreding
04-04-2024
- Bronpublicatie inwerkingtreding:
29-02-2024, PbEU L 2024, 2024/771 (uitgifte: 15-03-2024, regelingnummer: 2024/771)
- Vakgebied(en)
Agrarisch recht (V)
Gezondheidsrecht / Voedsel- en warenkwaliteit
A. Bepaling van vocht
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan vocht in diervoeders. Er wordt op gewezen dat in het geval van diervoeders die vluchtige stoffen, zoals organische zuren, bevatten bij de bepaling van het vochtgehalte ook een aantal vluchtige stoffen wordt gemeten.
Dit voorschrift heeft geen betrekking op de analyse van melkproducten en mengvoeders die overwegend uit melkproducten bestaan, van dierlijke en plantaardige vetten en van oliehoudende zaden en vruchten.
De bepaling van het vochtgehalte in oliehoudende zaden gebeurt volgens de methode van norm EN ISO 665 Oliezaden — Bepaling van het gehalte aan vocht en vluchtige bestanddelen, met dien verstande dat sojabonen moeten worden gemalen voordat het vochtgehalte wordt bepaald.
2. Beginsel
Het monster wordt gedroogd onder bepaalde omstandigheden, die afhankelijk zijn van de aard van het diervoeder. Het massaverlies wordt door weging bepaald. Vaste diervoeders met een hoog vochtgehalte moeten eerst worden voorgedroogd.
3. Apparatuur
- 3.1.
Molen van een materiaal dat geen vocht absorbeert, die gemakkelijk te reinigen is en waarmee snel en gelijkmatig kan worden gemalen zonder noemenswaardig warmte op te wekken, die zo goed mogelijk kan worden afgesloten van de buitenlucht en voldoet aan de eisen genoemd onder punten 4.1.1 en 4.1.2 (bv. microkruisslagmolens, micromolens met waterkoeling, demonteerbare kogelmolens, langzaam lopende kogelmolens en molens met getande schijven).
- 3.2.
Analytische balans, nauwkeurigheid 1 mg.
- 3.3.
Droogschalen van roestbestendig metaal of van glas voorzien van een luchtdicht afsluitend deksel en met een zodanig nuttig oppervlak dat het monster kan worden uitgespreid tot ongeveer 0,3 g/cm2.
- 3.4.
Elektrische droogstoof met thermostaat (± 2 °C), waarmee de temperatuur snel kan worden geregeld en die goed ventileert (1).
- 3.5.
Elektrische vacuümdroogstoof met oliepomp, voorzien van een inrichting voor toevoer van gedroogde, warme lucht of voorzien van een droogmiddel (bv. calciumoxide).
- 3.6.
Exsiccator met dikke, geperforeerde plaat van metaal of porselein en met een effectief droogmiddel.
4. Werkwijze
NB: | De in dit hoofdstuk beschreven handelingen moeten direct na het openen van de verpakking van de monsters worden uitgevoerd. De analyses moeten ten minste in duplo worden uitgevoerd. |
4.1. Voorbereiding
4.1.1. Diervoeders met uitzondering van de onder punten 4.1.2 en 4.1.3 genoemde
Neem ten minste 50 g van het monster. Maak dit, zo nodig, op passende wijze fijn, zodanig dat veranderingen in het vochtgehalte worden voorkomen (zie punt 6).
4.1.2. Granen en grutten
Neem ten minste 50 g van het monster. Maal dit tot deeltjes van zodanige grootte dat ten minste 50 % ervan door een zeef van 0,5 mm gaat en dat niet meer dan 10 % blijft liggen op een zeef met ronde mazen van 1 mm.
4.1.3. Vloeibare of brijachtige diervoeders; diervoeders die in hoofdzaak bestaan uit vet
Neem ongeveer 25 g monster, tot op 10 mg nauwkeurig gewogen, voeg een passende hoeveelheid watervrij zand toe, tot op 10 mg nauwkeurig gewogen, en meng tot een homogeen product is verkregen.
4.2. Drogen
Droog een droogschaal (punt 3.3) met het deksel in de droogstoof gedurende 30 min ± 1 minuten op 103 °C, verwijder hem uit de droogstoof en laat het geheel afkoelen tot omgevingstemperatuur in de exsiccator (punt 3.6).
4.2.1. Diervoeders met uitzondering van de onder punten 4.2.2 en 4.2.3 genoemde
Weeg de droogschaal met deksel tot op 1 mg nauwkeurig. Breng ongeveer 5 g van het monster, tot op 1 mg nauwkeurig gewogen, in de getarreerde droogschaal en spreid gelijkmatig uit. Plaats de droogschaal zonder deksel in een vooraf op 103 °C gebrachte droogstoof. Om te voorkomen dat de temperatuur te veel daalt, dient de droogschaal zo snel mogelijk in de droogstoof gebracht te worden. Laat gedurende 4 uur drogen, gerekend vanaf het tijdstip dat de stoof weer op een temperatuur van 103 °C is. Sluit na het openen van de stoof de droogschaal onmiddellijk met het deksel, neem hem uit de stoof, laat gedurende 30–45 minuten afkoelen in de exsiccator (punt 3.6) en weeg tot op 1 mg nauwkeurig.
Monsters die in hoofdzaak ([amp]gt; 50 %) bestaan uit vet van plantaardige of dierlijke oorsprong, worden nog eens gedurende 30 minuten bij 103 °C in de stoof gedroogd. Het verschil tussen de resultaten van beide wegingen mag niet meer bedragen dan 0,1 % vocht.
4.2.2. Graan, meel, grutten en gries
Weeg de droogschaal met deksel tot op 0,5 mg nauwkeurig. Breng ongeveer 5 g van het fijngemaakte monster, tot op 1 mg nauwkeurig gewogen, in de getarreerde droogschaal en spreid gelijkmatig uit. Plaats de droogschaal zonder deksel in een vooraf op 130 °C gebrachte droogstoof. Om te voorkomen dat de temperatuur te veel daalt, dient de droogschaal zo snel mogelijk in de droogstoof gebracht te worden. Laat gedurende 2 uur drogen, gerekend vanaf het tijdstip dat de stoof weer op een temperatuur van 130 °C is. Sluit na het openen van de stoof de droogschaal onmiddellijk met het deksel, neem hem uit de stoof, laat gedurende 30–45 minuten afkoelen in de exsiccator (punt 3.6) en weeg tot op 1 mg nauwkeurig.
4.2.3. Mengvoeders met een gehalte aan sacharose of lactose van meer dan 4 %: voedermiddelen als johannesbrood, gehydrolyseerde graanproducten, moutkiemen, suikerbietensnijdsels, visperssap en suikersap
Weeg de droogschaal met deksel tot op 0,5 mg nauwkeurig. Breng ongeveer 5 g van het monster, tot op 1 mg nauwkeurig gewogen, in de getarreerde droogschaal en spreid gelijkmatig uit. Plaats de droogschaal zonder deksel in de vooraf op 80–85 °C gebrachte vacuümdroogstoof (punt 3.5). Om te voorkomen dat de temperatuur te veel daalt, dient de droogschaal zo snel mogelijk in de droogstoof gebracht te worden.
Stel de druk in op 100 Torr en droog het monster gedurende 4 uur bij deze druk, hetzij onder toevoer van droge, warme lucht, hetzij met behulp van een droogmiddel (ongeveer 300 g voor 20 monsters). In het laatste geval wordt bij het bereiken van de voorgeschreven druk de verbinding met de vacuümpomp verbroken. Reken de droogtijd vanaf het tijdstip dat de droogstoof weer op een temperatuur van 80–85 °C is. Laat na het beëindigen van de droogtijd de druk in de stoof voorzichtig weer komen op die van de buitenlucht. Sluit na het openen van de vacuümdroogstoof de droogschaal met het deksel, neem hem uit de stoof, laat gedurende 30–45 minuten afkoelen in de exsiccator (punt 3.6) en weeg vervolgens tot op 1 mg nauwkeurig. Droog nogmaals gedurende 30 minuten onder vacuüm in de stoof bij 80–85 °C en weeg opnieuw. Het verschil tussen de resultaten van beide wegingen mag niet meer bedragen dan 0,1 % vocht.
4.3. (Gedeeltelijk) voordrogen
‘Natte’ diervoeders met een massafractie van minder dan 85 % droge stof (bv. voedergewassen, total mixed ration, (niet-)vloeibare diervoeders) moeten voor het fijnmalen gedeeltelijk worden gedroogd om de stabiele stoffen ervan te kunnen analyseren; voor instabiele stoffen is gedeeltelijke droging niet mogelijk.
Gedeeltelijke droging kan worden uitgevoerd met behulp een oven met geforceerde ventilatie of microgolf of door vriesdrogen. Met uitzondering van gedeeltelijke droging door vriesdrogen, is het de bedoeling het voeder te drogen zonder dat de temperatuur van het monster 60 °C of hoger wordt, zodat de chemische samenstelling minimaal wordt beïnvloed. Drogen bij temperaturen boven 60 °C veroorzaakt chemische veranderingen in het diervoeder (bv. eiwitafbraak). Voordat de gedeeltelijke droge stof wordt gemeten moet het gedroogde voeder gedurende ongeveer 15 minuten bij kamertemperatuur worden geëquilibreerd, zodat de mogelijke vochtverandering die zich tijdens het malen en de opslag kan voordoen, tot een minimum wordt beperkt. Bij drogen bij temperaturen onder 60 °C wordt niet al het water uit het diervoeder verwijderd; gedeeltelijke (voor)droging is derhalve niet representatief voor de totale droge stof van het diervoeder. Na het drogen wordt het submonster gemalen en geanalyseerd op de (uiteindelijke) droge stof van het gedeeltelijk droge monster (het resterende vochtgehalte is 3 % tot 15 %) wanneer andere chemische bestanddelen worden bepaald.
Daarom wordt voor het bepalen van droge stof een procedure van twee stappen aanbevolen. Bepaal eerst het gehalte aan gedeeltelijke droge stof (indien minder dan 85 % droge stof), en bepaal vervolgens het gehalte aan resterende droge stof op een gemalen testmonster en vermenigvuldig de gedeeltelijke droge stof met de resterende droge stof om het totale gehalte aan droge stof te bepalen.
5. Berekening van de resultaten
Het vochtgehalte van het monster in procent (X) wordt weergegeven door de volgende formules:
5.1. Drogen zonder voordrogen
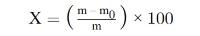
waarbij:
m = | oorspronkelijke massa van het monster (in g); |
m0 = | massa van het gedroogde monster (in g). |
5.2. Drogen zonder voordrogen (2)
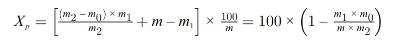
waarbij:
m = | oorspronkelijke massa van het monster (in g); |
m1 = | massa van het monster na voordrogen (in g); |
m2 = | massa van het monster na fijnmaken (in g); |
m0 = | massa van het gedroogde monster (in g). |
5.3. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepalingen mag niet meer bedragen dan 0,2 % van de absolute vochtwaarde, behalve voor nat voeder voor gezelschapsdieren en hondenkluiven, waarvoor het verschil niet meer dan 0,5 % van de absolute vochtwaarde mag bedragen.
6. Opmerking
Indien het monster fijngemaakt moet worden en dit een verandering van het vochtgehalte van het product ten gevolge heeft, moeten de analyseresultaten die betrekking hebben op de bestanddelen van het diervoeder, omgerekend worden naar het vochtgehalte van het oorspronkelijke monster.
B. Bepaling van vocht in dierlijke en plantaardige vetten en oliën
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan vocht, water en andere vluchtige stoffen in dierlijke en plantaardige vetten en oliën.
2. Beginsel
Het monster wordt bij 103 °C gedroogd tot constante massa (het massaverlies tussen twee opeenvolgende wegingen mag niet meer dan 1 mg zijn). Het massaverlies wordt door weging bepaald.
3. Apparatuur
- 3.1.
Schaal met vlakke bodem, van corrosiebestendig materiaal, diameter 8–9 cm, hoogte circa 3 cm.
- 3.2.
Thermometer met een versterkt reservoir en een expansieruimte, gekalibreerd van ongeveer 80 °C tot ten minste 110 °C, lengte circa 10 cm.
- 3.3.
Zandbad of elektrische verwarmingsplaat.
- 3.4.
Exsiccator met een effectief droogmiddel.
- 3.5.
Analytische balans.
4. Werkwijze
Breng ongeveer 20 g van het gehomogeniseerde monster, tot op 1 mg nauwkeurig gewogen, in de droge, getarreerde schaal (punt 3.1) met de thermometer (punt 3.2). Verhit onder voortdurend roeren met de thermometer op het zandbad of op de verwarmingsplaat (punt 3.3) zodanig dat na ongeveer 7 minuten een temperatuur van 90 °C bereikt wordt.
Verminder de toevoer van warmte overeenkomstig de frequentie waarmee gasbellen van de bodem van de schaal opstijgen. De temperatuur mag niet hoger komen dan 105 °C. Roer onder voortdurend schrapen over de bodem van de schaal tot de belvorming ophoudt.
Verwarm nog enkele malen tot 103 ± 2 °C om er zeker van te zijn dat al het vocht uitgedreven wordt; laat tussen twee opeenvolgende verhittingen afkoelen tot 93 °C. Laat vervolgens in de exsiccator (punt 3.4) afkoelen tot kamertemperatuur en weeg. Herhaal deze procedure totdat het massaverlies tussen twee opeenvolgende wegingen niet meer bedraagt dan 2 mg.
Deze tabel moet als volgt worden gelezen: | Een massatoename van het monster na herhaalde verwarming duidt op oxidatie van het vet. Gebruik in dat geval bij de berekening het resultaat van de weging die vlak voor de massatoename gedaan werd. |
5. Berekening van de resultaten
Het vochtgehalte van het monster in procent (X) volgt uit de volgende formule:
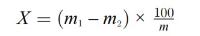
waarbij:
m = | massa van het analysemonster (in g); |
m1 = | massa van de schaal met inhoud voor verhitting (in g); |
m2 = | massa van de schaal met inhoud na verhitting (in g). |
Resultaten beneden 0,05 % moeten aangegeven worden als ‘minder dan 0,05 %’.
Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer bedragen dan 0,1 % absoluut.
C. Bepaling van get stikstofgegalte en berekening van get gegalte aan ruw eiwit
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan ruw eiwit in diervoeders aan de hand van het stikstofgehalte, bepaald volgens de kjeldahlmethode (3).
2. Beginsel
Het monster wordt ontsloten met zwavelzuur in aanwezigheid van een katalysator. De zure oplossing wordt met een oplossing van natriumhydroxide basisch gemaakt. De ammoniak wordt afgedestilleerd en opgevangen in een bekende hoeveelheid zwavelzuur, waarvan de overmaat met een standaardoplossing natriumhydroxide wordt getitreerd.
Ook kan de vrijgekomen ammoniak in een overmaat boorzuur worden geleid, waarna met zoutzuur of zwavelzuur wordt getitreerd.
3. Reagentia
- 3.1.
Kaliumsulfaat.
- 3.2.
Katalysator: koper(II)oxide (CuO) of koper(II)sulfaat-pentahydraat (CuSO45H2O).
- 3.3.
Zinkkorrels.
- 3.4.
Zwavelzuur, ρ20 = 1,84 g/ml.
- 3.5.
Zwavelzuur, gesteld, c(H2SO4) = 0,25 mol/l.
- 3.6.
Zwavelzuur, gesteld, c(H2SO4) = 0,10 mol/l.
- 3.7.
Zwavelzuur, gesteld, c(H2SO4) = 0,05 mol/l.
- 3.8.
Methylroodindicator: los 300 mg methylrood op in 100 ml ethanol, σ = 95–96 % (V/V).
- 3.9.
Natriumhydroxideoplossing (mag technisch zuiver zijn), β = 40 g/100 ml (m/V: 40 %).
- 3.10.
Natriumhydroxide, gestelde oplossing, c(NaOH) = 0,25 mol/l.
- 3.11.
Natriumhydroxide, gestelde oplossing, c(NaOH) = 0,10 mol/l.
- 3.12.
Puimsteenkorrels, met zoutzuur gewassen en gegloeid.
- 3.13.
Aceetanilide (smeltpunt 114 °C, N-gehalte 10,36 %).
- 3.14.
Sacharose (vrij van stikstof).
- 3.15.
Boorzuur (H3BO3).
- 3.16.
Methylroodindicatoroplossing: los 100 mg methylrood op in 100 ml ethanol of methanol.
- 3.17.
Broomkresolgroenoplossing: los 100 mg broomkresolgroen op in 100 ml ethanol of methanol.
- 3.18.
Boorzuuroplossing (10–40 g/l, afhankelijk van de gebruikte apparatuur).
Bij colorimetrische eindpuntsbepaling moeten de methylrood- en broomkresolgroenindicator aan de boorzuuroplossingen worden toegevoegd. Bij de bereiding van 1 liter boorzuur wordt, voordat het volume wordt aangevuld, 7 ml methylroodindicatoroplossing (punt 3.16) en 10 ml broomkresolgroenoplossing (punt 3.17) toegevoegd.
De pH van de boorzuuroplossing kan afhankelijk van het gebruikte water van keer tot keer verschillen. De pH van de boorzuuroplossing moet tussen 4.3 en 4.7 liggen. Vaak moet een kleine hoeveelheid base worden toegevoegd om een positieve blanco te verkrijgen.
NB:
Toevoeging van 3–4 ml NaOH (punt 3.11) aan 1 liter boorzuuroplossing van 10 g/l geeft doorgaans goede resultaten. Bewaar de oplossing bij kamertemperatuur in het donker en afgeschermd tegen bronnen van ammoniakdamp.
- 3.19.
Zoutzuur, gesteld, c(HCl) = 0,10 mol/l.
NB:
Andere gestelde oplossingen (punten 3.5, 3.6, 3.7, 3.10, 3.11 en 3.19) mogen worden gebruikt, mits hiervoor in de berekeningen wordt gecorrigeerd. De concentraties moeten altijd tot op vier decimalen worden uitgedrukt.
4. Apparatuur
Apparatuur, geschikt voor het uitvoeren van ontsluiting, destillatie en titratie volgens Kjeldahl.
5. Werkwijze
5.1. Ontsluiting
Weeg 1 g van het monster tot op 0,001 g nauwkeurig af en breng dit in de recipiënt van de ontsluitingsapparatuur. Voeg hieraan toe 15 g kaliumsulfaat (punt 3.1), een geschikte hoeveelheid katalysator (punt 3.2) (0,3–0,4 g koper(II)oxide of 0,9–1,2 g koper(II)sulfaat-pentahydraat), 25 ml zwavelzuur (punt 3.4) en zo nodig een paar puimsteenkorrels (punt 3.12); meng het geheel.
Verwarm de recipiënt eerst zacht, zo nodig onder af en toe zwenken, totdat de massa is verkoold en het schuim is verdwenen; verhit vervolgens krachtiger tot de vloeistof regelmatig kookt. Er is voldoende verhit wanneer het kokende zuur tegen de wand van de recipiënt condenseert. Zorg ervoor dat de wand niet oververhit raakt en dat er geen organische stof aan de wand gaat vastzitten.
Kook nog twee uur nadat de oplossing helder en lichtgroen geworden is; laat vervolgens afkoelen.
5.2. Destillatie
Voeg genoeg water toe om de sulfaten volledig op te lossen. Laat afkoelen; voeg zo nodig enkele zinkkorrels (punt 3.3) toe. Volg de procedure van punt 5.2.1 of 5.2.2.
5.2.1. Destillatie met opvang in zwavelzuur
Breng in de opvangkolf van de destillatieapparatuur een nauwkeurig afgemeten hoeveelheid van 25 ml zwavelzuur (punt 3.5 of 3.7), afhankelijk van het verwachte stikstofgehalte. Voeg enkele druppels methylroodindicator (punt 3.8) toe.
Verbind de ontsluitingsrecipiënt met de koeler van het destillatieapparaat en zorg ervoor dat het uiteinde van de koelbuis zich ten minste 1 cm onder het vloeistofoppervlak in de opvangkolf bevindt (zie opmerking in punt 8.3). Giet langzaam 100 ml natriumhydroxideoplossing (punt 3.9) in de ontsluitingsrecipiënt, zonder ammoniakverlies (zie opmerking in punt 8.1). Verwarm de recipiënt totdat alle ammoniak overgedestilleerd is.
5.2.2. Destillatie met opvang in boorzuur
Volg de hierna beschreven procedure als het ammoniakgehalte van het destillaat met de hand bepaald wordt. Volg de gebruiksaanwijzing van de destillatieapparatuur als deze volledig geautomatiseerd is, inclusief bepaling van het ammoniakgehalte van het destillaat.
Plaats een opvangkolf met 25–30 ml boorzuuroplossing (punt 3.18) aan het uiteinde van de koeler, zodanig dat het uiteinde zich onder het vloeistofoppervlak van de oplossing met overmaat boorzuur bevindt. Stel het destillatieapparaat in op een afgifte van 50 ml natriumhydroxideoplossing (punt 3.9). Stel het destillatieapparaat in werking volgens de gebruiksaanwijzing en destilleer de door het toevoegen van de natriumhydroxideoplossing vrijkomende ammoniak af. Vang het destillaat op in de boorzuuroplossing. De hoeveelheid destillaat (duur van de stoomdestillatie) hangt af van de hoeveelheid stikstof in het monster. Volg de gebruiksaanwijzing.
NB: | Bij een halfautomatisch destillatieapparaat verlopen de toevoeging van overmaat natriumhydroxide en de stoomdestillatie automatisch. |
5.3. Titratie
Volg de procedure van punt 5.3.1 of 5.3.2.
5.3.1. Zwavelzuur
Titreer de overmaat zwavelzuur in de opvangkolf terug met natriumhydroxideoplossing (punt 3.10 of 3.11, afhankelijk van de concentratie van het gebruikte zwavelzuur), totdat het eindpunt is bereikt.
5.3.2. Boorzuur
Titreer de inhoud van de opvangkolf met een buret met het gestelde zoutzuur (punt 3.19) of zwavelzuur (punt 3.6) en lees af hoeveel titrant gebruikt is.
Bij colorimetrische eindpuntsbepaling is het eindpunt bij het eerste spoor van roze kleur in de vloeistof. Lees de buret met een nauwkeurigheid van 0,05 ml af. Een magneetroerder met verlichting of een fotometrische detector kan helpen bij de bepaling van het eindpunt.
Bij gebruik van een stoomdestillatieapparaat met automatische titratie gebeurt dit automatisch.
Volg de gebruiksaanwijzing voor het gebruikte destillatieapparaat (al dan niet met titrator).
NB: | Bij gebruik van een automatisch titratiesysteem begint de titratie onmiddellijk na de destillatie en wordt de 1 %-boorzuuroplossing (punt 3.18) gebruikt. |
Bij een volledig automatisch destillatieapparaat kan de automatische titratie van de ammoniak ook worden uitgevoerd met eindpuntsbepaling met een potentiometrisch pH-systeem.
In dat geval wordt een automatische titrator met pH-meter gebruikt. De pH-meter moet door middel van gangbare ijkmethoden naar behoren geijkt zijn in het pH-gebied tussen 4 en 7.
Het eindpunt van de titratie, het steilste punt in de titratiecurve (buigpunt) ligt bij pH 4,6.
5.4. Blancobepaling
Om te bevestigen dat de reagentia vrij van stikstof zijn, wordt een blancobepaling (ontsluiting, destillatie en titratie) uitgevoerd met 1 g sacharose (punt 3.14) in plaats van het monster.
6. Berekening van de resultaten
De berekeningen worden uitgevoerd zoals aangegeven in punt 6.1 of 6.2.
6.1. Berekening voor titratie als beschreven in punt 5.3.1
Het gehalte aan ruw eiwit, uitgedrukt als massapercentage, wordt berekend met de volgende formule:
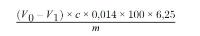
waarbij
V0 = | het volume (in ml) NaOH (punt 3.10 of 3.11) dat in de blancobepaling is gebruikt; |
V1 = | het volume (in ml) NaOH (punt 3.10 of 3.11) dat in de titratie van het monster is gebruikt; |
c = | de concentratie (in mol/l) natriumhydroxide (punt 3.10 of 3.11); |
m = | de massa (in g) van het monster. |
6.2. Berekening voor titratie als beschreven in punt 5.3.2
6.2.1. Titratie met zoutzuur
Het gehalte aan ruw eiwit, uitgedrukt als massapercentage, wordt berekend met de volgende formule:
(V1 − V0) × c × 1,4 × 6,25 / m
waarbij:
m = | de massa (in g) van het analysemonster; |
c = | de concentratie (in mol/l) van het gestelde zoutzuur (punt 3.19); |
V0 = | het volume (in ml) zoutzuur dat in de blancobepaling is gebruikt; |
V1 = | het volume (in ml) zoutzuur dat in de monsterbepaling is gebruikt. |
6.2.2. Titratie met zwavelzuur
Het gehalte aan ruw eiwit, uitgedrukt als massapercentage, wordt berekend met de volgende formule:
(V1 − V0) × c × 1,4 × 6,25 / m
waarbij
m = | de massa (in g) van het analysemonster; |
c = | de concentratie (in mol/l) van het gestelde zwavelzuur (punt 3.6); |
V0 = | het volume (in ml) zwavelzuur (punt 3.6) dat voor de blancobepaling is gebruikt; |
V1 = | het volume (in ml) zwavelzuur (punt 3.6) dat voor de monsterbepaling is gebruikt. |
7. Verificatie van de methode
7.1. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer bedragen dan:
- —
0,4 % absoluut voor ruweiwitgehalten van minder dan 20 %,
- —
2,0 % van het hoogste resultaat voor ruweiwitgehalten van 20 % tot 40 %,
- —
0,8 % absoluut voor ruweiwitgehalten van meer dan 40 %.
7.2. Reproduceerbaarheid
Het verschil tussen de resultaten van twee bepalingen die op hetzelfde monster in verschillende laboratoria zijn uitgevoerd, mag niet groter zijn dan:
- —
1,8 % absoluut voor ruweiwitgehalten van minder dan 20 %,
- —
9,0 % van het hoogste resultaat voor ruweiwitgehalten van 20 % tot 40 %,
- —
3,6 % absoluut voor ruweiwitgehalten van meer dan 40 %.
7.3. Nauwkeurigheid
Voer de bepaling (ontsluiting, destillatie en titratie) uit op passende hoeveelheid aceetanilide (punt 3.13) (bv. 0,2–0,3 g) in aanwezigheid van 1 g sacharose (punt 3.14); 1 g aceetanilide verbruikt 14,80 ml zwavelzuur (punt 3.5). Er moet ten minste 99 % worden teruggevonden.
8. Opmerkingen
- 8.1.
De apparatuur kan tot het manuele, halfautomatische of automatische type behoren. Indien de ontsluitingsvloeistof tussen ontsluiting en destillatie overgebracht moet worden, mag er geen verlies optreden. Indien de recipiënt van de destillatieapparatuur niet voorzien is van een druppeltrechter, moet de natriumhydroxideoplossing langzaam langs de wand toegevoegd worden, onmiddellijk voordat de recipiënt met de koeler wordt verbonden.
- 8.2.
Herhaal de bepaling met een grotere hoeveelheid zwavelzuur (punt 3.4) dan vermeld in punt 5.1, wanneer het materiaal tijdens het ontsluiten vast wordt.
- 8.3.
Voor producten met een laag stikstofgehalte kan het volume zwavelzuur (punt 3.7) dat in de opvangkolf wordt gebracht zo nodig worden verminderd tot 10 of 15 ml en met water tot 25 ml worden aangevuld.
- 8.4.
Voor routineanalyse mogen andere analysemethoden worden gebruikt om het ruweiwitgehalte te bepalen, maar de in dit deel C beschreven kjeldahlmethode is de referentiemethode. Voor elke matrix afzonderlijk moet worden aangetoond dat met de alternatieve methode (bv. Dumas) dezelfde resultaten worden verkregen als met de referentiemethode. Aangezien de met de alternatieve methode verkregen resultaten ook na verificatie van de gelijkwaardigheid van beide methoden enigszins kunnen afwijken van de met de referentiemethode verkregen resultaten, moet in het analyseverslag worden vermeld welke methode voor de bepaling van het ruweiwitgehalte gebruikt is.
D. Bepaling van ureum
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan ureum dat als toevoegingsmiddel voor diervoeders voor herkauwers wordt gebruikt.
2. Beginsel
Het monster wordt onder toevoeging van een klaringsmiddel in water gesuspendeerd. De suspensie wordt gefiltreerd. In het filtraat wordt na toevoegen van 4-dimethylaminobenzaldehyd (4-DMAB) het gehalte aan ureum bepaald door meting van de extinctie bij een golflengte van 420 mm.
3. Reagentia
- 3.1.
4-Dimethylaminobenzaldehydoplossing: los 1,6 g 4-DMAB op in 100 ml ethanol 96 % en voeg 10 ml zoutzuur (ρ20 = 1,19 g/ml) toe. Het reagens is slechts twee weken houdbaar.
- 3.2.
Carrez I-oplossing: los 21,9 g zinkacetaat, Zn(CH3COO)2·2H2O, en 3 g ijsazijn op in water. Vul met water aan tot 100 ml.
- 3.3.
Carrez II-oplossing: los 10,6 g kaliumhexacyanoferraat(II), K4Fe(CN)63H2O, op in water. Vul met water aan tot 100 ml.
- 3.4.
Actieve kool die geen ureum adsorbeert (controleer dit).
- 3.5.
Ureum, oplossing van 0,1 % (m/V).
4. Apparatuur
- 4.1.
Roteerapparaat met ongeveer 35 à 40 omwentelingen per minuut.
- 4.2.
Reageerbuizen: 160 × 16 mm, met geslepen stop.
- 4.3.
Spectrofotometer.
5. Werkwijze
5.1. Analyse van het monster
Breng 2 g van het monster, tot op 1 mg nauwkeurig gewogen, en 1 g actieve kool (punt 3.4) in een maatkolf van 500 ml. Voeg 400 ml water en 5 ml Carrez I-oplossing (punt 3.2) toe, meng gedurende ongeveer 30 seconden en voeg 5 ml Carrez II-oplossing (punt 3.3) toe. Laat gedurende 30 min. roteren in het roteerapparaat. Vul vervolgens met water aan tot de streep, schud en filtreer.
Pipetteer van het heldere en kleurloze filtraat 5 ml in een reageerbuis met geslepen stop, voeg 5 ml 4-DMAB-oplossing (punt 3.1) toe en meng. Plaats de buis in een waterbad op 20 °C (± 4 °C). Meet na 15 minuten met de spectrofotometer de extinctie van de monsteroplossing bij 420 nm. Vergelijk het resultaat met de blanco-oplossing van de reagentia.
5.2. IJkgrafiek
Breng in maatkolven van 100 ml resp. 1, 2, 4, 5 en 10 ml ureumoplossing (punt 3.5), vul aan tot de streep met water (en meng). Pipetteer van elk van deze oplossingen 5 ml af, voeg hieraan telkens 5 ml 4-DMAB-oplossing (punt 3.1) toe en meng. Meet de extinctie tegen een oplossing die 5 ml 4-DMAB en 5 ml water, vrij van ureum, bevat, zoals hierboven aangegeven. Stel een ijkgrafiek op.
6. Berekening van de resultaten
Bepaal aan de hand van de ijkgrafiek de hoeveelheid ureum in het monster.
Druk het resultaat uit in mg ureum per kg monster.
7. Evaluatie van de methode
7.1. Herhaalbaarheid
Het verschil tussen de resultaten van twee bepalingen die op hetzelfde monster in hetzelfde laboratorium door dezelfde medewerker zijn uitgevoerd, mag niet groter zijn dan:
- —
bij 420 nm;
- —
50 % van het hoogste resultaat bij ureumgehalten tussen 3 000 mg/kg en 5 000 mg/kg;
- —
25 % van het hoogste resultaat bij ureumgehalten tussen 5 000 mg/kg en 7 000 mg/kg;
- —
20 % van het hoogste resultaat bij ureumgehalten 7 000 mg/kg of meer;
- —
bij 435 nm;
- —
40 % van het hoogste resultaat bij ureumgehalten tussen 3 000 mg/kg en 5 000 mg/kg;
- —
25 % van het hoogste resultaat bij ureumgehalten tussen 5 000 mg/kg en 9 000 mg/kg;
- —
5 % van het hoogste resultaat bij ureumgehalten 9 000 mg/kg of meer.
7.2. Reproduceerbaarheid
Het verschil tussen de resultaten van twee bepalingen die op hetzelfde monster in verschillende laboratoria en/of door verschillende medewerkers zijn uitgevoerd, mag niet groter zijn dan:
- —
bij 420 nm;
- —
3 000 mg/kg absoluut, bij ureumgehalten tussen 3 000 mg/kg en 12 000 mg/kg;
- —
4 500 mg/kg absoluut, bij ureumgehalten van 12 000 mg/kg of meer;
- —
bij 435 nm;
- —
50 % van het hoogste resultaat bij ureumgehalten tussen 3 000 mg/kg en 8 000 mg/kg;
- —
25 % van het hoogste resultaat bij ureumgehalten van 8 000 mg/kg of meer.
8. Resultaten van een ringonderzoek
Er werd een vergelijkend onderzoek georganiseerd waaraan 18 EU-laboratoria hebben deelgenomen. Monsters van vijf positieve diervoeders voor herkauwers (in de tabel met MAT aangeduid) werden geanalyseerd (1 analyse) in duplicaten in blinde tests, en één blanco mengvoeder voor herkauwers werd één keer geanalyseerd.
Berekeningen voor de herhaalbaarheid (r) en de reproduceerbaarheid (R) zoals gedefinieerd in internationale richtsnoeren werden uitgevoerd na verwijdering van uitschieters door variatieanalyse van de geldige waarden.
De berekende prestatiecijfers van de methode (herhaalbaarheid, reproduceerbaarheid) zijn weergegeven in de volgende tabellen. Voor alle geteste monsters, met inbegrip van het blancomateriaal, werden geen fout-positieve of fout-negatieve resultaten gevonden.
MAT 2 | MAT 5 | MAT 3 | MAT 4 | MAT 6 | |
|---|---|---|---|---|---|
Schapen | Runderen | Schapen | Schapen | Runderen | |
Doelmassafractie (mg kg−1) | 3 000 | 5 000 | 7 001 | 9 036 | 11 000 |
Gemiddelde massafractie (mg kg−1) | 4 241 | 6 993 | 7 830 | 9 962 | 12 071 |
Standaardafwijking van de reproduceerbaarheid sR (mg kg−1) | 1 141 | 1 303 | 985 | 994 | 1 711 |
Standaardafwijking van de herhaalbaarheid sr (mg kg−1) | 723 | 601 | 549 | 712 | 737 |
Relatieve standaarddeviatie van de reproduceerbaarheid, RSDR (%) | 27 | 19 | 13 | 10 | 14 |
Relatieve standaardafwijking van de reproduceerbaarheid RSDr (%) | 17 | 9 | 7 | 7 | 6 |
Reproduceerbaarheidsgrens, R [R = 2,8 × sR] | 3 195 | 3 649 | 2 759 | 2 784 | 4 790 |
Herhaalbaarheidsgrens, r [r = 2,8 × sr] | 2 024 | 1 684 | 1 536 | 1 994 | 2 064 |
MAT 2 | MAT 5 | MAT 3 | MAT 4 | MAT 6 | |
|---|---|---|---|---|---|
Schapen | Runderen | Schapen | Schapen | Runderen | |
Doelmassafractie (mg kg−1) | 3 000 | 5 000 | 7 001 | 9 036 | 11 000 |
Gemiddelde massafractie (mg kg−1) | 4 101 | 6 467 | 7 890 | 10 062 | 11 642 |
Standaardafwijking van de reproduceerbaarheid sR (mg kg−1) | 706 | 1 194 | 675 | 745 | 1 378 |
Standaardafwijking van de herhaalbaarheid sr (mg kg−1) | 570 | 628 | 613 | 196 | 167 |
Relatieve standaarddeviatie van de reproduceerbaarheid, RSDR (%) | 17 | 18 | 9 | 7 | 12 |
Relatieve standaardafwijking van de reproduceerdbaarheid RSDr (%) | 14 | 10 | 8 | 2 | 1 |
Reproduceerbaarheidsgrens, R [R = 2,8 × sR] | 1 977 | 3 344 | 1 889 | 2 087 | 3 859 |
Herhaalbaarheidsgrens, r [r = 2,8 × sr] | 1 596 | 1 759 | 1 715 | 549 | 467 |
9. Opmerkingen
- 9.1.
Indien het gehalte aan ureum meer bedraagt dan 3 % wordt het monster teruggebracht tot 1 g, of het filtraat zodanig verdund dat in 500 ml niet meer dan 50 mg ureum aanwezig is.
- 9.2.
Bij lage gehalten aan ureum moet meer analysemateriaal afgewogen worden, zo lang een helder en kleurloos filtraat wordt verkregen.
- 9.3.
Bovenstaande resultaten van ringonderzoeken wijzen niet op een significant verschil in precisie tussen ureum gemeten bij 420 nm of bij 435 nm.
E. Bepaling van aminozuren (met uitzondering van tryptofaan)
Voor de bepaling van aminozuren (met uitzondering van tryptofaan) worden de volgende analysemethoden toegepast:
- —
EN ISO 13903 Diervoeders — Bepaling van het gehalte aan aminozuren;
- —
EN ISO 17180 Diervoeders — Bepaling van het gehalte aan lysine, methionine en threonine in commerciële aminozuurproducten en voormengsels (4);
- —
de in de punten 1 tot en met 10 beschreven analysemethode.
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van de vrije (synthetische en natuurlijke) aminozuren en de totale hoeveelheid (vrije en in peptiden gebonden) aminozuren in voedermiddelen, mengvoeders en voormengsels die minder dan 10 % (5) van elk aminozuur bevatten, waarbij gebruik wordt gemaakt van een aminozuuranalysator. De methode kan worden gebruikt voor bepaling van de volgende aminozuren: cysteïne/cystine, methionine, lysine, treonine, alanine, arginine, asparaginezuur, glutaminezuur, glycine, histidine, isoleucine, leucine, fenylalanine, proline, serine, tyrosine en valine.
Deze methode maakt geen onderscheid tussen de verschillende zouten van het aminozuur, en kan niet differentiëren tussen de D- en L-vorm van aminozuren. De methode kan niet worden gebruikt voor de bepaling van tryptofaan of van hydroxyanalogen van aminozuren.
2. Beginsel
2.1. Vrije aminozuren
De vrije aminozuren worden met verdund zoutzuur geëxtraheerd. Stikstofhoudende macromoleculen die meekomen bij de extractie worden geprecipiteerd met sulfosalicylzuur en door filtratie verwijderd. De pH van de gefiltreerde oplossing wordt op 2,20 gebracht. De aminozuren worden gescheiden door ionenwisselingschromatografie, en na reactie met ninhydrine bepaald door fotometrische detectie bij 570 nm.
2.2. Totaal aminozuurgehalte
De gekozen werkwijze is afhankelijk van de te onderzoeken aminozuren. Cysteïne/cystine en methionine moeten vóór hydrolyse tot resp. cysteïnezuur en methioninesulfon worden geoxideerd. Tyrosine moet worden bepaald in hydrolysaten van niet-geoxideerde monsters. Alle andere aminozuren die in punt 1 (Doel en toepassingsgebied) zijn genoemd, kunnen zowel in geoxideerde als in niet-geoxideerde monsters worden bepaald.
De oxidatie wordt uitgevoerd bij 0 °C met een mengsel van permierenzuur en fenol. Overmaat oxidatiemiddel wordt ontleed met dinatriumdisulfiet. Het geoxideerde of niet-geoxideerde monster wordt gedurende 23 uur gehydrolyseerd met zoutzuur (punt 3.20). De pH van het hydrolysaat wordt op 2,20 gebracht. De aminozuren worden door ionenwisselingschromatografie van elkaar gescheiden en worden bepaald door reactie met ninhydrine gevolgd door fotometrische detectie bij 570 nm (440 nm voor proline).
3. Reagentia
Er moet dubbel gedestilleerd water of water van vergelijkbare kwaliteit worden gebruikt (geleidbaarheid [amp]lt; 10 μS).
- 3.1.
Waterstofperoxide, w = 30 % (m/m).
- 3.2.
Mierenzuur, w = 98–100 % (m/m).
- 3.3.
Fenol.
- 3.4.
Dinatriumdisulfiet.
- 3.5.
Natriumhydroxide.
- 3.6.
5-Sulfosalicylzuur-dihydraat.
- 3.7.
Zoutzuur, d = 1,18 g/ml (ongeveer).
- 3.8.
Trinatriumcitraat-dihydraat.
- 3.9.
2,2'-Thiodiethanol (thiodiglycol).
- 3.10.
Natriumchloride.
- 3.11.
Ninhydrine.
- 3.12.
Lichtpetroleum, kooktraject 40–60 °C.
- 3.13.
Norleucine, of een andere verbinding die kan dienen als interne standaard.
- 3.14.
Stikstofgas ([amp]lt; 10 ppm zuurstof).
- 3.15.
Octaan-1-ol.
- 3.16.
Aminozuren.
- 3.16.1.
Standaardverbindingen van de aminozuren zoals genoemd in punt 1 (Doel en toepassingsgebied). Zuivere verbindingen, zonder kristalwater. Vóór gebruik gedurende een week drogen in vacuüm boven P2O5 of H2SO4.
- 3.16.2.
Cysteïnezuur.
- 3.16.3.
Methioninesulfon.
- 3.17.
Natriumhydroxideoplossing, c = 7,5 mol/l:
Los 300 g NaOH (punt 3.5) op in water en vul aan tot 1 liter.
- 3.18.
Natriumhydroxideoplossing, c = 1 mol/l:
Los 40 g NaOH (punt 3.5) op in water en vul aan tot 1 liter.
- 3.19.
Mierenzuur-fenoloplossing:
Meng 889 g mierenzuur (punt 3.2) met 111 g water en voeg 4,73 g fenol (punt 3.3) toe.
- 3.20.
Hydrolysemengsel, c = 6 mol HCl/l met 1 g fenol/l:
Voeg 1 g fenol (punt 3.3) toe aan 492 ml HCl (punt 3.7) en vul aan met water tot 1 liter.
- 3.21.
Extractiemengsel, c = 0,1 mol HCl/l met 2 % thiodiglycol: neem 8,2 ml HCl (punt 3.7), meng met circa 900 ml water, voeg 20 ml thiodiglycol (punt 3.9) toe en vul aan met water tot 1 liter (meng 3.7 en 3.9 niet direct).
- 3.22.
5-Sulfosalicylzuuroplossing, β = 6 %:
Los 60 g 5-sulfosalicylzuur (punt 3.6) op in water en vul aan met water tot 1 liter.
- 3.23.
Oxidatiemengsel (permierenzuur-fenol):
Meng in een klein bekerglas 0,5 ml waterstofperoxide (punt 3.1) met 4,5 ml mierenzuur-fenoloplossing (punt 3.19). Incubeer gedurende 1 uur bij 20–30 °C zodat er permierenzuur wordt gevormd, en koel vervolgens in een ijsbad met smeltend ijs (15 minuten) voordat de vloeistof aan het monster wordt toegevoegd.
Voorzichtig: vermijd aanraking met de huid en draag beschermende kleding.
- 3.24.
Citraatbuffer, c = 0,2 mol Na+/l, pH 2,20:
Los 19,61 g natriumcitraat (punt 3.8), 5 ml thiodiglycol (punt 3.9), 1 g fenol (punt 3.3) en 16,50 ml HCl (punt 3.7) op in ongeveer 800 ml water. Breng de pH op 2,20. Vul aan met water tot 1 liter.
- 3.25.
Elutiebuffers, bereid overeenkomstig de voorschriften voor de gebruikte analysator (punt 4.9).
- 3.26.
Ninhydrinereagens, bereid overeenkomstig de voorschriften voor de gebruikte analysator (punt 4.9).
- 3.27.
Standaardaminozuuroplossingen. Deze oplossingen moeten worden bewaard bij een temperatuur van minder dan 5 °C.
- 3.27.1.
Stamoplossing van aminozuren (punt 3.16.1).
c = 2,5 μmol/ml van elk aminozuur in zoutzuur.
Commercieel verkrijgbaar.
- 3.27.2.
Stamoplossing van cysteïnezuur en methioninesulfon, c = 1,25 μmol/ml.
Los 0,2115 g cysteïnezuur (punt 3.16.2) en 0,2265 g methioninesulfon (punt 3.16.3) op in citraatbuffer (punt 3.24) in een maatkolf van 1 liter, en vul aan tot de streep met citraatbuffer. Bewaar, niet langer dan twaalf maanden, bij een temperatuur van minder dan 5 °C. Deze oplossing wordt niet gebruikt wanneer de stamoplossing (punt 3.27.1) cysteïnezuur en methioninesulfon bevat.
- 3.27.3.
Stamoplossing van de interne standaard, bv. norleucine, c = 20 μmol/ml.
Los 0,6560 g norleucine (punt 3.13) op in citraatbuffer (punt 3.24) in een maatkolf van 250 ml en vul aan tot de streep met citraatbuffer. Bewaar, niet langer dan zes maanden, bij een temperatuur van minder dan 5 °C.
- 3.27.4.
Standaardaminozuurijkoplossing voor gebruik bij hydrolysaten, c = 5 nmol/50 μl cysteïnezuur en methioninesulfon, en c = 10 nmol/50 μl van de andere aminozuren. Los 2,2 g natriumchloride (punt 3.10) op in een 100 ml bekerglas met 30 ml citraatbuffer (punt 3.24). Voeg 4,00 ml stamoplossing van aminozuren (punt 3.27.1) toe, 4,00 ml stamoplossing van cysteïnezuur en methioninesulfon (punt 3.27.2), en — indien van toepassing — 0,50 ml stamoplossing van de interne standaard (punt 3.27.3). Breng de pH met natriumhydroxideoplossing (punt 3.18) op 2,20.
Breng kwantitatief over in een maatkolf van 50 ml, vul aan tot de streep met citraatbuffer (punt 3.24) en meng.
Bewaar, niet langer dan drie maanden, bij een temperatuur van minder dan 5 °C.
Zie ook de opmerkingen in punt 9.1.
- 3.27.5.
Standaardaminozuurijkoplossing voor gebruik bij hydrolysaten, bereid volgens punt 5.3.3.1, en voor gebruik bij extracten (punt 5.2). De ijkoplossing wordt bereid als beschreven in punt 3.27.4, met weglating van natriumchloride.
Bewaar, niet langer dan drie maanden, bij een temperatuur van minder dan 5 °C.
4. Apparatuur
- 4.1.
Rondbodemkolf, 100 of 250 ml, met terugvloeikoeler.
- 4.2.
Fles van borosilicaatglas, 100 ml, met schroefdop voorzien van rubber/teflon inlay (bv. Duran, Schott) voor gebruik in de oven.
- 4.3.
Oven met geforceerde ventilatie en temperatuurregulering, nauwkeuriger dan ± 2 °C.
- 4.4.
pH-meter (in drie decimalen afleesbaar).
- 4.5.
Membraanfilter, 0,22 μm.
- 4.6.
Centrifuge
- 4.7.
Rotatieverdamper.
- 4.8.
Mechanisch schudapparaat of magneetroerder.
- 4.9.
Aminozuuranalysator of HPLC-apparatuur met ionenwisselingskolom, onderdeel voor de ninhydrinereactie, nakolomsderivatisering en fotometrische detector.
De kolom wordt gevuld met gesulfoneerd polystyreenhars waarop aminozuren van elkaar en van ander ninhydrinepositief materiaal worden gescheiden. Het debiet van buffer en ninhydrine wordt gereguleerd door pompen met een nauwkeurigheid van ± 0,5 %, zowel tijdens de standaardijking als tijdens de analyse van het monster.
Bij sommige aminozuuranalysatoren kunnen hydrolysemethoden worden gebruikt waarbij het hydrolysaat een natriumconcentratie heeft van c = 0,8 mol/l, terwijl ook al het uit de oxidatiestap overgebleven mierenzuur nog aanwezig is. Andere analysatoren geven geen goede scheiding van bepaalde aminozuren in hydrolysaten met een overmaat mierenzuur en/of een hoge natriumconcentratie. In zulke gevallen wordt het volume zuur gereduceerd door verdamping tot ongeveer 5 ml na hydrolyse en vóór instelling van de juiste pH. De verdamping gebeurt onder vacuüm bij ten hoogste 40 °C.
5. Werkwijze
5.1. Monstervoorbewerking
Het monster wordt gemalen tot de deeltjes een zeef met een maaswijdte van 0,5 mm passeren. Monsters met een hoge vochtigheidsgraad moeten ofwel aan lucht met een temperatuur van hoogstens 50 °C worden gedroogd, ofwel voorafgaand aan het malen worden gevriesdroogd. Monsters met een hoog vetgehalte moeten voor het malen worden geëxtraheerd met petroleumether (punt 3.12).
5.2. Bepaling van vrije aminozuren
Weeg een geschikte hoeveelheid (1–5 g) van het voorbewerkte monster (punt 5.1) op 0,2 mg nauwkeurig af in een erlenmeyer en voeg 100,0 ml extractiemengsel (punt 3.21) toe. Schud of roer het mengsel gedurende 60 minuten in een schudapparaat of met een magneetroerder (punt 4.8). Laat het neerslag bezinken en pipetteer 10,0 ml van de bovenstaande vloeistof in een bekerglas van 100 ml.
Voeg onder aanhoudend roeren 5,0 ml sulfosalicylzuuroplossing (punt 3.22) toe, en roer nog 5 minuten door op de magneetroerder. Filtreer of centrifugeer de bovenstaande vloeistof om eventueel aanwezig neerslag te verwijderen. Breng 10,0 ml van de verkregen oplossing in een bekerglas van 100 ml op pH 2,20 met natriumhydroxideoplossing (punt 3.18), spoel de oplossing met citraatbuffer (punt 3.24) in een maatkolf van geschikt volume, en vul aan tot de streep met bufferoplossing (punt 3.24).
Voeg, als er een interne standaard wordt gebruikt, 1,00 ml interne standaard (punt 3.27.3) toe per 100 ml eindoplossing en vul aan tot de streep met bufferoplossing (punt 3.24).
Ga verder met de chromatografiestap volgens punt 5.4.
Als chromatografie van de extracten niet dezelfde dag mogelijk is, moeten zij worden bewaard bij een temperatuur van minder dan 5 °C.
5.3. Bepaling van de totale hoeveelheid aminozuren
5.3.1. Oxidatie
Weeg een 0,1–1 g van het voorbewerkte monster (punt 5.1) tot op 0,2 mg nauwkeurig af in:
- —
een rondbodemkolf van 100 ml (punt 4.1) in geval van open hydrolyse (punt 5.3.2.3), of
- —
een rondbodemkolf van 250 ml (punt 4.1) als een lage natriumconcentratie vereist wordt (punt 5.3.3.1), of
- —
een fles van 100 ml met schroefdop (punt 4.2) voor gesloten hydrolyse (punt 5.3.2.4).
De ingewogen hoeveelheid monster moet een stikstofgehalte van ongeveer 10 mg hebben en mag niet meer dan 100 mg vocht bevatten.
Breng de kolf/fles in een ijsbad met smeltend ijs op 0 °C, voeg 5 ml oxidatiemengsel (punt 3.23) toe en meng met een gebogen glazen spatel. Sluit de kolf/fles met de spatel erin af met luchtdichte folie en zet het ijsbad met het gesloten vat gedurende 16 uur in een koelkast bij 0 °C. Neem de kolf/fles na 16 uur uit de koelkast en ontleed de overmaat oxidatiereagens door 0,84 g dinatriumdisulfiet (punt 3.4) toe te voegen.
Ga verder met 5.3.2.1.
5.3.2. Hydrolyse
5.3.2.1. Hydrolyse van geoxideerde monsters
Voeg aan het volgens 5.3.1 geoxideerde monster 25 ml hydrolysemengsel (punt 3.20) toe, waarbij zorgvuldig alle sporen van het mengsel van de wand van het vat en van de spatel worden gespoeld.
Ga, afhankelijk van de gebruikte hydrolyseprocedure, verder met 5.3.2.3 of 5.3.2.4.
5.3.2.2. Hydrolyse van niet-geoxideerde monsters
Weeg 0,1–1 g van het voorbewerkte monster (punt 5.1) tot op 0,2 mg nauwkeurig af in een rondbodemkolf van 100 ml of 250 ml (punt 4.1) of in een fles met schroefdop van 100 ml (punt 4.2). De ingewogen hoeveelheid monster moet een stikstofgehalte van ongeveer 10 mg hebben. Voeg voorzichtig 25 ml hydrolysemengsel (punt 3.20) toe en meng met het monster. Ga verder met punt 5.3.2.3 of punt 5.3.2.4.
5.3.2.3. Open hydrolyse
Doe drie glasparels bij het mengsel (bereid volgens 5.3.2.1 of 5.3.2.2) en kook gedurende 23 uur in een kolf voorzien van een terugvloeikoeler. Spoel, na beëindiging van de hydrolyse, de koeler schoon met 5 ml citraatbuffer (punt 3.24). Neem de koeler van de kolf en plaats de kolf in een ijsbad.
Ga verder met 5.3.3.
5.3.2.4. Gesloten hydrolyse
Zet de fles met het volgens 5.3.2.1 of 5.3.2.2 bereide mengsel in een oven (punt 4.3) bij 110 °C. Laat gedurende het eerste uur de schroefdop los op de fles staan, om te voorkomen dat zich druk opbouwt als gevolg van gasvorming en om explosies te voorkomen. Sluit de fles niet af met de dop. Draai de dop na een uur op de fles en laat deze gedurende 23 uur in de oven (punt 4.3) staan. Neem de fles uit de oven als de hydrolyse is voltooid, draai de dop voorzichtig van de fles en zet deze in een bad met smeltend ijs. Laat afkoelen.
Breng, afhankelijk van de manier waarop de pH wordt ingesteld (punt 5.3.3), de inhoud van de fles met behulp van citraatbuffer (punt 3.24) kwantitatief over in een bekerglas of rondbodemkolf van 250 ml.
Ga verder met 5.3.3.
5.3.3. Aanpassen van de pH
Ga verder met aanpassing van de pH volgens 5.3.3.1 of 5.3.3.2, afhankelijk van de natriumtolerantie van de aminozuuranalysator (punt 4.9).
5.3.3.1. Chromatografiesystemen (punt 4.9) die een lage natriumconcentratie vereisen
Bij aminozuuranalysatoren die een lage natriumconcentratie vereisen (en waarbij het volume zuur wordt ingedampt) wordt aanbevolen een stamoplossing van de interne standaard (punt 3.27.3) te gebruiken.
Voeg in dit geval vóór het indampen 2,00 ml van de stamoplossing van de interne standaard (punt 3.27.3) toe aan het hydrolysaat.
Voeg twee druppels octaan-1-ol (punt 3.15) toe aan het hydrolysaat, verkregen volgens 5.3.2.3 of 5.3.2.4.
Breng met een rotatieverdamper (punt 4.7) onder vacuüm bij 40 °C het volume terug tot 5–10 ml. Wordt het eindvolume per ongeluk kleiner dan 5 ml, dan moet het hydrolysaat worden weggegooid en de analyse opnieuw worden ingezet.
Breng de pH op 2,20 met natriumhydroxideoplossing (punt 3.18) en ga verder met 5.3.4.
5.3.3.2. Alle andere aminozuuranalysatoren (punt 4.9)
Neem het volgens 5.3.2.3 of 5.3.2.4 verkregen hydrolysaat en neutraliseer het ten dele door voorzichtig, onder roeren, 17 ml natriumhydroxideoplossing (punt 3.17) toe te voegen; let op dat de temperatuur niet hoger wordt dan 40 °C.
Breng de pH op 2,20 bij kamertemperatuur met natriumhydroxideoplossing (punt 3.17) en daarna natriumhydroxideoplossing (punt 3.18). Ga verder met 5.3.4.
5.3.4. Monsteroplossing voor chromatografie
Breng het op pH gebrachte hydrolysaat (punt 5.3.3.1 of 5.3.3.2) met citraatbuffer (punt 3.24) kwantitatief over in een 200 ml maatkolf en vul aan tot de streep met buffer (punt 3.24).
Als er nog geen interne standaard is gebruikt, voeg dan nu 2,00 ml interne standaard (punt 3.27.3) toe en vul aan tot de streep met citraatbuffer (punt 3.24). Meng goed.
Ga verder met de chromatografiestap (punt 5.4).
Als chromatografie van de monsteroplossingen niet dezelfde dag mogelijk is, moeten zij worden bewaard bij een temperatuur van minder dan 5 °C.
5.4. Chromatografie
Laat het extract (punt 5.2) of hydrolysaat (punt 5.3.4) voor de chromatografische bepaling op kamertemperatuur komen. Schud het mengsel en filtreer een geschikte hoeveelheid door een 0,22 μm membraanfilter (punt 4.5). De resulterende heldere oplossing wordt gebruikt voor ionenwisselingschromatografie met behulp van een aminozuuranalysator (punt 4.9).
Injectie kan met de hand worden gedaan of automatisch. Het is van belang dat steeds dezelfde hoeveelheid oplossing ± 0,5 % op de kolom wordt gebracht voor analyse van standaarden en monsters — tenzij er een interne standaard wordt gebruikt — en dat de verhouding natrium/aminozuur in standaard- en monsteroplossingen onderling zo veel mogelijk overeenkomen.
Hoe vaak er ijkbepalingen nodig zijn is afhankelijk van de stabiliteit van het ninhydrinereagens en van het analytische systeem in het algemeen. Standaarden en monsters worden zodanig met citraatbuffer (punt 3.24) verdund dat de standaard een piekoppervlakte levert die 30–200 % bedraagt van de piekoppervlakte van het monster.
Er zal een zekere variabiliteit zitten in de chromatografie van aminozuren, afhankelijk van het type analysator en de gebruikte soort hars. Het systeem waarvoor wordt gekozen moet de aminozuren van elkaar en van andere ninhydrinepositieve stoffen kunnen scheiden. Binnen het bepalingsbereik moet het chromatografiesysteem een lineaire respons geven op veranderingen in de hoeveelheid aminozuren die op de kolom worden gebracht.
Er moeten bij de chromatografische analyse van een equimolaire oplossing van de te bepalen aminozuren dal/piekratio's worden verkregen die overeenkomen met de hieronder genoemde. Deze equimolaire oplossing moet ten minste 30 % bevatten van de maximale hoeveelheid van elk aminozuur die met het aminozuuranalysesysteem (punt 4.9) nog nauwkeurig kan worden bepaald.
Voor scheiding van treonine en serine mag de dal/piekratio voor de kleinste piek van de twee overlappende aminozuren op het chromatogram niet meer bedragen dan 2:10. (Als alleen cysteïne/cystine, methionine, threonine en lysine worden bepaald, wordt de nauwkeurigheid van de bepaling ongunstig beïnvloed door onvoldoende scheiding van aangrenzende pieken.) Voor alle andere aminozuren moet de scheiding beter zijn dan 1:10.
Het systeem moet lysine van ‘lysineartefacten’ en van ornithine kunnen scheiden.
6. Berekening van de resultaten
De piekoppervlakte van monster en standaard wordt voor elk aminozuur afzonderlijk bepaald en het gehalte (X), uitgedrukt als g aminozuur per kg monster, wordt berekend.
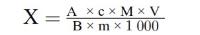
Vermenigvuldig bij gebruik van een interne standaard met: D/C
A = | piekoppervlakte van hydrolysaat of extract; |
B = | piekoppervlakte van standaardijkoplossing; |
C = | piekoppervlakte van interne standaard in hydrolysaat of extract; |
D = | piekoppervlakte van interne standaard, standaardijkoplossing; |
M = | molecuulgewicht van het te bepalen aminozuur; |
c = | concentratie standaard in μmol/ml; |
m = | massa monster (g) (gecorrigeerd tot oorspronkelijke massa indien gedroogd of ontvet); |
V = | ml totaal hydrolysaat (punt 5.3.4) of ml berekend totaal verdunningsvolume van het extract (punt 6.1). |
Cystine en cysteïne worden in hydrolysaten van geoxideerde monsters beide bepaald als cysteïnezuur, maar berekend als cystine (C6H12N2O4S2, M = 240,30 g/mol) door een molecuulgewicht van 120,15 (= 0,5 × 240,30 g/mol) te nemen.
Methionine wordt in hydrolysaten van geoxideerd monster bepaald als methioninesulfon, maar berekend als methionine met gebruikmaking van het molecuulgewicht van methionine: 149,21 g/mol.
Toegevoegd vrij methionine wordt na extractie bepaald als methionine; voor de berekening wordt hetzelfde molecuulgewicht gebruikt.
- 6.1.
Het totale verdunningsvolume van extracten (F) voor de bepaling van vrije aminozuren (punt 5.2) wordt als volgt berekend:
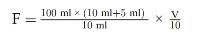
V =
eindvolume van het extract.
7. Evaluatie van de methode
De methode is in 1990 getest in een internationaal ringonderzoek, waarvoor vier soorten diervoeders zijn gebruikt (mengvoer voor varkens, slachtkuikenvoer, eiwitconcentraat, voormengsel).
NB: | De methode is in 2003 getest tijdens een tweede internationaal ringonderzoek met blinde tests van duplicaten van monsters van startvoer voor mestkippen, afmestvoer voor mestkippen, mais, vismeel en pluimveemeel. Zie voor meer gedetailleerde informatie EN ISO 13903. |
De waarden van het ringonderzoek van 1990 (na verwijdering van uitschieters) van gemiddelde en standaardafwijking worden gegeven in de hierna volgende tabellen:
Referentiemateriaal | Aminozuur | |||
|---|---|---|---|---|
Treonine | Cysteïne/cystine | Methionine | Lysine | |
Varkensmengvoeder | 6,94 n = 15 | 3,01 n = 17 | 3,27 n = 17 | 9,55 n = 13 |
Slachtkuikenmengvoeder | 9,31 n = 16 | 3,92 n = 18 | 5,08 n = 18 | 13,93 n = 16 |
Eiwitconcentraat | 22,32 n = 16 | 5,06 n = 17 | 12,01 n = 17 | 47,74 n = 15 |
Voormengsel | 58,42 n = 16 | - | 90,21 n = 16 | 98,03 n = 16 |
n = aantal deelnemende laboratoria. | ||||
7.1. Herhaalbaarheid
De herhaalbaarheid, uitgedrukt als ‘intralaboratoriumstandaardafwijking’, van bovengenoemd ringonderzoek wordt weergegeven in de volgende tabel:
Referentiemateriaal | Aminozuur | |||
|---|---|---|---|---|
Treonine | Cysteïne/cystine | Methionine | Lysine | |
Varkensmengvoeder | 1,9 n = 15 | 3,3 n = 17 | 3,4 n = 17 | 2,8 n = 13 |
Slachtkuikenmengvoeder | 2,1 n = 16 | 2,8 n = 18 | 3,1 n = 18 | 2,1 n = 16 |
Eiwitconcentraat | 2,7 n = 16 | 2,6 n = 17 | 2,2 n = 17 | 2,4 n = 15 |
Voormengsel | 2,2 n = 16 | - | 2,4 n = 16 | 2,1 n = 16 |
n = aantal deelnemende laboratoria. | ||||
7.2. Reproduceerbaarheid
De waarden van de standaardafwijking tussen laboratoria onderling, verkregen in bovengenoemd ringonderzoek worden weergegeven in onderstaande tabel:
Referentie-materiaal | Aminozuur | |||
|---|---|---|---|---|
Treonine | Cysteïne/cystine | Methionine | Lysine | |
Varkensmeng-voeder | 4,1 n = 15 | 9,9 n = 17 | 7,0 n = 17 | 3,2 n = 13 |
Slachtkuiken-mengvoeder | 5,2 n = 16 | 8,8 n = 18 | 10,9 n = 18 | 5,4 n = 16 |
Eiwit-concentraat | 3,8 n = 16 | 12,3 n = 17 | 13,0 n = 17 | 3,0 n = 15 |
Voormengsel | 4,3 n = 16 | - | 6,9 n = 16 | 6,7 n = 16 |
n = aantal deelnemende laboratoria. | ||||
8. Gebruik van referentiematerialen
Of de methode op de juiste manier is toegepast dient te worden geverifieerd door herhaalde bepaling van gecertificeerde referentiematerialen, voor zover beschikbaar. Aanbevolen wordt de ijking uit te voeren met gecertificeerde aminozuurijkoplossingen.
9. Opmerkingen
- 9.1.
In verband met verschillen tussen aminozuuranalysatoren moeten de uiteindelijke concentraties van de ijkoplossingen van standaardaminozuren (zie punt 3.27.4 en punt 3.27.5) en van het hydrolysaat (zie punt 5.3.4) als richtsnoer worden beschouwd.
Het lineaire meetbereik van het apparaat moet voor alle aminozuren worden gecontroleerd.
De standaardoplossing wordt zodanig verdund met citraatbuffer dat pieken in het midden van het bereik worden verkregen.
- 9.2.
Indien HPLC-apparatuur wordt gebruikt voor de analyse van de hydrolysaten moeten de proefomstandigheden worden geoptimaliseerd overeenkomstig de aanbevelingen van de leverancier.
- 9.3.
Bij toepassing van de methode op mengvoeders en voormengsels die meer dan 1 % chloride bevatten (krachtvoer, minerale voeders, complementaire diervoeders) is het mogelijk dat voor methionine een te lage waarde wordt gemeten en is een speciale behandeling vereist.
10. Prestatiecriteria
Samenvoeging van de resultaten (behalve voor tyrosine) van de twee ringonderzoeken (die van 1990 zijn vermeld in punt 7 en die van 2005 zijn vervat in EN/ISO 13903) levert de volgende criteria voor herhaalbaarheid en reproduceerbaarheid op. De uit deze twee ringonderzoeken afgeleide waarden kunnen wellicht niet op andere dan de vermelde concentratiebereiken en matrices worden toegepast.
10.1. Herhaalbaarheid
Het verschil tussen de resultaten van twee bepalingen die op hetzelfde monster in hetzelfde laboratorium door dezelfde medewerker zijn uitgevoerd, mag niet groter zijn dan:
- —
6 % van het hoogste resultaat bij totale aminozuren bij glycine, alanine, lysine, proline, glumatinezuur, isoleucine en histidine.
- —
8 % van het hoogste resultaat bij totale aminozuren bij treonine, fenylalanine, methionine, asparaginezuur en leucine.
- —
10 % van het hoogste resultaat bij totale aminozuren bij arginine en valine.
- —
12 % van het hoogste resultaat bij totale aminozuren serine.
- —
15 % van het hoogste resultaat bij totale aminozuren cysteïne/cystine.
10.2. Reproduceerbaarheid
Het verschil tussen de resultaten van twee bepalingen die op hetzelfde monster in verschillende laboratoria en/of door verschillende medewerkers zijn uitgevoerd, mag niet groter zijn dan:
- —
15 % van het hoogste resultaat bij totale aminozuren bij glycine, arginine en treonine.
- —
20 % van het hoogste resultaat bij totale aminozuren bij lysine, proline, fenylalanine, methionine en asparaginezuur.
- —
22 % van het hoogste resultaat bij totale aminozuren bij glutaminezuur en leucine.
- —
27 % van het hoogste resultaat bij totale aminozuren arginine.
- —
32 % van het hoogste resultaat bij totale aminozuren isoleucine.
- —
35 % van het hoogste resultaat bij totale aminozuren bij valine en serine.
- —
40 % van het hoogste resultaat bij totale aminozuren histidine.
- —
50 % van het hoogste resultaat bij totale aminozuren cysteïne/cystine.
F. Bepaling van tryptofaan
Voor de bepaling van tryptofaan worden de volgende analysemethoden toegepast:
- —
EN ISO 13904 Diervoeders — Bepaling van het gehalte aan tryptofaan;
- —
de in de punten 1 tot en met 9 beschreven analysemethode.
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van de totale hoeveelheid tryptofaan en de hoeveelheid vrij tryptofaan in diervoeders. Zij maakt geen onderscheid tussen de D- en de L-vorm.
2. Beginsel
Voor de bepaling van de totale hoeveelheid tryptofaan wordt het monster onder basische condities gehydrolyseerd met een verzadigde bariumhydroxideoplossing en gedurende 20 uur tot 110 °C verhit. Na de hydrolyse wordt er een interne standaard toegevoegd.
Voor de bepaling van de hoeveelheid vrij tryptofaan wordt het monster onder licht zure condities geëxtraheerd in aanwezigheid van een interne standaard.
Het tryptofaan en de interne standaard in het hydrolysaat of extract worden bepaald door HPLC met fluorescentiedetectie.
3. Reagentia
- 3.1.
Er dient dubbel gedestilleerd water of water van gelijkwaardige kwaliteit te worden gebruikt (conductiviteit [amp]lt; 10 μS/cm).
- 3.2.
Standaardstof: tryptofaan (zuiverheid/gehalte ≥ 99 %), gedroogd onder vacuüm boven difosforpentaoxide.
- 3.3.
Interne standaard: α-methyltryptofaan (zuiverheid/gehalte ≥ 99 %), gedroogd onder vacuüm boven difosforpentaoxide.
- 3.4.
Bariumhydroxide-octahydraat (er dient op te worden toegezien dat Ba(OH)2·8H2O niet langdurig aan lucht wordt blootgesteld om de vorming van BaCO3 te voorkomen; dit zou de bepaling kunnen storen) (zie opmerking in punt 9.3).
- 3.5.
Natriumhydroxide.
- 3.6.
Orthofosforzuur, w = 85 % (m/m).
- 3.7.
Zoutzuur, ρ20 1,19 g/ml
- 3.8.
Methanol, HPLC-kwaliteit of gelijkwaardig.
- 3.9.
Lichtpetroleum, kooktraject 40–60 °C.
- 3.10.
Natriumhydroxideoplossing, c = 1 mol/l:
Los 40,0 g NaOH (punt 3.5) op in water en vul met water aan tot 1 liter (punt 3.1).
- 3.11.
Zoutzuur, c = 6 mol/l:
Neem 492 ml HCl (punt 3.7) en vul met water aan tot 1 liter.
- 3.12.
Zoutzuur, c = 1 mol/l:
Neem 82 ml HCl (punt 3.7) en vul met water aan tot 1 liter.
- 3.13.
Zoutzuur, c = 0,1 mol/l:
Neem 8,2 ml HCl (punt 3.7) en vul met water aan tot 1 liter.
- 3.14.
Orthofosforzuur, c = 0,5 mol/l:
Neem 34 ml orthofosforzuur (punt 3.6) en vul met water (punt 3.1) aan tot 1 liter.
- 3.15.
Geconcentreerde tryptofaanoplossing (punt 3.2), c = 2,50 μmol/ml:
Los 0,2553 g tryptofaan (punt 3.2) in een maatkolf van 500 ml op in zoutzuur (punt 3.13) en vul aan tot de streep met zoutzuur (punt 3.13). Gedurende maximaal vier weken houdbaar bij −18 °C.
- 3.16.
Geconcentreerde internestandaardoplossing, c = 2,50 μmol/ml:
Los 0,2728 g α-methyltryptofaan (punt 3.3) in een maatkolf van 500 ml op in zoutzuur (punt 3.13) en vul aan tot de streep met zoutzuur (punt 3.13). Gedurende maximaal vier weken houdbaar bij −18 °C.
- 3.17.
IJkstandaardoplossing van tryptofaan en interne standaard:
Neem 2,00 ml geconcentreerde tryptofaanoplossing (punt 3.15) en 2,00 ml geconcentreerde internestandaardoplossing (α-methyltryptofaan) (punt 3.16). Verdun met water (punt 3.1) en methanol (punt 3.8) tot ongeveer hetzelfde volume en ongeveer dezelfde methanolconcentratie (10–30 %) als het eindhydrolysaat.
Deze oplossing moet vóór gebruik vers worden bereid.
Bescherm tijdens de bereiding tegen direct zonlicht.
- 3.18.
Azijnzuur.
- 3.19.
1,1,1-Trichloor-2-methylpropaan-2-ol.
- 3.20.
Ethanolamine, m [amp]gt; 98 % (m/m).
- 3.21.
Oplossing van 1 g 1,1,1-trichloor-2-methylpropaan-2-ol (punt 3.19) in 100 ml methanol (punt 3.8).
- 3.22.
Mobiele fase voor HPLC: 3,00 g azijnzuur (punt 3.18) + 900 ml water (punt 3.1) 50,0 ml oplossing (punt 3.21) van 1,1,1-trichloor-2-methylpropaan-2-ol (punt 3.19) in methanol (punt 3.8) (1 g/100 ml). Breng de pH op 5,00 met ethanolamine (punt 3.20). Vul aan met water tot 1 000 ml (punt 3.1).
Apparatuur 4
- 4.1.
HPLC-apparatuur met een spectrofluorimetrische detector.
- 4.2.
HPLC-kolom: 125 mm × 4 mm, C18, vulling van 3 μm, of een gelijkwaardige kolom.
- 4.3.
pH-meter.
- 4.4.
Polypropyleenkolf, inhoud 125 ml, met brede hals en schroefdop.
- 4.5.
Membraanfilter, 0,45 μm.
- 4.6.
Autoclaaf 110 (± 2) °C, 1,4 (± 0,1) bar.
- 4.7.
Mechanisch schudapparaat of magneetroerder.
- 4.8.
Vortexmenger.
5. Werkwijze
5.1. Monstervoorbewerking
Het monster wordt gemalen tot de deeltjes een zeef met een maaswijdte van 0,5 mm passeren. Monsters met een hoge vochtigheidsgraad moeten ofwel aan lucht met een temperatuur van hoogstens 50 °C worden gedroogd, ofwel voorafgaand aan het malen worden gevriesdroogd. Monsters met een hoog vetgehalte dienen voorafgaand aan het malen te worden geëxtraheerd met petroleumether (punt 3.9).
5.2. Bepaling van de hoeveelheid vrij tryptofaan (extract)
Weeg een geschikte hoeveelheid (1–5 g) van het voorbewerkte monster (punt 5.1) tot op 1 mg nauwkeurig af in een erlenmeyer. Voeg 100,0 ml zoutzuur (punt 3.13) en 5,00 ml geconcentreerde internestandaardoplossing (punt 3.16) toe. Schud of meng gedurende 60 minuten met behulp van een schudapparaat of een magneetroerder (punt 4.7). Laat het bezinksel neerslaan en pipetteer 10,0 ml van de bovenstaande oplossing in een bekerglas. Voeg 5 ml orthofosforzuur (punt 3.14) toe. Breng de pH met natriumhydroxide (punt 3.10) op 3. Voeg voldoende methanol (punt 3.8) toe om een methanolconcentratie tussen 10 en 30 % in het eindvolume te verkrijgen. Breng over in een maatkolf met een geschikt volume en verdun met water tot een volume dat is vereist voor de chromatografie (bij benadering hetzelfde volume als de ijkstandaardoplossing (punt 3.17)).
Filtreer een paar ml van de oplossing door een membraanfilter van 0,45 μm (punt 4.5) vóór injectie in de HPLC-kolom. Ga verder met de chromatografiestap volgens 5.4.
Bescherm de standaardoplossing en extracten tegen direct zonlicht. Als het niet mogelijk is de extracten dezelfde dag te analyseren, kunnen ze gedurende maximaal drie dagen bij 5 °C worden bewaard.
5.3. Bepaling van de totale hoeveelheid tryptofaan (hydrolysaat)
Weeg 0,1–1 g van het voorbewerkte monster (punt 5.1) tot op 0,2 mg nauwkeurig af in de polypropyleenmaatkolf (punt 4.4). De ingewogen hoeveelheid monster moet een stikstofgehalte hebben van ongeveer 10 mg. Voeg 8,4 g bariumhydroxide-octahydraat (punt 3.4) en 10 ml water toe. Meng in een wervelmenger (punt 4.8) of magneetroerder (punt 4.7). Laat de magneet met tefloncoating in het mengsel zitten. Spoel de wanden van het vat af met 4 ml water. Plaats de schroefdop erop en sluit de maatkolf losjes. Breng over in een autoclaaf (punt 4.6) met kokend water en laat het geheel 30–60 minuten stomen. Sluit de autoclaaf en autoclaveer gedurende 20 uur bij 110 (± 2) °C.
Breng de temperatuur terug tot iets onder 100 °C alvorens het drukvat te openen. Voeg 30 ml water op kamertemperatuur aan het warme mengsel toe om uitkristalliseren van Ba(OH)2·8H2O tegen te gaan. Schud of roer voorzichtig. Voeg 2,00 ml geconcentreerde internestandaardoplossing (α-methyltryptofaan) (punt 3.16) toe. Laat de vaten gedurende 15 minuten in een water/ijsbad afkoelen.
Voeg 5 ml orthofosforzuur (punt 3.14) toe. Laat het vat in het koelbad, neutraliseer al roerend met zoutzuur (punt 3.11) en breng de pH met zoutzuur (punt 3.12) op 3,0. Voeg voldoende methanol toe om een methanolconcentratie tussen 10 en 30 % in het eindvolume te verkrijgen. Breng over in een maatkolf met een geschikt volume en verdun met water tot het volume dat voor de chromatografie vereist is (bv. 100 ml). Toevoeging van methanol mag geen neerslag veroorzaken.
Filtreer een paar ml van de oplossing door een membraanfilter van 0,45 μm (punt 4.5) vóór injectie in de HPLC-kolom. Ga verder met de chromatografiestap volgens 5.4.
Bescherm de standaardoplossing en de hydrolysaten tegen direct zonlicht. Als het niet mogelijk is de hydrolysaten dezelfde dag te analyseren, kunnen ze gedurende maximaal drie dagen bij 5 °C worden bewaard.
5.4. HPLC-bepaling
De volgende condities voor isocratische elutie worden als leidraad aangegeven; er mogen andere parameters worden gebruikt mits hiermee gelijkwaardige resultaten worden verkregen (zie ook de opmerkingen in punt 9.1 en 9.2):
HPLC-kolom (punt 4.2): | 125 mm × 4 mm, C18, vulling van 3 μm, of een gelijkwaardige kolom. |
kolomtemperatuur: | kamertemperatuur; |
mobiele fase (punt 3.22): | 3,00 g azijnzuur (punt 3.18) + 900 ml water (punt 3.1) 50,0 ml oplossing (punt 3.21) van 1,1,1-trichloor-2-methylpropaan-2-ol (punt 3.19) in methanol (punt 3.8) (1 g/100 ml). Breng de pH op 5,00 met ethanolamine (punt 3.20). Vul aan tot 1 000 ml met water (punt 3.1); |
elutiesnelheid: | 1 ml/min. |
benodigde tijd: | ongeveer 34 minuten; |
detectiegolflengte: | excitatie: 280 nm, emissie: 356 nm; |
injectievolume | 20 μl. |
6. Berekening van de resultaten
De hoeveelheid tryptofaan (X) in g per 100 g monster wordt berekend.
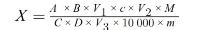
A = | piekoppervlakte van interne standaard, ijkstandaardoplossing (punt 3.17); |
B = | piekoppervlakte van tryptofaan, extract (punt 5.2) of hydrolysaat (punt 5.3); |
V1 = | volume in ml (2 ml) van geconcentreerde tryptofaanoplossing (punt 3.15), toegevoegd aan de ijkoplossing (punt 3.17); |
c = | concentratie in μmol/ml (= 2,50) van geconcentreerde tryptofaanoplossing (punt 3.15), toegevoegd aan de ijkoplossing (punt 3.17); |
V2 = | volume in ml van geconcentreerde internestandaardoplossing (punt 3.16), toegevoegd bij de extractie (punt 5.2) (= 5,00 ml) of aan het hydrolysaat (punt 5.3) (= 2,00 ml); |
C = | pekoppervlakte van interne standaard, extract (punt 5.2) of hydrolysaat (punt 5.3); |
D = | piekoppervlakte van tryptofaan, ijkstandaardoplossing (punt 3.17); |
V3 = | volume in ml (= 2,00 ml) van geconcentreerde internestandaardoplossing (punt 3.16) toegevoegd aan de ijkstandaardoplossing (punt 3.17); |
m = | massa van het analysemonster in g (gecorrigeerd tot de oorspronkelijke massa indien gedroogd en/of ontvet); |
M = | molecuulgewicht van tryptofaan (= 204,23 g/mol). |
7. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer dan 10 % van het hoogste resultaat bedragen.
8. Resultaten van een ringonderzoek
In EU-verband is een ringonderzoek verricht (de vierde vergelijkende studie) waarbij drie monsters werden geanalyseerd door maximaal twaalf laboratoria om de hydrolysemethode te certificeren. De analyses werden voor elk monster vijfmaal uitgevoerd. De resultaten staan in de volgende tabel.
monster 1 varkensvoer | monster 2 varkensvoer met toegevoegd L-tryptofaan | monster 3 varkenskrachtvoer | |
|---|---|---|---|
L | 12 | 12 | 12 |
n | 50 | 55 | 50 |
Gemiddelde [g/kg] | 2,42 | 3,40 | 4,22 |
sr [g/kg] | 0,05 | 0,05 | 0,08 |
r [g/kg] | 0,14 | 0,14 | 0,22 |
CVr [%] | 1,9 | 1,6 | 1,9 |
SR [g/kg] | 0,15 | 0,20 | 0,09 |
R [g/kg] | 0,42 | 0,56 | 0,25 |
CVR [%] | 6,3 | 6,0 | 2,2 |
L = | aantal laboratoria die resultaten hebben ingestuurd; | ||
n = | aantal afzonderlijke resultaten, na eliminatie van uitschieters (m.b.v. Cochran- en Dixon-toets); | ||
sr = | standaardafwijking van de herhaalbaarheid; | ||
SR = | standaardafwijking van de reproduceerbaarheid; | ||
r = | herhaalbaarheid; | ||
R = | reproduceerbaarheid; | ||
CVr = | variatiecoëfficiënt van de herhaalbaarheid, in %; | ||
CVR = | variatiecoëfficiënt van de reproduceerbaarheid, in %. | ||
Bij een ander ringonderzoek in EU-verband (de derde vergelijkende studie) werden twee monsters geanalyseerd door maximaal 13 laboratoria om de methode voor extractie van vrij tryptofaan te certificeren. De analyses werden voor elk monster vijfmaal uitgevoerd. De resultaten staan in de volgende tabel.
monster 4 mengsel van tarwe en soja | monster 5 mengsel van tarwe en soja (= monster 4) met toegevoegd tryptofaan (0,457 g/kg) | |
|---|---|---|
L | 12 | 12 |
n | 55 | 60 |
Gemiddelde [g/kg] | 0,391 | 0,931 |
sr [g/kg] | 0,005 | 0,012 |
r [g/kg] | 0,014 | 0,034 |
CVr [%] | 1,34 | 1,34 |
SR [g/kg] | 0,018 | 0,048 |
R [g/kg] | 0,050 | 0,134 |
CVR [%] | 4,71 | 5,11 |
L = | aantal laboratoria die resultaten hebben ingestuurd; | |
n = | aantal afzonderlijke resultaten, na eliminatie van uitschieters (m.b.v. Cochran- en Dixon-toets); | |
sr = | standaardafwijking van de herhaalbaarheid; | |
SR = | standaardafwijking van de reproduceerbaarheid; | |
r = | herhaalbaarheid; | |
R = | reproduceerbaarheid; | |
CVr = | variatiecoëfficiënt van de herhaalbaarheid, in %; | |
CVR = | variatiecoëfficiënt van de reproduceerbaarheid, in %. | |
Bij een ander ringonderzoek in EU-verband werden vier monsters geanalyseerd door maximaal zeven laboratoria met als doel een tryptofaancertificatie voor hydrolyse. De resultaten staan in onderstaande tabel. De analyses werden voor elk monster vijfmaal herhaald.
monster 1 mengvoer voor varkens (CRM 117) | monster 2 vismeel met laag vetgehalte (CRM 118) | monster 3 sojameel (CRM 119) | monster 4 mageremelkpoeder (CRM 120) | |
|---|---|---|---|---|
L | 7 | 7 | 7 | 7 |
n | 25 | 30 | 30 | 30 |
Gemiddelde [g/kg] | 2,064 | 8,801 | 6,882 | 5,236 |
sr [g/kg] | 0,021 | 0,101 | 0,089 | 0,040 |
r [g/kg] | 0,059 | 0,283 | 0,249 | 0,112 |
CVr [%] | 1,04 | 1,15 | 1,30 | 0,76 |
SR [g/kg] | 0,031 | 0,413 | 0,283 | 0,221 |
R [g/kg] | 0,087 | 1,156 | 0,792 | 0,619 |
CVR [%] | 1,48 | 4,69 | 4,11 | 4,22 |
L = | aantal laboratoria die resultaten hebben ingestuurd; | |||
n = | aantal afzonderlijke resultaten, na eliminatie van uitschieters (m.b.v. Cochran- en Dixon-toets); | |||
sr = | standaardafwijking van de herhaalbaarheid; | |||
SR = | standaardafwijking van de reproduceerbaarheid; | |||
r = | herhaalbaarheid; | |||
R = | reproduceerbaarheid; | |||
CVr = | variatiecoëfficiënt van de herhaalbaarheid, in %; | |||
CVR = | variatiecoëfficiënt van de reproduceerbaarheid, in %. | |||
9. Opmerkingen
- 9.1.
Onder de volgende speciale chromatografische condities kan een betere scheiding tussen tryptofaan en α-methyltryptofaan worden verkregen.
Isocratische elutie met gradiëntreiniging van de kolom:
HPLC-kolom:
125 mm × 4 mm, C18, vulling van 5 μm, of een gelijkwaardige kolom.
kolomtemperatuur:
32 °C
mobiele fase:
A: 0,01 mol/l KH2PO4/methanol, 95 + 5 (V+V)
B: Methanol
gradiëntprogramma:
0 min. 100 % A
0 % B
15 min. 100 % A
0 % B
17 min. 60 % A
40 % B
19 min. 60 % A
40 % B
21 min. 100 % A
0 % B
33 min. 100 % A
0 % B
elutiesnelheid:
1,2 ml/min
benodigde tijd:
ongeveer 33 minuten.
- 9.2.
De chromatografie varieert afhankelijk van het type HPLC en kolomvullingsmateriaal. Met het gekozen systeem moet een basislijnscheiding tussen tryptofaan en de interne standaard tot stand gebracht kunnen worden. Verder is het van belang dat afbraakproducten goed van tryptofaan en de interne standaard worden gescheiden. Er moeten hydrolysaten zonder interne standaard worden gebruikt om de basislijn onder de interne standaard te controleren op verontreinigingen. Het is van belang dat de uitvoeringstijd lang genoeg is voor de elutie van alle afbraakproducten, daar anders traag eluerende pieken de volgende chromatografische bepalingen kunnen storen.
Binnen het bepalingsgebied moet het chromatografiesysteem een lineaire respons geven. De lineaire respons moet worden gemeten bij een constante (de normale) concentratie van de interne standaard en bij verschillende tryptofaanconcentraties. Het is van belang dat de piekgrootte zowel voor tryptofaan als voor de interne standaard binnen het lineaire gebied van het HPLC/fluorescentiesysteem ligt. Als de piek van tryptofaan en/of de interne standaard te klein of te groot is, dient de analyse te worden herhaald met een andere monstergrootte en/of een gewijzigd eindvolume.
- 9.3.Bariumhydroxide
De oplosbaarheid van bariumhydroxide neemt mettertijd steeds verder af. Dit resulteert in een troebele oplossing voor de HPLC-bepaling, die lage waarden voor tryptofaan kan opleveren.
G. Bepaling van ruw vet
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methoden voor de bepaling van het gehalte aan ruw vet in diervoeder.
Naargelang van de aard en samenstelling van het diervoeder en de reden van de analyse moet één van de twee hieronder beschreven methoden worden gevolgd.
Voor de bepaling van ruw vet in oliehoudende zaden en vruchten en in diervoeders waarin het gehalte aan ruw vet hoger is dan 15 %, moet de extractie plaatsvinden volgens methode A en vervolgens nogmaals volgens methode B (punt 5.3).
1.1. Methode A — rechtstreeks extraheerbaar ruw vet
Deze methode geldt voor voedermiddelen van plantaardige oorsprong, met uitzondering van die waarvoor methode B kan worden toegepast.
1.2. Methode B — totaal ruw vet
Deze methode geldt voor voedermiddelen van dierlijke oorsprong en voor alle mengvoeders. Zij moet worden gebruikt voor alle diervoeders waaruit het ruwe vet niet volledig kan worden geëxtraheerd zonder voorafgaande hydrolyse; dit geldt bijvoorbeeld voor glutenproducten, gist, aardappeleiwitten en producten die behandelingen als extrusie, vervlokking en verhitting ondergaan.
1.3. Interpretatie van de resultaten
In alle gevallen waarin met methode B als uitkomst een hoger percentage wordt geconstateerd dan met methode A, wordt de uitkomst van methode B als de juiste waarde beschouwd.
2. Beginsel
2.1. Methode A
Het ruwe vet wordt geëxtraheerd met petroleumether. Het oplosmiddel wordt afgedestilleerd en het residu gedroogd en gewogen.
2.2. Methode B
Het monster wordt bij verhoogde temperatuur met zoutzuur behandeld. Het mengsel wordt afgekoeld en gefiltreerd. Het residu wordt gewassen en gedroogd en verder volgens methode A geanalyseerd.
3. Reagentia
- 3.1.
Petroleumether, kooktraject: 40 – 60 °C. Het broomgetal moet kleiner dan 1 zijn en het verdampingsresidu kleiner dan 2 mg/100 ml.
- 3.2.
Natriumsulfaat, watervrij.
- 3.3.
Zoutzuur, c = 3 mol/l.
- 3.4.
Filtermateriaal, bijvoorbeeld kiezelgoer, Hyflo-supercel.
4. Apparatuur
- 4.1.
Extractieapparaat. Indien het apparaat werkt met een hevel (Soxhlet) moet de refluxsnelheid zodanig zijn dat ongeveer tien cyclussen per uur worden doorlopen; bij apparaten zonder hevel moet de refluxsnelheid ongeveer 10 ml per minuut zijn.
- 4.2.
Extractiehulzen die geen in petroleumether oplosbaar materiaal bevatten en een aan de eisen van 4.1 aangepaste porositeit hebben.
- 4.3.
Droogstof, hetzij een vacuümstoof ingesteld op 75 °C ± 3 °C of een oven met luchtcirculatie ingesteld op 100 °C ± 3 °C.
5. Werkwijze
5.1. Methode A (zie punt 8.1)
Weeg 5 g van het monster tot op 1 mg nauwkeurig af, breng dit in een extractiehuls (punt 4.2) en dek het af met ontvette watten.
Breng de huls in een extractieapparaat (punt 4.1) en extraheer gedurende 6 uur met petroleumether (punt 3.1). Vang het extract op in een van enkele stukjes puimsteen voorzien, gedroogd en getarreerd kolfje (6).
Destilleer het oplosmiddel af en droog het residu vervolgens gedurende 1,5 uur in de droogstoof (punt 4.3). Laat afkoelen in een exsiccator en weeg. Droog nogmaals gedurende 30 minuten om zeker te zijn dat de massa van het vet constant is (het massaverlies tussen de twee wegingen mag niet meer bedragen dan 1 mg).
5.2. Methode B
Weeg 2,5 g van het monster tot op 1 mg nauwkeurig af (punt 8.2), breng het in een bekerglas van 400 ml of een erlenmeyer van 300 ml en voeg 100 ml zoutzuur (punt 3.3) en enkele stukjes puimsteen toe. Bedek het bekerglas met een horlogeglas of sluit de erlenmeyer aan op een terugvloeikoeler. Breng het mengsel op een kleine vlam of op een kookplaat net aan de kook en laat het gedurende 1 uur zachtjes koken. Draag er zorg voor dat de stof niet aan de wand gaat vastzitten.
Koel af en voeg zoveel filtermateriaal (punt 3.4) toe dat bij het filtreren geen vetverlies optreedt. Filtreer door nat, vetvrij dubbel filtreerpapier. Was het residu met koud water totdat het waswater neutraal is. Controleer of het filtraat vet bevat. Indien in het filtraat vet aanwezig is, moet het monster vóór de hydrolyse geëxtraheerd worden met petroleumether, volgens methode A.
Breng het dubbelfilter met residu op een horlogeglas en droog het gedurende 1,5 uur in een droogstoof (punt 4.3) op 100 °C ± 3 °C.
Breng het dubbelfilter met gedroogd residu in een extractiehuls (punt 4.2) en dek het af met ontvette watten. Breng de huls in een extractieapparaat (punt 4.1) en handel verder als beschreven in punt 5.1, tweede en derde alinea.
5.3. Extractie volgens methode A en herhaalde extractie volgens methode B.
Voor de bepaling van ruw vet in oliehoudende zaden en vruchten en in diervoeders waarin het gehalte aan ruw vet hoger is dan 15 %, moet de extractie plaatsvinden volgens methode A en vervolgens nogmaals volgens methode B.
Dit wil zeggen dat het residu of een deel van het residu na extractie met petroleumether (methode A) opnieuw wordt geëxtraheerd met zoutzuur (methode B). Het gehalte aan ruw vet is de som van de resultaten van de methoden A en B.
6. Weergave van de resultaten
Druk de massa van het residu uit als percentage van het monster.
7. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer bedragen dan:
- —
0,2 % in absolute waarde, voor ruwvetgehalten lager dan 5 %;
- —
4,0 % van het hoogste resultaat voor gehalten tussen 5 en 10 %,
- —
0,4 % in absolute waarde, voor gehalten boven 10 %.
8. Opmerkingen
- 8.1.
Producten met een hoog vetgehalte, die moeilijk fijn te maken zijn, of waarvan moeilijk een homogeen analysemonster kan worden getrokken, worden als volgt behandeld.
Weeg 20 g van het monster op 1 mg nauwkeurig af en meng dit met 10 g of meer watervrij natriumsulfaat (punt 3.2). Extraheer het mengsel met petroleumether (punt 3.1) zoals beschreven in punt 5.1. Breng het volume van het extract met petroleumether (punt 3.1) op 500 ml en meng. Breng 50 ml van deze oplossing in een van enkele stukjes puimsteen voorziene, gedroogde en getarreerde kolf. Destilleer het oplosmiddel af, droog het residu en handel verder als beschreven in punt 5.1, laatste alinea.
Verwijder het oplosmiddel uit het extractieresidu in de huls en maak het residu dan fijn tot een deeltjesgrootte van 1 mm. Breng het residu weer in de huls (geen natriumsulfaat toevoegen) en handel verder als beschreven in punt 5.1, tweede en derde alinea.
Bereken het vetgehalte als percentage van het monster met de volgende formule:
(10m1 + m2) × 5
waarbij:
m1 =
massa in g van het residu na de eerste extractie (aliquot deel van het extract);
m2 =
massa in g van het residu na de tweede extractie.
- 8.2.
Bij sommige producten (bv. vetarme producten) kan een groter testmonster worden gebruikt.
- 8.3.
Bij voeder voor gezelschapsdieren dat een hoog vochtgehalte heeft, kan het nodig zijn om vóór hydrolyse en extractie via methode B watervrij natriumsulfaat toe te voegen.
- 8.4.
Wat punt 5.2 betreft kan het doeltreffender zijn om warm in plaats van koud water te gebruiken om het residu, na filtrering, te wassen.
- 8.5.
Het kan nodig zijn sommige diervoeders langer dan anderhalf uur te drogen. Te veel drogen moet evenwel worden voorkomen aangezien dit tot lage resultaten kan leiden. Er mag gebruik worden gemaakt van een microgolfoven.
H. Bepaling van ruwe celstof
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan in zuur en basisch milieu onoplosbare, vetvrije organische bestanddelen in diervoeders, standaard aangeduid als ruwe celstof.
De methode is niet van toepassing in het geval van houtcellulose en plantaardige koolstof (te fijne deeltjes).
2. Beginsel
Het monster wordt, zo nodig na ontvetten, achtereenvolgens behandeld met kokende oplossingen van zwavelzuur en kaliumhydroxide van bepaalde concentraties. Het residu wordt afgefiltreerd op een filter van gesinterd glas, gewassen, gedroogd, gewogen en bij een temperatuur van 475 tot 500 °C gegloeid. Het massaverlies als gevolg van het gloeien is een maat voor het gehalte aan ruwe celstof in het testmonster.
3. Reagentia
- 3.1.
Zwavelzuur, c = 0,13 mol/l.
- 3.2.
Antischuimmiddel (bv. n-octanol).
- 3.3.
Filtreerhulpmiddel (Celite 545 of gelijkwaardig), gedurende vier uur bij 500 °C verhit (punt 8.6).
- 3.4.
Aceton.
- 3.5.
Petroleumether, kooktraject: 40–60 °C.
- 3.6.
Zoutzuur, c = 0,5 mol/l.
- 3.7.
Kaliumhydroxideoplossing, c = 0,23 mol/l.
4. Apparatuur
- 4.1.
Verwarmingstoestel voor ontsluiting met zwavelzuur en kaliumhydroxideoplossing, voorzien van een houder voor de filterkroes (punt 4.2), een afvoerbuis met kraan voor de vloeistofafvoer en de vacuümaansluiting, eventueel met perslucht. Het toestel moet vóór gebruik dagelijks 5 minuten met kokend water worden voorverwarmd.
- 4.2.
Glasfilterkroes met filter van gesinterd glas met poriën van 40–90 μm. Voor het eerste gebruik wordt de filterkroes enkele minuten op 500 °C verhit en afgekoeld (punt 8.6).
- 4.3.
Kookcilinder met een inhoud van ten minste 270 ml met terugvloeikoeler.
- 4.4.
Droogstoof met thermostaat.
- 4.5.
Moffeloven met thermostaat.
- 4.6.
Extractietoestel, voorzien van een houder voor de filterkroes (punt 4.2) en een afvoerbuis met kraan voor de vacuümaansluiting en de vloeistofafvoer.
- 4.7.
Verbindingsringen voor de aansluiting tussen het verwarmingstoestel (punt 4.1), de filterkroes (punt 4.2) en de kookcilinder (punt 4.3) en voor de aansluiting tussen het extractietoestel (punt 4.6) en de filterkroes.
5. Werkwijze
Weeg 1 g van het bereide monster tot op 1 mg nauwkeurig af, breng het in de filterkroes (punt 4.2) (zie opmerkingen onder 9.1, 9.2 en 9.3) en voeg 1 g filtreerhulpmiddel (punt 3.3) toe.
Sluit het verwarmingstoestel (punt 4.1) en de filterkroes (punt 4.2) op elkaar aan en verbind vervolgens de kookcilinder (punt 4.3) met de filterkroes. Breng in de kookcilinder met de filterkroes 150 ml tot het kookpunt verhit zwavelzuur (punt 3.1) en voeg zo nodig enkele druppels antischuimmiddel (punt 3.2) toe.
Breng de vloeistof in 5 ± 2 minuten aan de kook en kook krachtig gedurende precies 30 minuten.
Open de kraan van de afvoerbuis (punt 4.1) en filtreer het zwavelzuur onder vacuüm door de filterkroes. Was het residu op het filter driemaal met telkens 30 ml kokend water. Na elke wasstap dient het residu te worden drooggezogen.
Sluit de kraan van de afvoerbuis en breng in de kookcilinder met filterkroes 150 ml tot het kookpunt verhitte kaliumhydroxideoplossing (punt 3.7) en enkele druppels antischuimmiddel (punt 3.2). Breng de vloeistof in 5 ± 2 minuten aan de kook en kook krachtig gedurende precies 30 minuten. Filtreer en was het residu op dezelfde wijze als na de behandeling met zwavelzuur.
Zuig het residu na de laatste wasbehandeling droog en sluit de filterkroes met inhoud aan op het extractietoestel (punt 4.6). Was het residu onder vacuüm driemaal met telkens 25 ml aceton (punt 3.4). Na elke wasstap dient het residu te worden drooggezogen.
Droog de filterkroes in de droogstoof bij 130 °C tot constante massa. Koel de kroes na elke droging in de exsiccator af en weeg snel. Plaats de filterkroes vervolgens in een moffeloven en veras de inhoud ten minste 30 minuten bij 475–500 °C tot constante massa (het massaverlies tussen twee opeenvolgende wegingen mag niet meer dan 2 mg zijn).
Koel de filterkroes na elke verassing eerst af in de moffeloven en vervolgens in de exsiccator en weeg daarna.
Verricht op gelijke wijze een blancobepaling zonder monster. Het massaverlies als gevolg van het verassen mag niet meer dan 4 mg bedragen.
6. Berekening van de resultaten
Bereken het gehalte aan ruwe celstof als percentage van het monster met de volgende formule:
X = (m0 − m1) × 100 / m
waarbij:
m = | hoeveelheid monster in g; |
m0 = | massaverlies na verassen bij de bepaling met het analysemonster, in g; |
m1 = | massaverlies na verassen bij de blancobepaling, in g. |
7. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer bedragen dan:
- —
0,6 % absoluut bij gehalten aan ruwe celstof van minder dan 10 %;
- —
6 % van het hoogste resultaat, bij gehalten aan ruwe celstof van 10 % of meer.
8. Reproduceerbaarheid
Het verschil tussen de resultaten van twee bepalingen die op hetzelfde monster in verschillende laboratoria zijn uitgevoerd, mag niet meer bedragen dan:
- —
1,0 % absoluut bij gehalten aan ruwe celstof van minder dan 10 %;
- —
10 % van het hoogste resultaat, bij gehalten aan ruwe celstof van 10 % of meer.
9. Opmerkingen
- 9.1.
Diervoeders die meer dan 10 % ruw vet bevatten, moeten voorafgaande aan de bepaling worden ontvet met petroleumether (punt 3.5). Sluit de filterkroes (punt 4.2) met het ingewogen monster aan op het extractietoestel (punt 4.6) en was onder vacuüm driemaal met telkens 30 ml petroleumether. Zuig het monster droog, sluit de filterkroes aan op het verwarmingstoestel (punt 4.1) en voer de bepaling uit zoals beschreven in punt 5.
- 9.2.
Diervoeders die niet direct met petroleumether (punt 3.5) extraheerbare vetten bevatten, moeten zoals aangegeven in punt 8.1 worden ontvet en vervolgens na opkoken met zwavelzuur nogmaals worden ontvet. Sluit na opkoken met zwavelzuur en daaropvolgend wassen de filterkroes met inhoud aan op het extractietoestel (punt 4.6) en was driemaal met telkens 30 ml aceton, gevolgd door driemaal wassen met telkens 30 ml petroleumether. Zuig het filter droog onder vacuüm en vervolg de bepaling zoals beschreven bij punt 5, te beginnen met de behandeling met kaliumhydroxideoplossing.
- 9.3.
Diervoeders die meer dan 5 % carbonaat, uitgedrukt als calciumcarbonaat, bevatten, worden als volgt behandeld. Sluit de filterkroes (punt 4.2) met het ingewogen monster aan op het verwarmingstoestel (punt 4.1). Was het monster driemaal met 30 ml zoutzuur (punt 3.6). Wacht na elke toevoeging van zoutzuur ongeveer een minuut voordat het monster wordt afgefiltreerd. Was eenmaal met 30 ml water en voer de bepaling verder uit zoals beschreven bij punt 5.
- 9.4.
Indien voor meervoudige bepalingen uitgeruste apparatuur wordt gebruikt (met een aantal aan hetzelfde verwarmingstoestel aangesloten filterkroezen), mogen in dezelfde reeks geen twee bepalingen van hetzelfde monster uitgevoerd worden.
- 9.5.
Wanneer de zure of basische oplossingen na opkoken moeilijk te filtreren zijn, moet perslucht door de afvoerbuis van het verwarmingstoestel worden geblazen, waarna het filtreren wordt voortgezet.
- 9.6.
Met het oog op de levensduur van de glasfilterkroezen mag de verassingstemperatuur niet hoger dan 500 °C zijn. Bij het verhitten en afkoelen moeten temperatuurschokken worden vermeden.
I. Bepaling van suikers
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan reducerende suikers en aan suikers totaal na inversie, uitgedrukt als glucose of eventueel, na vermenigvuldigen met de factor 0,95, als sacharose. De methode is toepasbaar voor mengvoeders. Voor andere diervoeders dienen bijzondere werkwijzen in acht te worden genomen. Het gehalte aan lactose moet eventueel afzonderlijk bepaald worden en bij de berekening moet met dat resultaat rekening gehouden worden.
Deze methode moet worden gebruikt voor de bepaling van het suikergehalte voor gebruik bij de berekening van de energiewaarde van het diervoeder.
Indien het suikergehalte voor andere doeleinden moet worden bepaald, kunnen andere analysemethoden worden gebruikt.
2. Beginsel
De suikers worden in verdunde ethanol opgelost; de oplossing wordt met Carrez I- en Carrez II-oplossing geklaard. Na het afdampen van de ethanol worden — voor en na inversie — de bepalingen uitgevoerd volgens de methode Luff-Schoorl.
3. Reagentia
- 3.1.
Ethanol 40 % (V/V), d = 0,948 g/ml bij 20 °C, geneutraliseerd ten opzichte van fenolftaleïne.
- 3.2.
Carrez I-oplossing: los 21,9 g zinkacetaat, Zn(CH3COO)2·2H2O, en 3 g ijsazijn op in water. Vul met water aan tot 100 ml.
- 3.3.
Carrez II-oplossing: los 10,6 g kaliumhexacyanoferraat(II), K4Fe(CN)63H2O, op in water. Vul met water aan tot 100 ml.
- 3.4.
Methyloranje, oplossing van 0,1 % (m/V).
- 3.5.
Zoutzuur 4 mol/l.
- 3.6.
Zoutzuur 0,1 mol/l.
- 3.7.
Natriumhydroxideoplossing 0,1 mol/l.
- 3.8.
Luff-Schoorl-reagens:
Voeg, onder voorzichtig omzwenken, de citroenzuuroplossing (punt 3.8.2) bij de natriumcarbonaatoplossing (punt 3.8.3). Voeg daarna toe de kopersulfaatoplossing (punt 3.8.1) en vul aan met water tot 1 liter. Laat een nacht staan en filtreer.
Controleer de concentraties in het aldus verkregen reagens (Cu 0,05 mol/l, Na2CO3 1 mol/l), zie punt 5.4, laatste alinea. De pH van de oplossing moet ongeveer 9,4 zijn.
- 3.8.1.
Kopersulfaatoplossing: los 25 g kopersulfaat, CuSO4·5H2O, vrij van ijzer, op in 100 ml water.
- 3.8.2.
Citroenzuuroplossing: los op 50 g citroenzuur p.a., C6H8O7•H2O, in 50 ml water.
- 3.8.3.
Natriumcarbonaatoplossing: los 143,8 g watervrij natriumcarbonaat op in ongeveer 300 ml warm water. Laat afkoelen.
- 3.9.
Natriumthiosulfaatoplossing 0,1 mol/l.
- 3.10.
Zetmeeloplossing: voeg aan 1 liter kokend water een suspensie van 5 g oplosbaar zetmeel in 30 ml water toe en houd 3 minuten aan de kook; laat vervolgens afkoelen en voeg eventueel 10 mg kwik(II)jodide toe als conserveermiddel.
- 3.11.
Zwavelzuur 3 mol/l.
- 3.12.
Kaliumjodideoplossing 30 % (m/V).
- 3.13.
Puimsteenkorrels, met zoutzuur uitgekookt, met water gewassen en gedroogd.
- 3.14.
3-Methylbutaan-l-ol.
4. Apparatuur
Roteerapparaat met ongeveer 35 à 40 omwentelingen per minuut.
5. Werkwijze
5.1. Extractie van het monster
Breng 2,5 g van het monster, tot op 1 mg nauwkeurig gewogen, in een maatkolf van 250 ml. Voeg 200 ml ethanol (punt 3.1) toe en laat de kolf gedurende 1 uur roteren. Voeg 5 ml Carrez I-oplossing (punt 3.2) toe en schud gedurende ongeveer 30 seconden. Voeg vervolgens 5 ml Carrez II-oplossing (punt 3.3) toe en schud gedurende 1 minuut. Vul aan tot de streep met ethanol (punt 3.1), meng en filtreer. Neem 200 ml van het filtraat en damp in tot op ongeveer de helft van het volume, teneinde het grootste gedeelte van de ethanol te verwijderen. Breng het restant kwantitatief met heet water over in een maatkolf van 200 ml, koel af, vul aan tot de streep met water, meng en filtreer zo nodig. Gebruik deze oplossing voor de bepaling van reducerende suikers en voor de bepaling van suikers totaal na inversie.
5.2. Bepaling van reducerende suikers
Pipetteer een hoeveelheid van ten hoogste 25 ml van de oplossing af, die minder dan 60 mg reducerende suikers, uitgedrukt als glucose, bevat. Vul zo nodig met gedestilleerd water aan tot 25 ml en bepaal het gehalte aan reducerende suikers volgens Luff-Schoorl. Druk het resultaat uit als percentage glucose.
5.3. Bepaling van totaal suikers na inversie
Pipetteer 50 ml van de oplossing in een maatkolf van 100 ml; voeg enkele druppels methyloranje (punt 3.4) toe en voeg vervolgens, voorzichtig en onder voortdurend omzwenken, zoutzuur (punt 3.5) toe totdat een duidelijke omslag naar rood verkregen is. Voeg dan 15 ml zoutzuur (punt 3.6) toe en plaats de kolf gedurende 30 minuten in een bad met flink kokend water. Koel snel af tot ongeveer 20 °C en voeg 15 ml natriumhydroxideoplossing (punt 3.7) toe. Vul aan met water tot 100 ml en meng goed. Pipetteer een hoeveelheid van ten hoogste 25 ml, die minder dan 60 mg reducerende suikers, uitgedrukt als glucose, bevat. Vul zo nodig met gedestilleerd water aan tot 25 ml en bepaal het gehalte aan reducerende suikers volgens Luff-Schoorl. Druk het resultaat uit als percentage glucose, of eventueel sacharose door vermenigvuldigen met de factor 0,95.
5.4. Titratie volgens Luff-Schoorl
Pipetteer 25 ml Luff-Schoorl-reagens (punt 3.8) in een erlenmeyer van 300 ml en voeg vervolgens precies 25 ml van de geklaarde suikeroplossing toe. Verhit na toevoeging van twee puimsteenkorrels (punt 3.13) onder omzwenken uit de hand boven een vrije vlam van matige hoogte, zodanig dat de vloeistof in ongeveer 2 minuten kookt. Plaats daarna de erlenmeyer onmiddellijk op een draadgaas met een asbestplaat met een opening van ongeveer 6 cm diameter; steek van te voren onder het draadgaas een vlam aan en regel deze zodanig dat alleen de bodem van de erlenmeyer verwarmd wordt. Verbind de erlenmeyer met een terugvloeikoeler. Laat vanaf dit moment precies 10 minuten koken, koel dan onmiddellijk af in koud water en titreer na 5 minuten als volgt.
Voeg aan de vloeistof 10 ml kaliumjodideoplossing (punt 3.12) toe en onmiddellijk daarna voorzichtig (wegens het sterke schuimen) 25 ml zwavelzuur (punt 3.11). Titreer dan met natriumthiosulfaatoplossing (punt 3.9) tot roomgeel, voeg de zetmeeloplossing (punt 3.10) als indicator toe en voltooi de titratie.
Verricht eenzelfde titratie in een mengsel van precies 25 ml Luff-Schoorl-reagens (punt 3.8) en 25 ml water na toevoeging van 10 ml kaliumjodideoplossing (punt 3.12) en 25 ml zwavelzuur (punt 3.11), maar nu zonder verwarmen.
6. Berekening van de resultaten
Bepaal aan de hand van de onderstaande tabel de hoeveelheid glucose in mg die overeenkomt met het verschil van de beide titratie-uitkomsten, uitgedrukt in ml natriumthiosulfaatoplossing 0,1 mol/l. Druk het resultaat uit als percentage van het monster.
7. Bijzondere werkwijzen
- 7.1.
Weeg bij diervoeders met een hoog gehalte aan melasse en bij andere diervoeders die weinig homogeen zijn 20 g af in een maatkolf van 1 liter; voeg 500 ml water toe en laat gedurende 1 uur roteren. Klaar daarna met telkens de viervoudige hoeveelheden Carrez I- en II-oplossing (punt 3.2) en (punt 3.3), zoals onder 5.1 beschreven. Vul dan aan tot de streep met ethanol 80 % (V/V).
Meng en filtreer. Verwijder de ethanol zoals in 5.1 beschreven. Indien er geen gedextrineerd zetmeel aanwezig is, wordt met gedestilleerd water aangevuld.
- 7.2.
Weeg van melasse en van voedermiddelen die een hoog gehalte aan suikers, maar praktisch geen zetmeel bevatten (johannesbrood, suikerbietensnijdsels enz.) 5 g in een maatkolf van 250 ml; voeg 200 ml gedestilleerd water toe en laat gedurende 1 uur, of langer indien nodig, roteren. Klaar met Carrez I- en II-oplossing (punt 3.2) en (punt 3.3), zoals onder 5.1 beschreven. Vul aan tot de streep met koud water, meng en filtreer. Handel voor de bepaling van suikers totaal als bij 5.3.
8. Opmerkingen
- 8.1.
Om schuimvorming te voorkomen verdient het aanbeveling vóór het verwarmen met het reagens volgens Luff-Schoorl ongeveer 1 ml 3-methylbutaan-1-ol (punt 3.1) toe te voegen (ongeacht het volume).
- 8.2.
Het verschil tussen het percentage suikers totaal na inversie, uitgedrukt als glucose, en het percentage reducerende suikers, uitgedrukt als glucose, geeft — na vermenigvuldiging met 0,95 — het percentage sacharose.
- 8.3.
Het gehalte aan reducerende suikers exclusief lactose kan op twee manieren worden bepaald:
- 8.3.1.
Voor een benaderende berekening wordt het gehalte aan lactose — gevonden bij een afzonderlijke bepaling — vermenigvuldigd met 0,675 en van het gehalte aan reducerende suikers afgetrokken.
- 8.3.2.
Voor een nauwkeurige berekening van de reducerende suikers exclusief lactose is het echter noodzakelijk dat bij de beide bepalingen uiteindelijk dezelfde hoeveelheid analysemateriaal in bewerking genomen wordt. Een van de bepalingen wordt uitgevoerd in een deel van de oplossing verkregen in 5.1, de andere bepaling in een deel van de oplossing verkregen bij de bepaling van lactose volgens de desbetreffende methode (na vergisting van andere suikers en klaring).
In beide gevallen wordt het suikergehalte bepaald volgens Luff-Schoorl en berekend als mg glucose. Deze waarden worden van elkaar afgetrokken en het verschil wordt uitgedrukt als percentage van het monster.
Voorbeeld
De beide afgepipetteerde hoeveelheden komen bij elke bepaling overeen met 250 mg analysemateriaal.
In het eerste geval wordt 17 ml natriumthiosulfaatoplossing 0,1 mol/l verbruikt, overeenkomend met 44,2 mg glucose; in het tweede geval 11 ml, overeenkomend met 27,6 mg glucose.
Het verschil bedraagt dus 16,6 mg glucose.
Het gehalte aan reducerende suikers, exclusief lactose, berekend als glucose, bedraagt dan:
(4 × 16,6/10) = 6.64%
Tabel van de waarden voor 25 ml Luff-Schoorl-reagens ml Na2S2O3 0,1 mol/l, verwarmd gedurende 2 minuten, aan de kook gedurende 10 minuten Na2S2O3
0,1 mol/l
Glucose, fructose, invertsuikers
C6H12O6
Lactose
C12H22O11
Na2S2O3
0,1 mol/l
ml
mg
verschil
mg
verschil
ml
1
2,4
2,4
3,6
3,7
1
2
4,8
2,4
7,3
3,7
2
3
7,2
2,5
11,0
3,7
3
4
9,7
2,5
14,7
3,7
4
5
12,2
2,5
18,4
3,7
5
6
14,7
2,5
22,1
3,7
6
7
17,2
2,6
25,8
3,7
7
8
19,8
2,6
29,5
3,7
8
9
22,4
2,6
33,2
3,8
9
10
25,0
2,6
37,0
3,8
10
11
27,6
2,7
40,8
3,8
11
12
30,3
2,7
44,6
3,8
12
13
33,0
2,7
48,4
3,8
13
14
35,7
2,8
52,2
3,8
14
15
38,5
2,8
56,0
3,9
15
16
41,3
2,9
59,9
3,9
16
17
44,2
2,9
63,8
3,9
17
18
47,1
2,9
67,7
4,0
18
19
50,0
3,0
71,7
4,0
19
20
53,0
3,0
75,7
4,1
20
21
56,0
3,1
79,8
4,1
21
22
59,1
3,1
83,9
4,1
22
23
62,2
88,0
23
J. Bepaling van lactose
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan lactose in diervoeders die meer dan 0,5 % lactose bevatten.
2. Beginsel
De suikers worden in water opgelost. De oplossing wordt vergist met Saccharomyces cerevisiae, waarbij de lactose niet wordt afgebroken. Na klaren en filtreren wordt in het filtraat het gehalte aan lactose bepaald volgens Luff-Schoorl.
3. Reagentia
- 3.1.
Suspensie van Saccharomyces cerevisiae: suspendeer 25 g verse gist in 100 ml water. In de koelkast bewaren: ten hoogste een week houdbaar.
- 3.2.
Carrez I-oplossing: los 21,9 g zinkacetaat, Zn(CH3COO)2·2H2O, en 3 g ijsazijn op in water. Vul met water aan tot 100 ml.
- 3.3.
Carrez II-oplossing: los 10,6 g kaliumhexacyanoferraat(II), K4Fe(CN)63H2O, op in water. Vul met water aan tot 100 ml.
- 3.4.
Luff-Schoorl-reagens:
Voeg, onder voorzichtig omzwenken, de citroenzuuroplossing (punt 3.4.2) bij de natriumcarbonaatoplossing (punt 3.4.3). Voeg daarna toe de kopersulfaatoplossing (punt 3.4.1) en vul aan met water tot 1 liter. Laat een nacht staan en filtreer. Controleer de concentraties in het aldus verkregen reagens (Cu 0,05 mol/l, Na2CO31 mol/l). De pH van de oplossing moet ongeveer 9,4 zijn.
- 3.4.1.
Kopersulfaatoplossing: los 25 g kopersulfaat, CuSO4·5H2O, vrij van ijzer, op in 100 ml water.
- 3.4.2.
Citroenzuuroplossing: los op 50 g citroenzuur p.a., C6H8O7•H2O, in 50 ml water.
- 3.4.3.
Natriumcarbonaatoplossing: los 143,8 g watervrij natriumcarbonaat op in ongeveer 300 ml warm water. Laat afkoelen.
- 3.5.
Puimsteenkorrels, met zoutzuur uitgekookt, met water gewassen en gedroogd.
- 3.6.
Kaliumjodideoplossing 30 % (m/V).
- 3.7.
Zwavelzuur 3 mol/l.
- 3.8.
Natriumthiosulfaatoplossing 0,1 mol/l.
- 3.9.
Zetmeeloplossing: voeg aan 1 liter kokend water een suspensie van 5 g oplosbaar zetmeel in 30 ml water toe, koel vervolgens af en voeg eventueel 10 mg kwik(II)jodide toe als conserveermiddel.
4. Apparatuur
Waterbad met thermostaat, ingesteld op 38–40 °C.
5. Werkwijze
Breng 1 g van het monster, tot op 1 mg nauwkeurig gewogen, in een maatkolf van 100 ml. Voeg 25–30 ml water toe. Plaats de kolf gedurende 30 minuten in een kokendwaterbad. Koel dan af tot ongeveer 35 °C, voeg 5 ml gistsuspensie (punt 3.1) toe en meng. Plaats de kolf gedurende 2 uur in een waterbad van 38–40 °C. Koel vervolgens af tot ongeveer 20 °C.
Voeg daarna toe 2,5 ml Carrez-I-oplossing (punt 3.2) en schud gedurende 30 sec.; voeg dan toe 2,5 ml Carrez-II-oplossing (punt 3.3) en schud weer gedurende 30 sec. Vul nu aan met water tot 100 ml, meng en filtreer. Pipetteer van het filtraat een hoeveelheid van ten hoogste 25 ml, die bij voorkeur 40–80 mg lactose bevat, in een erlenmeyer van 300 ml; vul zo nodig aan met water tot 25 ml.
Verricht op dezelfde wijze een blancobepaling met 5 ml gistsuspensie (punt 3.1). Bepaal het gehalte aan lactose volgens Luff-Schoorl als volgt: voeg precies 25 ml Luff-Schoorl-reagens (punt 3.4) toe. Verhit na toevoeging van twee puimsteenkorrels (punt 3.5) onder omzwenken uit de hand boven een vrije vlam van matige hoogte, zodanig dat de vloeistof in ongeveer 2 minuten kookt. Plaats daarna de erlenmeyer onmiddellijk op een draadgaas met een asbestplaat met een opening van ongeveer 6 cm diameter; steek van te voren onder het draadgaas een vlam aan en regel deze zodanig dat alleen de bodem van de erlenmeyer verwarmd wordt. Verbind de erlenmeyer met een terugvloeikoeler. Laat vanaf dit moment precies 10 minuten koken, koel dan onmiddellijk af in koud water en titreer na 5 minuten als volgt.
Voeg aan de vloeistof 10 ml kaliumjodideoplossing (punt 3.6) toe en onmiddellijk daarna voorzichtig (wegens het sterke schuimen) 25 ml zwavelzuur (punt 3.7). Titreer dan met natriumthiosulfaatoplossing (punt 3.8) tot roomgeel, voeg de zetmeeloplossing (punt 3.9) als indicator toe en voltooi de titratie.
Verricht eenzelfde titratie in een mengsel van precies 25 ml Luff-Schoorl-reagens (punt 3.4) en 25 ml water na toevoeging van 10 ml kaliumjodideoplossing (punt 3.6) en 25 ml zwavelzuur (punt 3.7), maar nu zonder verwarmen.
6. Berekening van de resultaten
Bepaal aan de hand van de onderstaande tabel de hoeveelheid lactose in mg die overeenkomt met het verschil van de beide titratie-uitkomsten, uitgedrukt in ml natriumthiosulfaatoplossing 0,1 mol/l.
Druk het resultaat (watervrije lactose) uit als percentage van het monster.
7. Opmerking
- 1.
Voeg, indien het gehalte aan vergistbare suikers hoger is dan 40 %, meer dan 5 ml gistsuspensie (punt 3.1) toe.
- 2.
Bij ‘lactosearme’ diervoeders (bv. melk voor katten) wordt lactose omgezet in fructose, die niet binnen 2 uur volledig is gegist, wat leidt tot hogere of vals-positieve resultaten (vanwege fructoseresiduen die in het extract achterblijven).
Tabel van de waarden voor 25 ml Luff-Schoorl-reagens ml Na2S2O3 0,1 mol/l, verwarmd gedurende 2 minuten, aan de kook gedurende 10 minuten Na2S2O3
0,1 mol/l
Glucose, fructose, invertsuikers
C6H12O6
Lactose
C12H22O11
Na2S2O3
0,1 mol/l
ml
mg
verschil
mg
verschil
ml
1
2,4
2,4
3,6
3,7
1
2
4,8
2,4
7,3
3,7
2
3
7,2
2,5
11,0
3,7
3
4
9,7
2,5
14,7
3,7
4
5
12,2
2,5
18,4
3,7
5
6
14,7
2,5
22,1
3,7
6
7
17,2
2,6
25,8
3,7
7
8
19,8
2,6
29,5
3,7
8
9
22,4
2,6
33,2
3,8
9
10
25,0
2,6
37,0
3,8
10
11
27,6
2,7
40,8
3,8
11
12
30,3
2,7
44,6
3,8
12
13
33,0
2,7
48,4
3,8
13
14
35,7
2,8
52,2
3,8
14
15
38,5
2,8
56,0
3,9
15
16
41,3
2,9
59,9
3,9
16
17
44,2
2,9
63,8
3,9
17
18
47,1
2,9
67,7
4,0
18
19
50,0
3,0
71,7
4,0
19
20
53,0
3,0
75,7
4,1
20
21
56,0
3,1
79,8
4,1
21
22
59,1
3,1
83,9
4,1
22
23
62,2
88,0
23
K. Bepaling van zetmeel
Polarimetrische methode
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan zetmeel en hoogmoleculaire afbraakproducten van zetmeel in diervoeders om na te gaan of die in overeenstemming zijn met de vermelde energiewaarde (bepalingen in bijlage VII) en Verordening (EG) nr. 767/2009.
Deze methode moet worden gebruikt voor de bepaling van het zetmeelgehalte voor gebruik bij de berekening van de energiewaarde van het diervoeder.
Indien het zetmeelgehalte voor andere doeleinden moet worden bepaald, kunnen andere analysemethoden worden gebruikt.
2. Beginsel
De bepaling bestaat uit twee onderdelen. Het eerste deel omvat de behandeling van het monster met verdund zoutzuur. Na klaren en filtreren wordt de optische draaiing van de oplossing polarimetrisch bepaald.
Het tweede deel omvat de extractie van het monster met ethanol 40 %. Na aanzuren van het filtraat met zoutzuur, klaren en filtreren wordt de optische draaiing gemeten zoals bij het eerste deel.
Het verschil tussen de twee metingen, vermenigvuldigd met een bekende factor geeft het zetmeelgehalte van het monster.
3. Reagentia
- 3.1.
Zoutzuur, 25 % (m/m), d = 1,126 g/ml.
- 3.2.
Zoutzuur, 1,13 % (m/V).
De sterkte moet worden gecontroleerd door titratie met natriumhydroxideoplossing 0,1 mol/l ten opzichte van de indicator methylrood 0,1 % (m/V) in ethanol 94 % (V/V). Om 10 ml te neutraliseren is 30,94 ml NaOH 0,1 mol/l nodig.
- 3.3.
Carrez I-oplossing: los 21,9 g zinkacetaat, Zn(CH3COO)2·2H2O, en 3 g ijsazijn op in water. Vul met water aan tot 100 ml.
- 3.4.
Carrez II-oplossing: los 10,6 g kaliumhexacyanoferraat(II), K4Fe(CN)63H2O, op in water. Vul met water aan tot 100 ml.
- 3.5.
Ethanol 40 % (V/V), d = 0,948 g/ml bij 20 °C.
4. Apparatuur
- 4.1.
Erlenmeyer van 250 ml met normaalslijpstuk en terugvloeikoeler.
- 4.2.
Polarimeter of sacharimeter.
5. Werkwijze
5.1. Monstervoorbewerking
Maak het monster zo fijn dat het door een zeef met ronde mazen van 0,5 mm diameter gaat.
5.2. Bepaling van de totale optische draaiing (P of S) (zie opmerking in punt 7.1)
Weeg 2,5 g van het monster tot op 1 mg nauwkeurig af in een maatkolf van 100 ml. Voeg 25 ml zoutzuur (punt 3.2) toe, schud de kolf totdat het monster goed gesuspendeerd is en voeg nogmaals 25 ml zoutzuur (punt 3.2) toe. Plaats de kolf in een kokendwaterbad en schud gedurende de eerste 3 minuten krachtig en regelmatig om klontvorming te voorkomen. De hoeveelheid water in het bad moet groot genoeg zijn om aan de kook te blijven wanneer de kolf erin wordt geplaatst. De kolf mag tijdens het schudden niet uit het water worden gehaald. Neem na precies 15 minuten de kolf uit het bad, voeg 30 ml koud water toe en laat onmiddellijk afkoelen tot 20 °C.
Voeg 5 ml Carrez I-oplossing (punt 3.3) toe en schud gedurende ongeveer 30 seconden. Voeg vervolgens 5 ml Carrez II-oplossing (punt 3.4) toe en schud nogmaals gedurende ongeveer 30 seconden. Vul aan tot de streep met water, meng en filtreer. Als het filtraat niet volledig helder is (wat zelden voorkomt), herhaal dan de bepaling met grotere hoeveelheden Carrez I- en II-oplossing, bijvoorbeeld 10 ml.
Meet vervolgens de optische draaiing van de oplossing in een buis van 200 mm met de polarimeter of de sacharimeter.
5.3. Bepaling van de optische draaiing (P' of S") van de in ethanol 40 % oplosbare stoffen
Weeg 5 g van het monster tot op 1 mg nauwkeurig af in een maatkolf van 100 ml en voeg ongeveer 80 ml ethanol (punt 3.5) toe (zie opmerking in punt 7.2). Laat de kolf gedurende 1 uur staan bij kamertemperatuur; schud de oplossing gedurende die tijd zesmaal krachtig, zodat het monster goed met de ethanol wordt vermengd. Vul vervolgens aan tot de streep met ethanol (punt 3.5), meng en filtreer.
Pipetteer 50 ml van het filtraat (= 2,5 g monster) in een erlenmeyer van 250 ml, voeg 2,1 ml zoutzuur (punt 3.1) toe en schud krachtig. Verbind de erlenmeyer met een terugvloeikoeler en plaats hem in een kokendwaterbad. Neem na precies 15 minuten de erlenmeyer uit het bad, breng de inhoud ervan over in een maatkolf van 100 ml, spoel na met een kleine hoeveelheid koud water en laat afkoelen tot 20 °C.
Klaar vervolgens met Carrez I- en II-oplossing (punt 3.3) en (punt 3.4), vul aan tot de streep met water, meng, filtreer en meet de optische draaiing als aangegeven onder 5.2, tweede en derde alinea.
6. Berekening van de resultaten
Het zetmeelgehalte van het monster (in %) wordt als volgt berekend:
- 6.1.Meting met de polarimeter
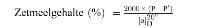
P =
totale optische draaiing in booggraden;
P' =
optische draaiing in booggraden van de in ethanol 40 % oplosbare stoffen;
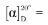
specifieke optische draaiing van zuiver zetmeel. De waarden die standaard voor deze factor worden gebruikt zijn:
+ 185,9°: rijstzetmeel
+ 185,7°: aardappelzetmeel
+ 184,6°: maiszetmeel
+ 182,7°: tarwezetmeel
+ 181,5°: gerstzetmeel
+ 181,3°: haverzetmeel
+ 184,0°: ander zetmeelsoorten en zetmeelmengsels in mengvoeders.
- 6.2.Metingen met de sacharimeter
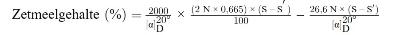
S =
totale optische draaiing in sacharimetrische graden;
S' =
optische draaiing in sacharimetrische graden van de in ethanol 40 % oplosbare stoffen;
N =
massa in g van de hoeveelheid sacharose die in 100 ml water bij meting met een buis van 200 mm een optische draaiing van 100 sacharimetrische graden geeft:
16,29 g voor Franse sacharimeters,
26,00 g voor Duitse sacharimeters,
20,00 g voor gemengde sacharimeters.
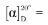
specifieke optische draaiing van zuiver zetmeel (zie 6.1).
- 6.3.Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer bedragen dan 0,4 absoluut bij zetmeelgehalten van minder dan 40 %, en 1 % relatief bij zetmeelgehalten van 40 % of meer.
7. Opmerkingen
- 7.1.
Als het monster meer dan 6 % carbonaten bevat, berekend als calciumcarbonaat, moeten deze voor de bepaling van de totale optische draaiing worden ontleed door een behandeling met precies de daarvoor benodigde hoeveelheid verdund zwavelzuur.
- 7.2.
Producten met een hoog gehalte aan lactose, zoals weipoeder, mageremelkpoeder enz., worden na het toevoegen van de 80 ml ethanol (punt 3.5) als volgt behandeld. Verbind de erlenmeyer met een terugvloeikoeler en plaats hem gedurende 30 minuten in een waterbad van 50 °C. Laat vervolgens afkoelen en handel verder als beschreven onder 5.3.
- 7.3.
Voor de hierna vermelde voedermiddelen is bekend dat zij, als ze in aanzienlijke hoeveelheden in diervoeders voorkomen, de bepaling van het zetmeelgehalte via de polarimetrische methode kunnen storen, zodat foutieve resultaten kunnen worden verkregen:
- —
producten van (suiker)bieten, zoals (suiker)bietenpulp, (suiker)bietenmelasse, (suiker)bietenpulp-gemelasseerd, (suiker)biet-vinasse, (biet)suiker;
- —
citruspulp;
- —
lijnzaad; lijnzaadschilfers; lijnzaadschroot;
- —
kool- en raapzaad; kool- en raapzaadschilfers; kool- en raapzaadschroot; kool- en raapzaadschillen;
- —
zonnebloemzaad; zonnebloemzaadschroot; zonnebloemzaadschroot van gedeeltelijk ontdopt zaad;
- —
kokosschilfers; kokosschroot;
- —
aardappelpulp;
- —
gedroogde gist;
- —
producten met een hoog gehalte aan inuline (bv. topinamboerchips en -meel);
- —
kanen;
- —
sojaboonproducten.
In deze gevallen kan de analysemethode van Verordening (EG) nr. 121/2008 (7) worden toegepast. Deze methode kan ook worden gebruikt voor diervoeder dat minder dan 1 % zetmeel bevat.
L. Bepaling van ruwe as
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan ruwe as in diervoeders.
2. Beginsel
De stof wordt gegloeid bij een temperatuur van 550 °C, waarna het residu wordt gewogen.
3. Reagentia
Ammoniumnitraatoplossing 20 % (m/V).
4. Apparatuur
- 4.1.
Elektrische verwarmingsplaat.
- 4.2.
Elektrische moffeloven met thermostaat.
- 4.3.
Verassingsschalen van kwarts, porselein of platina, rechthoekig (ca. 60 × 40 × 25 mm) of rond (diameter 60–75 mm, hoogte 20 tot 40 mm).
5. Werkwijze
Weeg ongeveer 5 g van het monster (2,5 g in geval van stoffen die neiging hebben tot opzwellen) tot op 1 mg nauwkeurig af in een tevoren op 550 °C gegloeide en na afkoeling gewogen verassingsschaal. Verhit de schaal op de elektrische verwarmingsplaat langzamerhand totdat het analysemateriaal verkoold is. Volg daarna de werkwijze zoals beschreven in 5.1 of 5.2.
- 5.1.
Plaats de schaal in de op 550 °C ingestelde, geijkte moffeloven. Verhit zo lang, totdat een witte, lichtgrijze of roodachtige as verkregen is, die duidelijk vrij is van kooldeeltjes. Plaats de schaal daarna in een exsiccator en weeg direct nadat de schaal is afgekoeld.
- 5.2.
Plaats de schaal in de op 550 °C ingestelde, geijkte moffeloven. Gloei gedurende 3 uur. Plaats de schaal daarna in een exsiccator en weeg direct nadat de schaal is afgekoeld. Gloei nogmaals gedurende 30 minuten om zeker te zijn dat de massa van de as constant is (het massaverlies tussen de twee wegingen mag niet meer bedragen dan 1 mg).
6. Berekening van de resultaten
Bereken de massa van het residu door de massa van de lege schaal af te trekken.
Druk het resultaat uit als percentage van het monster.
7. Opmerkingen
- 7.1.
Bij stoffen die moeilijk te verassen zijn, worden na ten minste 3 uur gloeien aan de afgekoelde ruwe as enkele druppels ammoniumnitraatoplossing 20 % of water toegevoegd (echter voorzichtig om verstuiven en vastbakken van de stof te vermijden). Na drogen in een droogstoof wordt opnieuw gegloeid. Herhaal zo nodig deze bewerking totdat een volledige verassing is verkregen.
- 7.2.
Stoffen die ook na behandeling als beschreven onder 7.1 niet volledig verast zijn, worden als volgt behandeld. Na 3 uur gloeien wordt de as met heet gedestilleerd water opgenomen en door een klein asvrij filter afgefiltreerd. Filter en residu worden vervolgens in de gebruikte asschaal teruggebracht en opnieuw gegloeid. Nadat de schaal is afgekoeld wordt het filtraat in dezelfde schaal gebracht, ingedampt tot droog, gegloeid en gewogen.
- 7.3.
Van oliën en vetten wordt een hoeveelheid van 25 g nauwkeurig afgewogen in een voor deze hoeveelheid passende schaal. Vervolgens wordt de stof verkoold door het analysemateriaal met een reep asvrij filtreerpapier in brand te steken. Na het verkolen wordt het residu met een juist voldoende hoeveelheid water bevochtigd. Vervolgens wordt gedroogd en verder behandeld als beschreven in punt 5.
M. Bepaling van in zoutzuur onoplosbare as
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van in zoutzuur onoplosbare, minerale bestanddelen van diervoeders. Afhankelijk van de aard van het monster zijn twee werkwijzen vastgesteld.
- 1.1.
Methode A: toepasbaar voor organische voedermiddelen en voor de meeste mengvoeders.
- 1.2.
Methode B: toepasbaar voor mineralen en mineralenmengsels, alsmede voor mengvoeders waarvan het gehalte aan in zoutzuur onoplosbare as, bepaald volgens werkwijze A, meer bedraagt dan 1 %.
2. Beginsel
- 2.1.
Methode A: het monster wordt verast, de as behandeld met kokend zoutzuur en het onoplosbare residu wordt afgefiltreerd en gewogen.
- 2.2.
Methode B: het monster wordt met zoutzuur behandeld. De oplossing wordt afgefiltreerd, het residu wordt verast en de as wordt dan verder behandeld zoals onder werkwijze A beschreven.
3. Reagentia
- 3.1.
Zoutzuur 3 mol/l.
- 3.2.
Trichloorazijnzuuroplossing 20 % (m/V).
- 3.3.
Trichloorazijnzuuroplossing 1 % (m/V).
4. Apparatuur
- 4.1.
Elektrische verwarmingsplaat.
- 4.2.
Elektrische moffeloven met thermostaat.
- 4.3.
Verassingsschalen van kwarts, porselein of platina, rechthoekig (ca. 60 × 40 × 25 mm) of rond (diameter 60–75 mm, hoogte 20 tot 40 mm).
- 4.4.
Asvrije filters.
5. Werkwijze
5.1. Methode A:
Veras het analysemateriaal op dezelfde manier als bij de bepaling van ruwe as beschreven is. Men kan ook de bij de ruwe asbepaling verkregen as gebruiken.
Breng de as met 75 ml zoutzuur (punt 3.1) over in een bekerglas van 250–400 ml. Breng de vloeistof voorzichtig tot koken en houdt daarna gedurende 15 min. juist aan de kook. Filtreer de hete oplossing door een asvrij papieren filter en was het residu met heet water uit tot zuurvrij. Droog het filter met residu en veras bij een temperatuur van tenminste 550 °C en ten hoogste 700 °C in een getarreerde verassingsschaal. Laat afkoelen in een exsiccator en weeg.
5.2. Werkwijze B
Weeg 5 g van het monster tot op 1 mg nauwkeurig af in een bekerglas van 250–400 ml. Voeg achtereenvolgens 25 ml water en 25 ml zoutzuur (punt 3.1) toe, zwenk om en laat staan totdat de gasontwikkeling is opgehouden. Voeg dan nog 50 ml zoutzuur (punt 3.1) toe. Wacht nogmaals tot een eventuele gasontwikkeling praktisch tot stilstand is gekomen. Verwarm daarna het bekerglas op een waterbad gedurende 30 min, of zoveel langer als nodig is om eventueel aanwezig zetmeel volledig te hydrolyseren. Filtreer de hete oplossing over een asvrij filter en was het filter uit met ongeveer 50 ml heet water (zie opmerking in punt 7). Plaats het filter met residu in een verassingsschaaltje, droog en veras bij tenminste 550 °C en ten hoogste 700 °C. Breng de as met 75 ml zoutzuur (punt 3.1) over in een bekerglas van 250–400 ml, en handel verder als beschreven onder 5.1, tweede alinea.
6. Berekening van de resultaten
Bereken de massa van het residu door de massa van de lege schaal af te trekken. Druk het resultaat uit als percentage van het monster.
7. Opmerking
Als bij het filtreren moeilijkheden worden ondervonden, wordt de bepaling opnieuw gedaan, maar wordt in plaats van 50 ml zoutzuur (punt 3.1) 50 ml trichloorazijnzuuroplossing 20 % (m/V) (punt 3.2) toegevoegd en wordt het filter met hete trichloorazijnzuuroplossing 1 % (punt 3.3) uitgewassen.
N. Bepaling van totaal fosfor
Het totaal aan fosfor wordt bepaald
- —
volgens de analysemethode van EN 15510 Diervoeders: Methoden voor analyse en monsterneming — Bepaling van calcium, natrium, fosfor, magnesium, kalium, ijzer, zink, koper, mangaan, kobalt, molybdeen en lood met ICP-AES of
- —
de analysemethode van EN 15621 Diervoeders: Methoden voor analyse en monsterneming — Bepaling van het gehalte aan calcium, natrium, fosfor, magnesium, kalium, zwavel, ijzer, zink, koper, mangaan en kobalt door ICP-AES na ontsluiting onder druk, of
- —
volgens de hieronder beschreven fotometrische methode.
Fotometrische methode
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan totaal fosfor in diervoeders. De methode is bijzonder geschikt voor de analyse van diervoeders met een laag gehalte aan fosfor. In bepaalde gevallen (producten die rijk zijn aan fosfor) kan een gravimetrische methode worden toegepast.
2. Beginsel
Het monster wordt ontsloten, hetzij langs droge weg (organische diervoeders), hetzij langs natte weg (minerale stoffen en vloeibare diervoeders), en in zure oplossing gebracht. De oplossing wordt behandeld met vanadaat-molybdaatreagens. De extinctie van de gevormde geelgekleurde oplossing bij 430 nm wordt gemeten met een spectrofotometer.
3. Reagentia
- 3.1.
Calciumcarbonaat.
- 3.2.
Zoutzuur, ρ20 = 1,10 g/ml (ongeveer 6 mol/l).
- 3.3.
Zoutzuur, ρ20 = 1,045 g/ml.
- 3.4.
Salpeterzuur, ρ20 = 1,38–1,42 g/ml.
- 3.5.
Zwavelzuur, ρ20 = 1,84 g/ml.
- 3.6.
Vanadaat-molybdaatreagens: meng in een maatkolf van 1 liter 200 ml ammoniumheptamolybdaatoplossing (punt 3.6.1), 200 ml ammoniummonovanadaatoplossing (punt 3.6.2) en 134 ml salpeterzuur (punt 3.4). Vul aan tot de streep met water.
- 3.6.1.
Ammoniumheptamolybdaatoplossing: los 100 g ammoniumheptamolybdaat, (NH4)6Mo7O24·4H2O, op in warm water. Voeg 10 ml ammonia (d = 0,91 g/ml) toe en vul aan met water tot 1 liter.
- 3.6.2.
Ammoniumheptamolybdaatoplossing: los 2,35 g ammoniummonovanadaat, NH4VO3, op in 400 ml warm water. Voeg langzaam, onder voortdurend roeren, 20 ml verdund salpeterzuur (7 ml HNO3 (punt 3.4) + 13 ml H2O) toe en vul aan met water tot 1 liter.
- 3.7.
Fosforstandaardoplossing 1 mg/ml: los 4,387 g kaliumdiwaterstoffosfaat, KH2PO4, op in water Vul aan met water tot 1 liter.
4. Apparatuur
- 4.1.
Verassingschalen van kwarts, porselein of platina.
- 4.2.
Elektrische moffeloven met thermostaat, ingesteld op 550 °C.
- 4.3.
Kjeldahlkolf van 250 ml.
- 4.4.
Maatkolven en pipetten.
- 4.5.
Spectrofotometer.
- 4.6.
Reageerbuizen, doorsnede ca. 16 mm, met normaalslijpstuk 14,5; inhoud: van 25 tot en met 30 ml.
5. Werkwijze
5.1. Bereiding van de oplossing
Bereid de oplossing als beschreven onder 5.1.1 of 5.1.2, afhankelijk van de aard van het monster.
5.1.1. Algemene werkwijze
Breng 1 g of meer van het monster, tot op 1 mg nauwkeurig gewogen, in een kjeldahlkolf. Voeg 20 ml zwavelzuur (punt 3.5) toe en zwenk om, teneinde het analysemateriaal goed met het zuur te bevochtigen en vastzitten aan de wand van de kolf te voorkomen. Verwarm de kolf en laat gedurende 10 minuten koken. Laat even afkoelen, voeg 2 ml salpeterzuur (punt 3.4) toe en verwarm zacht. Laat weer even afkoelen, voeg opnieuw een weinig salpeterzuur (punt 3.4) toe en breng weer aan de kook. Herhaal deze bewerkingen totdat de oplossing kleurloos is. Laat hierna afkoelen, voeg een weinig water toe, giet de vloeistof in een maatkolf van 500 ml en spoel de kjeldahlkolf met heet water uit. Laat afkoelen, vul aan tot de streep met water, meng en filtreer.
5.1.2. Werkwijze voor monsters die organische stoffen bevatten, maar geen calcium- of magnesiumdiwaterstoffosfaat
Weeg ongeveer 2,5 g monster tot op 1 mg nauwkeurig af in een verassingsschaal en meng door en door met 1 g calciumcarbonaat (punt 3.1). Veras in de moffeloven bij 550 °C totdat een witte of grijze as verkregen is (een kleine hoeveelheid koolstof stoort niet). Breng de as in een bekerglas van 250 ml, voeg 20 ml water toe en voeg vervolgens zoutzuur (punt 3.2) toe tot het bruisen ophoudt. Voeg dan nog 10 ml zoutzuur (punt 3.2) toe. Wacht nogmaals tot een eventuele gasontwikkeling praktisch tot stilstand is gekomen. Plaats het bekerglas op een zandbad en damp in tot droog om het kiezelzuur onoplosbaar te maken. Neem het residu op in 10 ml salpeterzuur (punt 3.3) en laat gedurende 5 minuten koken op het zandbad of de verwarmingsplaat, zonder dat tot droog ingedampt wordt. Giet de vloeistof in een maatkolf van 500 ml en spoel het bekerglas meermalen met heet water uit. Laat afkoelen, vul aan tot de streep met water, meng en filtreer.
5.2. Ontwikkelen van de kleur en meten van de extinctie
Verdun een aliquoot deel van het onder punt 5.1.1 of 5.1.2 verkregen filtraat zo, dat een concentratie aan fosfor verkregen wordt van ten hoogste 40 μg/ml. Pipetteer 10 ml van deze oplossing in een reageerbuis (punt 4.6), voeg 10 ml vanadaat-molybdaatreagens (punt 3.6) toe en meng. Laat gedurende ten minste 10 minuten staan bij 20 °C. Meet dan met een spectrofotometer de extinctie bij 430 nm tegen een mengsel van 10 ml vanadaat-molybdaatreagens (punt 3.6) en 10 ml water.
5.3. IJkgrafiek
Bereid van de standaardoplossing (punt 3.7) oplossingen, die respectievelijk 5, 10, 20, 30 en 40 μg fosfor per ml bevatten. Voeg aan 10 ml van elk van deze oplossingen 10 ml vanadaat-molybdaatreagens (punt 3.6) toe en meng. Laat gedurende ten minste 10 min staan bij 20 °C. Meet dan de extincties zoals beschreven in 5.2. Stel een ijkgrafiek op, waarbij op de abscis de hoeveelheden fosfor en op de ordinaat de daarbij behorende extinctiewaarden worden uitgezet. Het verloop van de ijkgrafiek is lineair voor concentraties aan fosfor van 0 tot 40 μg fosfor per ml.
6. Berekening van de resultaten
Bepaal aan de hand van de ijkgrafiek het gehalte aan fosfor in het analysemonster.
Druk het resultaat uit als percentage van het monster.
Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer bedragen dan:
- —
3 % relatief ten opzichte van het hoogste resultaat bij gehalten van minder dan 5 % fosfor;
- —
0,15 % absoluut bij gehalten van 5 % of meer.
O. Bepaling van cgloor van cgloriden
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van chloor van in water oplosbare chloriden, standaard uitgedrukt als natriumchloride. Het is toepasbaar voor alle diervoeders.
2. Beginsel
Chloriden worden in water opgelost. Indien het analysemateriaal organische stoffen bevat, wordt een klaring toegepast. De oplossing wordt met salpeterzuur zwak aangezuurd en chloriden worden met een zilvernitraatoplossing als zilverchloride neergeslagen. De overmaat zilvernitraat wordt volgens de volhardmethode teruggetitreerd met ammoniumthiocyanaatoplossing.
3. Reagentia
- 3.1.
Ammoniumthiocyanaatoplossing 0,1 mol/l.
- 3.2.
Zilvernitraatoplossing 0,1 mol/l.
- 3.3.
Verzadigde oplossing van ammoniumijzer(III)sulfaat, (NH4)Fe(SO4)2.
- 3.4.
Salpeterzuur, d = 1,38 g/ml.
- 3.5.
Di-ethylether.
- 3.6.
Aceton.
- 3.7.
Carrez I-oplossing: los 21,9 g zinkacetaat, Zn(CH3COO)2·2H2O, en 3 g ijsazijn op in water. Vul met water aan tot 100 ml.
- 3.8.
Carrez II-oplossing: los 10,6 g kaliumhexacyanoferraat(II), K4Fe(CN)63H2O, op in water. Vul met water aan tot 100 ml.
- 3.9.
Actieve kool, vrij van chloriden en geen chloriden absorberend.
4. Apparatuur
Roteerapparaat met ongeveer 35 à 40 omwentelingen per minuut.
5. Werkwijze
5.1. Bereiding van de oplossing
Bereid al naar de aard van het monster, een oplossing als onder 5.1.1, 5.1.2 of 5.1.3 beschreven.
Verricht tegelijkertijd een blancobepaling zonder analysemateriaal.
5.1.1. Monsters die geen organische stoffen bevatten
Weeg ten hoogste 10 g analysemateriaal, waarin niet meer dan 3 g chloor als chloriden aanwezig is, tot op 1 mg nauwkeurig af in een maatkolf van 500 ml met 400 ml water van omstreeks 20 °C. Laat gedurende 30 min roteren, vul aan tot de streep, meng en filtreer.
5.1.2. Monsters die organische stoffen bevatten, met uitzondering van producten vermeld onder 5.1.3
Weeg ongeveer 5 g van het analysemateriaal tot op 1 mg nauwkeurig af in een maatkolf van 500 ml. Voeg 1 g actieve kool (punt 3.9) toe en daarna 400 ml water van omstreeks 20 °C en 5 ml Carrez I-oplossing (punt 3.7), zwenk gedurende 30 seconden om en voeg dan 5 ml Carrez II-oplossing (punt 3.8) toe. Laat gedurende 30 min roteren, vul aan tot de streep, meng en filtreer.
5.1.3. Bakkerijafvalproducten, lijnkoeken en lijnmeel, producten met veel lijnmeel en andere producten met een hoog gehalte aan slijmstoffen of colloïdale stoffen (bv. gedextrineerd zetmeel)
Bereid de oplossing als beschreven onder 5.1.2, maar filtreer niet af. Laat vervolgens bezinken (zo nodig wordt gecentrifugeerd). Pipetteer 100 ml van de bovenstaande vloeistof in een maatkolf van 200 ml. Voeg aceton (punt 3.6) toe, meng, vul aan tot de streep met aceton, meng en filtreer.
5.2. Titratie
Pipetteer 25–100 ml van het filtraat (afhankelijk van het te verwachten gehalte aan chloor), verkregen volgens 5.1.1, 5.1.2 of 5.1.3, in een erlenmeyer. De afgepipetteerde hoeveelheid mag niet meer dan 150 mg chloor (Cl) bevatten. Verdun zo nodig met water tot ten minste 50 ml. Voeg vervolgens toe 5 ml salpeterzuur (punt 3.4), 2 ml ammoniumijzersulfaatoplossing (punt 3.3) en 2 druppels ammoniumthiocyanaatoplossing (punt 3.1) uit een tot op het nulpunt gevulde buret. Voeg daarna uit een buret zilvernitraatoplossing (punt 3.2) toe, totdat een overmaat van 5 ml aanwezig is. Voeg dan 5 ml di-ethylether (punt 3.5) toe en schud krachtig om het neerslag te doen samenklonteren. Titreer de overmaat zilvernitraat met ammoniumthiocyanaatoplossing (punt 3.1) totdat een roodbruine kleur ontstaat, die ten minste één minuut blijft.
6. Berekening van de resultaten
Bereken de hoeveelheid chloor (X), uitgedrukt als percentage natriumchloride, met de volgende formule:
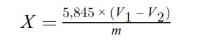
waarbij:
V1 = | ml toegevoegde zilvernitraatoplossing 0,1 mol/l; |
V2 == | ml ammoniumthiocyanaatoplossing 0,1 mol/l verbruikt bij de titratie; |
m == | gewicht van het monster in het aliquot, g. |
Indien een blancoproef een verbruik aan zilvernitraatoplossing 0,1 mol/l oplevert, wordt deze waarde van het volume (V1 — V2) afgetrokken.
7. Opmerkingen
- 7.1.
De titratie kan ook potentiometrisch of amperometrisch uitgevoerd worden.
- 7.2.
Producten met een zeer hoog gehalte aan vet dienen tevoren met diethylether of met petroleumether ontvet te worden.
- 7.3.
Bij vismelen kan de titratie volgens Mohr uitgevoerd worden.
Voetnoten
Voor het drogen van granen, meel, grutten en gries moet de oven een zodanige warmtecapaciteit hebben dat, indien zij is voorverwarmd op 131 °C, deze temperatuur na het inzetten van het maximale aantal monsters weer binnen 45 minuten wordt bereikt. De ventilatie moet zodanig zijn dat wanneer het maximale aantal monsters zachte tarwe gedurende twee uur wordt gedroogd, de resultaten minder dan 0,15 % verschillen van de resultaten na vier uur drogen.
Voor meer details over de berekening wordt verwezen naar EN ISO 6498 — Diervoeders — Richtlijnen voor de bereiding van analysemonsters.
Het stikstofgehalte kan in alle diervoeders worden bepaald, maar conversiefactor 6,25 voor de berekening van het gehalte aan ruw eiwit is mogelijk niet van toepassing op voedermiddelen van insecten (lagere conversiefactor), en voor bepaalde voeders voor gezelschapsdieren en bloedplasma-eiwitten (hogere conversiefactor)
De analysemethode van EN 17180 kan worden toegepast als alternatieve methode voor officiële controles voor de bepaling van aminozuren in diervoeders die meer dan 10 % aminozuren bevatten.
Deze methode is voor voormengsels die meer dan 10 % toevoegingsmiddelen voor diervoeding bevatten niet door een ringonderzoek gevalideerd. Met de nodige kleine wijzigingen kan de methode echter ook op die matrices worden toegepast, mits zij vervolgens intern wordt gevalideerd. Nadere informatie is beschikbaar op https://ec.europa.eu/jrc/en/eurl/feed-additives/authorisation.
Neem, indien het vet later kwalitatief moet worden onderzocht, glasparels in plaats van stukjes puimsteen.
Verordening (EG) nr. 121/2008 van de Commissie van 11 februari 2008 tot vaststelling van een analysemethode ter bepaling van het zetmeelgehalte in bereidingen van de soort gebruikt voor het voederen van dieren (GN-code 2309) (PB L 37 van 12.2.2008, blz. 3).