Einde inhoudsopgave
Verordening (EG) Nr. 152/2009 tot vaststelling van de bemonsterings- en analysemethoden voor de officiële controle van diervoeders
Bijlage IV Analysemethoden ter controle van het gehalte aan toegelaten toevoegingsmiddelen in diervoeders
Geldend
Geldend vanaf 04-04-2024
- Bronpublicatie:
29-02-2024, PbEU L 2024, 2024/771 (uitgifte: 15-03-2024, regelingnummer: 2024/771)
- Inwerkingtreding
04-04-2024
- Bronpublicatie inwerkingtreding:
29-02-2024, PbEU L 2024, 2024/771 (uitgifte: 15-03-2024, regelingnummer: 2024/771)
- Vakgebied(en)
Agrarisch recht (V)
Gezondheidsrecht / Voedsel- en warenkwaliteit
(A) Bepaling van vitamine A
Vitamine A wordt bepaald volgens:
- —
de analysemethode van EN 17547 — Animal feeding stuffs: Methods of sampling and analysis — Determination of vitamin A, E and D (1) content — Method using solid phase extraction (SPE) clean-up and high-performance liquid chromatography (HPLC), of
- —
reversed-phase hogedrukvloeistofchromatografie (RP-HPLC) met uv- of fluorescentiedetectie, zoals beschreven in de volgende punten 1 tot en met 9.
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van vitamine A (retinol) in diervoeders. Onder vitamine A worden begrepen all-trans-retinylalcohol en de cis-isomeren daarvan die met deze methode worden bepaald. Het gehalte aan vitamine A wordt uitgedrukt in Internationale Eenheden (IE) per kg. 1 IE komt overeen met de activiteit van 0,300 μg all-trans-vitamine A-alcohol of 0,344 μg all-trans-vitamine A-acetaat of 0,550 μg all-trans-vitamine A-palmitaat.
De bepaalbaarheidsgrens is 2 000 IE vitamine A/kg.
2. Beginsel
Het monster wordt gehydrolyseerd met een ethanolische kaliumhydroxideoplossing waarna de vitamine A wordt geëxtraheerd met petroleumether. Het oplosmiddel wordt verwijderd door verdamping en het residu wordt opgelost in methanol en, indien noodzakelijk, verdund tot de gewenste concentratie. Het gehalte aan vitamine A wordt bepaald met reversed-phase hogedrukvloeistofchromatografie (RP-HPLC) met uv- of fluorescentiedetectie. De chromatografische parameters worden zodanig gekozen dat er geen scheiding optreedt tussen de all-trans-vitamine A-alcohol en de cis-isomeren ervan.
3. Reagentia
- 3.1.
Ethanol, σ = 96 %.
- 3.2.
Lichtpetroleum, kooktraject 40 °C-60 °C
- 3.3.
Methanol.
- 3.4.
Kaliumhydroxideoplossing, c = 50 g/100 ml.
- 3.5.
Natriumascorbaatoplossing, c = 10 g/100 ml (zie opmerking in punt 7.7).
- 3.6.
Natriumsulfide, Na2S · xH2O (x = 7–9).
- 3.6.1.
Natriumsulfideoplossing, c = 0,5 mol/l in glycerol, β = 120 g/l (voor x = 9) (zie opmerking in punt 7.8).
- 3.7.
Fenolftaleïneoplossing, c = 2 g/100 ml in ethanol (punt 3.1).
- 3.8.
Propaan-2-ol.
- 3.9.
Mobiele fase voor HPLC: mengsel van methanol (punt 3.3) en water, bv. 980 + 20 (V + V). De exacte verhouding wordt bepaald door de eigenschappen van de gebruikte kolom.
- 3.10.
Stikstof, zuurstofvrij.
- 3.11.
All-trans-vitamine A-acetaat, extra zuiver, met gecertificeerde activiteit, bv. 2,80 × 106 IE/g.
- 3.11.1.
Stamoplossing van all-trans-vitamine A-acetaat: weeg 50 mg vitamine A-acetaat (punt 3.10) tot op 0,1 mg nauwkeurig af in een maatkolf van 100 ml. Los op in propaan-2-ol (punt 3.8) en vul aan tot de streep met hetzelfde oplosmiddel. De nominale concentratie van deze oplossing is 1 400 IE vitamine A per ml. Het exacte gehalte dient te worden bepaald volgens 5.6.3.1.
- 3.12.
All-trans-vitamine A-palmitaat, extra zuiver, met gecertificeerde activiteit, bv. 1,80 × 106 IE/g.
- 3.12.1.
Stamoplossing van all-trans-vitamine A-palmitaat: weeg 80 mg vitamine A-palmitaat (punt 3.12) tot op 0,1 mg nauwkeurig af in een maatkolf van 100 ml. Los op in propaan-2-ol (punt 3.8) en vul aan tot de streep met hetzelfde oplosmiddel. De nominale concentratie van deze oplossing is 1 400 IE vitamine A per ml. Het exacte gehalte dient te worden bepaald volgens 5.6.3.2.
- 3.13.
2,6-Di-tert-butyl-4-methylfenol (BHT) (zie opmerking in punt 7.5).
4. Apparatuur
- 4.1.
Rotatieverdamper.
- 4.2.
Bruin glaswerk:
- 4.2.1.
Platbodemkolven of erlenmeyers, 500 ml, met slijpstuk.
- 4.2.2.
Maatkolven met geslepen stop en een smalle hals, 10, 25, 100 en 500 ml.
- 4.2.3.
Scheitrechters, 1 000 ml, met geslepen stop.
- 4.2.4.
Peervormige kolven, 250 ml, met slijpstuk.
- 4.3.
Allihn-condensor, huislengte 300 mm, met slijpstuk en adapter voor gasaanvoerleiding.
- 4.4.
Papieren vouwfilter voor fasescheiding, diameter 185 mm (bv. Schleicher & Schuell 597 HY 1/2).
- 4.5.
HPLC-apparatuur met injectiesysteem:
- 4.5.1.
HPLC-kolom, 250 mm × 4 mm, C18, vulling van 5 of 10 μm, of een gelijkwaardige kolom (prestatiecriterium: slechts één piek voor alle retinolisomeren onder de HPLC-condities).
- 4.5.2.
Uv- of fluorescentiedetector met variabele golflengte.
- 4.6.
Spectrofotometer met kwartscuvetten van 10 mm.
- 4.7.
Waterbad met magneetroerder.
- 4.8.
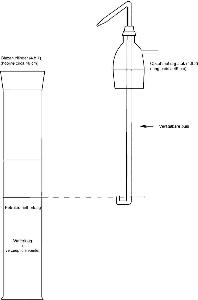
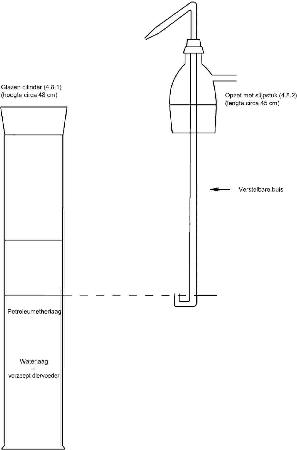
Extractieapparatuur (zie figuur 1) bestaande uit:
- 4.8.1.
Glazen cilinder met een inhoud van 1 l, voorzien van een hals en stop van geslepen glas
- 4.8.2.
Opzet met slijpstuk, voorzien van een zijarm en een verstelbare buis door het midden. De verstelbare buis moet een U-vormig benedenuiteinde hebben en een uitstroomopening aan het andere uiteinde, zodat de bovenste vloeistoflaag in de cilinder kan overlopen naar een scheitrechter.
5. Werkwijze
NB: | Vitamine A is gevoelig voor (uv-)licht en oxidatie. Alle bewerkingen moeten plaatsvinden buiten de invloed van licht (met bruin glaswerk of glaswerk dat is beschermd met aluminiumfolie) en zuurstof (spoelen met stikstof). Tijdens de extractie dient de lucht boven de vloeistof te worden vervangen door stikstof (voorkom overdruk door de stop af en toe even los te maken). |
5.1. Monstervoorbewerking
Maal het monster zo fijn dat het een zeef met mazen van 1 mm kan passeren, en zorg dat er geen warmte vrijkomt. Het malen dient onmiddellijk voorafgaand aan het wegen en verzepen te geschieden, daar er anders vitamine A-verliezen kunnen optreden. Indien de deeltjesgrootte gelijkmatig is verdeeld (bv. voormengsels en toevoegingsmiddelen voor diervoeding), worden de monsters niet gemalen.
5.2. Verzeping
Weeg, afhankelijk van het vitamine A-gehalte, tussen 2 en 25 g van het monster tot op 1 mg nauwkeurig af in een platbodemkolf of erlenmeyer van 500 ml (punt 4.2.1). Bij lage concentraties kan het gewicht van het monster worden verhoogd om voldoende deeltjes in het monster te hebben. Voeg achtereenvolgens al roerend 130 ml ethanol (punt 3.1), ongeveer 100 mg BHT (punt 3.13), 2 ml natriumascorbaatoplossing (punt 3.5) en 2 ml natriumsulfideoplossing (punt 3.6) toe. Sluit een condensor (punt 4.3) aan op de kolf en dompel de kolf in een waterbad met magneetroerder (punt 4.7). Breng het mengsel aan de kook en laat het 5 minuten refluxen. Voeg daarna 25 ml kaliumhydroxideoplossing (punt 3.4) toe via de condensor (punt 4.3) en laat het mengsel nog eens 25 minuten terugvloeien, al roerend onder een trage stikstofstroom. Spoel vervolgens de condensor met circa 20 ml water en laat de inhoud van de kolf afkoelen tot kamertemperatuur.
5.3. Extractie
Giet de verzepingsoplossing al spoelend met in totaal 250 ml water kwantitatief over in een scheitrechter van 1 000 ml (punt 4.2.3) of in de extractieapparatuur (punt 4.8). Spoel de verzepingsmaatkolf achtereenvolgens met 25 ml ethanol (punt 3.1) en 100 ml petroleumether (punt 3.2) en giet het uitspoelsel over in de scheitrechter of de extractieapparatuur. De verhouding van water en ethanol in de gecombineerde oplossingen dient ongeveer 2:1 te zijn. Schud het mengsel krachtig gedurende 2 minuten en laat het daarna 2 minuten staan om het te laten bezinken.
5.3.1. Extractie met een scheitrechter (punt 4.2.3)
Breng na scheiding van de lagen (zie opmerking in punt 7.3) de petroleumether over in een andere scheitrechter (punt 4.2.3). Herhaal deze extractie tweemaal met 100 ml petroleumether (punt 3.2) en tweemaal met 50 ml petroleumether (punt 3.2).
Was de gecombineerde extracten tweemaal in de scheitrechter onder voorzichtig omzwenken (om emulsievorming tegen te gaan) met hoeveelheden van 100 ml water en vervolgens onder herhaaldelijk schudden met telkens nieuwe hoeveelheden van 100 ml water, totdat het water kleurloos blijft bij toevoeging van fenolftaleïneoplossing (punt 3.7) (viermaal wassen is gewoonlijk voldoende). Filtreer het gewassen extract door een droog vouwfilter voor fasescheiding (punt 4.4) in een maatkolf van 500 ml (punt 4.2.2) om eventueel aanhangend water te verwijderen. Spoel de scheitrechter en het filter met 50 ml petroleumether (punt 3.2), vul aan tot de streep met petroleumether (punt 3.2) en meng goed.
5.3.2. Extractie met extractieapparatuur (punt 4.8)
Vervang na scheiding van de lagen (zie opmerking in punt 7.3) de stop van de glazen cilinder (punt 4.8.1) door de opzet (punt 4.8.2) en plaats het U-vormige benedenuiteinde van de verstelbare buis zodanig dat het zich juist boven het niveau van het scheidingsvlak bevindt. Breng, onder toepassing van druk uit een stikstofleiding op de zijarm, de bovenste laag petroleumether over in een scheitrechter van 1 000 ml (punt 4.2.3). Voeg 100 ml petroleumether (punt 3.2) toe aan de glazen cilinder, doe de stop erop en schud goed. Wacht tot de lagen gescheiden zijn en breng de bovenste laag over in de scheitrechter zoals beschreven. Herhaal de extractieprocedure nog eens met 100 ml petroleumether (punt 3.2), daarna nog tweemaal met telkens 50 ml petroleumether (punt 3.2) en breng de petroleumetherlagen over in de scheitrechter.
Was de gecombineerde petroleumetherextracten zoals beschreven in 5.3.1 en ga verder te werk zoals daar beschreven.
5.4. Bereiding van de monsteroplossing voor HPLC
Pipetteer een aliquot van het petroleumetherextract (uit 5.3.1 of 5.3.2) in een peervormige kolf van 250 ml (punt 4.2.4). Damp het oplosmiddel in tot het bijna droog is met de rotatievacuümverdamper (punt 4.1) bij gereduceerde druk en een badtemperatuur van hoogstens 40 °C. Herstel de atmosferische druk door toevoer van stikstof (punt 3.10) en neem de kolf uit de rotatieverdamper. Verwijder het resterende oplosmiddel met een stikstofstroom (punt 3.10) en los het residu onmiddellijk op in een bekend volume (10–100 ml) methanol (punt 3.3) (de concentratie vitamine A dient in het gebied van 5 IU/ml tot 30 IU/ml te liggen).
5.5. HPLC-bepaling
Vitamine A wordt afgescheiden in een C18 reversed-phase kolom (punt 4.5.1) en de concentratie wordt gemeten door middel van een uv-detector (325 nm) of fluorescentiedetector (excitatie: 325 nm, emissie: 475 nm) (punt 4.5.2).
Injecteer een aliquot (bv. 20 μl) van de oplossing in methanol die is verkregen in 5.4 en elueer met de mobiele fase (punt 3.9). Bereken de gemiddelde piekhoogte (-oppervlakte) van diverse injecties van dezelfde monsteroplossing en de gemiddelde piekhoogte (-oppervlakte) van diverse injecties van de ijkoplossingen (punt 5.6.2).
HPLC-condities
De volgende condities worden als leidraad aangegeven; er mogen andere parameters worden gebruikt mits hiermee gelijkwaardige resultaten worden verkregen:
HPLC-kolom (punt 4.5.1): | 250 mm × 4 mm, C18, vulling van 5 of 10 μm, of een gelijkwaardige kolom; |
mobiele fase (punt 3.9): | mengsel van methanol (punt 3.3) en water, bv. 980 + 20 (V + V); |
elutiesnelheid: | 1–2 ml/minuut; |
detector (punt 4.5.2): | uv-detector (325 nm) of fluorescentiedetector (excitatie: 325 nm, emissie: 475 nm) |
5.6. IJking
5.6.1. Bereiding van de standaard-werkoplossingen
Pipetteer 20 ml van de vitamine A-acetaat-stamoplossing (punt 3.11.1) of 20 ml van de vitamine A-palmitaat-stamoplossing (punt 3.12.1) in een platbodemkolf of erlenmeyer van 500 ml (punt 4.2.1) en hydrolyseer zoals beschreven onder 5.2, echter zonder toevoeging van BHT. Extraheer vervolgens met petroleumether (punt 3.2) volgens 5.3 en vul tot 500 ml aan met petroleumether (punt 3.2). Damp 100 ml van dit extract met de rotatieverdamper (zie 5.4) in tot het bijna droog is, verwijder het resterende oplosmiddel met een stikstofstroom (punt 3.10) en neem het residu op in 10,0 ml methanol (punt 3.3). De nominale concentratie van deze oplossing is 560 IE vitamine A per ml. Het exacte gehalte dient te worden bepaald volgens 5.6.3.3. De standaard-werkoplossing moet vóór gebruik vers worden bereid.
Pipetteer 2,0 ml van deze standaard-werkoplossing in een maatkolf van 20 ml, vul aan tot de streep met methanol (punt 3.3) en meng. De nominale concentratie van deze verdunde standaard-werkoplossing is 56 IE vitamine A per ml.
5.6.2. Bereiding van de ijkoplossingen en tekenen van de ijkgrafiek
Breng 1,0, 2,0, 5,0 en 10,0 ml van de verdunde standaard-werkoplossing over in een reeks maatkolven van 20 ml, vul aan tot de streep met methanol (punt 3.3) en meng. De nominale concentraties van deze oplossingen zijn 2,8, 5,6, 14,0 en 28,0 IE vitamine A per ml.
Injecteer diverse malen 20 μl van iedere ijkoplossing en bepaal de gemiddelde piekhoogten (-oppervlakten). Maak met de gemiddelde piekhoogten (-oppervlakten) een ijkgrafiek, rekening houdend met de resultaten van de uv-controle (punt 5.6.3.3).
5.6.3. Uv-standaardisatie van de standaardoplossingen
5.6.3.1. Vitamine A-acetaat-stamoplossing
Pipetteer 2,0 ml van de vitamine A-acetaat-stamoplossing (punt 3.11.1) in een maatkolf van 50 ml (punt 4.2.2) en vul aan tot de streep met propaan-2-ol (punt 3.8). De nominale concentratie van deze oplossing is 56 IE vitamine A per ml. Pipetteer 3,0 ml van deze verdunde vitamine A-acetaatoplossing in een maatkolf van 25 ml en vul aan tot de streep met propaan-2-ol (punt 3.8). De nominale concentratie van deze oplossing is 6,72 IE vitamine A per ml. Neem met de spectrofotometer (punt 4.6) het uv-spectrum van deze oplossing tussen 300 nm en 400 nm op tegen propaan-2-ol (punt 3.8). Het extinctiemaximum moet tussen 325 nm en 327 nm liggen.
Berekening van het vitamine A-gehalte:
IE vitamine A/ml = E326 × 19,0
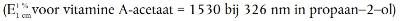
5.6.3.2. Vitamine A-palmitaat-stamoplossing
Pipetteer 2,0 ml van de vitamine A-palmitaat-stamoplossing (punt 3.12.1) in een maatkolf van 50 ml (punt 4.2.2) en vul aan tot de streep met propaan-2-ol (punt 3.8). De nominale concentratie van deze oplossing is 56 IE vitamine A per ml. Pipetteer 3,0 ml van deze verdunde vitamine A-palmitaatoplossing in een maatkolf van 25 ml en vul aan tot de streep met propaan-2-ol (punt 3.8). De nominale concentratie van deze oplossing is 6,72 IE vitamine A per ml. Neem met de spectrofotometer (punt 4.6) het uv-spectrum van deze oplossing tussen 300 nm en 400 nm op tegen propaan-2-ol (punt 3.8). Het extinctiemaximum moet tussen 325 nm en 327 nm liggen.
Berekening van het vitamine A-gehalte:
IE vitamine A/ml = E326 × 19,0
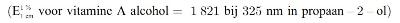
5.6.3.3. Vitamine A-standaard-werkoplossing
Pipetteer 3,0 ml van de onverdunde vitamine A-standaard-werkoplossing die is bereid volgens 5.6.1 in een maatkolf van 50 ml (punt 4.2.2) en vul aan tot de streep met propaan-2-ol (punt 3.8). Pipetteer 5,0 ml van deze oplossing in een maatkolf van 25 ml en vul aan tot de streep met propaan-2-ol (punt 3.8). De nominale concentratie van deze oplossing is 6,72 IE vitamine A per ml. Neem met de spectrofotometer (punt 4.6) het uv-spectrum van deze oplossing tussen 300 nm en 400 nm op tegen propaan-2-ol (punt 3.8). Het extinctiemaximum moet tussen 325 nm en 327 nm liggen.
Berekening van het vitamine A-gehalte:
IE vitamine A/ml = E325 × 18,3
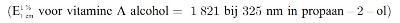
6. Berekening van de resultaten
Bepaal de concentratie van de monsteroplossing in IE/ml uit de gemiddelde hoogte (oppervlakte) van de vitamine A-pieken van de monsteroplossing aan de hand van de ijkgrafiek (punt 5.6.2).
Het vitamine A-gehalte w in IE/kg van het monster wordt verkregen met de volgende formule:
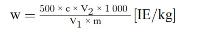
waarbij:
c = | vitamine A-concentratie van de monsteroplossing (punt 5.4) in IE/ml; |
V1 = | volume van de monsteroplossing (punt 5.4) in ml; |
V2 = | volume van het in 5.4 genomen aliquot in ml; |
m = | massa van het analysemonster in g. |
7. Opmerkingen
- 7.1.
Voor monsters met een lage vitamine A-concentratie kan het zinvol zijn de petroleumetherextracten van twee verzepingsfracties (gewogen hoeveelheid: 25 g) voor de HPLC-bepaling te combineren tot één monsteroplossing.
- 7.2.
Het voor de analyse ingewogen monster mag niet meer dan 2 g vet bevatten.
- 7.3.
Als er geen fasescheiding optreedt, voeg dan circa 10 ml ethanol (punt 3.1) toe om de emulsie te breken.
- 7.4.
Met levertraan en andere zuivere vetten dient de verzepingstijd te worden verlengd tot 45–60 minuten.
- 7.5.
In plaats van BHT mag ook hydrochinon worden gebruikt.
- 7.6.
Met een normalefasekolom kunnen de retinolisomeren van elkaar worden gescheiden. In dat geval moeten bij de berekeningen de piekhoogten (-oppervlakten) van alle cis- en trans-isomeren bij elkaar worden opgeteld.
- 7.7.
In plaats van natriumascorbaatoplossing mag ook circa 150 mg ascorbinezuur worden gebruikt.
- 7.8.
In plaats van natriumsulfideoplossing mag ook circa 50 mg EDTA worden gebruikt.
- 7.9.
Bij de analyse van vitamine A in melkvervangers moet op het volgende worden gelet:
- —
bij de verzeping (punt 5.2): als gevolg van de hoeveelheid vet in het monster is mogelijk een grotere hoeveelheid kaliumhydroxideoplossing (punt 3.4) nodig;
- —
bij de extractie (punt 5.3): in verband met de aanwezigheid van emulsies kan het nodig zijn de verhouding water/ethanol van 2:1 te wijzigen.
Om na te gaan of de gebruikte analysemethode in deze specifieke matrix (melkvervanger) betrouwbare resultaten geeft, moet een analyseportie worden gebruikt om de terugvinding te bepalen. Als het terugvindingspercentage kleiner dan 80 % is, moet het analyseresultaat voor terugvinding gecorrigeerd worden.
8. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer dan 15 % van het hoogste resultaat bedragen.
9. Resultaten van een ringonderzoek (2)
Voormengsel | Voeder met voormengsel | Mineraalconcentraat | Eiwitvoeder | Biggenvoeder | |
|---|---|---|---|---|---|
L | 13 | 12 | 13 | 12 | 13 |
n | 48 | 45 | 47 | 46 | 49 |
gemiddelde [IE/kg] | 17,02 × 106 | 1,21 × 106 | 537 100 | 151 800 | 18 070 |
sr [IE/kg] | 0,51 × 106 | 0,039 × 106 | 22 080 | 12 280 | 682 |
r [IE/kg] | 1,43 × 106 | 0,109 × 106 | 61 824 | 34 384 | 1 910 |
CVr [%] | 3,0 | 3,5 | 4,1 | 8,1 | 3,8 |
sR [IE/kg] | 1,36 × 106 | 0,069 × 106 | 46 300 | 23 060 | 3 614 |
R [IE/kg] | 3,81 × 106 | 0,193 × 106 | 129 640 | 64 568 | 10 119 |
CVR [%] | 8,0 | 6,2 | 8,6 | 15 | 20 |
L: aantal laboratoria n: aantal bepalingen sr: standaardafwijking van de herhaalbaarheid; sR: standaardafwijking van de reproduceerbaarheid; r: herhaalbaarheid R: reproduceerbaarheid CVr: variatiecoëfficiënt van de herhaalbaarheid; CVR: variatiecoëfficiënt van de reproduceerbaarheid. | |||||
Figuur 1 Extractieapparatuur (4.8)
(B) Bepaling van vitamine E
Vitamine E wordt bepaald volgens:
- —
de analysemethode van EN 17547 — Animal feeding stuffs: Methods of sampling and analysis — Determination of vitamin A, E and D (3) content — Method using solid phase extraction (SPE) clean-up and high-performance liquid chromatography (HPLC), of
- —
reversed-phase hogedrukvloeistofchromatografie (RP-HPLC) met uv- of fluorescentiedetectie, zoals beschreven in de volgende punten 1 tot en met 9.
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan vitamine E in diervoeders. Het gehalte aan vitamine E wordt uitgedrukt in mg DL-α-tocoferolacetaat per kg. 1 mg DL-α-tocoferolacetaat komt overeen met 0,91 mg DL-α-tocoferol (vitamine E).
De bepaalbaarheidsgrens is 2 mg vitamine E/kg. Deze bepaalbaarheidsgrens kan alleen worden gehaald met een fluorescentiedetector. Met een uv-detector is de bepaalbaarheidsgrens 10 mg/kg.
2. Beginsel
Het monster wordt gehydrolyseerd met een ethanolische kaliumhydroxideoplossing en de vitamine E wordt geëxtraheerd met petroleumether. Het oplosmiddel wordt verwijderd door verdamping en het residu wordt opgelost in methanol en, indien noodzakelijk, verdund tot de gewenste concentratie. Het gehalte aan vitamine E wordt bepaald door reversed-phase hogedrukvloeistofchromatografie (RP-HPLC) met fluorescentie- of uv-detectie.
3. Reagentia
- 3.1.
Ethanol, σ = 96 %.
- 3.2.
>ISO_1>Lichtpetroleum, kooktraject 40 °C-60 °C
- 3.3.
Methanol.
- 3.4.
Kaliumhydroxideoplossing, c = 50 g/100 ml.
- 3.5.
Natriumascorbaatoplossing, c = 10 g/100 ml (zie opmerking in punt 7.7).
- 3.6.
Natriumsulfide, Na2S · xH2O (x = 7–9).
- 3.6.1.
Natriumsulfideoplossing, c = 0,5 mol/l in glycerol, β = 120 g/l (voor x = 9) (zie opmerking in punt 7.8).
- 3.7.
Fenolftaleïneoplossing, c = 2 g/100 ml in ethanol (punt 3.1).
- 3.8.
Mobiele fase voor HPLC: mengsel van methanol (punt 3.3) en water, bv. 980 + 20 (V + V). De exacte verhouding wordt bepaald door de eigenschappen van de gebruikte kolom.
- 3.9.
Stikstof, zuurstofvrij.
- 3.10.
DL-α-tocoferolacetaat, extra zuiver, met gecertificeerde activiteit.
- 3.10.1.
Stamoplossing van DL-α-tocoferolacetaat: weeg 100 mg DL-α-tocoferolacetaat (punt 3.10) tot op 0,1 mg nauwkeurig af in een maatkolf van 100 ml. Los op in ethanol (punt 3.1) en vul aan tot de streep met hetzelfde oplosmiddel. 1 ml van deze oplossing bevat 1 mg DL-α-tocoferolacetaat. (uv-controle: zie 5.6.1.3; stabilisatie: zie opmerking in punt 7.4).
- 3.11.
DL-α-tocoferol, extra zuiver, met gecertificeerde activiteit.
- 3.11.1.
Stamoplossing van DL-α-tocoferol: weeg 100 mg DL-α-tocoferol (punt 3.10) tot op 0,1 mg nauwkeurig af in een maatkolf van 100 ml. Los op in ethanol (punt 3.1) en vul aan tot de streep met hetzelfde oplosmiddel. 1 ml van deze oplossing bevat 1 mg DL-α-tocoferol. (uv-controle: zie 5.6.2.3; stabilisatie: zie opmerking in punt 7.4).
- 3.12.
2,6-Di-tert-butyl-4-methylfenol (BHT) (zie opmerking in punt 7.5).
4. Apparatuur
- 4.1.
Rotatieverdamper.
- 4.2.
Bruin glaswerk:
- 4.2.1.
Platbodemkolven of erlenmeyers, 500 ml, met slijpstuk.
- 4.2.2.
Maatkolven met geslepen stop en een smalle hals, 10, 25, 100 en 500 ml.
- 4.2.3.
Scheitrechters, 1 000 ml, met geslepen stop.
- 4.2.4.
Peervormige kolven, 250 ml, met slijpstuk.
- 4.3.
Allihn-condensor, huislengte 300 mm, met slijpstuk en adapter voor gasaanvoerleiding.
- 4.4.
Papieren vouwfilter voor fasescheiding, diameter 185 mm (bv. Schleicher & Schuell 597 HY 1/2).
- 4.5.
HPLC-apparatuur met injectiesysteem:
- 4.5.1.
HPLC-kolom, 250 mm × 4 mm, C18, vulling van 5 of 10 μm of een gelijkwaardige kolom.
- 4.5.2.
Fluorescentie- of UV-detector met variabele golflengte
- 4.6.
Spectrofotometer met kwartscuvetten van 10 mm.
- 4.7.
Waterbad met magneetroerder.
- 4.8.
Extractieapparatuur (zie figuur 2) bestaande uit:
- 4.8.1.
Glazen cilinder met een inhoud van 1 l, voorzien van een hals en stop van geslepen glas
- 4.8.2.
Opzet met slijpstuk, voorzien van een zijarm en een verstelbare buis door het midden. De verstelbare buis moet een U-vormig benedenuiteinde hebben en een uitstroomopening aan het andere uiteinde, zodat de bovenste vloeistoflaag in de cilinder kan overlopen naar een scheitrechter.
5. Werkwijze
NB: | Vitamine E is gevoelig voor (uv-)licht en oxidatie. Alle bewerkingen moeten plaatsvinden buiten de invloed van licht (met bruin glaswerk of glaswerk dat is beschermd met aluminiumfolie) en zuurstof (spoelen met stikstof). Tijdens de extractie dient de lucht boven de vloeistof te worden vervangen door stikstof (voorkom overdruk door de stop af en toe even los te maken). |
5.1. Monstervoorbewerking
Maal het monster zo fijn dat het een zeef met mazen van 1 mm kan passeren, en zorg dat er geen warmte vrijkomt. Het malen dient onmiddellijk voorafgaand aan het wegen en verzepen te geschieden, daar er anders vitamine E-verliezen kunnen optreden.
5.2. Verzeping
Weeg, afhankelijk van het vitamine E-gehalte, tussen 2 en 25 g van het monster tot op 0,01 g nauwkeurig af in een kolf of erlenmeyer van 500 ml (punt 4.2.1). Voeg achtereenvolgens al roerend 130 ml ethanol (punt 3.1), ongeveer 100 mg BHT (punt 3.12), 2 ml natriumascorbaatoplossing (punt 3.5) en 2 ml natriumsulfideoplossing (punt 3.6) toe. Sluit een condensor (punt 4.3) aan op de kolf en dompel de kolf in een waterbad met magneetroerder (punt 4.7). Breng het mengsel aan de kook en laat het 5 minuten refluxen. Voeg daarna 25 ml kaliumhydroxideoplossing (punt 3.4) toe via de condensor (punt 4.3) en laat het mengsel nog eens 25 minuten terugvloeien, al roerend onder een trage stikstofstroom. Spoel vervolgens de condensor met circa 20 ml water en laat de inhoud van de kolf afkoelen tot kamertemperatuur.
5.3. Extractie
Giet de verzepingsoplossing al spoelend met in totaal 250 ml water kwantitatief over in een scheitrechter van 1 000 ml (punt 4.2.3) of in de extractieapparatuur (punt 4.8). Spoel de verzepingsmaatkolf achtereenvolgens met 25 ml ethanol (punt 3.1) en 100 ml petroleumether (punt 3.2) en giet het uitspoelsel over in de scheitrechter of de extractieapparatuur. De verhouding van water en ethanol in de gecombineerde oplossingen dient ongeveer 2:1 te zijn. Schud het mengsel krachtig gedurende 2 minuten en laat het daarna 2 minuten staan om het te laten bezinken.
5.3.1. Extractie met een scheitrechter (punt 4.2.3)
Breng na scheiding van de lagen (zie opmerking in punt 7.3) de petroleumether over in een andere scheitrechter (punt 4.2.3). Herhaal deze extractie tweemaal met 100 ml petroleumether (punt 3.2) en tweemaal met 50 ml petroleumether (punt 3.2).
Was de gecombineerde extracten tweemaal in de scheitrechter onder voorzichtig omzwenken (om emulsievorming tegen te gaan) met hoeveelheden van 100 ml water en vervolgens onder herhaaldelijk schudden met telkens nieuwe hoeveelheden van 100 ml water, totdat het water kleurloos blijft bij toevoeging van fenolftaleïneoplossing (punt 3.7) (viermaal wassen is gewoonlijk voldoende). Filtreer het gewassen extract door een droog vouwfilter voor fasescheiding (punt 4.4) in een maatkolf van 500 ml (punt 4.2.2) om eventueel aanhangend water te verwijderen. Spoel de scheitrechter en het filter met 50 ml petroleumether (punt 3.2), vul aan tot de streep met petroleumether (punt 3.2) en meng goed.
5.3.2. Extractie met extractieapparatuur (punt 4.8)
Vervang na scheiding van de lagen (zie opmerking in punt 7.3) de stop van de glazen cilinder (punt 4.8.1) door de opzet (punt 4.8.2) en plaats het U-vormige benedenuiteinde van de verstelbare buis zodanig dat het zich juist boven het niveau van het scheidingsvlak bevindt. Breng, onder toepassing van druk uit een stikstofleiding op de zijarm, de bovenste laag petroleumether over in een scheitrechter van 1 000 ml (punt 4.2.3). Voeg 100 ml petroleumether (punt 3.2) toe aan de glazen cilinder, doe de stop erop en schud goed. Wacht tot de lagen gescheiden zijn en breng de bovenste laag over in de scheitrechter zoals beschreven. Herhaal de extractieprocedure nog eens met 100 ml petroleumether (punt 3.2), daarna nog tweemaal met telkens 50 ml petroleumether (punt 3.2) en breng de petroleumetherlagen over in de scheitrechter.
Was de gecombineerde petroleumetherextracten zoals beschreven in 5.3.1 en ga verder te werk zoals daar beschreven.
5.4. Bereiding van de monsteroplossing voor HPLC
Pipetteer een aliquot van het petroleumetherextract (uit 5.3.1 of 5.3.2) in een peervormige kolf van 250 ml (punt 4.2.4). Damp het oplosmiddel in tot het bijna droog is met de rotatievacuümverdamper (punt 4.1) bij gereduceerde druk en een badtemperatuur van hoogstens 40 °C. Herstel de atmosferische druk door toevoer van stikstof (punt 3.9) en neem de kolf uit de rotatieverdamper. Verwijder het resterende oplosmiddel met een stikstofstroom (punt 3.9) en neem het residu onmiddellijk op in een bekend volume (10–100 ml) methanol (punt 3.3) (de concentratie DL-α-tocoferol moet tussen 5 en 30 μg/ml liggen).
5.5. HPLC-bepaling
Vitamine E wordt afgescheiden in een C18 reversed-phase kolom (punt 4.5.1) en de concentratie wordt gemeten door middel van een fluorescentiedetector (excitatie: 295 nm, emissie: 330 nm) of een uv-detector (292 nm) (punt 4.5.2).
Injecteer een aliquot (bv. 20 μl) van de oplossing in methanol die is verkregen in 5.4 en elueer met de mobiele fase (punt 3.8). Bereken de gemiddelde piekhoogte (-oppervlakte) van diverse injecties van dezelfde monsteroplossing en de gemiddelde piekhoogte (-oppervlakte) van diverse injecties van de ijkoplossingen (punt 5.6.2).
HPLC-condities
De volgende condities worden als leidraad aangegeven; er mogen andere parameters worden gebruikt mits hiermee gelijkwaardige resultaten worden verkregen:
HPLC-kolom 4.5.1): | 250 mm × 4 mm, C18, vulling van 5 of 10 μm of een gelijkwaardige kolom. |
mobiele fase (punt 3.8): | mengsel van methanol (punt 3.3) en water, bv. 980 + 20 (V + V); |
elutiesnelheid: | 1–2 ml/minuut; |
detector (punt 4.5.2): | fluorescentiedetector (excitatie: 295 nm, emissie: 330 nm) of uv-detector (292 nm) |
5.6. IJking (DL-α-tocoferolacetaat of DL-α-tocoferol)
5.6.1. DL-α-tocoferolacetaat-standaard
5.6.1.1. Bereiding van de standaard-werkoplossing
Pipetteer 25 ml van de DL-α-tocoferolacetaat-stamoplossing (punt 3.10.1) in een platbodemkolf of erlenmeyer van 500 ml (punt 4.2.1) en hydrolyseer zoals beschreven onder 5.2. Extraheer vervolgens met petroleumether (punt 3.2) volgens 5.3 en vul aan tot 500 ml met petroleumether. Damp 25 ml van dit extract met de rotatieverdamper (zie 5.4) in tot het bijna droog is, verwijder het resterende oplosmiddel met een stikstofstroom (punt 3.9) en neem het residu op in 25,0 ml methanol (punt 3.3). De nominale concentratie van deze oplossing is 45,5 μg DL-α-tocoferol per ml, wat overeenkomt met 50 g DL-α-tocoferolacetaat per ml. De standaard-werkoplossing moet vóór gebruik vers worden bereid.
5.6.1.2. Bereiding van de ijkoplossingen en tekenen van de ijkgrafiek
Breng 1,0, 2,0, 4,0 en 10,0 ml van de standaard-werkoplossing over in een reeks maatkolven van 20 ml, vul aan tot de streep met methanol (punt 3.3) en meng. De nominale concentraties van deze oplossingen zijn 2,5, 5,0, 10,0 en 25,0 μg/ml DL-α-tocoferolacetaat, d.w.z. 2,28, 4,55, 9,10 en 22,8 μg/ml DL-α-tocoferol.
Injecteer diverse malen 20 μl van iedere ijkoplossing en bepaal de gemiddelde piekhoogten (-oppervlakten). Maak met deze gemiddelde piekhoogten (-oppervlakten) een ijkgrafiek.
5.6.1.3. Uv-standaardisatie van de DL-α-tocoferolacetaat-stamoplossing (punt 3.10.1)
Verdun 5,0 ml van de DL-α-tocoferolacetaat-stamoplossing (punt 3.10.1) tot 25,0 ml met ethanol en neem met de spectrofotometer (punt 4.6) het uv-spectrum van deze oplossing tussen 250 nm en 320 nm op tegen ethanol (punt 3.1).
Het absorptiemaximum moet bij 284 nm liggen:
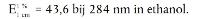
Bij deze verdunning moet een extinctiewaarde van 0,84 tot 0,88 worden verkregen.
5.6.2. DL-α-tocoferolacetaat-standaard
5.6.2.1. Bereiding van de standaard-werkoplossing
Pipetteer 2 ml van de DL-α-tocoferol-stamoplossing (punt 3.11.1) in een maatkolf van 50 ml, los op in methanol (punt 3.3) en vul aan tot de streep met methanol. De nominale concentratie van deze oplossing is 40 μg DL-α-tocoferol per ml, wat overeenkomt met 44,0 g DL-α-tocoferolacetaat per ml. De standaard-werkoplossing moet vóór gebruik vers worden bereid.
5.6.2.2. Bereiding van de ijkoplossingen en tekenen van de ijkgrafiek
Breng 1,0, 2,0, 4,0 en 10,0 ml van de standaard-werkoplossing over in een reeks maatkolven van 20 ml, vul aan tot de streep met methanol (punt 3.3) en meng. De nominale concentraties van deze oplossingen zijn 2,0, 4,0, 8,0 en 20,0 μg/ml DL-α-tocoferol, d.w.z. 2,20, 4,40, 8,79 en 22,0 μg/ml DL-α-tocoferol.
Injecteer diverse malen 20 μl van iedere ijkoplossing en bepaal de gemiddelde piekhoogten (-oppervlakten). Maak met deze gemiddelde piekhoogten (-oppervlakten) een ijkgrafiek.
5.6.2.3. Uv-standaardisatie van de DL-α-tocoferol-stamoplossing (punt 3.11.1)
Verdun 2,0 ml van de DL-α-tocoferol-stamoplossing (punt 3.11.1) tot 25,0 ml met ethanol en neem met de spectrofotometer (punt 4.6) het uv-spectrum van deze oplossing tussen 250 nm en 320 nm op tegen ethanol (punt 3.1). Het absorptiemaximum moet bij 292 nm liggen:
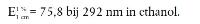
Bij deze verdunning moet een extinctiewaarde van 0,6 worden verkregen.
6. Berekening van de resultaten
Bepaal de concentratie van de monsteroplossing in μg/ml uit de gemiddelde hoogte (oppervlakte) van de vitamine E-pieken van de monsteroplossing (berekend als DL-α-tocoferolacetaat) aan de hand van de ijkgrafiek (punt 5.6.1.2 of 5.6.2.2).
Het vitamine E-gehalte w in mg/kg van het monster wordt verkregen met de volgende formule:
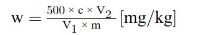
waarbij:
c = | vitamine E-concentratie (als DL-α-tocoferolacetaat) van de monsteroplossing (punt 5.4) in μg/ml; |
V1 = | volume van de monsteroplossing (punt 5.4) in ml; |
V2 = | volume van het in 5.4 genomen aliquot in ml; |
m = | massa van het analysemonster in g. |
7. Opmerkingen
- 7.1.
Voor monsters met een lage vitamine E-concentratie kan het zinvol zijn de petroleumetherextracten van twee verzepingsfracties (gewogen hoeveelheid: 25 g) voor de HPLC-bepaling te combineren tot één monsteroplossing.
- 7.2.
Het voor de analyse ingewogen monster mag niet meer dan 2 g vet bevatten.
- 7.3.
Als er geen fasescheiding optreedt, voeg dan circa 10 ml ethanol (punt 3.1) toe om de emulsie te breken.
- 7.4.
Voeg na de spectrofotometrische meting van de oplossing van DL-α-tocoferolacetaat respectievelijk DL-α-tocoferol volgens 5.6.1.3 of 5.6.2.3 circa 10 mg BHT (punt 3.12) aan de oplossing (punt 3.10.1 of 3.10.2) toe en bewaar de oplossing in een koelkast (maximale houdbaarheid: vier weken).
- 7.5.
In plaats van BHT mag ook hydrochinon worden gebruikt.
- 7.6.
Met een normalefasekolom kunnen α-, β-, γ- en δ-tocoferol van elkaar worden gescheiden.
- 7.7.
In plaats van natriumascorbaatoplossing mag ook circa 150 mg ascorbinezuur worden gebruikt.
- 7.8.
In plaats van natriumsulfideoplossing mag ook circa 50 mg EDTA worden gebruikt.
- 7.9.
Vitamine E-acetaat hydrolyseert in basisch milieu zeer snel en is daarom erg gevoelig voor oxidatie, met name in aanwezigheid van sporenelementen als ijzer of koper. Dat betekent dat bij de bepaling van vitamine E in voormengsels met een concentratie van meer dan 5 000 mg/kg afbraak van vitamine E kan optreden. Daarom wordt ter bevestiging een HPLC-methode met enzymatische afbraak van de vitamine E-formulering zonder verzeping aanbevolen.
8. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer dan 15 % van het hoogste resultaat bedragen.
9. Resultaten van een ringonderzoek (4)
Voormengsel | Voeder met voormengsel | Mineraalconcentraat | Eiwitvoeder | Biggenvoeder | |
|---|---|---|---|---|---|
L | 12 | 12 | 12 | 12 | 12 |
n | 48 | 48 | 48 | 48 | 48 |
gemiddelde [mg/kg] | 17 380 | 1 187 | 926 | 315 | 61,3 |
sr [mg/kg] | 384 | 45,3 | 25,2 | 13,0 | 2,3 |
r [mg/kg] | 1 075 | 126,8 | 70,6 | 36,4 | 6,4 |
CVr [%] | 2,2 | 3,8 | 2,7 | 4,1 | 3,8 |
sR mg/kg] | 830 | 65,0 | 55,5 | 18,9 | 7,8 |
R [mg/kg] | 2 324 | 182,0 | 155,4 | 52,9 | 21,8 |
CVR [%] | 4,8 | 5,5 | 6,0 | 6,0 | 12,7 |
L: aantal laboratoria n: aantal bepalingen sr: standaardafwijking van de herhaalbaarheid sR: standaardafwijking van de reproduceerbaarheid r: herhaalbaarheid R: reproduceerbaarheid CVr: variatiecoëfficiënt van de herhaalbaarheid CVR: variatiecoëfficiënt van de reproduceerbaarheid | |||||
Figuur 2 Extractieapparatuur (4.8)
(C) Bepaling van de sporenelementen ijzer, koper, mangaan en zink
IJzer, koper, mangaan en zink worden bepaald volgens:
- —
de analysemethode van EN 15510 Diervoeders: Methoden voor analyse en monsterneming — Bepaling van calcium, natrium, fosfor, magnesium, kalium, ijzer, zink, koper, mangaan, kobalt, molybdeen en lood met ICP-AES, of
- —
de analysemethode van EN 15621 Diervoeders: Methoden voor analyse en monsterneming — Bepaling van het gehalte aan calcium, natrium, fosfor, magnesium, kalium, zwavel, ijzer, zink, koper, mangaan en kobalt door ICP-AES na ontsluiting onder druk, of
- —
de analysemethode van EN 17053 Diervoeders: Methoden van bemonstering en analyse — Bepaling van sporenelementen, zware metalen en andere elementen in diervoeders door ICP-MS (multi-methode), of
- —
de analysemethode van EN ISO 6869 Diervoeders: Bepaling van de gehalten aan calcium, koper, ijzer, magnesium, mangaan, kalium, natrium en zink — Methode met gebruik van atomaireabsorptiespectrometrie, of
- —
De in de punten 1 tot en met 8 beschreven methode voor atomaireabsorptiespectrometrie (FAAS) met een vlam.
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van de sporenlementen ijzer, koper, mangaan en zink in diervoeders (5). De bepaalbaarheidsgrenzen zijn:
- —
ijzer (Fe): 20 mg/kg
- —
koper (Cu): 10 mg/kg
- —
mangaan (Mn): 20 mg/kg
- —
zink (Zn): 20 mg/kg
2. Beginsel
Het monster wordt, na destructie van eventueel aanwezig organisch materiaal, in zoutzuur opgelost. De elementen ijzer, koper, mangaan en zink worden na verdunning bepaald door middel van atoomabsorptiespectometrie.
3. Reagentia
Inleiding
Voor de bereiding van reagentia en analyseoplossingen moet water worden genomen waarin de te bepalen kationen niet voorkomen; dit kan worden bereid door het water tweemaal te destilleren in een destilleerapparaat van borosilicaatglas of kwarts, dan wel door het tweemaal te zuiveren met behulp van ionenwisselaars.
De reagentia moeten ten minste van analysekwaliteit zijn. De afwezigheid van het te bepalen element moet worden gecontroleerd door een blancobepaling. Zo nodig moeten de reagentia nog verder worden gezuiverd.
In plaats van de hieronder beschreven standaardoplossingen kunnen in de handel verkrijgbare standaardoplossingen worden gebruikt, waarvan de zuiverheid gegarandeerd en voor gebruik gecontroleerd is.
- 3.1.
Zoutzuur (d:1.19 g/ml).
- 3.2.
Zoutzuur (6 mol/l).
- 3.3.
Zoutzuur (0,5 mol/l).
- 3.4.
Fluorwaterstofzuur, 38 – 40 % (v/v), met een ijzergehalte van minder dan 1 mg/l en een indamprest (uitgedrukt als sulfaat) van minder dan 10 mg/l.
- 3.5.
Zwavelzuur (d: 1,84 g/ml).
- 3.6.
Waterstofperoxide (ongeveer 100 volumedelen zuurstof (30 % m/m)).
- 3.7.
Standaardijzeroplossing (1 000 μg Fe/ml), als volgt bereid of gelijkwaardige in de handel verkrijgbare oplossing: los 1 g ijzerdraad op in 200 ml zoutzuur 6 mol/l (punt 3.2), voeg 16 ml waterstofperoxide (punt 3.6) toe en vul aan met water tot 1 liter.
- 3.7.1.
Verdunde standaardijzeroplossing (100 μg Fe/ml), bereid door één deel standaardoplossing (punt 3.7) met negen delen water te verdunnen.
- 3.8.
Standaardkoperoplossing (1 000 μg Cu/ml), als volgt bereid of gelijkwaardige in de handel verkrijgbare oplossing:
- —
los 1 g koperpoeder op in 25 ml zoutzuur 6 mol/l (punt 3.2), voeg 5 ml waterstofperoxide (punt 3.6) toe en vul aan met water tot 1 liter.
- 3.8.1.
Verdunde standaardkoperoplossing (10 μg Cu/ml), bereid door één deel standaardoplossing (punt 3.8) met negen delen water te verdunnen en één deel van de aldus bereide oplossing wederom met negen delen water te verdunnen.
- 3.9.
Standaardmangaanoplossing (1 000 μg Mn/ml), als volgt bereid of gelijkwaardige in de handel verkrijgbare oplossing:
- —
los 1 g mangaanpoeder op in 25 ml zoutzuur 6 mol/l (punt 3.2) en vul aan met water tot 1 liter.
- 3.9.1.
Verdunde standaardmangaanoplossing (10 μg Mn/ml), bereid door één deel standaardoplossing (punt 3.9) met negen delen water te verdunnen en één deel van de aldus bereide oplossing wederom met negen delen water te verdunnen.
- 3.10.
Standaardzinkoplossing (1 000 μg Zn/ml), als volgt bereid of gelijkwaardige in de handel verkrijgbare oplossing:
- —
los 1 g zinkband of bladzink op in 25 ml zoutzuur 6 mol/l (punt 3.2) en vul aan met water tot 1 liter.
- 3.10.1.
Verdunde standaardzinkoplossing (10 μg Zn/ml), bereid door één deel standaardoplossing (punt 3.10) met negen delen water te verdunnen en één deel van de aldus bereide oplossing wederom met negen delen water te verdunnen.
- 3.11.
Lanthaanchlorideoplossing: los 12 g lanthaanoxide op in 150 ml water, voeg 100 ml zoutzuur 6 mol/l (punt 3.2) toe en vul aan met water tot 1 liter.
4. Apparatuur
- 4.1.
Moffeloven met temperatuurregelaar en bij voorkeur een pyrometer.
- 4.2.
Glaswerk van resistent borosilicaat. Aanbevolen wordt materiaal te nemen dat uitsluitend voor de bepaling van sporenelementen wordt gebruikt.
- 4.3.
Atoomabsorptiespectrofotometer die qua gevoeligheid en nauwkeurigheid in het betreffende meetgebied voldoet aan de eisen die in verband met de methode worden gesteld.
5. Werkwijze (6)
5.1. Monsters met organisch materiaal
5.1.1. Verassen en bereiden van de oplossing voor de analyse (7)
5.1.1.1
Weeg 5–10 g monster tot op 0,2 mg nauwkeurig af in een schaal van kwarts of platina (zie opmerking b), droog in de droogstoof bij 105 °C en plaats de schaal in de koude moffeloven (punt 4.1). Sluit de oven (zie opmerking c) en breng de temperatuur in ongeveer 90 minuten geleidelijk op 450–475 °C. Handhaaf deze temperatuur gedurende 4–16 uur (bijvoorbeeld ‘s nachts) zodat het koolstofhoudende materiaal verdwijnt; open vervolgens de moffeloven en laat afkoelen (zie opmerking d).
Bevochtig de inhoud van de schaal met water en breng deze over in een bekerglas van 250 ml. Spoel de schaal uit met in totaal ongeveer 5 ml zoutzuur (punt 3.1) en voeg dit langzaam en voorzichtig toe aan de inhoud van het bekerglas (de reactie kan hevig zijn doordat er CO2 ontstaat). Voeg onder roeren druppelsgewijs meer zoutzuur (punt 3.1) toe tot het bruisen ophoudt. Damp in tot droog onder nu en dan roeren met een glazen staaf.
Voeg vervolgens bij het residu 15 ml zoutzuur 6 mol/l (punt 3.2) toe en daarna ongeveer 120 ml water. Roer met de glazen roerstaaf en laat deze in het bekerglas staan; dek het bekerglas af met een horlogeglas. Breng de inhoud zachtjes aan de kook en houd aan de kook tot er geen as meer zichtbaar in de oplossing gaat. Filtreer over asvrij filtreerpapier en vang het filtraat op in een maatkolf van 250 ml. Spoel het bekerglas en het filtreerpapier uit met 5 ml heet zoutzuur 6 mol/l (punt 3.2) en tweemaal met kokend water. Vul aan tot de streep met water (de zoutzuurconcentratie is dan ongeveer 0,5 mol/l).
5.1.1.2
Indien het residu op het filtreerpapier zwart is (koolstof) breng het dan opnieuw in de moffeloven en veras weer bij 450 – 475 °C. Deze verassing, die slechts enkele uren duurt (ongeveer 3–5 uur), is voltooid zodra de as er wit of bijna wit uitziet. Neem het residu op met ongeveer 2 ml zoutzuur (punt 3.1), damp in tot droog en voeg 5 ml zoutzuur 6 mol/l (punt 3.2) toe. Verwarm de oplossing en filtreer deze in de maatkolf; vul aan tot de streep met water (de zoutzuurconcentratie is dan ongeveer 0,5 mol/l).
Opmerkingen:
- a)
Bij de bepaling van sporenelementen moet men bedacht zijn op het gevaar van contaminatie, vooral door zink, koper en ijzer. Daarom mogen deze metalen niet voorkomen in het materiaal dat voor de bereiding van de monsters wordt gebruikt.
Ter beperking van het algemene contaminatierisico moet worden gewerkt in een stofvrije atmosfeer met uiterst schone apparatuur en zorgvuldig gewassen glaswerk. Vooral de zinkbepaling is gevoelig voor verschillende soorten contaminatie, bv. door glaswerk, reagentia, stof enz.
- b)
De massa van het te verassen monster wordt berekend aan de hand van het te verwachten gehalte aan sporenelementen in het diervoeder, rekening houdend met de gevoeligheid van de te gebruiken spectrofotometer. Bij sommige diervoeders met een zeer laag gehalte aan sporenelementen kan het wellicht noodzakelijk zijn te beginnen met 10–20 g analysemateriaal en de uiteindelijke oplossing aan te vullen tot slechts 100 ml.
- c)
Het verassen moet worden uitgevoerd in een gesloten moffeloven zonder lucht- of zuurstoftoevoer.
- d)
De op de pyrometer afgelezen temperatuur mag niet meer bedragen dan 475 °C.
5.1.2. Spectrofotometrische bepaling
5.1.2.1. Bereiding van de ijkoplossingen
Bereid voor ieder te bepalen element op basis van de verdunde standaardoplossingen 3.7.1, 3.8.1, 3.9.1 en 3.10.1 een reeks ijkoplossingen, elk met een zoutzuurconcentratie van ongeveer 0,5 mol/l en (bij ijzer, mangaan en zink) een gehalte aan lanthaanchloride dat overeenkomt met 0,1 % La (m/V).
De gekozen gehaltes aan sporenelementen moeten binnen het gevoeligheidsbereik van de te gebruiken spectrofotometer liggen. In de onderstaande tabellen zijn bij wijze van voorbeeld de samenstellingen opgegeven van typische reeksen ijkoplossingen; naargelang van het type en de gevoeligheid van de gebruikte spectrofotometer kan het echter noodzakelijk zijn andere concentraties te kiezen.
μg Fe/ml | 0 | 0,5 | 1 | 2 | 3 | 4 | 5 |
ml verdunde standaardoplossing (punt 3.7.1) (1 ml = 100 μg Fe) | 0 | 0,5 | 1 | 2 | 3 | 4 | 5 |
ml HCl (punt 3.2) | 7 | 7 | 7 | 7 | 7 | 7 | 7 |
+ 10 ml lanthaanchlorideoplossing (punt 3.11), met water aanvullen tot 100 ml | |||||||
μg Cu/ml | 0 | 0,1 | 0,2 | 0,4 | 0,6 | 0,8 | 1,0 |
ml verdunde standaardoplossing (punt 3.8.1) (1 ml = 10 μg Cu) | 0 | 1 | 2 | 4 | 6 | 8 | 10 |
ml HCl (punt 3.2) | 8 | 8 | 8 | 8 | 8 | 8 | 8 |
μg Mn/ml | 0 | 0,1 | 0,2 | 0,4 | 0,6 | 0,8 | 1,0 |
ml verdunde standaardoplossing (punt 3.9.1) (1 ml = 10 μg Mn) | 0 | 1 | 2 | 4 | 6 | 8 | 10 |
ml HCl (punt 3.2) | 7 | 7 | 7 | 7 | 7 | 7 | 7 |
+ 10 ml lanthaanchlorideoplossing (punt 3.11), met water aanvullen tot 100 ml | |||||||
μg Zn/ml | 0 | 0,05 | 0,1 | 0,2 | 0,4 | 0,6 | 0,8 |
ml verdunde standaardoplossing (punt 3.10.1) (1 ml = 10 μg Zn) | 0 | 0,5 | 1 | 2 | 4 | 6 | 8 |
ml HCl (punt 3.2) | 7 | 7 | 7 | 7 | 7 | 7 | 7 |
+ 10 ml lanthaanchlorideoplossing (punt 3.11), met water aanvullen tot 100 ml | |||||||
5.1.2.2. Bereiding van de oplossingen voor de analyse
Voor de bepaling van koper kan de volgens 5.1.1 bereide oplossing in de regel rechtstreeks worden gebruikt. Indien het noodzakelijk is om het gehalte binnen de reeks van de ijkoplossingen te brengen, kan een aliquot van die oplossing worden gepipetteerd in een maatkolf van 100 ml die daarna tot de streep wordt aangevuld met zoutzuur 0,5 mol/l (punt 3.3).
Voor de bepaling van ijzer, mangaan en zink wordt een aliquot van de volgens 5.1.1 bereide oplossing gepipetteerd in een maatkolf van 100 ml, waarna 10 ml lanthaanchorideoplossing (punt 3.11) wordt toegevoegd en tot de streep wordt aangevuld met zoutzuur 0,5 mol/l (punt 3.3) (zie ook de opmerking onder 8).
5.1.2.3. Blancobepaling
Bij de blancobepaling moet de volledige werkwijze worden toegepast, maar dan zonder monstermateriaal. De ijkoplossing ‘0’ mag niet als blanco worden gebruikt.
5.1.2.4. Meting van de atoomabsorptie
Meet de atoomabsorptie van de ijkoplossingen en van de te analyseren oplossing met een oxiderende lucht-acetyleenvlam bij de volgende golflengten:
Fe: 248,3 nm;
Cu: 324,8 nm;
Mn: 279,5 nm;
Zn: 213,8 nm;
Voer iedere meting viermaal uit.
5.2. Minerale diervoeders
Indien het monster geen organisch materiaal bevat, is verassing vooraf overbodig. Handel dan als beschreven in 5.1.1.1, te beginnen met de tweede alinea. Indampen met waterstoffluorideoplossing kan worden overgeslagen.
6. Berekening van de resultaten
Bereken het gehalte aan sporenelementen in de te analyseren oplossing aan de hand van een ijkgrafiek. Druk de resultaten uit in mg sporenelement per kg monster (ppm).
7. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer bedragen dan:
- —
5 mg/kg absoluut, voor gehaltes aan het betrokken sporenelement van maximaal 50 mg/kg;
- —
10 % van het hoogste resultaat, voor gehaltes aan het betrokken sporenelement van 50 tot en met 100 mg/kg;
- —
10 mg/kg absoluut, voor gehaltes aan het betrokken sporenelement van 100 tot en met 200 mg/kg;
- —
5 % van het hoogste resultaat, voor gehaltes aan het betrokken sporenelement van meer dan 200 mg/kg.
8. Opmerking
De aanwezigheid van grote hoeveelheden fosfaten kan de bepaling van ijzer, mangaan en zink storen. Die storing kan worden weggenomen door toevoeging van lanthaanchlorideoplossing (punt 3.11). Indien echter de massaverhouding (Ca + Mg)/P groter dan 2 is, kan de toevoeging van lanthaanchlorideoplossing (punt 3.11) aan de te analyseren oplossing en de ijkoplossingen achterwege blijven.
(D) Bepaling van halofuginon
DL-trans-7-broom-6-chloor-3-[3-(3-hydroxy-2-piperidyl)acetonyl]chinazoline-4(3H)-on-hydrobromide
Het gehalte halofuginon wordt bepaald volgens:
- —
de analysemethode van EN 17299 Diervoeders: Bemonsterings- en analysemethoden — Screening en bepaling van toegestane coccidiostatica op het niveau van additieven en 1 % en 3 % kruisbesmetting, van niet-geregistreerde coccidiostatica, en van één antibioticum op subadditieve niveaus, in mengvoeders met hogedrukvloeistofchromatografie (HPLC) — Tandem massaspectrometrische detectie (LC-MS/MS), of
- —
reversed-phase hogedrukvloeistofchromatografie (HPLC) met uv-detectie, zoals beschreven in de volgende punten 1 tot en met 8.
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan halofuginon in diervoeders. De bepaalbaarheidsgrens is 1 mg/kg.
2. Beginsel
Na behandeling met heet water wordt halofuginon als vrije base in ethylacetaat geëxtraheerd en vervolgens als hydrochloride in zure waterige oplossing geëxtraheerd. Het extract wordt gezuiverd door middel van ionenwisselingschromatografie. Het gehalte aan halofuginon wordt bepaald met reversed-phase hogedrukvloeistofchromatografie (HPLC) met uv-detectie.
3. Reagentia
- 3.1.
Acetonitril, HPLC-kwaliteit of gelijkwaardig.
- 3.2.
Amberlite XAD-2 hars
- 3.3.
Ammoniumacetaat.
- 3.4.
Ethylacetaat
- 3.5.
IJsazijn
- 3.6.
Halofuginon standaardstof (4(3H)chinazolinon-7-broom-6-chloor-[3-(3-hydroxy-2-piperidyl)acetonyl]-dl-trans-hydrobromide, E 764)
- 3.6.1.
Standaardstockoplossing halofuginon, 100 μg/ml
Weeg 50 mg halofuginon (punt 3.6) tot op 0,1 mg nauwkeurig af in een maatkolf van 500 ml, los op in ammoniumacetaatbuffer (punt 3.18), vul aan tot de streep met bufferoplossing en meng. Deze oplossing is bij 5 °C in het donker drie weken houdbaar.
- 3.6.2.
IJkoplossingen
Breng in een reeks maatkolven van 100 ml respectievelijk 1,0, 2,0, 3,0, 4,0 en 6,0 ml stamoplossing (punt 3.6.1). Vul aan tot de streep met mobiele fase (punt 3.21) en meng. Deze oplossingen hebben concentraties van respectievelijk 1,0, 2,0, 3,0, 4,0 en 6,0 mg/ml halofuginon. Deze oplossingen moeten vóór gebruik vers worden bereid.
- 3.7.
Zoutzuur (ρ20 = 1,16 g/ml ongeveer).
- 3.8.
Methanol.
- 3.9.
Zilvernitraat
- 3.10.
Natriumascorbaat
- 3.11.
Natriumcarbonaat
- 3.12.
Natriumchloride
- 3.13.
EDTA (ethyleendiaminetetraazijnzuur, dinatriumzout)
- 3.14.
Water, HPLC-kwaliteit of gelijkwaardig
- 3.15.
Natriumcarbonaatoplossing, c = 10 g/100 ml
- 3.16.
Met natriumchloride verzadigde natriumcarbonaatoplossing, c = 5 g/100 ml.
Los 50 g natriumcarbonaat (punt 3.11) op in water, vul aan tot 1 liter en voeg natriumchloride (punt 3.12) toe tot de oplossing verzadigd is.
- 3.17.
Zoutzuur, ca. 0,1 mol/l
Vul 10 ml zoutzuur (punt 3.7) aan met water tot 1 liter.
- 3.18.
Ammoniumacetaatbuffer, ongeveer 0,25 mol/l.
Los 19,3 g ammoniumacetaat (punt 3.3) en 30 ml ijsazijn (punt 3.5) op in water (punt 3.14) en vul aan tot 1 liter.
- 3.19.
Bereiding Amberlite XAD-2-hars
Was een geschikte hoeveelheid Amberlite (punt 3.2) met water tot alle chloride-ionen zijn verwijderd, zoals vastgesteld met een zilvernitraatproef (punt 3.20) op het waswater. Was de hars daarna met 50 ml methanol (punt 3.8), doe de methanol weg en bewaar de hars onder verse methanol.
- 3.20.
Zilvernitraatoplossing, ca. 0,1 mol/l
Los 0,17 g zilvernitraat (punt 3.9) op in 10 ml water.
- 3.21.
Mobiele fase HPLC
Meng 500 ml acetonitril (punt 3.1) met 300 ml ammoniumacetaatbuffer (punt 3.18) en 1 200 ml water (punt 3.14). Breng de pH met azijnzuur (punt 3.5) op 4,3. Filtreer door een filter van 0,22 μm (punt 4.8) en ontgas de oplossing (bv. door 10 minuten ultrasoonbehandeling). De oplossing is in afgesloten toestand in het donker één maand houdbaar.
4. Apparatuur
- 4.1.
Ultrasoonbad.
- 4.2.
Rotatieverdamper.
- 4.3.
Centrifuge.
- 4.4.
HPLC-apparatuur met uv-detector met variabele golflengte of diodearraydetector.
- 4.4.1.
HPLC-kolom, 300 mm × 4 mm, C18, vulling van 10 μm of een gelijkwaardige kolom.
- 4.5.
Glazen kolom (300 mm × 10 mm) voorzien van een gesinterd-glasfilter en een kraan.
- 4.6.
Glasvezelfilters, diameter 150 mm.
- 4.7.
Membraanfilter, 0,45 μm.
- 4.8.
Membraanfilter, 0,22 μm.
5. Werkwijze
NB: | Halofuginon als vrije base is in basisch milieu en in ethylacetaat niet stabiel. Het mag niet langer dan 30 minuten in ethylacetaat blijven. |
5.1. Algemeen
- 5.1.1.
Er moet een blanco diervoeder worden geanalyseerd om te controleren of er geen halofuginon of storende stoffen aanwezig zijn.
- 5.1.2.
Het terugvindingspercentage moet worden bepaald door analyse van het blanco diervoeder waaraan een vergelijkbare hoeveelheid halofuginon is toegevoegd als aanwezig in het monster. Voor een gehalte van 3 mg/kg wordt 300 μl stamoplossing (punt 3.6.1) aan 10 g blanco diervoeder toegevoegd. Vervolgens wordt gemengd en 10 minuten gewacht alvorens de extractiestap (punt 5.2) uit te voeren.
NB:
Voor de toepassing van deze methode moet het blanco diervoeder van vergelijkbare soort zijn als het monster en mag hierin bij analyse geen halofuginon aantoonbaar zijn.
5.2. Extractie
Weeg 10 g van het voorbewerkte monster tot op 0,1 g nauwkeurig af in een centrifugebuis van 200 ml, voeg 0,5 g natriumascorbaat (punt 3.10), 0,5 g EDTA (punt 3.13) en 20 ml water toe en meng. Plaats de buis 5 minuten in een waterbad van 80 °C. Voeg na afkoelen tot kamertemperatuur 20 ml natriumcarbonaatoplossing (punt 3.15) toe en meng. Voeg direct daarna 100 ml ethylacetaat (punt 3.4) toe en schud 15 seconden krachtig met de hand. Plaats de buis daarna, met niet geheel afgesloten stop, 3 minuten in een ultrasoonbad (punt 4.1). Centrifugeer 2 minuten en decanteer daarna het ethylacetaat door een glasvezelfilter (punt 4.6) in een scheitrechter van 500 ml. Herhaal de extractie van het monster met een tweede portie van 100 ml ethylacetaat. Was de verzamelde extracten 1 minuut met 50 ml met natriumchloride verzadigde natriumcarbonaatoplossing (punt 3.16) en doe de waterlaag weg.
Extraheer de organische laag 1 minuut met 50 ml zoutzuur (punt 3.17). Breng de onderstaande waterige fase over in een scheitrechter van 250 ml. Extraheer de organische laag 1,5 minuut lang met nog eens 50 ml zoutzuur en voeg dit bij het eerste extract. Was de verzamelde zuurextracten door ongeveer 10 seconden omzwenken met 10 ml ethylacetaat (punt 3.4).
Breng de waterige fase kwantitatief over in een rondbodemkolf van 250 ml en doe de organische fase weg. Damp met een rotatieverdamper (punt 4.2) al het overblijvende ethylacetaat uit de oplossing af. De temperatuur van het waterbad mag niet hoger dan 40 °C zijn. Bij een verminderde druk van ca. 25 mbar is alle ethylacetaat bij 38 °C in 5 minuten verwijderd.
5.3. Clean-up
5.3.1. Voorbereiding van de Amberlite-kolom
Voor elk monsterextract wordt een XAD-2-kolom gemaakt. Breng 10 g bereide Amberlite (punt 3.19) met methanol (punt 3.8) in een glazen kolom (punt 4.5). Doe een propje glaswol bovenop het harsbed. Laat de methanol uit de kolom lopen en was de hars met 100 ml water, waarbij het vloeistofniveau boven het harsbed moet blijven. Laat de kolom voor gebruik 10 minuten equilibreren. Zorg ervoor dat de kolom nooit droog komt te staan.
5.3.2. Clean-up van monsterextract
Breng het extract (punt 5.2) kwantitatief over op de bovenkant van de voorbereide Amberlite-kolom (punt 5.3.1) en elueer de kolom; doe het eluaat weg. De elutiesnelheid mag niet meer dan 20 ml/minuut bedragen. Spoel de rondbodemkolf met 20 ml zoutzuur (punt 3.17) en gebruik de spoelvloeistof om de harskolom te spoelen. Blaas eventuele resten zuur door met een stroom lucht. Doe de spoelvloeistof weg. Breng 100 ml methanol (punt 3.8) op de kolom, laat 5–10 ml elueren en vang het eluaat op in een rondbodemkolf van 250 ml. Laat de rest van de methanol 10 min met de hars equilibreren, vervolg de elutie met een snelheid van niet meer dan 20 ml/min. en vang het eluaat op in dezelfde rondbodemkolf. Damp de methanol af met de rotatieverdamper (punt 4.2), waarbij de temperatuur van het waterbad niet boven 40 °C mag komen. Breng het residu met de mobiele fase (punt 3.21) kwantitatief over in een maatkolf van 10 ml. Vul aan tot de streep met mobiele fase en meng. Een deel wordt door een membraanfilter (punt 4.7) gefiltreerd. Gebruik deze oplossing voor de HPLC-bepaling (punt 5.4).
5.4. HPLC-bepaling
5.4.1. Parameters
De volgende condities worden als leidraad aangegeven; er mogen andere parameters worden gebruikt mits hiermee gelijkwaardige resultaten worden verkregen:
HPLC-kolom (punt 4.4.1);
mobiele fase voor HPLC (punt 3.21);
elutiesnelheid: 1,5–2 ml/minuut;
detectiegolflengte: 243 nm;
injectievolume: 40 – 100 μl.
Controleer de stabiliteit van het chromatografisch system door enige malen de ijkoplossing (punt 3.6.2) met 3,0 mg/ml te injecteren totdat constante piekhoogten (-oppervlakten) en retentietijden worden verkregen.
5.4.2. IJkgrafiek
Injecteer elke ijkoplossing (punt 3.6.2) enkele malen en meet voor elke concentratie de piekhoogten (-oppervlakten). Maak een ijkgrafiek met de gemiddelde piekhoogten of -oppervlakten als ordinaat en de bijbehorende concentraties in μg/ml als abscis.
5.4.3. Monsteroplossing
Injecteer het monsterextract (punt 5.3.2) enige malen, waarbij hetzelfde volume als voor de ijkoplossingen wordt gebruikt, en bepaal de gemiddelde piekhoogte (-oppervlakte) van de halofuginonpieken.
6. Berekening van de resultaten
Bepaal uit de gemiddelde hoogte (-oppervlakte) van de halofuginonpieken van de monsteroplossing op basis van de ijkgrafiek (punt 5.4.2) de concentratie van de monsteroplossing in μg/ml.
Het gehalte aan halofuginon w (mg/kg) wordt verkregen met de volgende formule:
w = c × 10 / m
waarbij:
c: | concentratie halofuginon van de monsteroplossing in μg/ml |
m: | massa van het analysemonster in g. |
7. Validatie van de resultaten
7.1. Identiteit
De identiteit van de geanalyseerde stof kan worden bevestigd door co-chromatografie of met een diode array detector, waarbij de spectra van het monsterextract en de ijkoplossing (punt 3.6.2) met 6,0 μg/ml worden vergeleken.
7.1.1. Cochromatografie
Voeg aan een deel van het monsterextract een geschikte hoeveelheid van een ijkoplossing (punt 3.6.2) toe. De toegevoegde hoeveelheid halofuginon moet ongeveer gelijk zijn aan de geschatte hoeveelheid halofuginon in het monsterextract.
Alleen de hoogte van de halofuginonpiek mag naar verhouding toenemen, rekening houdend met de toegevoegde hoeveelheid en de verdunning van het extract. De piekbreedte op de helft van de maximale hoogte moet binnen ± 10 % van de oorspronkelijke breedte liggen.
7.1.2. Diodearraydetectie
De resultaten worden op grond van de volgende criteria beoordeeld:
- a)
de golflengten van de absorptiemaxima van de spectra van het monster en de standaard, gemeten op de top van de chromatografische piek, moeten overeenkomen binnen een marge die wordt bepaald door het oplossend vermogen van het detectiesysteem. Voor diodearraydetectie is deze marge meestal ± 2 nm;
- b)
Tussen 225 en 300 nm mogen de spectra van het monster en de standaard, gemeten op de top van de chromatografische piek, voor het gedeelte van de spectra met een relatieve absorptie van 10–100 % niet van elkaar verschillen. Aan dit criterium is voldaan wanneer dezelfde maxima aanwezig zijn en de afwijking tussen de twee spectra op geen enkel punt meer dan 15 % van de extinctie van de standaard bedraagt;
- c)
Tussen 225 en 300 nm mogen de spectra in de buigpunten en op de top van de chromatografische piek van het monsterextract voor het gedeelte van de spectra met een relatieve absorptie van 10–100 % niet van elkaar verschillen. Aan dit criterium is voldaan wanneer dezelfde maxima aanwezig zijn en de afwijking tussen de spectra op geen enkel punt meer dan 15 % van de extinctie van het spectrum van de top bedraagt.
Indien aan een van deze criteria niet is voldaan, is de aanwezigheid van de te analyseren stof niet bevestigd.
7.2. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag bij halofuginongehalten tot maximaal 3 mg/kg niet meer dan 0,5 mg/kg bedragen.
7.3. Terugvinding
Voor het blancomonster met toevoeging moet het terugvindingspercentage ten minste 80 % bedragen.
8. Resultaten van een ringonderzoek
In een ringonderzoek (8) werden drie monsters door acht laboratoria onderzocht.
monster A (blanco) bij ontvangst | monster B (meel) | monster C (pellets) | |||
|---|---|---|---|---|---|
bij ontvangst | na twee maanden | bij ontvangst | na twee maanden | ||
gemiddelde [mg/kg] | ND | 2,80 | 2,42 | 2,89 | 2,45 |
SR [mg/kg] | - | 0,45 | 0,43 | 0,40 | 0,42 |
CVR [%] | - | 16 | 18 | 14 | 17 |
Ontv.: [%] | 86 | 74 | 88 | 75 | |
ND= niet aantoonbaar SR= standaardafwijking van de reproduceerbaarheid CVR= variatiecoëfficiënt van de reproduceerbaarheid (%) Ontv.:= terugvinding in % | |||||
(E) Bepaling van robenidine
1,3-bis[(4-chloorbenzylideen)amino]guanidine-hydrochloride
Het gehalte robenidine wordt bepaald volgens:
- —
de analysemethode van EN 17299 Diervoeders: Bemonsterings- en analysemethoden — Screening en bepaling van toegestane coccidiostatica op het niveau van additieven en 1 % en 3 % kruisbesmetting, van niet-geregistreerde coccidiostatica, en van één antibioticum op subadditieve niveaus, in mengvoeders met hogedrukvloeistofchromatografie (HPLC) — Tandem massaspectrometrische detectie (LC-MS/MS), of
- —
reversed-phase hogedrukvloeistofchromatografie (HPLC) met uv-detectie, zoals beschreven in de volgende punten 1 tot en met 8.
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan robenidine in diervoeders. De bepaalbaarheidsgrens is 5 mg/kg.
2. Beginsel
Het monster wordt met aangezuurde methanol geëxtraheerd. Het extract wordt gedroogd en een gedeelte ervan wordt opgezuiverd over een aluminiumoxidekolom. Robenidine wordt met methanol uit de kolom geëlueerd, geconcentreerd en tot een geschikt volume aangevuld met mobiele fase. Het gehalte aan robenidine wordt bepaald met reversed-phase hogedrukvloeistofchromatografie (HPLC) met uv-detectie.
3. Reagentia
- 3.1.
Methanol.
- 3.2.
Aangezuurde methanol
Breng 4,0 ml zoutzuur (ρ20 = 1,18 g/ml) over in een maatkolf van 500 ml, vul aan tot de streep met methanol (punt 3.1) en meng. Deze oplossing moet vóór gebruik vers worden bereid.
- 3.3.
Acetonitril, HPLC-kwaliteit of gelijkwaardig.
- 3.4.
Moleculaire zeef
Korrels van type 3A, 8–12 mesh (korrels van 1,6–2,5 mm, kristallijn aluminosilicaat, poriediameter 0,3 mm)
- 3.5.
Aluminiumoxide, zuur, activiteitsklasse I voor kolomchromatografie.
Breng 100 g aluminiumoxide over in een geschikte kolf en voeg 2,0 ml water toe. Sluit de kolf af met een stop en schud de kolf ongeveer 20 minuten. In een goed afgesloten kolf bewaren.
- 3.6.
Kaliumdiwaterstoffosfaat-oplossing, c = 0,025 mol/l
Los 3,40 g kaliumdiwaterstoffosfaat op in water (HPLC-kwaliteit of gelijkwaardig) in een maatkolf van 1 000 ml, vul aan tot de streep met water en meng.
- 3.7.
Dinatriumwaterstoffosfaat-oplossing, c = 0,025 mol/l
Los 3,55 g watervrij dinatriumwaterstoffosfaat (of 4,45 g dihydraat of 8,95 g dodecahydraat ervan) op in water (HPLC-kwaliteit of gelijkwaardig) in een maatkolf van 1 liter, vul aan tot de streep met water en meng.
- 3.8.
Mobiele fase HPLC
Meng de volgende reagentia met elkaar:
650 ml acetonitril (punt 3.3),
250 ml water (HPLC-kwaliteit of gelijkwaardig),
50 ml kaliumdiwaterstoffosfaatoplossing (punt 3.6),
50 ml dinatriumwaterstoffosfaatoplossing (punt 3.7).
Filtreer over een filter van 0,22 μm (punt 4.6) en ontgas de oplossing (bv. door 10 minuten ultrasoonbehandeling).
- 3.9.
Standaardstof
Zuiver robenidine: 1,3-bis[(4-chloorbenzylideen)amino]guanidine-hydrochloride.
- 3.9.1.
Stamoplossing van robenidine: 300 μg/ml.
Weeg 30 mg standaardstof robenidine (punt 3.9) tot op 0,1 mg nauwkeurig af in een maatkolf van 100 ml, los dit op in aangezuurde methanol (punt 3.2), vul aan tot de streep en meng. Wikkel de kolf in aluminiumfolie en bewaar deze in het donker.
- 3.9.2.
Werkoplossing van robenidine: 12 μg/ml.
Breng 10,0 ml stamoplossing (punt 3.9.1) over in een maatkolf van 250 ml, vul aan tot de streep met de mobiele fase (punt 3.8) en meng. Wikkel de kolf in aluminiumfolie en bewaar deze in het donker.
- 3.9.3.
IJkoplossingen
Breng in een reeks maatkolven van 50 ml respectievelijk 5,0, 10,0, 15,0, 20,0 en 25,0 ml werkoplossing (punt 3.9.2). Vul aan tot de streep met mobiele fase (punt 3.8) en meng. Deze oplossingen komen overeen met respectievelijk 1,2, 2,4, 3,6, 4,8 en 6,0 mg/ml robenidine. Deze oplossingen moeten vóór gebruik vers worden bereid.
- 3.10.
Water, HPLC-kwaliteit of gelijkwaardig.
4. Apparatuur
- 4.1.
Glazen kolom
Gemaakt van bruin glas, voorzien van een kraan en een reservoir van ongeveer 150 ml inhoud; inwendige diameter 10–15 mm, lengte 250 mm.
- 4.2.
Mechanisch schudapparaat of magneetroerder
- 4.3.
Rotatieverdamper.
- 4.4.
HPLC-apparatuur met uv-detector met variabele golflengte of diodearraydetector; bereik 250–400 nm.
- 4.4.1.
HPLC-kolom: 300 mm × 4 mm, C18, vulling van 10 μm, of gelijkwaardig.
- 4.5.
Glasvezelfilters (Whatman GF/A of soortgelijk materiaal)
- 4.6.
Membraanfilter, 0,22 μm.
- 4.7.
Membraanfilter, 0,45 μm.
5. Werkwijze
NB: | Robenidine is lichtgevoelig. Bij alle bewerkingen moet bruin glaswerk worden gebruikt. |
5.1. Algemeen
- 5.1.1.
Er moet een blanco diervoeder worden geanalyseerd om te controleren of er geen robenidine of storende stoffen aanwezig zijn.
- 5.1.2.
De terugvinding moet bepaald worden door middel van analyse van het blanco diervoeder (punt 5.1.1) waaraan een vergelijkbare hoeveelheid robenidine is toegevoegd als aanwezig in het monster. Pipetteer voor een gehalte van 60 mg/kg 3,0 ml stamoplossing (punt 3.9.1) in een erlenmeyer van 250 ml. Damp de oplossing in een stroom stikstof in tot ongeveer 0,5 ml. Voeg 15 g blanco diervoeder toe, meng en wacht 10 minuten, alvorens de extractiestap (punt 5.2) uit te voeren.
NB:
Voor de toepassing van deze methode moet het blanco diervoeder van vergelijkbare soort te zijn als het monster en mag hierin bij analyse geen robenidine aantoonbaar zijn.
5.2. Extractie
Weeg ongeveer 15 g van het voorbereide monster tot op 0,01 g nauwkeurig af. Breng het over in een erlenmeyer van 250 ml en voeg 100,0 ml aangezuurde methanol (punt 3.2) toe; sluit de kolf af en schud 1 uur met het schudapparaat (punt 4.2). Filtreer de oplossing door een glasvezelfilter (punt 4.5) en vang het hele filtraat op in een erlenmeyer van 150 ml. Voeg 7,5 g moleculaire zeef (punt 3.4) toe, sluit de kolf af met een stop en schud 5 minuten. Filtreer onmiddellijk door een glasvezelfilter. Bewaar deze oplossing voor de clean-up (punt 5.3).
5.3. Clean-up
5.3.1. Bereiding van de aluminiumoxidekolom
Doe een propje glaswol onder in een glazen kolom (punt 4.1) en druk dit met een glazen staaf aan. Weeg 11,0 g bereid aluminiumoxide (punt 3.5) af en breng dit over in de kolom. Het aluminiumoxide moet zo weinig mogelijk aan de atmosfeer worden blootgesteld. Tik zachtjes onderaan tegen de gevulde kolom zodat het aluminiumoxide zich zet.
5.3.2. Clean-up van het monster
Pipetteer 5,0 ml van het volgens 5.2 bereide monsterextract op de kolom. Houd de punt van de pipet dicht tegen de kolomwand en laat de oplossing door het aluminiumoxide absorberen. Elueer het robenidine met 100 ml methanol (punt 3.1) met een elutiesnelheid van 2–3 ml/min en vang het eluaat op in een rondbodemkolf van 250 ml. Damp de methanoloplossing droog met de rotatieverdamper (punt 4.3) onder verminderde druk bij 40 °C. Neem het residu op in 3–4 ml mobiele fase (punt 3.8) en breng de oplossing kwantitatief over in een maatkolf van 10 ml. Spoel de rondbodemkolf na met enkele porties van 1–2 ml mobiele fase en breng deze spoelvloeistof in de maatkolf over. Vul aan tot de streep met dezelfde vloeistof en meng. Een deel wordt door een membraanfilter van 0,45 μm (punt 4.7) gefiltreerd. Gebruik deze oplossing voor de HPLC-bepaling (punt 5.4).
5.4. HPLC-bepaling
5.4.1. Parameters
De volgende condities worden als leidraad aangegeven; er mogen andere parameters worden gebruikt mits gelijkwaardige resultaten worden verkregen:
HPLC-kolom (punt 4.4.1);
mobiele fase voor HPLC (punt 3.8);
elutiesnelheid: 1,5–2 ml/minuut;
detectiegolflengte: 317 nm;
injectievolume: 20 – 50 μl.
Controleer de stabiliteit van het chromatografisch systeem door enige malen de ijkoplossing (punt 3.9.3) met 3,6 mg/ml te injecteren totdat constante piekhoogten (-oppervlakten) en retentietijden worden verkregen.
5.4.2. IJkgrafiek
Injecteer elke ijkoplossing (punt 3.9.3) enkele malen en meet voor elke concentratie de piekhoogten (-oppervlakten). Maak een ijkgrafiek met de gemiddelde piekhoogten of -oppervlakten als ordinaat en de bijbehorende concentraties in μg/ml als abscis.
5.4.3. Monsteroplossing
Injecteer het monsterextract (punt 5.3.2) enige malen waarbij hetzelfde volume als voor de ijkoplossingen wordt gebruikt; bepaal de gemiddelde piekhoogte (oppervlakte) van de robenidinepieken.
6. Berekening van de resultaten
Bepaal uit de gemiddelde hoogte (oppervlakte) van de robenidinepieken van de monsteroplossing aan de hand van de ijkgrafiek (punt 5.4.2) de concentratie van de monsteroplossing in μg/ml.
Het gehalte aan robenidine w (mg/kg) in het monster wordt verkregen met de volgende formule:
w = c × 200 / m
waarbij:
c = | concentratie robenidine van de monsteroplossing in μg/ml; |
m = | massa van het analysemonster in g. |
7. Validatie van de resultaten
7.1. Identiteit
De identiteit van de geanalyseerde stof kan worden bevestigd door co-chromatografie of met een diode array detector, waarbij de spectra van het monsterextract en de ijkoplossing (punt 3.9.3) met 6 μg/ml worden vergeleken.
7.1.1. Cochromatografie
Voeg aan een deel van het monsterextract een geschikte hoeveelheid van een ijkoplossing (punt 3.9.3) toe. De toegevoegde hoeveelheid robenidine moet ongeveer gelijk zijn aan de geschatte hoeveelheid robenidine in het monsterextract.
Alleen de hoogte van de robenidinepiek mag naar verhouding toenemen, rekening houdend met de toegevoegde hoeveelheid en de verdunning van het extract. De piekbreedte op de helft van de maximale hoogte moet binnen ± 10 % van de oorspronkelijke breedte liggen.
7.1.2. Diodearraydetectie
De resultaten worden op grond van de volgende criteria beoordeeld:
- a)
de golflengten van de absorptiemaxima van de spectra van het monster en de standaard, gemeten op de top van de chromatografische piek, moeten overeenkomen binnen een marge die wordt bepaald door het oplossend vermogen van het detectiesysteem. Voor diodearraydetectie is deze marge meestal ± 2 nm;
- b)
tussen 250 en 400 nm mogen de spectra van het monster en de standaard, gemeten op de top van de chromatografische piek, voor het gedeelte van de spectra met een relatieve absorptie van 10–100 % niet van elkaar verschillen. Aan dit criterium is voldaan wanneer dezelfde maxima aanwezig zijn en de afwijking tussen de twee spectra op geen enkel punt meer dan 15 % van de extinctie van de standaard bedraagt;
- c)
tussen 250 en 400 nm mogen de spectra in de buigpunten en op de top van de chromatografische piek van het monsterextract voor het gedeelte van de spectra met een relatieve absorptie van 10–100 % niet van elkaar verschillen. Aan dit criterium is voldaan wanneer dezelfde maxima aanwezig zijn en de afwijking tussen de spectra op geen enkel punt meer dan 15 % van de extinctie van het spectrum van de top bedraagt.
Indien aan een van deze criteria niet is voldaan, is de aanwezigheid van de te analyseren stof niet bevestigd.
7.2. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag bij robenidinegehalten van meer dan 15 mg/kg niet meer dan 10 % van het hoogste resultaat bedragen.
7.3. Terugvinding
Voor het blancomonster met toevoeging moet het terugvindingspercentage ten minste 85 % bedragen.
8. Resultaten van een ringonderzoek
In EU-verband is een ringonderzoek georganiseerd waarin vier monsters pluimveevoer en konijnenvoer, als voedermeel of in pelletvorm, door twaalf laboratoria werden onderzocht. Op elk monster werden duploanalyses uitgevoerd. De resultaten staan in de volgende tabel.
Pluimvee | Konijnen | ||||
|---|---|---|---|---|---|
meel | pellets | meel | pellets | ||
gemiddelde [mg/kg] | 27,00 | 27,99 | 43,6 | 40,1 | |
sr [mg/kg] | 1,46 | 1,26 | 1,44 | 1,66 | |
CVr [%] | 5,4 | 4,5 | 3,3 | 4,1 | |
SR [mg/kg] | 4,36 | 3,36 | 4,61 | 3,91 | |
CVR [%] | 16,1 | 12,0 | 10,6 | 9,7 | |
terugvinding [%] | 90,0 | 93,3 | 87,2 | 80,2 | |
sr= standaardafwijking van de herhaalbaarheid; CVr= variatiecoëfficiënt van de herhaalbaarheid, in %; SR= standaardafwijking van de reproduceerbaarheid; CVR= variatiecoëfficiënt van de reproduceerbaarheid, in %. | |||||
(F) Bepaling van diclazuril
(±)-4-Chloorfenyl[2,6-dichloor-4-(2,3,4,5-tetrahydro-3,5-dioxo-1,2,4-triazine-2-yl)fenyl]acetonitril
Het gehalte diclazuril wordt bepaald volgens:
- —
de analysemethode van EN 17299 Diervoeders: Bemonsterings- en analysemethoden — Screening en bepaling van toegestane coccidiostatica op het niveau van additieven en 1 % en 3 % kruisbesmetting, van niet-geregistreerde coccidiostatica, en van één antibioticum op subadditieve niveaus, in mengvoeders met hogedrukvloeistofchromatografie (HPLC) — Tandem massaspectrometrische detectie (LC-MS/MS), of
- —
ternaire-gradiënt-reversed-phase hogedrukvloeistofchromatografie (HPLC) met uv-detectie, zoals beschreven in de volgende punten 1 tot en met 9.
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van diclazuril in mengvoeders en voormengsels (9). De aantoonbaarheidsgrens is 0,1 mg/kg, de bepaalbaarheidsgrens 0,5 mg/kg. Lagere bepaalbaarheidsgrenzen zijn haalbaar, maar dit moet door de gebruiker worden gevalideerd.
2. Beginsel
Na toevoeging van een interne standaard wordt het monster geëxtraheerd met aangezuurde methanol. In het geval van diervoeders wordt een aliquot van het extract opgezuiverd met een C18-vastefasekolom. Diclazuril wordt uit de kolom geëlueerd met een mengsel van aangezuurde methanol en water. Na indamping wordt het residu opgelost in DMF/water. In het geval van voormengsels wordt het extract ingedampt en wordt het residu opgelost in DMF/water. Het gehalte aan diclazuril wordt bepaald door middel van ternaire gradiënt reversed-phase hogedrukvloeistofchromatografie (HPLC) met uv-detectie.
3. Reagentia
- 3.1.
Water, HPLC-kwaliteit of gelijkwaardig.
- 3.2.
Ammoniumacetaat.
- 3.3.
Tetrabutylammoniumwaterstofsulfaat (TBHS).
- 3.4.
Acetonitril, HPLC-kwaliteit of gelijkwaardig.
- 3.5.
Methanol, HPLC-kwaliteit of gelijkwaardig.
- 3.6.
N,N-dimethylformamide (DMF).
- 3.7.
Zoutzuur, ρ20 = 1,19 g/ml.
- 3.8.
Standaardstof: diclazuril: (±)-4-chloorfenyl[2,6-dichloor-4-(2,3,4,5-tetrahydro—3,5-dioxo-1,2,4-triazine-2-yl)fenyl]acetonitril van gegarandeerde zuiverheid.
- 3.8.1.
Stamoplossing van diclazuril, 500 μg/ml
Weeg 25 mg standaardstof diclazuril (punt 3.8) tot op 0,1 mg nauwkeurig af in een maatkolf van 50 ml. Los op in DMF (punt 3.6) en meng. Vul aan tot de streep met DMF (punt 3.6) en meng. Wikkel de kolf in aluminiumfolie of gebruik een bruine kolf en bewaar de kolf in een koelkast. Bij een temperatuur van ten hoogste 4 °C is de oplossing stabiel gedurende één maand (10).
- 3.8.2.
Standaardoplossing diclazuril, 50 μg/ml
Breng 5,00 ml van de stamoplossing (punt 3.8.1) over in een maatkolf van 50 ml, vul aan tot de streep met DMF (punt 3.6) en meng. Wikkel de kolf in aluminiumfolie of gebruik een bruine kolf en bewaar de kolf in een koelkast. Bij een temperatuur van ten hoogste 4 °C is de oplossing gedurende één maand stabiel.
- 3.9.
Interne standaard: 2,6-dichloor-α-(4-chloorfenyl)-4-(4,5-dihydro—3,5-dioxo-1,2,4-triazine-2(3H)-yl)-α-methylbenzeenacetonitril (methyldiclazuril).
- 3.9.1.
Stamoplossing interne standaard, 500 μg/ml.
Weeg 25 mg interne standaard (punt 3.9) tot op 0,1 mg nauwkeurig af in een maatkolf van 50 ml. Los op in DMF (punt 3.6) en meng. Vul aan tot de streep met DMF (punt 3.6) en meng. Wikkel de kolf in aluminiumfolie of gebruik een bruine kolf en bewaar de kolf in een koelkast. Bij een temperatuur van ten hoogste 4 °C is de oplossing gedurende één maand stabiel.
- 3.9.2.
Internestandaardoplossing, 50 μg/ml.
Breng 5,00 ml van de stamoplossing van de interne standaard (punt 3.9.1) over in een maatkolf van 50 ml, vul aan tot de streep met DMF (punt 3.6) en meng. Wikkel de kolf in aluminiumfolie of gebruik een bruine kolf en bewaar de kolf in een koelkast. Bij een temperatuur van ten hoogste 4 °C is de oplossing gedurende één maand stabiel.
- 3.9.3.
Internestandaardoplossing voor voormengsels, p/1 000 mg/ml (p = nominale gehalte van diclazuril in het voormengsel in mg/kg).
Weeg 0,1 mg p/10 mg van de interne standaard tot op 0,1 mg nauwkeurig af in een maatkolf van 100 ml, los op in DMF (punt 3.6) in een ultrasoonbad (punt 4.7), vul aan tot de streep met DMF en meng. Wikkel de kolf in aluminiumfolie of gebruik een bruine kolf en bewaar de kolf in een koelkast. Bij een temperatuur van ten hoogste 4 °C is de oplossing gedurende één maand stabiel.
- 3.10.
IJkoplossingen
- 3.10.1.
IJkoplossing, 1 μg/ml (diclazuril).
Pipetteer 1,00 ml standaardoplossing diclazuril (punt 3.8.2) en 2,00 ml internestandaardoplossing (punt 3.9.2) in een maatkolf van 50 ml. Voeg 17 ml DMF (punt 3.6) toe, vul aan tot de streep met water (punt 3.1) en meng. Deze oplossing moet vóór gebruik vers worden bereid.
- 3.10.2.
IJkoplossing, 2 μg/ml (diclazuril).
Pipetteer 2,00 ml standaardoplossing diclazuril (punt 3.8.2) en 2,00 ml internestandaardoplossing (punt 3.9.2) in een maatkolf van 50 ml. Voeg 16 ml DMF (punt 3.6) toe, vul aan tot de streep met water (punt 3.1) en meng. Deze oplossing moet vóór gebruik vers worden bereid.
- 3.10.3.
IJkoplossing, 3 μg/ml (diclazuril).
Pipetteer 3,00 ml standaardoplossing diclazuril (punt 3.8.2) en 2,00 ml internestandaardoplossing (punt 3.9.2) in een maatkolf van 50 ml. Voeg 15 ml DMF (punt 3.6) toe, vul aan tot de streep met water (punt 3.1) en meng. Deze oplossing moet vóór gebruik vers worden bereid.
- 3.10.4.
IJkoplossing, 4 μg/ml (diclazuril).
Pipetteer 4,00 ml standaardoplossing diclazuril (punt 3.8.2) en 2,00 ml internestandaardoplossing (punt 3.9.2) in een maatkolf van 50 ml. Voeg 14 ml DMF (punt 3.6) toe, vul aan tot de streep met water (punt 3.1) en meng. Deze oplossing moet vóór gebruik vers worden bereid.
- 3.10.5.
IJkoplossing, 5 μg/ml (diclazuril).
Pipetteer 5,00 ml standaardoplossing diclazuril (punt 3.8.2) en 2,00 ml internestandaardoplossing (punt 3.9.2) in een maatkolf van 50 ml. Voeg 13 ml DMF (punt 3.6) toe, vul aan tot de streep met water (punt 3.1) en meng. Deze oplossing moet vóór gebruik vers worden bereid.
NB:
de ijkoplossingen (punt 3.10.1, 3.10.2, 3.10.3, 3.10.4 en 3.10.5) hebben betrekking op een diclazurilconcentratie in diervoeders van 0,5 tot 2,5 mg/kg bij gebruik van het huidige protocol.
- 3.11.
C18-vastefasekolom, bv. Mega Bond Elut, volume: 20 cc, massa van de vaste fase: 5 000 mg (voorconditionering volgens de richtsnoeren van de leverancier).
- 3.12.
Extractievloeistof: aangezuurde methanol.
Pipetteer 5,0 ml zoutzuur (punt 3.7) in 1 000 ml methanol (punt 3.5) en meng.
- 3.13.
Mobiele fase voor HPLC:
- 3.13.1.
Eluens A: ammoniumacetaat-tetrabutylammoniumwaterstofsulfaatoplossing.
Los 5 g ammoniumacetaat (punt 3.2) en 3,4 g TBHS (punt 3.3) op in 1 000 ml water (punt 3.1) en meng.
- 3.13.2.
Eluens B: acetonitril (punt 3.4).
- 3.13.3.
Eluens C: methanol (punt 3.5)
4. Apparatuur
- 4.1.
Mechanisch schudapparaat.
- 4.2.
Apparatuur voor ternaire-gradiënt-HPLC.
- 4.2.1.
HPLC-kolom, Hypersil ODS, vulling van 3 μm, 100 mm × 4,6 mm, of een gelijkwaardige kolom.
- 4.2.2.
Uv-detector met variabele golflengte of diodearraydetector.
- 4.3.
Rotatieverdamper.
- 4.4.
Membraanfilter (bv. chemisch resistente nylon), 0,45 μm
- 4.5.
Wegwerpspuit, 5 ml
- 4.6.
Ontgassysteem.
- 4.7.
Ultrasoonbad.
5. Werkwijze
5.1. Algemeen
5.1.1. Blanco diervoeder
Er moet een blanco diervoeder worden geanalyseerd om te controleren of er geen diclazuril of storende stoffen aanwezig zijn. De blanco dient van vergelijkbare soort te zijn als het monster en hierin mogen geen diclazuril of storende stoffen aantoonbaar zijn.
5.1.2. Bepaling van de terugvinding
Het terugvindingspercentage dient te worden bepaald door analyse van het blanco diervoeder waaraan een vergelijkbare hoeveelheid diclazuril is toegevoegd als aanwezig in het monster. Voeg voor een gehalte van 1 mg/kg 0,1 ml stamoplossing (punt 3.8.1) toe aan 50 g van een blanco, meng zorgvuldig, laat gedurende 10 minuten staan en meng vervolgens nog enige malen alvorens de extractiestap (punt 5.2) uit te voeren.
Als een blanco diervoeder van vergelijkbare soort niet beschikbaar is (zie 5.1.1), kan het terugvindingspercentage ook worden bepaald met de standaardadditiemethode. Hierbij wordt aan het te analyseren monster een vergelijkbare hoeveelheid diclazuril toegevoegd als aanwezig in het monster. Dit monster wordt geanalyseerd samen met het monster waaraan geen carbadox is toegevoegd, en het terugvindingspercentage kan dan door aftrekking worden berekend.
5.2. Extractie
5.2.1. Mengvoeders
Weeg ongeveer 50 g monster tot op 0,01 g nauwkeurig af. Breng dit over in een erlenmeyer van 500 ml, voeg 1,00 ml internestandaardoplossing (punt 3.9.2) en 200 ml extractievloeistof (punt 3.12) toe en sluit de erlenmeyer af. Schud het mengsel op het schudapparaat (punt 4.1) gedurende één nacht. Laat het mengsel 10 minuten staan om het te laten bezinken. Breng 20 ml van de bovenstaande vloeistof over in een geschikte glazen recipiënt en verdun met 20 ml water (punt 3.1). Breng deze oplossing over in een kolom (punt 3.11) en zorg dat de oplossing de kolom passeert door het aanleggen van een vacuüm (punt 4.6). Was de voorkolom met 25 ml van een mengsel van de extractievloeistof (punt 3.12) en water (punt 3.1), 65 + 35 (V + V). Doe de opgevangen fracties weg en elueer de verbindingen met 25 ml van een mengsel van extractievloeistof (punt 3.12) en water, 80 + 20 (V + V). Damp deze fractie in met een rotatieverdamper (punt 4.3) bij 60 °C, totdat de fractie juist droog is. Los het residu op in 1,0 ml DMF (punt 3.6), voeg 1,5 ml water (punt 3.1) toe en meng. Filtreer door een membraanfilter (punt 4.4), gemonteerd op een wegwerpspuit (punt 4.5). Vervolg met de HPLC-bepaling (punt 5.3).
5.2.2. Voormengsels
Weeg ongeveer 1 g monster tot op 0,001 g nauwkeurig af. Breng dit over in een erlenmeyer van 500 ml, voeg 1,00 ml internestandaardoplossing (punt 3.9.3) en 200 ml extractievloeistof (punt 3.12) toe en sluit de erlenmeyer af. Schud het mengsel op het schudapparaat (punt 4.1) gedurende één nacht. Laat het mengsel 10 minuten staan om het te laten bezinken. Breng een aliquot van 10 000/p ml (p = nominaal gehalte van diclazuril in het voormengsel in mg/kg) van de bovenstaande vloeistof over in een rondbodemkolf van geschikte maat. Damp de vloeistof met de rotatieverdamper (punt 4.3) onder verminderde druk en bij 60 °C in, totdat het residu juist droog is geworden. Neem het residu op in 10,0 ml DMF (punt 3.6), voeg 15,0 ml water (punt 3.1) toe en meng. Vervolg met de HPLC-bepaling (punt 5.3).
5.3. HPLC-bepaling
5.3.1. Parameters
De volgende condities worden als leidraad aangegeven; er mogen andere parameters worden gebruikt mits gelijkwaardige of betere resultaten worden verkregen.
- —
HPLC-kolom (punt 4.2.1): 100 mm × 4,6 mm, Hypersil ODS, 3 μm vulling, of een gelijkwaardige kolom;
- —
Mobiele fase
- —
eluens A (punt 3.13.1): waterige oplossing van ammoniumacetaat en tetrabutylammoniumwaterstofsulfaat;
- —
eluens B (punt 3.13.2): acetonitril;
- —
eluens C (punt 3.13.3): methanol.
- —
Elutiemethode — lineaire gradiënt
- —
begincondities A + B + C = 60 + 20 + 20 (V + V + V);
- —
schakel na 10 minuten elutie over op gradiëntelutie naar: A + B + C = 45 + 20 + 35 (V + V + V);
- —
spoel met B gedurende 10 minuten;
- —
elutiesnelheid: 1,5–2 ml/min;
- —
injectievolume: 20 μl;
- —
detectiegolflengte: 280 nm;
Controleer de stabiliteit van het chromatografische systeem door enige malen de ijkoplossing (punt 3.10.2) van 2 μg/m diclurazil en de interne standaard te injecteren totdat constante piekhoogten en retentietijden worden verkregen.
5.3.2. Chromatografische analyse van ijkoplossingen
Injecteer tweemaal 20 μl van iedere ijkoplossing (punt 3.10.1, 3.10.2, 3.10.3, 3.10.4 en 3.10.5), identificeer en integreer de pieken van diclazuril en de interne standaard en bepaalde de ijkkromme op basis van de verhouding tussen de gemiddelde piekhoogte of -oppervlakte van diclazuril en de gemiddelde piekhoogte of -oppervlakte van de concentratie interne standaard versus diclazuril in de ijkoplossingen (μg/ml).
5.3.3. Chromatografische analyse van monsteroplossingen
Injecteer tweemaal 20 μl monsteroplossing (punt 5.2.1 of 5.2.2) en bepaal de gemiddelde hoogte of oppervlakte van de diclazurilpiek en de piek van de interne standaard.
6. Berekening van de resultaten
6.1. Mengvoeders
Het gehalte aan diclazuril w (mg/kg) in het monster wordt verkregen met de volgende formule:
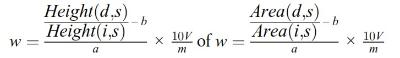
waarbij:
- —
Height(d,s) = de piekhoogte van diclurazil in de monsteroplossing (punt 5.2.1)
- —
Area(d,s) = de pieke oppervlakte van diclazuril in de monsteroplossing (punt 5.2.1)
- —
Height(i,s) = de piekhoogte van de interne standaard in de monsteroplossing (punt 5.2.1)
- —
Area(i,s) = de piekoppervlakte van de interne standaard in de monsteroplossing (punt 5.2.1)
- —
b = het intercept van de ijkkromme van de ijkoplossingen (punt 3.10.1, 3.10.3, 3.10.4, 3.10.2 en 3.10.5) overeenkomstig punt 5.3.2
- —
a = de helling van de ijkkromme van de ijkoplossingen (punt 3.10.1, 3.10.3, 3.10.4, 3.10.2 en 3.10.5) overeenkomstig punt 5.3.2
- —
m = de massa is van de proefeenheid, in mg
- —
V = het volume van het monsterextract na opnieuw opnemen volgens 5.2.1, in ml (d.w.z. 2,5 ml).
6.2. Voormengsels
Het gehalte aan diclazuril w (mg/kg) in het monster wordt verkregen met de volgende formule:
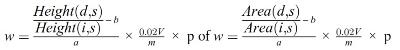
waarbij:
- —
Height(d,s) = de piekhoogte van diclurazil in de monsteroplossing (punt 5.2.2)
- —
Area(d,s) = de pieke oppervlakte van diclazuril in de monsteroplossing (punt 5.2.2)
- —
Height(i,s) = de piekhoogte van de interne standaard in de monsteroplossing (punt 5.2.2)
- —
Area(i,s) = de piekoppervlakte van de interne standaard in de monsteroplossing (punt 5.2.2)
- —
b = het intercept van de ijkkromme van de ijkoplossingen (punt 3.10.1, 3.10.3, 3.10.4, 3.10.2 en 3.10.5) overeenkomstig punt 5.3.2
- —
a = de helling van de ijkkromme van de ijkoplossingen (punt 3.10.1, 3.10.3, 3.10.4, 3.10.2 en 3.10.5) overeenkomstig punt 5.3.2
- —
m = de massa is van de proefeenheid, in mg
- —
V = het volume van het monsterextract na opnieuw opnemen volgens 5.2.2, in ml (d.w.z. 25 ml)
- —
p = het nominale gehalte aan diclazuril in het voormengsel in mg/kg.
7. Validatie van de resultaten
7.1. Identiteit
De identiteit van de geanalyseerde stof kan worden bevestigd door cochromatografie of met een diodearraydetector, waarbij de spectra van het monsterextract (punt 5.2.1 of 5.2.2) en de ijkoplossing (punt 3.10.2) worden vergeleken.
7.1.1. Cochromatografie
Voeg aan een deel van het monsterextract (punt 5.2.1 of 5.2.2) een geschikte hoeveelheid van een ijkoplossing (punt 3.10.2) toe. De toegevoegde hoeveelheid diclazuril moet ongeveer gelijk zijn aan de geschatte hoeveelheid diclazuril in het monsterextract.
Alleen de hoogte van de diclazurilpiek en die van de piek van de interne standaard mogen naar verhouding toenemen, rekening houdend met de toegevoegde hoeveelheid en de verdunning van het extract. De piekbreedte op de helft van de maximale piekhoogte moet binnen ± 10 % van de oorspronkelijke breedte liggen.
7.1.2. Diodearraydetectie
De resultaten worden op grond van de volgende criteria beoordeeld:
- a)
de golflengten van de absorptiemaxima van de spectra van het monster en de standaard, gemeten op de top van de chromatografische piek, moeten overeenkomen binnen een marge die wordt bepaald door het oplossend vermogen van het detectiesysteem. Voor diodearraydetectie is deze marge meestal ± 2 nm;
- b)
tussen 230 en 320 nm mogen de spectra van het monster en de standaard, opgenomen op de top van de chromatografische piek voor het gedeelte van de spectra met een relatieve extinctie van 10–100 % niet van elkaar verschillen. Aan dit criterium is voldaan wanneer dezelfde maxima aanwezig zijn en de afwijking tussen de spectra op geen enkel punt meer dan 15 % van de extinctie van de standaard bedraagt;
- c)
tussen 230 en 320 nm mogen de spectra in de buigpunten en op de top van de chromatografische piek van het monsterextract voor het gedeelte van de spectra met een relatieve extinctie van 10–100 % niet van elkaar verschillen. Aan dit criterium is voldaan wanneer dezelfde maxima aanwezig zijn en de afwijking tussen de spectra op geen enkel punt meer dan 15 % van de extinctie van het spectrum van de top bedraagt.
Indien aan een van deze criteria niet is voldaan, is de aanwezigheid van de te analyseren stof niet bevestigd.
Herhaalbaarheid 7.2
Het verschil tussen de resultaten van twee onafhankelijk bepalingen met twee submonsters mag niet meer bedragen dan:
- —
30 % van het hoogste resultaat bij diclazurilgehalten tussen 0,5 mg/kg en 2,5 mg/kg;
- —
0,75 mg/kg voor diclazurilgehalten tussen 2,5 mg/kg en 5 mg/kg;
- —
15 % van het hoogste resultaat bij diclazurilgehalten van meer dan 5 mg/kg.
7.3. Terugvinding
Voor het (blanco)monster met toevoeging dient het terugvindingspercentage ten minste 80 % te bedragen.
8. Resultaten van een ringonderzoek
Er werden twee ringonderzoeken uitgevoerd. In het eerste, die in 1994 door een andere groep laboratoria werd uitgevoerd, werden twee monsters van voormengsels (O 100, A 100) en drie monsters van aanvullend voeder voor pluimvee (L1, Z1, K1) geanalyseerd. Een voormengselmonster werd gemengd met een organische matrix (O 100) en het andere met een anorganische matrix (A 100). Het theoretische gehalte is 100 mg diclazuril per kg. De laboratoria waren gevraagd elk monster eenmaal of in duplo te analyseren. (Voor meer details over het eerste ringonderzoek zie Journal of AOAC International, Volume 77, nr. 6, 1994, blz. 1359–1361).
In het tweede ringonderzoek werden drie mengvoeders voor pluimvee geanalyseerd, met diclazurilconcentraties van 0,9 mg/kg (MAT 1), 1,5 mg/kg (MAT 2) en blanco diervoeder (MAT 3). Nadere details over dit tweede ringonderzoek zijn vervat in het technisch rapport van het JRC (2016) en in Journal of AOAC International, Volume 102, nr. 2, 2019, blz. 646–652. De resultaten van de twee ringonderzoeken worden in onderstaande tabel weergegeven.
monster 1A 100 | monster 2O 100 | monster 3 L1 | monster 4 Z1 | monster 5 K1 | monster 6 MAT 1 | monster 7 MAT 2 | monster 8 MAT 3 | |
|---|---|---|---|---|---|---|---|---|
L | 11 | 11 | 11 | 11 | 6 | 10 | 9 | 10 |
n | 19 | 18 | 19 | 19 | 12 | 20 | 18 | 10 |
gemiddelde (mg/kg) | 100,8 | 103,5 | 0,89 | 1,15 | 0,89 | 1,0 | 1,5 | < LOQ |
Sr (mg/kg) | 5,88 | 7,64 | 0,15 | 0,02 | 0,03 | 0,11 | 0,07 | - |
CVr (%) | 5,83 | 7,38 | 17,32 | 1,92 | 3,34 | 11,2 | 4,5 | - |
SR (mg/kg) | 7,59 | 7,64 | 0,17 | 0,11 | 0,12 | 0,18 | 0,21 | - |
CVR (%) | 7,53 | 7,38 | 18,61 | 9,67 | 13,65 | 18,1 | 14,3 | - |
nominaal gehalte (mg/kg) | 100 | 100 | 1,0 | 1,0 | 1,0 | 0,9 | 1,5 | - |
referentie (*1) | eerste onderzoek uit 1 994 | eerste onderzoek uit 1 994 | eerste onderzoek uit 1 994 | eerste onderzoek uit 1 994 | eerste onderzoek uit 1 994 | tweede onderzoek uit 2 015 | tweede onderzoek uit 2 015 | tweede onderzoek uit 2 015 |
L = aantal laboratoria n = aantal bepalingen Sr = standaardafwijking van de herhaalbaarheid CVr = variatiecoëfficiënt van de herhaalbaarheid SR = standaardafwijking van de reproduceerbaarheid CVR = variatiecoëfficiënt van de reproduceerbaarheid LOQ = bepaalbaarheidsgrens | ||||||||
9. Algemene opmerkingen
Eerder moet zijn aangetoond dat de diclazurilrespons lineair is in het gebied van de gemeten concentraties.
Ten minste voor de analyse van diclazuril in mengvoeders met een hoog vetgehalte (meer dan 12 % vet) mag de analysemethode worden vervangen door andere op HPLC gebaseerde methoden, bv. hogedrukvloeistofchromatografie in combinatie met massaspectrometrie (HPLC-MS), mits de alternatieve methode gelijkwaardige prestatiekenmerken heeft (terugvindingspercentage, precisie bij herhaalbaarheid en reproduceerbaarheid).
(G) Bepaling van het gehalte aan lasalocide-natrium
Natriumzout van een door Streptomyces lasaliensis geproduceerd polyethermonocarbonzuur
Het gehalte lasalocide-natrium wordt bepaald volgens:
- —
de analysemethode van EN 17299 Diervoeders: Bemonsterings- en analysemethoden — Screening en bepaling van toegestane coccidiostatica op het niveau van additieven en 1 % en 3 % kruisbesmetting, van niet-geregistreerde coccidiostatica, en van één antibioticum op subadditieve niveaus, in mengvoeders met hogedrukvloeistofchromatografie (HPLC) — Tandem massaspectrometrische detectie (LC-MS/MS), of
- —
reversed-phase hogedrukvloeistofchromatografie (HPLC) met spectrofluorimetrische (fluorescentie) detectie., zoals beschreven in de volgende punten 1 tot en met 8.
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van lasolacide-natrium in diervoeders. De aantoonbaarheidsgrens is 5 mg/kg, de bepaalbaarheidsgrens 10 mg/kg.
2. Beginsel
Lasalocide-natrium wordt uit het monster geëxtraheerd met aangezuurde methanol, en het gehalte wordt bepaald met reversed-phase hogedrukvloeistofchromatografie (HPLC) met spectrofluorimetrische (fluorescentie) detectie.
3. Reagentia
- 3.1.
Kaliumdiwaterstoffosfaat (KH2PO4).
- 3.2.
Fosforzuur, w = 85 % (m/m).
- 3.3.
Verdund fosforzuur, c = 20 %.
Verdun 23,5 ml fosforzuur (punt 3.2) met water tot 100 ml.
- 3.4.
6-Methyl-2-heptylamine (1,5-dimethylhexylamine), w = 99 % (m/m).
- 3.5.
Methanol, HPLC-kwaliteit of gelijkwaardig.
- 3.6.
Zoutzuur, d = 1,19 g/ml.
- 3.7.
Fosfaatbufferoplossing, c = 0,01 mol/l
Los 1,36 g KH2PO4 (punt 3.1) op in 500 ml water (punt 3.11), voeg 3,5 ml fosforzuur (punt 3.2) en 10,0 ml 6-methyl-2-heptylamine (punt 3.4) toe. Breng de pH op 4,0 met verdund fosforzuur (punt 3.3) en verdun tot 1 000 ml met water (punt 3.11).
- 3.8.
Aangezuurde methanol
Breng 5,0 ml zoutzuur (punt 3.6) over in een maatkolf van 1 000 ml, vul aan tot de streep met methanol (punt 3.5) en meng. Deze oplossing moet vóór gebruik vers worden bereid.
- 3.9.
HPLC mobiele fase, fosfaatbufferoplossing-methanol, 5 + 95 (V + V)
Meng 5 ml fosfaatbuffer (punt 3.7) met 95 ml methanol (punt 3.5).
- 3.10.
Lasalocide-natrium standaardstof van gegarandeerde zuiverheid, C34H53O8Na (natriumzout van door Streptomyces lasaliensis geproduceerd polyether monocarbonzuur), E763
- 3.10.1.
Stamoplossing van lasalocide-natrium, 500 μg/ml
Weeg 50 mg lasalocide-natrium (punt 3.10) tot op 0,1 mg nauwkeurig af in een maatkolf van 100 ml en los op in aangezuurde methanol (punt 3.8), vul aan tot de streep met hetzelfde oplosmiddel en meng. Deze oplossing moet vóór gebruik vers worden bereid.
- 3.10.2.
Werkoplossing van lasalocide-natrium, 50 μg/ml
Pipetteer 10,0 ml van de stamoplossing (punt 3.10.1) in een maatkolf van 100 ml, vul aan tot de streep met aangezuurde methanol (punt 3.8) en meng. Deze oplossing moet vóór gebruik vers worden bereid.
- 3.10.3.
IJkoplossingen
Breng 1,0, 2,0, 4,0, 5,0 en 10,0 ml werkoplossing (punt 3.10.2) in een reeks maatkolven van 50 ml. Vul aan tot de streep met aangezuurde methanol (punt 3.8) en meng. Deze oplossingen komen overeen met respectievelijk 1,0, 2,0, 4,0, 5,0 en 10,0 μg lasalocide-natrium per ml. Deze oplossingen moeten vóór gebruik vers worden bereid.
- 3.11.
Water, HPLC-kwaliteit of gelijkwaardig
4. Apparatuur
- 4.1.
Ultrasoonbad (of schudmachine in een waterbad) met temperatuurregeling
- 4.2.
Membraanfilter, 0,45 μm
- 4.3.
HPLC-apparatuur met injectiesysteem, geschikt voor injectiehoeveelheden van 20 μl
- 4.3.1.
HPLC-kolom, 125 mm × 4 mm, reversed-phase C18, vulling van 5 μm, of een gelijkwaardige kolom.
- 4.3.2.
Spectrofluorimeter met variabele excitatie- en emissiegolflengte.
5. Werkwijze
5.1. Algemeen
5.1.1. Blanco diervoeder
Voor de bepaling van de terugvinding (punt 5.1.2) moet een blanco voedermonster worden geanalyseerd om te controleren of er geen lasalocide-natrium of storende stoffen aanwezig zijn. Het blanco voedermonster moet van een vergelijkbare soort zijn als het monster en hierin mogen geen lasalocide-natrium of storende stoffen aantoonbaar zijn.
5.1.2. Bepaling van de terugvinding
Het terugvindingspercentage moet worden bepaald door analyse van het blanco diervoeder waaraan een hoeveelheid lasalocide-natrium is toegevoegd die vergelijkbaar is met die in het monster. Breng voor een gehalte van 100 mg/kg 10,0 ml van de stamoplossing (punt 3.10.1) over in een erlenmeyer van 250 ml en damp de oplossing in tot ongeveer 0,5 ml. Voeg 50 g blanco toe, meng zorgvuldig, laat gedurende 10 minuten staan en meng vervolgens nog enige malen opnieuw alvorens de extractiestap (punt 5.2) uit te voeren.
Als een blanco diervoeder van vergelijkbare soort niet beschikbaar is (zie 5.1.1), kan het terugvindingspercentage ook worden bepaald met de standaardadditiemethode. Hierbij wordt aan het te analyseren monster een hoeveelheid lasalocide-natrium toegevoegd die vergelijkbaar is met die in het monster. Dit monster wordt geanalyseerd samen met het monster waaraan geen lasalocide-natrium is toegevoegd, en het terugvindingspercentage kan dan door aftrekking worden berekend.
5.2. Extractie
5.2.1. Diervoeders
Weeg 5–10 g van het monster tot op 0,01 g nauwkeurig af in een afsluitbare erlenmeyer van 250 ml. Voeg met een pipet 100,0 ml aangezuurde methanol (punt 3.8) toe. Sluit niet volledig af en zwenk de erlenmeyer om te dispergeren. Plaats de erlenmeyer gedurende 20 minuten in het ultrasoonbad (punt 4.1) bij ongeveer 40 °C, haal hem eruit en koel af tot kamertemperatuur. Laat ongeveer 1 uur staan totdat het gesuspendeerde materiaal is neergeslagen, filtreer vervolgens een aliquot door een membraanfilter van 0,45 μm (punt 4.2) in een daartoe geschikt monsterflesje. Vervolg met de HPLC-bepaling (punt 5.3).
5.2.2. Voormengsels
Weeg 2 g van het niet-gemalen voormengsel tot op 0,001 g nauwkeurig af in een maatkolf van 250 ml. Voeg 100,0 ml aangezuurde methanol (punt 3.8) toe en zwenk de maatkolf om te dispergeren. Plaats de kolf met inhoud gedurende 20 minuten in het ultrasoonbad (punt 4.1) bij ongeveer 40 °C, haal hem eruit en koel af tot kamertemperatuur. Verdun door aangezuurde methanol (punt 3.8) toe te voegen tot de streep en meng grondig. Laat ongeveer 1 uur staan totdat het gesuspendeerde materiaal is neergeslagen, filtreer vervolgens een aliquot door een membraanfilter van 0,45 μm (punt 4.2). Verdun een zodanige hoeveelheid van het heldere filtraat met aangezuurde methanol (punt 3.8) dat een oplossing met ongeveer 4 μg/ml lasalocide-natrium wordt verkregen. Vervolg met de HPLC-bepaling (punt 5.3).
5.3. HPLC-bepaling
5.3.1. Parameters
De volgende condities worden als leidraad aangegeven; er mogen andere parameters worden gebruikt mits gelijkwaardige resultaten worden verkregen:
HPLC- kolom (punt 4.3.1): | 125 mm × 4 mm, reverse-phase C18, vulling van 5 μm, of een gelijkwaardige kolom; |
mobiele fase (punt 3.9): | mengsel van fosfaatbuffer (punt 3.7) en methanol (punt 3.5), 5 + 95 (V + V); |
elutiesnelheid: | 1,2 ml/min. |
detectiegolflengte: | excitatie: 310 nm; |
Emissie 419 nm; | |
injectievolume: | 20 μl |
Controleer de stabiliteit van het HPLC-systeem door enige malen de ijkoplossing (punt 3.10.3) van 4,0 μg/ml te injecteren, totdat constante piekhoogten (of -oppervlakten) en retentietijden worden verkregen.
5.3.2. IJkgrafiek
Injecteer elke ijkoplossing (punt 3.10.3) enkele malen en meet voor elke concentratie de gemiddelde piekhoogte (-oppervlakte). Maak een ijklijn met de gemiddelde piekhoogten (-oppervlakten) als ordinaat en de bijbehorende concentraties in μg/ml als abscis.
5.3.3. Monsteroplossing
Injecteer de in 5.2.1 en 5.2.2 verkregen monsterextracten enige malen, waarbij hetzelfde injectievolume als voor de ijkoplossingen wordt gebruikt, en bepaal de gemiddelde piekhoogten (-oppervlakten) van de lasalocide-natriumpieken.
6. Berekening van de resultaten
Bereken uit de gemiddelde piekhoogte (-oppervlakte) die door injectie van de monsteroplossing (punt 5.3.3) tot stand is gekomen, het gehalte aan lasalocide-natrium (μg/ml) op basis van de ijklijn.
6.1. Diervoeders
Het gehalte aan lasalocide-natrium w (mg/kg) in het monster wordt verkregen met de volgende formule:
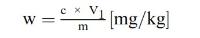
waarbij:
c = | het gehalte lasalocide-natrium van de monsteroplossing (punt 5.2.1) in g/ml; |
V1 = | volume van het monsterextract volgens 5.2.1 in ml (d.w.z. 100); |
m = | massa van het analysemonster in g. |
6.2. Voormengsels
Het gehalte aan lasalocide-natrium w (mg/kg) in het monster wordt verkregen met de volgende formule:
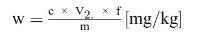
waarbij:
c = | het gehalte lasalocide-natrium van de monsteroplossing (punt 5.2.2) in g/ml; |
V2 = | volume van het monsterextract volgens 5.2.2 in ml (d.w.z. 250); |
f = | verdunningsfactor volgens 5.2.2; |
m = | massa van het analysemonster in g. |
7. Validatie van de resultaten
7.1. Identiteit
Op spectrofluorimetrische detectie gebaseerde methoden zijn minder aan storing onderhevig dan die waarbij uv-detectie wordt toegepast. De identiteit van de geanalyseerde stof kan worden vastgesteld door cochromatografie.
7.1.1. Cochromatografie
Voeg aan een deel van het monsterextract (punt 5.2.1 of 5.2.2) een juiste hoeveelheid van een ijkoplossing (punt 3.10.3) toe. De hoeveelheid toegevoegd lasalocide-natrium moet ongeveer even groot zijn als de in het monsterextract gevonden hoeveelheid. Alleen de hoogte van de lasalocide-natriumpiek mag naar verhouding toenemen, rekening houdend met de toegevoegde hoeveelheid en de verdunning van het extract. De piekbreedte op de helft van de maximale piekhoogte moet binnen ± 10 % liggen van de breedte van het monster waaraan geen lasalocide-natrium is toegevoegd.
7.2. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer bedragen dan:
- —
bij een gehalte aan lasalocide-natrium tussen 30 mg/kg en 100 mg/kg niet meer dan 15 % van het hoogste resultaat bedragen;
- —
bij een gehalte aan lasalocide-natrium tussen 100 mg/kg en 200 mg/kg niet meer dan 15 mg/kg bedragen;
- —
7,5 % van het hoogste resultaat bij een gehalte aan lasalocide-natrium van meer dan 200 mg/kg.
7.3. Terugvinding
Voor het (blanco) voedermonster met toevoeging moet het terugvindingspercentage ten minste 80 % bedragen. Voor het voormengselmonster met toevoeging moet het terugvindingspercentage ten minste 90 % bedragen.
8. Resultaten van een ringonderzoek
Er heeft een ringonderzoek (*1) plaatsgevonden waarbij twee voormengsels (monster 1 en 2) en vijf soorten voeder (monster 3 tot en met 7) door twaalf laboratoria zijn onderzocht. Op elk monster werden duploanalyses uitgevoerd. De resultaten staan in de volgende tabel.
monster 1 voormengsel voor kippen | monster 2 voormengsel voor kalkoenen | monster 3 pellets voor kalkoenen | monster 4 voederbrokjes voor kippen | monster 5 voeder voor kalkoenen | monster 6 voeder voor kippen A | monster 7 voeder voor kippen B | |
|---|---|---|---|---|---|---|---|
L | 12 | 12 | 12 | 12 | 12 | 12 | 12 |
n | 23 | 23 | 23 | 23 | 23 | 23 | 23 |
gemiddelde [mg/kg] | 5 050 | 16 200 | 76,5 | 78,4 | 92,9 | 48,3 | 32,6 |
sr [mg/kg] | 107 | 408 | 1,71 | 2,23 | 2,27 | 1,93 | 1,75 |
CVr [%] | 2,12 | 2,52 | 2,24 | 2,84 | 2,44 | 4,00 | 5,37 |
sR [mg/kg] | 286 | 883 | 3,85 | 7,32 | 5,29 | 3,47 | 3,49 |
CVR [%] | 5,66 | 5,45 | 5,03 | 9,34 | 5,69 | 7,18 | 10,70 |
nominaal gehalte [mg/kg] | 5 000 (*2) | 16 000 (*2) | 80 (*2) | 105 (*2) | 120 (*2) | 50 ((+)) | 35 ((+)) |
L= aantal laboratoria; n= aantal bepalingen; sr= standaardafwijking van de herhaalbaarheid; sR= standaardafwijking van de reproduceerbaarheid; CVr= variatiecoëfficiënt van de herhaalbaarheid, in %; CVR= variatiecoëfficiënt van de reproduceerbaarheid, in %. | |||||||
(H) Bepaling van amproliumhydrochloride
1-[(4-Amino-2-propyl-5-pyrimidinyl)methyl]-2-methylpyridiniumchloride-monohydrochloride
1. Doel en toepassingsgebied
Dit voorschrift beschrijft de methode voor de bepaling van het gehalte aan amprolium in diervoeders. De aantoonbaarheidsgrens is 1 mg/kg en de bepaalbaarheidsgrens 5 mg/kg.
2. Beginsel
Het monster wordt geëxtraheerd met een mengsel van methanol en water. Na verdunning met de mobiele fase en membraanfiltratie wordt het gehalte aan amprolium bepaald met kationenwisselings-hogedrukvloeistofchromatografie (HPLC) met uv-detectie.
3. Reagentia
- 3.1.
Methanol.
- 3.2.
Acetonitril, HPLC-kwaliteit of gelijkwaardig.
- 3.3.
Water, HPLC-kwaliteit of gelijkwaardig
- 3.4.
Natriumdiwaterstoffosfaat-oplossing, c = 0,1 mol/l
Los 13,80 g natriumdiwaterstoffosfaat-monohydraat in een maatkolf van 1 000 ml op in water (punt 3.3), vul aan tot de streep met water (punt 3.3) en meng.
- 3.5.
Natriumperchloraat-oplossing, c = 1,6 mol/l
Los 224,74 g natriumperchloraat-monohydraat in een maatkolf van 1 000 ml op in water (punt 3.3), vul aan tot de streep met water (punt 3.3) en meng.
- 3.6.
Mobiele fase voor HPLC (zie opmerking in punt 9.1).
Mengsel van acetonitril (punt 3.2), natriumdiwaterstoffosfaatoplossing (punt 3.4) en natriumperchloraatoplossing (punt 3.5), 450 + 450 + 100 (V + V + V); filtreer de oplossing vóór gebruik door een 0,22 μm membraanfilter (punt 4.3) en ontgas de oplossing (bv. in het ultrasoonbad (punt 4.4) gedurende ten minste 15 minuten).
- 3.7.
Standaardstof: zuiver amprolium, 1-[(4-amino-2-propyl-5-pyrimidinyl)methyl]-2-methylpyridiniumchloride, E 750 (zie opmerking in punt 9.2).
- 3.7.1.
Standaardstockoplossing amprolium, 500 μg/ml
Weeg 50 mg amprolium (punt 3.7) tot op 0,1 mg nauwkeurig af en breng in een maatkolf van 100 ml. Los op met 80 ml methanol (punt 3.1) door de kolf gedurende tien minuten in een ultrasoonbad (punt 4.4) te plaatsen. Koel de oplossing na de ultrasoonbehandeling af tot kamertemperatuur, vul aan tot de streep met water en meng. Bij een temperatuur van ten hoogste 4 °C is de oplossing stabiel gedurende één maand.
- 3.7.2.
Standaardtussenoplossing amprolium, 50 μg/ml
Pipetteer 5,0 ml van de standaardstockoplossing (punt 3.7.1) in een maatkolf van 50 ml, vul aan tot de maatstreep met extractievloeistof (punt 3.8) en meng. Bij een temperatuur van ten hoogste 4 °C is de oplossing stabiel gedurende één maand.
- 3.7.3.
IJkoplossingen
Pipetteer in een reeks maatkolven van 50 ml respectievelijk 0,5, 1,0 en 2,0 ml werkoplossing (punt 3.7.2). Vul aan tot de streep met mobiele fase (punt 3.6) en meng. Deze oplossingen komen overeen met respectievelijk 0,5, 1,0 en 2,0 μg amprolium per ml. Deze oplossingen moeten vóór gebruik vers worden bereid.
- 3.8.
Extractievloeistof
Een mengsel van methanol (punt 3.1) en water, 2 + 1 (V + V).
4. Apparatuur
- 4.1.
HPLC-apparatuur met injectiesysteem, geschikt voor injectiehoeveelheden van 100 μl.
- 4.1.1.
HPLC-kolom, 125 mm × 4 mm, cation exchange Nucleosil 10 SA, vulling van 5 of 10 μm, of een gelijkwaardige kolom.
- 4.1.2.
Uv-detector met variabele golflengte of diodearraydetector.
- 4.2.
Membraanfilter, PTFE-materiaal, 0,45 μm.
- 4.3.
Membraanfilter, 0,22 μm.
- 4.4.
Ultrasoonbad.
- 4.5.
Mechanisch schudapparaat of magneetroerder
5. Werkwijze
5.1. Algemeen
5.1.1. Blanco diervoeder
Voor de bepaling van het terugvindingspercentage (punt 5.1.2) moet een blanco diervoeder worden geanalyseerd om te controleren of er geen amprolium of storende stoffen aanwezig zijn. Het blanco diervoeder moet van vergelijkbare soort zijn als het monster en hierin mogen geen amprolium of storende stoffen aantoonbaar zijn.
5.1.2. Bepaling van de terugvinding
Het terugvindingspercentage moet worden bepaald door analyse van het blanco diervoeder waaraan een vergelijkbare hoeveelheid amprolium is toegevoegd als aanwezig in het monster. Voor een gehalte van 100 mg/kg wordt 10,0 ml standaardstockoplossing (punt 3.7.1.) in een erlenmeyer van 250 ml gepipetteerd en ingedampt tot een volume van ca. 0,5 ml. Voeg 50 g blanco diervoeder toe, meng zorgvuldig, laat gedurende tien minuten staan en meng vervolgens nog enige malen, alvorens de extractiestap (punt 5.2) uit te voeren.
Als een blanco diervoeder van vergelijkbare soort niet beschikbaar is (zie 5.1.1), kan het terugvindingspercentage ook worden bepaald met de standaardadditiemethode. Hierbij wordt aan het te analyseren monster een vergelijkbare hoeveelheid amprolium toegevoegd als aanwezig in het monster. Dit monster wordt geanalyseerd samen met het monster waaraan geen amprolium is toegevoegd, en het terugvindingspercentage kan dan door aftrekking worden berekend.
5.2. Extractie
5.2.1. Voormengsels (gehalte aan amprolium < 1 %) en diervoeders
Weeg afhankelijk van het gehalte aan amprolium 5–40 g monster tot op 0,01 g nauwkeurig af in een erlenmeyer van 500 ml en voeg 200 ml extractievloeistof (punt 3.8) toe. Plaats de erlenmeyer gedurende 15 minuten in een ultrasoonbad (punt 4.4). Haal de erlenmeyer uit het ultrasoonbad, en plaats hem gedurende 1 uur op het schudapparaat of de magneetroerder (punt 4.5). Verdun een aliquot van het extract met mobiele fase (punt 3.6) tot een amproliumconcentratie van 0,5–2 μg/ml en meng (zie opmerking in punt 9.3). Filtreer 5–10 ml van deze verdunde oplossing door een membraanfilter (punt 4.2). Vervolg met de HPLC-bepaling (punt 5.3).
5.2.2. Voormengsels (gehalte aan amprolium ≥ 1 %)
Weeg 1–4 g monster, afhankelijk van het gehalte aan amprolium, tot op 0,001 g nauwkeurig af in een erlenmeyer van 500 ml en voeg 200 ml extractievloeistof (punt 3.8) toe. Plaats de erlenmeyer gedurende 15 minuten in een ultrasoonbad (punt 4.4). Haal de erlenmeyer uit het ultrasoonbad, en plaats hem gedurende 1 uur op het schudapparaat of de magneetroerder (punt 4.5). Verdun een aliquot van het extract met mobiele fase (punt 3.6) tot een amproliumconcentratie van 0,5–2 μg/ml en meng. Filtreer 5–10 ml van deze verdunde oplossing door een membraanfilter (punt 4.2). Vervolg met de HPLC-bepaling (punt 5.3).
5.3. HPLC-bepaling
5.3.1. Parameters
De volgende condities worden als leidraad aangegeven; er mogen andere parameters worden gebruikt mits gelijkwaardige resultaten worden verkregen:
HPLC-kolom (punt 4.1.1): | 125 mm × 4 mm, cation exchange Nucleosil 10 SA, 5 of 10 μm vulling, of gelijkwaardig; |
mobiele fase (punt 3.6): | mengsel van acetonitril (punt 3.2), natriumdiwaterstoffosfaatoplossing (punt 3.4) en natriumperchloraatoplossing (punt 3.5), 450 + 450 + 100 (V + V + V); |
elutiesnelheid: | 0,7 −1 ml/minuut; |
detectiegolflengte: | 264 nm; |
injectievolume: | 100 μl. |
Controleer de stabiliteit van het HPLC-systeem door enige malen de ijkoplossing (punt 3.7.3) van 1,0 μg/ml te injecteren, totdat constante piekhoogten en retentietijden worden verkregen.
5.3.2. IJkgrafiek
Injecteer elke ijkoplossing (punt 3.7.3) enkele malen en meet voor elke concentratie de gemiddelde piekhoogte (-oppervlakte). Maak een ijkgrafiek met de gemiddelde piekhoogten of -oppervlakten als ordinaat en de bijbehorende concentraties in μg/ml als abscis.
5.3.3. Monsteroplossing
Injecteer het monsterextract (punt 5.2) enige malen waarbij hetzelfde volume als voor de ijkoplossingen wordt gebruikt en bepaal de gemiddelde piekhoogte (-oppervlakte) van de amproliumpieken.
6. Berekening van de resultaten
Bepaal uit de gemiddelde hoogte (oppervlakte) van de amproliumpieken van de monsteroplossing aan de hand van de ijkgrafiek (punt 5.3.2) de concentratie van de monsteroplossing in μg/ml.
Het gehalte aan amprolium w in mg/kg in het monster wordt verkregen met de volgende formule:
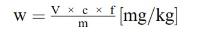
waarbij:
V = | volume van de extractievloeistof (punt 3.8) in ml volgens 5.2 (d.w.z. 200 ml); |
c = | amproliumconcentratie van de monsteroplossing (punt 5.2) in μg/ml; |
f = | verdunningsfactor volgens 5.2; |
m = | massa van het analysemonster in g. |
7. Validatie van de resultaten
7.1. Identiteit
De identiteit van de geanalyseerde stof kan worden bevestigd door cochromatografie of met een diode array detector, waarbij de spectra van het monsterextract (punt 5.2) en de ijkoplossing (punt 3.7.3) met 2,0 μg/ml worden vergeleken.
7.1.1. Cochromatografie
Voeg aan een deel van het monsterextract (punt 5.2) een geschikte hoeveelheid van een ijkoplossing (punt 3.7.3) toe. De toegevoegde hoeveelheid amprolium moet ongeveer gelijk zijn aan de geschatte hoeveelheid amprolium in het monsterextract.
Alleen de hoogte van de amproliumpiek mag naar verhouding toenemen, rekening houdend met de toegevoegde hoeveelheid en de verdunning van het extract. De piekbreedte op de helft van de maximale piekhoogte moet binnen ± 10 % van de oorspronkelijke breedte liggen.
7.1.2. Diodearraydetectie
De resultaten worden op grond van de volgende criteria beoordeeld:
- a)
de golflengten van de absorptiemaxima van de spectra van het monster en de standaard, gemeten op de top van de chromatografische piek, moeten overeenkomen binnen een marge die wordt bepaald door het oplossend vermogen van het detectiesysteem. Voor diodearraydetectie is deze marge meestal ± 2 nm;
- b)
tussen 210 en 320 nm mogen de spectra van het monster en de standaard, gemeten op de top van de chromatografische piek, voor het gedeelte van de spectra met een relatieve absorptie van 10–100 % niet van elkaar verschillen. Aan dit criterium is voldaan wanneer dezelfde maxima aanwezig zijn en de afwijking tussen de spectra op geen enkel punt meer dan 15 % van de extinctie van de standaard bedraagt;
- c)
tussen 210 en 320 nm mogen de spectra in de buigpunten en op de top van de chromatografische piek van het monsterextract voor het gedeelte van de spectra met een relatieve absorptie van 10–100 % niet van elkaar verschillen. Aan dit criterium is voldaan wanneer dezelfde maxima aanwezig zijn en de afwijking tussen de spectra op geen enkel punt meer dan 15 % van de extinctie van het spectrum van de top bedraagt.
Indien aan een van deze criteria niet is voldaan, is de aanwezigheid van de te analyseren stof niet bevestigd.
7.2. Herhaalbaarheid
Het verschil tussen de resultaten van een duplobepaling mag niet meer bedragen dan:
- —
bij amproliumgehalten tussen 25 en 500 mg/kg niet meer dan 15 % van het hoogste resultaat bedragen;
- —
bij amproliumgehalten tussen 500 en 1 000 mg/kg niet meer dan 75 mg/kg bedragen;
- —
bij amproliumgehalten van meer dan 1 000 mg/kg niet meer dan 7,5 % van het hoogste resultaat bedragen.
7.3. Terugvinding
Voor het (blanco)monster met toevoeging dient het terugvindingspercentage ten minste 90 % te bedragen.
8. Resultaten van een ringonderzoek
Er is een ringonderzoek uitgevoerd waarbij drie soorten pluimveevoer (monsters 1 t/m 3), een mineraal diervoeder (monster 4) en een voormengsel (monster 5) zijn onderzocht. De resultaten staan in de volgende tabel.
monster 1 (blanco diervoeder) | monster 2 | monster 3 | monster 4 | monster 5 | |
|---|---|---|---|---|---|
L | 14 | 14 | 14 | 14 | 15 |
n | 56 | 56 | 56 | 56 | 60 |
gemiddelde [mg/kg] | - | 45,5 | 188 | 5 129 | 25 140 |
sr [mg/kg] | - | 2,26 | 3,57 | 178 | 550 |
CVr [%] | - | 4,95 | 1,90 | 3,46 | 2,20 |
sR [mg/kg] | - | 2,95 | 11,8 | 266 | 760 |
CVR [%] | - | 6,47 | 6,27 | 5,19 | 3,00 |
nominaal gehalte [mg/kg] | - | 50 | 200 | 5 000 | 25 000 |
L: aantal laboratoria; n: aantal bepalingen; sr: standaardafwijking van de herhaalbaarheid; CVr: variatiecoëfficiënt van de herhaalbaarheid; sR: standaardafwijking van de reproduceerbaarheid; CVR: variatiecoëfficiënt van de reproduceerbaarheid. | |||||
9. Opmerkingen
- 9.1.
Als het monster thiamine bevat, verschijnt de thiaminepiek in het chromatogram net iets vóór de amproliumpiek. Bij toepassing van deze methode moeten amprolium en thiamine worden gescheiden. Als amprolium en thiamine niet worden gescheiden door de bij deze methode gebruikte kolom (punt 4.1.1), vervang dan ten hoogste 50 % van de acetonitrilfractie van de mobiele fase (punt 3.6) door methanol.
- 9.2.
Volgens de Britse Farmacopee vertoont het spectrum van een amproliumoplossing (c = 0,02 mol/l) in zoutzuur (c = 0,1 mol/l) maxima bij 246 nm en 262 nm. De extinctie bij 246 nm moet 0,84 bedragen en bij 262 nm 0,80.
- 9.3.
Het extract moet altijd worden verdund met de mobiele fase, omdat de retentietijd van de amproliumpiek anders aanzienlijk kan verschuiven door veranderingen in ionensterkte.
(I) Bepaling van narasin
Het gehalte narasin wordt bepaald volgens:
- —
de analysemethode van EN 17299 Diervoeders: Bemonsterings- en analysemethoden — Screening en bepaling van toegestane coccidiostatica op het niveau van additieven en 1 % en 3 % kruisbesmetting, van niet-geregistreerde coccidiostatica, en van één antibioticum op subadditieve niveaus, in mengvoeders met hogedrukvloeistofchromatografie (HPLC) — Tandem massaspectrometrische detectie (LC-MS/MS), of
- —
de analysemethode van EN ISO 14183 Diervoeders: Bepaling van het gehalte aan monesin, narasin en salinomycine — Vloeistof chromatografische methode met gebruik van post-columnderivatie.
(J) Bepaling van nicarbazine
Het gehalte nicarbazine wordt bepaald volgens:
- —
de analysemethode van EN 17299 Diervoeders: Bemonsterings- en analysemethoden — Screening en bepaling van toegestane coccidiostatica op het niveau van additieven en 1 % en 3 % kruisbesmetting, van niet-geregistreerde coccidiostatica, en van één antibioticum op subadditieve niveaus, in mengvoeders met hogedrukvloeistofchromatografie (HPLC) — Tandem massaspectrometrische detectie (LC-MS/MS), of
- —
de analysemethode van EN 15782 Diervoeders: Bepaling van nicarbazine — Methode met hoge-prestatie vloeistofchromatografie (HPLC).
(K) Bepaling van decoquinaat
Het gehalte decoquinaat wordt bepaald volgens:
- —
de analysemethode van EN 17299 Diervoeders: Bemonsterings- en analysemethoden — Screening en bepaling van toegestane coccidiostatica op het niveau van additieven en 1 % en 3 % kruisbesmetting, van niet-geregistreerde coccidiostatica, en van één antibioticum op subadditieve niveaus, in mengvoeders met hogedrukvloeistofchromatografie (HPLC) — Tandem massaspectrometrische detectie (LC-MS/MS), of
- —
de analysemethode van EN 16162 Diervoeders: Bepaling van decoquinaat door middel van HPLC met fluorescentie detectie.
(L) Bepaling van monensin
Het gehalte monensin wordt bepaald volgens:
- —
de analysemethode van EN 17299 Diervoeders: Bemonsterings- en analysemethoden — Screening en bepaling van toegestane coccidiostatica op het niveau van additieven en 1 % en 3 % kruisbesmetting, van niet-geregistreerde coccidiostatica, en van één antibioticum op subadditieve niveaus, in mengvoeders met hogedrukvloeistofchromatografie (HPLC) — Tandem massaspectrometrische detectie (LC-MS/MS), of
- —
de analysemethode van EN ISO 14183 Diervoeders: Bepaling van het gehalte aan monesin, narasin en salinomycine — Vloeistof chromatografische methode met gebruik van post-columnderivatie.
(M) Bepaling van salinomycine
Het gehalte salinomycine wordt bepaald volgens:
- —
de analysemethode van EN 17299 Diervoeders: Bemonsterings- en analysemethoden — Screening en bepaling van toegestane coccidiostatica op het niveau van additieven en 1 % en 3 % kruisbesmetting, van niet-geregistreerde coccidiostatica, en van één antibioticum op subadditieve niveaus, in mengvoeders met hogedrukvloeistofchromatografie (HPLC) — Tandem massaspectrometrische detectie (LC-MS/MS), of
- —
de analysemethode van EN ISO 14183 Diervoeders: Bepaling van het gehalte aan monesin, narasin en salinomycine — Vloeistof chromatografische methode met gebruik van post-columnderivatie.
(N) Bepaling van semduramycine
Het gehalte semduramycine wordt bepaald volgens:
- —
de analysemethode van EN 17299 Diervoeders: Bemonsterings- en analysemethoden — Screening en bepaling van toegestane coccidiostatica op het niveau van additieven en 1 % en 3 % kruisbesmetting, van niet-geregistreerde coccidiostatica, en van één antibioticum op subadditieve niveaus, in mengvoeders met hogedrukvloeistofchromatografie (HPLC) — Tandem massaspectrometrische detectie (LC-MS/MS), of
- —
de analysemethode van EN ISO 16158 Diervoeders: Bepaling van het semduramicine gehalte — Vloeistof chromatigrafische methode met gebruik van een beslisboom.
(O) En-normen
Voor de toepassing van artikel 34, lid 2, punt a), van Verordening (EU) 2017/625 zijn de volgende EN-normen van belang:
EN ISO 30024 Diervoeders — Bepaling van de ‘phytase’ activiteit
EN 17050 Animal feeding stuffs — methods of sampling and analysis — Determination of iodine in animal feed by ICP-MS
EN 17550 Animal feeding stuffs: Determination of carotenoids in animal compound feed and premixtures by reverse phase high performance liquid chromatography — UV detection (RP-HPLC-UV)
EN 15784 Diervoeders: Methode van monsterneming en analyse — Isolatie en telling van het aantal vermoedelijke Bacillus spp.
EN 15785 Diervoeders: Isolatie en telling van Bifidobacterium spp
EN 15786 Diervoeders: Methode van monsterneming en analyse — Isolatie en telling van Pediococcus spp.
EN 15787 Diervoeders: Methode van monsterneming en analyse — Isolatie en telling van Lactobacillus spp.
EN 15788 Diervoeders: Methode van monsterneming en analyse — Isolatie en telling van Enterococcus (E.faecum) spp.
EN 15789 Diervoeders: Methode van monsterneming en analyse — Isolatie en telling van gist probiotica varianten (Saccharomyces cerevisiae)
EN 15510 Diervoeders: Methoden voor analyse en monsterneming — Bepaling van calcium, natrium, fosfor, magnesium, kalium, ijzer, zink, koper, mangaan, kobalt, molybdeen en lood met ICP-AES (voor de analyse van de toevoegingsmiddelen voor diervoeding kobalt en molybdeem)
EN 15621 Diervoeders: Methoden voor analyse en monsterneming — Bepaling van het gehalte aan calcium, natrium, fosfor, magnesium, kalium, zwavel, ijzer, zink, koper, mangaan en kobalt door ICP-AES na ontsluiting onder druk (voor de analyse van het toevoegingsmiddel voor diervoeding kobalt)
EN 16159 Diervoeders — Bepaling van selenium met behulp van hydride generatie atomaire absorptie spectometrie (HGAAS) na ontsluiting met microgolven (extractie met 65 % salpeterzuur en 30 % waterstofperoxide) (voor de analyse van het toevoegingsmiddel voor diervoeding selenium)
EN 17053: Diervoeders: Methoden van bemonstering en analyse — Bepaling van sporenelementen, zware metalen en andere elementen in diervoeders door ICP-MS (multi-methode) (voor de analyse van de toevoegingsmiddelen voor diervoeding kobalt, molybdeen en selenium).
Voetnoten
De analysemethode van EN 17547 kan worden toegepast als alternatieve methode voor officiële controles voor de bepaling van vitamine A en E in plaats van de methoden die voor de bepaling van vitamine A in deel A van deze bijlage en voor vitamine E in deel B van deze bijlage zijn beschreven.
Uitgevoerd door de Werkgroep diervoeders van het Verband Deutscher Landwirtschaftlicher Untersuchungs- und Forschungsanstalten (VDLUFA).
De analysemethode van EN 17547 kan worden toegepast als alternatieve methode voor officiële controles voor de bepaling van vitamine A en E in plaats van de methoden die voor de bepaling van vitamine A in deel A van deze bijlage en voor vitamine E in deel B van deze bijlage zijn beschreven.
Uitgevoerd door de Werkgroep diervoeders van het Verband Deutscher Landwirtschaftlicher Untersuchungs- und Forschungsanstalten (VDLUFA).
Deze methode is voor verschillende voedermatrices gevalideerd door middel van een ringonderzoek. Nadere informatie is beschikbaar op https://ec.europa.eu/jrc/en/eurl/feed-additives/authorisation.
Er mogen andere ontsluitingsmethoden worden gebruikt, mits is aangetoond dat die vergelijkbare resultaten opleveren (bv. microgolfontsluiting onder hoge druk).
Groenvoer (vers of gedroogd) bevat soms grote hoeveelheden plantaardig kiezelzuur dat moet worden verwijderd omdat het sporenelementen kan vasthouden. Bij monsters van dergelijke diervoeders moet derhalve de volgende gewijzigde procedure worden toegepast. Ga te werk als in 5.1.1.1 tot en met de filtratie. Was het filtreerpapier met het onoplosbare residu tweemaal uit met kokend water en breng het in een kwarts- of platinaschaal.Veras in de moffeloven (punt 4.1) bij een temperatuur van ten hoogste 550 °C tot alle koolstofhoudend materiaal is verdwenen. Voeg na afkoelen enkele druppels water toe en daarna 10–15 ml waterstoffluorideoplossing (punt 3.4). Damp in tot droog bij ongeveer 150 °C. Indien het residu nog steeds enig kiezelzuur bevat, los het dan opnieuw op in enkele ml waterstoffluorideoplossing (punt 3.4) en damp in tot droog. Voeg 5 druppels zwavelzuur (punt 3.5) toe en verwarm tot er geen witte damp meer ontstaat. Voeg vervolgens 5 ml zoutzuur 6 mol/l (punt 3.2) en ongeveer 30 ml water toe, verwarm en filtreer de oplossing in een maatkolf van 250 ml; koel af en vul aan tot de streep met water (de zoutzuurconcentratie is dan ongeveer 0,5 mol/l). Handel verder als beschreven in 5.1.2.
The Analyst 108, 1983, blz. 1252–1256.
De methode mag ook worden gebruikt voor de bepaling van diclazuril in voedermiddelen.
Een langere stabiliteit (tot één jaar) kan mogelijk zijn, maar dit moet door het individuele laboratorium worden bevestigd.
Eerste onderzoek uit 1994 Journal of AOAC International, Volume 77, No 6, 1994, blz. 1359–1361; Tweede onderzoek uit 2015: technisch rapport van het JRC ‘Hervalidatie van een methode voor de bepaling van diclazuril door ringonderzoek ’ (2016).
Analyst, 1995, 120, blz. 2175–2180
Door de fabrikant opgegeven gehalte.
Door de fabrikant opgegeven gehalte.
Door de fabrikant opgegeven gehalte.
Door de fabrikant opgegeven gehalte.
Door de fabrikant opgegeven gehalte.
In het laboratorium bereid voeder.
In het laboratorium bereid voeder.