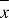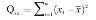Einde inhoudsopgave
Verordening (EG) Nr. 152/2009 tot vaststelling van de bemonsterings- en analysemethoden voor de officiële controle van diervoeders
Bijlage V Analysemethoden voor de controle op ongewenste stoffen in diervoeders
Geldend
Geldend vanaf 04-04-2024
- Bronpublicatie:
29-02-2024, PbEU L 2024, 2024/771 (uitgifte: 15-03-2024, regelingnummer: 2024/771)
- Inwerkingtreding
04-04-2024
- Bronpublicatie inwerkingtreding:
29-02-2024, PbEU L 2024, 2024/771 (uitgifte: 15-03-2024, regelingnummer: 2024/771)
- Vakgebied(en)
Agrarisch recht (V)
Gezondheidsrecht / Voedsel- en warenkwaliteit
(A) Bepaling van het gehalte aan dioxinen (PCDD/PCDF) en PCB's
Hoofdstuk I. Bemonsteringswijze en interpretatie van de analyseresultaten
1. Toepassingsgebied en definities
De monsters voor de officiële controle op het gehalte aan polychloordibenzo-p-dioxinen (PCDD's) en polychloordibenzofuranen (PCDF's) (1), dioxineachtige polychloorbifenylen (pcb's) en niet-dioxineachtige pcb's in diervoeders worden genomen overeenkomstig bijlage I. De in punt 5.1 van die bijlage beschreven kwantitatieve voorschriften voor de controle van stoffen of producten die gelijkmatig over het diervoeder verdeeld zijn, moeten worden gevolgd. De op die manier verkregen verzamelmonsters worden representatief geacht voor de partijen of subpartijen waarvan zij zijn genomen. Op basis van de gehalten die in de laboratoriummonsters worden geconstateerd, wordt bepaald of de partijen voldoen aan de maximumgehalten zoals vastgesteld bij Richtlijn 2002/32/EG.
Voor de toepassing van dit deel gelden de definities zoals vastgesteld in bijlage I bij Uitvoeringsverordening (EU) 2021/808 van de Commissie (2).
Daarnaast wordt voor de toepassing van dit deel verstaan onder:
‘screeningsmethoden’: methoden die worden gebruikt voor de selectie van monsters met een gehalte aan PCDD's/PCDF's en dioxineachtige pcb's dat de maximumgehalten of de actiedrempels overschrijdt. Hierbij moet een kosteneffectieve doorvoer van een groot aantal monsters mogelijk zijn, zodat de kans groter is dat nieuwe gevallen worden ontdekt waarbij het blootstellings- en het gezondheidsrisico voor de consument groot is. Screeningsmethoden moeten op bioanalytische of GC-MS-methoden gebaseerd zijn. De resultaten van monsters waarbij de vastgestelde afkapwaarde voor de controle op de naleving van het maximumgehalte wordt overschreden, moeten worden geverifieerd door een volledige heranalyse door middel van een bevestigingsmethode, uitgaande van het oorspronkelijke monster;
‘bevestigingsmethoden’: methoden die volledige of aanvullende informatie leveren voor de ondubbelzinnige identificatie en bepaling van PCDD's/PCDF's en dioxineachtige pcb's op het maximumgehalte of zo nodig op de actiedrempel. Bij die methoden wordt gaschromatografie/hogeresolutiemassaspectrometrie (GC-HRMS) of gaschromatografie/tandemmassaspectrometrie (GC-MS/MS) gebruikt.
(1)Tabel van toxische-equivalentiefactoren (TEF's) voor PCDD's, PCDF's en dioxineachtige pcb's: De WHO-TEF's voor menselijke risicobeoordeling zijn gebaseerd op de conclusies van de vergadering van deskundigen van de World Health Organization (WHO) International Programme on Chemical Safety (IPCS), die in juni 2005 in Genève is gehouden (Martin van den Berg e.a., The 2005 World Health Organization Re-evaluation of Human and Mammalian Toxic Equivalency Factors for Dioxins and Dioxin-like Compounds. Toxicological Sciences 93(2), 223–241 (2006)).
Congeneer | TEF-waarde | Congeneer | TEF-waarde |
|---|---|---|---|
Dibenzo-p-dioxinen (‘PCDD's’) en dibenzo-p-furanen (‘PCDF's’) | ‘Dioxineachtige’ pcb's non-ortho-pcb's + mono-ortho-pcb's | ||
2,3,7,8-TCDD | 1 | ||
1,2,3,7,8-PeCDD | 1 | Non-ortho-pcb's | |
1,2,3,4,7,8-HxCDD | 0,1 | PCB 77 | 0,0001 |
1,2,3,6,7,8-HxCDD | 0,1 | PCB 81 | 0,0003 |
1,2,3,7,8,9-HxCDD | 0,1 | PCB 126 | 0,1 |
1,2,3,4,6,7,8-HpCDD | 0,01 | PCB 169 | 0,03 |
OCDD | 0,0003 | Mono-ortho-pcb's | |
2,3,7,8-TCDF | 0,1 | PCB 105 | 0,00003 |
1,2,3,7,8-eCDF | 0,03 | PCB 114 | 0,00003 |
2,3,4,7,8-eCDF | 0,3 | PCB 118 | 0,00003 |
1,2,3,4,7,8-HxCDF | 0,1 | PCB 123 | 0,00003 |
1,2,3,6,7,8-HxCDF | 0,1 | PCB 156 | 0,00003 |
1,2,3,7,8,9-HxCDF | 0,1 | PCB 157 | 0,00003 |
2,3,4,6,7,8-HxCDF | 0,1 | PCB 167 | 0,00003 |
1,2,3,4,6,7,8-HpCDF | 0,01 | PCB 189 | 0,00003 |
1,2,3,4,7,8,9-HpCDF | 0,01 | ||
OCDF | 0,0003 | ||
Gebruikte afkortingen: ‘t’ = tetra; ‘Pe’ = penta; ‘Hx’ = hexa; ‘Hp’ = hepta; ‘O’ = octa; ‘CDD’ = chloordibenzodioxine; ‘CDF’ = chloordibenzofuran; ‘CB’ = chloorbifenyl.
2. Overeenstemming van de partij of subpartij met het maximumgehalte
2.1. Niet-dioxineachtige pcb's
De partij of subpartij is in overeenstemming met het maximumgehalte als het analyseresultaat voor de som van PCB 28, PCB 52, PCB 101, PCB 138, PCB 153 en PCB 180 (hierna niet-dioxineachtige pcb's genoemd) het maximumgehalte aan niet-dioxineachtige pcb's zoals vastgelegd in Richtlijn 2002/32/EG niet overschrijdt, rekening houdend met de uitgebreide meetonzekerheid (3). De partij of subpartij is niet in overeenstemming met het in Richtlijn 2002/32/EG vastgelegde maximumgehalte als het gemiddelde van de in geval van een tweede bepaling verkregen twee bovengrenzen (4) van het analyseresultaat (5) buiten redelijke twijfel groter is dan dat maximumgehalte, met inachtneming van de uitgebreide meetonzekerheid, d.w.z. dat de geanalyseerde concentratie na deductie van de uitgebreide meetonzekerheid wordt gebruikt om de naleving te controleren.
De uitgebreide meetonzekerheid wordt berekend met een dekkingsfactor 2, wat een betrouwbaarheidsniveau van ongeveer 95 % oplevert. Een partij of subpartij voldoet niet aan de voorschriften als het gemiddelde van de gemeten waarden minus de uitgebreide meetonzekerheid van het gemiddelde boven het maximumgehalte ligt.
De voorschriften van de bovenstaande alinea's van dit punt zijn van toepassing op het analyseresultaat van het monster voor officiële controledoeleinden. Op de analyse voor arbitragedoeleinden of in het kader van het advies van een tweede deskundige zijn de nationale voorschriften van toepassing.
2.2. PCDD's/PCDF's en dioxineachtige pcb's
De partij of subpartij is in overeenstemming met het maximumgehalte als het resultaat van één analyse,
- —
uitgevoerd aan de hand van een screeningsmethode met een fout-conformcijfer onder 5 % erop wijst dat het gehalte niet hoger is dan het maximumgehalte van respectievelijk PCDD's/PCDF's en de som van PCDD's/PCDF's en dioxineachtige pcb's, zoals neergelegd in Richtlijn 2002/32/EG;
- —
uitgevoerd aan de hand van een bevestigingsmethode het in Richtlijn 2002/32/EG vastgestelde maximumgehalte van respectievelijk PCDD's/PCDF's en de som van PCDD's/PCDF's en dioxineachtige pcb's niet overschrijdt, rekening houdend met de uitgebreide meetonzekerheid.
Voor screeningsassays wordt een afkapwaarde vastgesteld voor de beslissing inzake het al dan niet voldoen van het monster aan de maximumgehalten die voor respectievelijk PCDD's/PCDF's en de som van PCDD's/PCDF's en dioxineachtige pcb's zijn vastgesteld.
De partij of subpartij is niet in overeenstemming met het in Richtlijn 2002/32/EG vastgelegde maximumgehalte als het gemiddelde van de in geval van een tweede bepaling aan de hand van een bevestigingsmethode verkregen twee bovengrenzen (6) van het analyseresultaat (7) buiten redelijke twijfel groter is dan dat maximumgehalte, met inachtneming van de uitgebreide meetonzekerheid, d.w.z. dat de geanalyseerde concentratie na deductie van de uitgebreide meetonzekerheid wordt gebruikt om de naleving te controleren.
De uitgebreide meetonzekerheid wordt berekend met een dekkingsfactor 2, wat een betrouwbaarheidsniveau van ongeveer 95 % oplevert. Een partij of subpartij voldoet niet aan de voorschriften als het gemiddelde van de gemeten waarden minus de uitgebreide meetonzekerheid van het gemiddelde boven het maximumgehalte ligt.
De som van de geschatte uitgebreide onzekerheden van de afzonderlijke analyseresultaten van PCDD's/PCDF's en dioxineachtige pcb's moet worden gebruikt voor de som van PCDD's/PCDF's en dioxineachtige pcb's.
De voorschriften van de bovenstaande alinea's van dit punt zijn van toepassing op het analyseresultaat van het monster voor officiële controledoeleinden. Op de analyse voor verhaal- of arbitragedoeleinden zijn de nationale voorschriften van toepassing.
3. Resultaten die de actiedrempels als vastgesteld in bijlage II bij Richtlijn 2002/32/EG overschrijden
Actiedrempels zijn een instrument voor de selectie van monsters in gevallen waarin een bron van verontreiniging moet worden opgespoord en maatregelen moeten worden genomen om deze te reduceren of te elimineren. Met screeningsmethoden moeten de geschikte afkapwaarden voor de selectie van die monsters worden vastgesteld. Indien aanzienlijke inspanningen nodig zijn om een bron vast te stellen en de verontreiniging te reduceren of te elimineren, is het nodig de overschrijding van de actiedrempel te bevestigen door een tweede bepaling door middel van een bevestigingsmethode, met inachtneming van de uitgebreide meetonzekerheid (8).
Hoofdstuk II. Monstervoorbereiding en voorschriften voor de analysemethoden die worden gebruikt voor de officiële controle op het gehalte aan dioxinen (PCDD's/PCDF's) en dioxineachtige PCB's in diervoeders
1. Toepassingsgebied
De voorschriften in dit hoofdstuk gelden voor de analyse van diervoeders in verband met de officiële controle op het gehalte aan 2,3,7,8-gesubstitueerde PCDD's/PCDF's en dioxineachtige pcb's en betreffen de monstervoorbereiding en voorschriften voor de analyse voor andere doeleinden in verband met de regelgeving, met inbegrip van de controles die de exploitant van het diervoederbedrijf uitvoert teneinde te zorgen voor naleving van de bepalingen van Verordening (EG) nr. 183/2005 van het Europees Parlement en de Raad (9).
De controle op de aanwezigheid van PCDD's/PCDF's en dioxineachtige pcb's in diervoeders kan met twee verschillende typen analysemethoden worden uitgevoerd:
- a)Screeningsmethoden
Het doel van screeningsmethoden is het uitselecteren van monsters met een gehalte aan PCDD's/PCDF's en dioxineachtige pcb's dat de maximumgehalten of de actiedrempels overschrijdt. Bij screeningsmethoden moet een kosteneffectieve doorvoer van een groot aantal monsters worden gewaarborgd, zodat de kans groter is dat nieuwe gevallen worden ontdekt waarbij het blootstellings- en het gezondheidsrisico voor de consument groot is. Er moet naar worden gestreefd fout-conforme resultaten te voorkomen. Tot de screeningsmethoden behoren bioanalytische methoden en GC/MS-methoden.
Bij screeningsmethoden wordt het analyseresultaat met een afkapwaarde vergeleken, op grond waarvan wordt uitgemaakt of het maximumgehalte of de actiedrempel al dan niet overschreden kan zijn. De concentratie van PCDD's/PCDF's en de som van PCDD's/PCDF's en dioxineachtige pcb's in monsters die vermoedelijk niet in overeenstemming zijn met het maximumgehalte moeten worden bepaald of bevestigd met behulp van een bevestigingsmethode.
Daarnaast kunnen screeningsmethoden een indicatie geven van de gehalten aan PCDD's/PCDF's en dioxineachtige pcb's in het monster. Bij gebruikmaking van bioanalytische screeningsmethoden wordt het resultaat uitgedrukt in bioanalytische equivalenten (BEQ), terwijl het bij fysisch-chemische GC-MS-methoden uitgedrukt wordt in toxische equivalenten (TEQ). Aan de hand van de numerieke resultaten van screeningsmethoden kan worden aangetoond of al dan niet aan de maximumgehalten wordt voldaan of de actiedrempel wordt overschreden, en wordt een indicatie verkregen van de concentratiebereiken voor het geval dat follow-up met bevestigingsmethoden plaatsvindt. Zij zijn niet geschikt voor doeleinden als de beoordeling van achtergrondconcentraties, innameschattingen, het volgen van trends in de tijd of een nieuwe evaluatie van actiedrempels en maximumgehalten.
- b)Bevestigingsmethoden
Met bevestigingsmethoden kunnen PCDD's/PCDF's en dioxineachtige pcb's in een monster eenduidig worden geïdentificeerd en gekwantificeerd en wordt volledige informatie op congeneerniveau verkregen. Daarom kunnen die methoden worden gebruikt voor de controle op de maximumgehalten en actiedrempels en ter bevestiging van de resultaten van de screeningsmethoden. Verder kunnen de resultaten voor andere doeleinden worden gebruikt, zoals de bepaling van lage achtergrondconcentraties bij het diervoedertoezicht, het volgen van trends in de tijd, de beoordeling van de blootstelling en de opbouw van een gegevensbasis voor een eventuele nieuwe evaluatie van de actiedrempels en maximumgehalten. Zij zijn ook belangrijk voor het bepalen van congeneerpatronen met het oog op de identificatie van de bron van mogelijke contaminaties. Deze methoden maken gebruik van GC-HRMS. Ter bevestiging van de overeenstemming of het ontbreken van overeenstemming met het maximumgehalte kan ook GC-MS/MS worden gebruikt.
2. Achtergrond
Voor de berekening van de concentraties in TEQ worden de concentraties van de verschillende stoffen in een monster elk met de respectieve toxische-equivalentiefactor (TEF) (zie voetnoot 27 in hoofdstuk I) vermenigvuldigd en vervolgens bij elkaar opgeteld ter verkrijging van de totale concentratie aan dioxineachtige verbindingen, uitgedrukt in TEQ.
Voor de toepassing van dit deel A wordt onder ‘aanvaarde specifieke bepaalbaarheidsgrens van een afzonderlijke congeneer’ het laagste gehalte van de analyt verstaan dat met een redelijke statistische zekerheid kan worden gemeten, waarbij voldaan wordt aan identificatiecriteria als beschreven in internationale normen, bijvoorbeeld EN-norm 16215:2012 (Diervoeders — Bepaling van dioxinen en dioxineachtige polychloorbifenylen (pcb's) en indicator-polychloorbifenylen (pcb's) met behulp van gaschromatografie/hogeresolutiemassaspectrometrie (GC/HRMS)) en/of in de EPA-methoden 1613 en 1668, zoals herzien.
De bepaalbaarheidsgrens van een afzonderlijke congeneer kan worden vastgesteld als:
- a)
de concentratie van een analyt in een monsterextract die voor twee verschillende te meten ionen een instrumentele respons geeft met een signaal-ruisverhouding van 3:1 voor het zwakste ruwe signaal, of
- b)
als de berekening van de signaal-ruisverhouding om technische redenen geen betrouwbare resultaten oplevert, het laagste concentratiepunt op een ijkkromme dat een acceptabele (≤ 30 %), consistente (ten minste aan het begin en het eind van een monsteranalysereeks gemeten) afwijking geeft van de gemiddelde relatieve responsfactor, berekend voor alle punten van de ijkkromme in elke reeks monsters. De bepaalbaarheidsgrens wordt berekend uit het laagste concentratiepunt met inachtneming van de terugvinding van de interne standaarden en de monsterinweeg.
Bioanalytische screeningsmethoden geven geen resultaten op congeneerniveau, maar geven alleen een indicatie (10) van het TEQ-gehalte, uitgedrukt in bioanalytische equivalenten (BEQ), omdat wellicht niet alle verbindingen in een monsterextract dat in de test een respons geeft, aan alle vereisten van het TEQ-principe voldoen.
Screenings- en bevestigingsmethoden mogen alleen voor de controle van een bepaalde matrix worden toegepast als zij gevoelig genoeg zijn om betrouwbaar gehalten vast te stellen bij de actiedrempel of het maximumgehalte.
3. Kwaliteitsborgingsvoorschriften
- 3.1.
Er moeten maatregelen worden genomen om kruiscontaminatie in elke fase van de bemonsterings- en analyseprocedure te voorkomen.
- 3.2.
De monsters moeten worden opgeslagen en vervoerd in recipiënten van glas, aluminium, polypropyleen of polyethyleen die geschikt zijn voor opslag zonder invloed te hebben op het gehalte aan PCDD's/PCDF's en dioxineachtige pcb's in de monsters. Sporen papierstof moeten van de monsterrecipiënt worden verwijderd.
- 3.3.
De diervoedermonsters moeten zodanig worden bewaard en vervoerd dat de integriteit ervan bewaard blijft.
- 3.4.
Voor zover nodig wordt elk laboratoriummonster fijngemalen en zorgvuldig gemengd, zodat een volledig homogeen product ontstaat (bv. zo fijn gemalen dat het een zeef met mazen van 1 mm kan passeren). Als het vochtgehalte te hoog is, moeten de monsters voor het malen worden gedroogd.
- 3.5.
Reagentia, glaswerk en apparatuur moeten worden gecontroleerd op factoren die de op de TEQ of BEQ gebaseerde resultaten kunnen beïnvloeden.
- 3.6.
Er moet een blancobepaling worden verricht door de gehele analyseprocedure met weglating van het monster uit te voeren.
- 3.7.
Bij bioanalytische methoden moeten al het glaswerk en alle oplosmiddelen die bij de analysen worden gebruikt, worden getest om te zien of zij vrij zijn van verbindingen die de opsporing van de doelverbindingen in het werkbereik storen. Glaswerk moet worden gespoeld met oplosmiddelen en/of worden verhit tot een temperatuur waarbij sporen van PCDD's/PCDF's, dioxineachtige verbindingen en verbindingen die de bepaling kunnen storen, van het oppervlak worden verwijderd.
- 3.8.
Het te extraheren monster moet groot genoeg zijn om te voldoen aan de eisen inzake een voldoende laag werkbereik waarbinnen de te bepalen concentraties (maximumgehalten of actiedrempels) liggen.
- 3.9.
De specifieke monstervoorbereidingsprocedures voor de producten in kwestie moeten in overeenstemming zijn met internationaal aanvaarde richtsnoeren, zoals EN ISO 6498.
4. Voorschriften voor laboratoria
- 4.1.
Ingevolge Verordening (EU) 2017/625 moeten de laboratoria door een erkende instantie die werkt volgens ISO/IEC-handleiding 58 geaccrediteerd zijn om te garanderen dat zij kwaliteitsborging op hun analysen toepassen. De laboratoria moeten geaccrediteerd zijn overeenkomstig de norm EN-ISO/IEC 17025. De beginselen zoals beschreven in de ‘Technical Guidelines for the estimation of measurement uncertainty and limits of quantification for PCDD/F and PCB analysis’ moeten worden nageleefd (11).
- 4.2.
De geschiktheid van het laboratorium moet worden aangetoond doordat het steeds met goed gevolg deelneemt aan interlaboratoriumonderzoeken voor de gehaltebepaling van PCDD's/PCDF's en dioxineachtige pcb's in de betrokken diervoedermatrices en concentratiebereiken.
- 4.3.
De laboratoria die screeningsmethoden toepassen voor de routinematige controle van monsters moeten een nauwe samenwerking aangaan met de laboratoria die de bevestigingsmethode toepassen, zowel voor de kwaliteitscontrole als voor de bevestiging van het analyseresultaat van verdachte monsters.
5. Basisvoorschriften voor een analysemethode voor dioxinen (PCDD's/PCDF'S) en dioxineachtige PCB'S
5.1. Laag werkbereik en lage bepaalbaarheidsgrenzen
Voor PCDD's/PCDF's moeten de aantoonbare hoeveelheden wegens de extreme toxiciteit van sommige van deze verbindingen in het hoge femtogramgebied (10–15 g) liggen. Voor de meeste pcb-congeneren is een bepaalbaarheidsgrens in het nanogramgebied (10−9 g) al voldoende. Voor de bepaling van de sterker toxische dioxineachtige pcb-congeneren (met name non-ortho-gesubstitueerde congeneren) moet het ondereind van het werkbereik in het lage picogramgebied (10−12 g) liggen. Voor alle andere pcb-congeneren is een bepaalbaarheidsgrens in het nanogramgebied (10−9 g) voldoende.
5.2. Hoge selectiviteit (specificiteit)
- 5.2.1.
PCDD's/PCDF's en dioxineachtige pcb's moeten kunnen worden onderscheiden van tal van andere stoffen die tegelijkertijd worden geëxtraheerd en de bepaling kunnen storen, en die aanwezig zijn in concentraties die enkele orden van grootte hoger kunnen liggen dan de concentraties van de te bepalen analyten. Bij GC-MS-methoden moet onderscheid kunnen worden gemaakt tussen de verschillende congeneren, bv. tussen toxische congeneren (zoals de zeventien 2,3,7,8-gesubstitueerde PCDD's/PCDF's en de twaalf dioxineachtige pcb's) en andere congeneren.
- 5.2.2.
Met behulp van bioanalytische methoden moeten de doelverbindingen kunnen worden aangetoond als de som van PCDD's/PCDF's en/of dioxineachtige pcb's. Monsters moeten worden opgezuiverd om verbindingen te verwijderen die tot fout-niet-conforme resultaten leiden of verbindingen die de respons kunnen verminderen, waardoor fout-conforme resultaten worden verkregen.
5.3. Grote nauwkeurigheid (juistheid en precisie, schijnbare terugvinding bij bioassays)
- 5.3.1.
Bij GC-MS-methoden moet de bepaling een betrouwbare schatting van de werkelijke concentratie in een monster opleveren. Grote nauwkeurigheid is vereist om afwijzing van een resultaat van een monsteranalyse op grond van de geringe betrouwbaarheid van het bepaalde TEQ-gehalte te vermijden. De nauwkeurigheid wordt uitgedrukt als juistheid (verschil tussen de gemiddelde waarde die voor een analyt in een gecertificeerd referentiemateriaal is gemeten en zijn gecertificeerde waarde, uitgedrukt als een percentage van deze laatste waarde) en precisie (RSD, de relatieve standaardafwijking, berekend op basis van resultaten die onder reproduceerbaarheidsomstandigheden zijn verkregen)
- 5.3.2.
Voor bioanalytische methoden moet de schijnbare terugvinding bij bioassays worden bepaald. Onder ‘schijnbare terugvinding bij bioassays’ wordt het BEQ-gehalte verstaan dat is berekend aan de hand van de TCDD- of PCB 126-ijkkromme, na blancocorrectie en gedeeld door het met de bevestigingsmethode bepaalde TEQ-gehalte. Hierbij wordt getracht te corrigeren voor factoren zoals het verlies van PCDD's/PCDF's en dioxineachtige verbindingen bij de extractie en opzuivering, tegelijkertijd geëxtraheerde verbindingen die de respons doen toe- of afnemen (agonistische of antagonistische effecten), de kwaliteit van de fitting van de kromme of de verschillen tussen de waarden van de toxische-equivalentiefactor (TEF) en de relatieve potentiewaarde (REP). De schijnbare terugvinding bij bioassays wordt berekend aan de hand van geschikte referentiemonsters met een representatief congeneerpatroon rond het betrokken concentratieniveau.
5.4. Validering rond het maximumgehalte en algemene kwaliteitscontrolemaatregelen
- 5.4.1.
Laboratoria moeten de prestaties van een methode rond het maximumgehalte aantonen, bv. bij 0,5 maal, 1 maal en 2 maal het maximumgehalte, met een aanvaardbare variatiecoëfficiënt voor herhaalde analyse, tijdens de valideringsprocedure en bij een routineanalyse.
- 5.4.2.
Bij wijze van interne kwaliteitsborging moeten voortdurend blancobepalingen en bepalingen op verrijkte monsters of controlemonsters (bij voorkeur gecertificeerde referentiematerialen, indien beschikbaar) worden uitgevoerd. Voor blancobepalingen en bepalingen op verrijkte monsters of controlemonsters moeten kwaliteitscontrolekaarten worden bijgehouden en gecontroleerd om na te gaan of de prestatie van de analyse aan de vereisten beantwoordt.
5.5. Bepaalbaarheidsgrens
- 5.5.1.
Voor een bioanalytische screeningsmethode is het vaststellen van de bepaalbaarheidsgrens (LOQ) geen onontbeerlijk vereiste, maar wel moet worden aangetoond dat met de methode een onderscheid kan worden gemaakt tussen de blancowaarde en de afkapwaarde. Wanneer een BEQ-gehalte wordt aangegeven, moet een rapportagegrens worden vastgesteld in verband met monsters met een respons onder deze grens. Aangetoond moet worden dat het rapportageniveau ten minste een factor drie verschilt van procedureblanco's met een respons onder het werkbereik. Daarom moet het worden berekend op basis van monsters met de doelverbindingen rond het vereiste minimumgehalte, en niet op basis van een signaal-ruisverhouding of een assayblanco.
- 5.5.2.
De LOQ voor een bevestigingsmethode moet ongeveer een vijfde van het maximumgehalte bedragen.
5.6. Criteria voor de analyse
Voor betrouwbare resultaten van bevestigings- of screeningsmethoden moet rond het maximumgehalte voor de TEQ-waarde respectievelijk de BEQ-waarde aan de volgende criteria zijn voldaan, ongeacht of het om TEQ totaal of BEQ totaal (som van PCDD's/PCDF's en dioxineachtige pcb's) of afzonderlijke waarden voor PCDD's/PCDF's en dioxineachtige pcb's gaat:
Screening met bioanalytische of fysisch-chemische methoden | Bevestigingsmethoden | |
|---|---|---|
Fout-conformcijfer (*1) | < 5 % | |
Juistheid | −20 % tot +20 % | |
Herhaalbaarheid (RSDr) | < 20 % | |
Intermediaire precisie (RSDR) | < 25 % | < 15 % |
5.7. Specifieke voorschriften voor screeningsmethoden
- 5.7.1.
Voor een screening kunnen zowel GC-MS-methoden als bioanalytische methoden worden gebruikt. Voor GC-MS-methoden moet aan de in punt 6 beschreven voorschriften worden voldaan. Voor bioanalytische methoden op basis van cellen zijn specifieke voorschriften neergelegd in punt 7.
- 5.7.2.
Laboratoria die screeningsmethoden voor routinematige controles van monsters toepassen, moeten een nauwe samenwerking aangaan met laboratoria die de bevestigingsmethode toepassen.
- 5.7.3.
Verificatie van de prestaties van de screeningsmethode moet bij routinematige analysen plaatsvinden door middel van kwaliteitscontrole van de analyse en een voortdurende validering van de methode. Er moet een continu programma voor de controle van conforme resultaten zijn.
- 5.7.4.
Controle op mogelijke onderdrukking van de celrespons en de cytotoxiciteit:
20 % van de monsterextracten moet in een routinescreening worden gemeten zonder toevoeging van 2,3,7,8-TCDD en met toevoeging van 2,3,7,8-TCDD overeenkomstig het maximumgehalte of de actiedrempel, teneinde te controleren of de respons mogelijkerwijs wordt onderdrukt door de aanwezigheid van storende stoffen in het monsterextract. De gemeten concentratie van het verrijkte monster wordt vergeleken met de som van de concentratie van het niet-verrijkte monster en de toegevoegde concentratie. Indien deze gemeten concentratie meer dan 25 % lager is dan de berekende (totale) concentratie, is dit een aanwijzing voor een potentiële signaalonderdrukking; op het betrokken monster moet dan een bevestigingsanalyse met GC-HRMS worden uitgevoerd. De resultaten moeten worden gevolgd op kwaliteitscontrolekaarten.
- 5.7.5.
Kwaliteitscontrole bij conforme monsters:
Ongeveer 2–10 % van de conforme monsters, afhankelijk van de aard van de monstermatrix en de ervaring van het laboratorium, moet door middel van GC-HRMS worden bevestigd.
- 5.7.6.
Bepaling van fout-conformcijfers uit kwaliteitscontrolegegevens:
Het percentage fout-conforme resultaten van de screening van monsters onder en boven het maximumgehalte of de actiedrempel moet worden bepaald. Het fout-conformcijfer moet onder 5 % liggen. Als de kwaliteitscontrole van conforme monsters minimaal 20 bevestigde resultaten per matrix/matrixgroep heeft opgeleverd, worden op grond van deze gegevens conclusies over het fout-conformcijfer getrokken. De resultaten van monsters die in ringonderzoeken of bij verontreinigingsincidenten zijn geanalyseerd en die een concentratiebereik tot bijvoorbeeld tweemaal het maximumgehalte bestrijken, mogen ook worden meegeteld bij de minimaal 20 resultaten ter bepaling van het fout-conformcijfer. De monsters moeten de meest voorkomende congeneerpatronen, van diverse bronnen, bestrijken.
Hoewel screeningsassays vooral gericht zijn op het ontdekken van monsters boven de actiedrempel, is het criterium voor de bepaling van het fout-conformcijfer het maximumgehalte, waarbij rekening moet worden gehouden met de uitgebreide meetonzekerheid van de bevestigingsmethode.
- 5.7.7.
Mogelijk niet-conforme monsters van de screening moeten altijd worden geverifieerd door een volledige heranalyse van het oorspronkelijke monster met een bevestigingsmethode. Deze monsters kunnen ook worden gebruikt voor de bepaling van het percentage fout-niet-conforme resultaten. Bij screeningsmethoden is het fout-niet-conformcijfer het percentage resultaten die bij een bevestigingsanalyse conform blijken te zijn, terwijl bij de voorafgaande screening het monster als mogelijk niet-conform was aangemerkt. De evaluatie van het nut van de screeningsmethode moet worden gebaseerd op een vergelijking van het aantal fout-niet-conforme monsters met het totale aantal gecontroleerde monsters. Alleen als dit percentage laag genoeg is, is het gebruik van een screeningsinstrument zinvol.
- 5.7.8.
Bioanalytische methoden moeten onder valideringsomstandigheden een bruikbare indicatie geven van het TEQ-gehalte, berekend als en uitgedrukt in BEQ.
Ook voor onder herhaalbaarheidsomstandigheden uitgevoerde bioanalytische methoden zal de herhaalbaarheid binnen hetzelfde laboratorium (RSDr) in de regel geringer zijn dan de reproduceerbaarheid (RSDR).
6. Specifieke voorschriften voor GC-MS-methoden als screenings- en bevestigingsmethoden
6.1. Aanvaardbare verschillen tussen bovengrens en ondergrens bij WHO-TEQ-resultaten
Om overschrijding van het maximumgehalte of in voorkomend geval de actiedrempel te bevestigen, mag het verschil tussen de bovengrens en de ondergrens niet meer dan 20 % bedragen.
6.2. Controle van de terugvinding
- 6.2.1.
Aan het begin van de analyseprocedure, bijvoorbeeld vóór de extractie, moeten 13C-gelabelde 2,3,7,8-chloorgesubstitueerde interne PCDD/PCDF-standaarden en 13C-gelabelde interne dioxineachtige-pcb-standaarden worden toegevoegd om de analysemethode te valideren. Er moet ten minste één congeneer voor elk van de tetra- tot octagechloreerde homologe groepen voor PCDD's/PCDF's en ten minste één congeneer voor elk van de homologe groepen voor dioxineachtige pcb's worden toegevoegd (een andere mogelijkheid is het toevoegen van ten minste één congeneer voor elke voor de bepaling van PCDD's/PCDF's en dioxineachtige pcb's gebruikte massaspectrometrische meting van geselecteerde ionen). In het geval van bevestigingsmethoden moeten alle zeventien 13C-gelabelde 2,3,7,8-gesubstitueerde interne PCDD/PCDF-standaarden en alle twaalf 13C-gelabelde interne dioxineachtige-pcb-standaarden worden gebruikt.
- 6.2.2.
De relatieve responsfactoren moeten ook worden bepaald voor congeneren waarvoor geen 13C-gelabeld analogon is toegevoegd onder gebruikmaking van geschikte ijkoplossingen.
- 6.2.3.
In geval van diervoeders van plantaardige oorsprong en diervoeders van dierlijke oorsprong die minder dan 10 % vet bevatten, moeten de interne standaarden vóór de extractie worden toegevoegd. Bij diervoeders van dierlijke oorsprong die meer dan 10 % vet bevatten, kunnen de interne standaarden hetzij voor, hetzij na de vetextractie worden toegevoegd. Er moet een geschikte validering van de extractie-efficiëntie worden uitgevoerd, afhankelijk van het stadium waarin interne standaarden worden geïntroduceerd.
- 6.2.4.
Voordat de GC-MS-analyse wordt uitgevoerd, moeten een of twee (surrogaat)standaarden worden toegevoegd ter bepaling van de terugvinding.
- 6.2.5.
Bepaling van de terugvinding is vereist. Voor bevestigingsmethoden moet de terugvinding van de verschillende interne standaarden tussen 60 en 120 % liggen. Lagere of hogere terugvindingen voor bepaalde congeneren, met name voor sommige hepta- en octagechloreerde dibenzo-p-dioxinen en dibenzofuranen, kunnen worden geaccepteerd mits hun bijdrage tot de TEQ-waarde niet meer dan 10 % van de totale TEQ-waarde (gebaseerd op de som van PCDD's/PCDF's en dioxineachtige pcb's) bedraagt. Voor GC-MS-screeningsmethoden moet de terugvinding tussen 30 en 140 % liggen.
6.3. Verwijdering van storende stoffen
- —
De PCDD's/PCDF's moeten met behulp van geschikte chromatografische technieken (bij voorkeur met behulp van een florisil-, aluminiumoxide- en/of koolstofkolom) worden gescheiden van storende chloorverbindingen zoals niet-dioxineachtige pcb's en gechloreerde difenylethers.
- —
De gaschromatografische scheiding van de isomeren moet < 25 % piek-piek tussen 1,2,3,4,7,8-HxCDF en 1,2,3,6,7,8-HxCDF zijn.
6.4. IJking met standaardkromme
De ijkkromme moet het relevante bereik van maximumgehalten of actiedrempels bestrijken.
6.5. Specifieke criteria voor bevestigingsmethoden
- —
Voor GC-HRMS:
bij HRMS moet de resolutie normaliter groter dan of gelijk aan 10 000 zijn voor het hele massabereik bij een dalwaarde van 10 %;
verder moet worden voldaan aan de identificatie- en bevestigingscriteria als beschreven in internationale normen, bv. EN-norm 16215:2012 (Diervoeders — Bepaling van dioxinen en dioxineachtige polychloorbifenylen (pcb's) en indicator-polychloorbifenylen (pcb's) met behulp van gaschromatografie/hogeresolutiemassaspectrometrie (GC/HRMS)) en/of in de EPA-methoden 1613 en 1668, zoals herzien.
- —
Voor GC-MS/MS:
monitoring van ten minste twee specifieke precursorionen, elk met één specifiek corresponderend overgangsproduct-ion voor alle gelabelde en ongelabelde analyten binnen de scope van de analyse;
een maximaal toegestane tolerantie van de relatieve ionintensiteiten van ± 15 % voor de geselecteerde product-ionen ten opzichte van berekende of gemeten waarden (gemiddelde van ijkstandaarden), onder identieke MS/MS-condities, met name de botsingsenergie en de druk van het botsingsgas, voor elke overgang van een analyt.
een resolutie voor elke quadrupool gelijk aan of beter dan de resolutie overeenkomend met één massa-eenheid (d.w.z. voldoende om twee pieken te scheiden die één massa-eenheid verschillen), zodat eventuele storingen van de betrokken analyten zo klein mogelijk zijn;
voldoen aan de nadere criteria als beschreven in internationale normen, bv. EN-norm 16215:2012 (Diervoeders — Bepaling van dioxinen en dioxineachtige polychloorbifenylen (pcb's) en indicator-polychloorbifenylen (pcb's) met behulp van gaschromatografie/hogeresolutiemassaspectrometrie (GC/HRMS)) en/of in de EPA-methoden 1613 en 1668, zoals herzien, behalve de verplichting om GC-HRMS te gebruiken.
7. Specifieke voorschriften voor bioanalytische methoden
Bioanalytische methoden zijn methoden die zijn gebaseerd op het gebruik van biologische principes zoals assays op basis van cellen of receptoren of immunoassays. In dit punt worden algemene voorschriften voor bioanalytische methoden vastgesteld.
Een screeningsmethode bestempelt een monster in beginsel als conform dan wel als verdacht niet-conform. Daartoe wordt het berekende BEQ-gehalte vergeleken met de afkapwaarde (zie punt 7.3). Monsters onder de afkapwaarde worden conform verklaard en monsters boven of gelijk aan de afkapwaarde worden ervan verdacht niet-conform te zijn en moeten worden geanalyseerd met behulp van een bevestigingsmethode. In de praktijk kan een BEQ-gehalte van twee derde van het maximumgehalte als afkapwaarde worden aangehouden, mits een fout-conformcijfer van minder dan 5 % en een aanvaardbaar fout-niet-conformcijfer gewaarborgd zijn. Aangezien er afzonderlijke maximumgehalten voor PCDD's/PCDF's en voor de som van PCDD/PCDF's en dioxineachtige pcb's zijn, zijn voor de controle op de conformiteit van monsters zonder fractionering geschikte bioassay-afkapwaarden voor PCDD's/PCDF's nodig. Voor de controle van monsters die de actiedrempels overschrijden, moet een passend percentage van de desbetreffende actiedrempel als afkapwaarde worden gebruikt.
Als een indicatief gehalte in BEQ wordt gegeven, moeten de resultaten van het monster binnen het werkbereik liggen en de rapportagegrens overschrijden (zie de punten 7.1.1 en 7.1.6).
7.1. Evaluatie van de testrespons
7.1.1. Algemene voorschriften
- —
Wanneer de concentraties op basis van een TCDD-ijkkromme worden berekend, zullen de waarden aan het boveneind van de kromme een grote variatie (grote variatiecoëfficiënt (CV)) te zien geven. Het werkbereik is het gebied waar deze CV kleiner is dan 15 %. Het ondereind van het werkbereik (rapportagegrens) moet ten minste een factor drie boven de procedureblanco's worden vastgesteld. Het boveneind van het werkbereik ligt gewoonlijk bij de EC70-waarde (70 % van de maximale effectieve concentratie), maar lager als de CV in dit gebied hoger is dan 15 %. Het werkbereik moet bij de validering worden vastgesteld. De afkapwaarden (zie punt 7.3) moeten ruimschoots binnen het werkbereik liggen.
- —
Standaardoplossingen en monsterextracten moeten in triplo of ten minste in duplo worden getest. Bij duploanalysen moet een standaardoplossing of een controle-extract bij een test in vier à zes putjes verdeeld over de plaat een respons of een concentratie (alleen mogelijk binnen het werkbereik) te zien geven op basis van een CV < 15 %.
7.1.2. IJking
7.1.2.1. IJking met standaardkromme
- —
Het gehalte in monsters kan worden geschat door de testrespons te vergelijken met een ijkkromme van TCDD (of PCB 126 of een standaardmengsel van PCDD's/PCDF's en dioxineachtige pcb's), teneinde het BEQ-gehalte in het extract en vervolgens in het monster te berekenen.
- —
IJkkrommen moeten betrekking hebben op 8–12 concentraties (in elk geval in duplo) met voldoende concentraties in het onderste deel van de kromme (het werkbereik). Er moet speciale aandacht worden besteed aan de kwaliteit van de fitting van de kromme in het werkbereik. Bij niet-lineaire regressie is de R2-waarde niet of nauwelijks van nut om de juistheid van de fitting te schatten. Een betere fitting wordt bereikt door het verschil tussen de berekende en de waargenomen gehalten in het werkbereik van de kromme te minimaliseren, bijvoorbeeld door de residuele kwadratensom zo klein mogelijk te maken.
- —
Het geschatte gehalte in het monsterextract wordt vervolgens gecorrigeerd voor het BEQ-gehalte dat voor een matrix- of oplosmiddelblanco is berekend (om te corrigeren voor verontreinigingen afkomstig van de gebruikte oplosmiddelen en chemicaliën), en voor de schijnbare terugvinding (berekend uit het BEQ-gehalte van geschikte referentiemonsters met een representatief congeneerpatroon rond het maximumgehalte of de actiedrempel). Om voor de terugvinding te kunnen corrigeren, moet de schijnbare terugvinding binnen het betreffende meetgebied liggen (zie punt 7.1.4). Referentiemonsters die voor de correctie van de terugvinding worden gebruikt, moeten voldoen aan de in punt 7.2 gestelde eisen.
7.1.2.2. IJking met referentiemonsters
Ook kan gebruik worden gemaakt van een ijkkromme van ten minste vier referentiemonsters (zie punt 7.2.4): één matrixblanco plus drie referentiemonsters bij 0,5, 1 en 2 maal het maximumgehalte of de actiedrempel, waardoor het niet nodig is te corrigeren voor blanco en terugvinding als de matrixeigenschappen van de referentiemonsters overeenstemmen met die van de onbekende monsters. In dit geval kan de testrespons die overeenkomt met twee derde van het maximumgehalte (zie punt 7.3) rechtstreeks uit deze monsters worden berekend en als afkapwaarde worden gebruikt. Voor de controle van monsters die de actiedrempels overschrijden, moet een passend percentage van deze actiedrempels als afkapwaarde worden gebruikt.
7.1.3. Afzonderlijke bepaling van PCDD's/PCDF's en dioxineachtige pcb's
Extracten kunnen worden gesplitst in fracties die PCDD's/PCDF's respectievelijk dioxineachtige pcb's bevatten, waardoor het TEQ-gehalte aan PCDD's/PCDF's en dioxineachtige pcb's afzonderlijk (in BEQ) kan worden aangegeven. Bij voorkeur moet voor de evaluatie van de resultaten voor de fractie met dioxineachtige pcb's gebruik worden gemaakt van een standaardijkkromme voor PCB 126.
7.1.4. Schijnbare terugvinding bij bioassays
De ‘schijnbare terugvinding bij bioassays’ moet worden berekend aan de hand van geschikte referentiemonsters met representatieve congeneerpatronen rond het maximumgehalte of de actiedrempel, en uitgedrukt als het aandeel van het BEQ-gehalte in het TEQ-gehalte (in %). Afhankelijk van het type assay en de TEF's (12) die gebruikt zijn, kunnen de verschillen tussen de TEF- en de REP-factor voor dioxineachtige pcb's ertoe leiden dat de schijnbare terugvinding voor dioxineachtige pcb's in verhouding tot die voor PCDD's/PCDF's gering is. Als de PCDD's/PCDF's en de dioxineachtige pcb's afzonderlijk worden bepaald, moet de schijnbare terugvinding bij bioassays daarom voor dioxineachtige pcb's 20–60 % en voor PCDD's/PCDF's 50–130 % bedragen (deze intervallen gelden voor TCDD-ijkkrommen). Omdat het aandeel van dioxineachtige pcb's in de som van PCDD's/PCDF's en dioxineachtige pcb's naargelang de matrices en monsters kan variëren, komt het interval voor de schijnbare terugvinding bij bioassays voor de som van PCDD's/PCDF's en dioxineachtige pcb's op 30–130 %. Eventuele implicaties van ingrijpend herziene TEF-waarden voor de wetgeving van de Unie inzake PCDD's/PCDF's en dioxineachtige pcb's vereisen de herziening van die bereiken.
7.1.5. Controle van de terugvinding in verband met opzuivering
Bij de validering moet worden nagegaan of bij de opzuivering verbindingen verloren zijn gegaan. Een blancomonster dat is verrijkt met een mengsel van de verschillende congeneren, moet worden opgezuiverd (ten minste n = 3), waarna de terugvinding en de variabiliteit door middel van een bevestigingsmethode moeten worden gecontroleerd. Voor congeneren die in verschillende mengsels meer dan 10 % aan het TEQ-gehalte bijdragen, moet de terugvinding tussen 60 en 120 % bedragen.
7.1.6. Rapportagegrens
Wanneer BEQ-gehalten worden gerapporteerd, moet een rapportagegrens worden vastgesteld aan de hand van relevante matrixmonsters met kenmerkende congeneerpatronen, maar wegens de geringe precisie in het ondereind van de ijkkromme van de standaarden niet aan de hand van die kromme. Er moet rekening worden gehouden met effecten van de extractie en opzuivering. De rapportagegrens moet ten minste een factor drie boven de procedureblanco's worden vastgesteld.
7.2. Gebruik van referentiemonsters
- 7.2.1.
Referentiemonsters moeten representatief zijn voor de monstermatrix, de congeneerpatronen en de concentratiebereiken voor PCDD's/PCDF's en dioxineachtige pcb's rond het maximumgehalte of de actiedrempel.
- 7.2.2.
Elke testserie moet een matrixblanco, of wanneer dat niet mogelijk is een procedureblanco, en een referentiemonster voor het maximumgehalte of de actiedrempel bevatten. Deze monsters moeten op hetzelfde tijdstip en onder identieke omstandigheden worden geëxtraheerd en getest. De respons van het referentiemonster moet duidelijk hoger zijn dan die van het blancomonster, zodat de geschiktheid van de test gewaarborgd is. Die monsters kunnen worden gebruikt voor de correctie voor blanco en terugvinding.
- 7.2.3.
De referentiemonsters die voor de correctie voor terugvinding zijn gekozen, moeten representatief zijn voor de testmonsters, wat betekent dat de congeneerpatronen niet tot een onderschatting van het gehalte mogen leiden.
- 7.2.4.
Er kunnen extra referentiemonsters met een concentratie van bijvoorbeeld 0,5 en 2 maal het maximumgehalte of de actiedrempel worden onderzocht om aan te tonen dat de test in het voor de controle van het maximumgehalte of de actiedrempel relevante bereik voldoet. In combinatie kunnen deze monsters worden gebruikt voor de berekening van de BEQ-gehalten in testmonsters (zie punt 7.1.2.2).
7.3. Bepaling van afkapwaarden
Het verband tussen de bioanalytische resultaten in BEQ en de resultaten van de bevestigingsmethoden in TEQ moet worden vastgesteld, bijvoorbeeld door matrix-gematchte ijkexperimenten met referentiemonsters die met 0, 0,5, 1 en 2 maal het maximumgehalte zijn verrijkt en die voor elke concentratie zesmaal worden onderzocht (n = 24). Aan de hand van dit verband kunnen de correctiefactoren (voor blanco en terugvinding) worden geschat, maar deze moeten worden gecontroleerd overeenkomstig punt 7.2.2.
Er worden afkapwaarden vastgesteld om te beslissen of een monster in overeenstemming is met de maximumgehalten of om, indien van belang, actiedrempels te controleren, waarbij de desbetreffende maximumgehalten of actiedrempels hetzij voor PCDD's/PCDF's en dioxineachtige pcb's afzonderlijk, hetzij voor de som van PCDD's/PCDF's en dioxineachtige pcb's worden vastgesteld. Het gaat hierbij om het onderste eindpunt van de verdeling van de bioanalytische resultaten (gecorrigeerd voor blanco en terugvinding) en zij komen overeen met de beslissingsgrens van de bevestigingsmethode, die is gebaseerd op een betrouwbaarheidsniveau van 95 %, hetgeen betekent dat het fout-conformcijfer < 5 % bedraagt, en op een RSD < 25 %. De beslissingsgrens van de bevestigingsmethode is het maximumgehalte, met inachtneming van de uitgebreide meetonzekerheid.
De afkapwaarde (in BEQ) kan worden berekend op een van de in de punten 7.3.1, 7.3.2 en 7.3.3 beschreven manieren (zie figuur 1).
7.3.1
Gebruik van het onderste deel van het 95 %-voorspellingsinterval bij de beslissingsgrens van de bevestigingsmethode
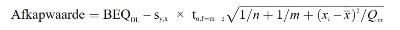
waarbij:
BEQDL | BEQ die overeenkomt met de beslissingsgrens van de bevestigingsmethode, namelijk het maximumgehalte met inachtneming van de uitgebreide meetonzekerheid |
sy,x | reststandaardafwijking |
t α,f = m-2 | studentfactor (α = 5 %, f = aantal vrijheidsgraden, eenzijdig) |
m | totaal aantal ijkpunten (index j) |
n | aantal herhalingen per gehalte |
xi | monsterconcentratie (in TEQ) van ijkpunt i, bepaald met een bevestigingsmethode |
| gemiddelde van de concentraties (in TEQ) van alle ijkmonsters |
| kwadratensom, i = index voor ijkpunt i |
7.3.2
Berekening aan de hand van bioanalytische resultaten (gecorrigeerd voor blanco en terugvinding) van meervoudige analysen van monsters (n ≥ 6), met een mate van verontreiniging die rond de beslissingsgrens van de bevestigingsmethode ligt, als onderste eindpunt van de gegevensverdeling bij de desbetreffende gemiddelde BEQ-waarde:
afkapwaarde = BEQDL − 1,64 × SDR
waarbij:
SDR | = standaardafwijking van de bioassayresultaten bij BEQDL, gemeten onder intralaboratoriumreproduceerbaarheidsomstandigheden. |
7.3.3
Berekening als gemiddelde waarde van bioanalytische resultaten (in BEQ, gecorrigeerd voor blanco en terugvinding) van meervoudige analysen van monsters (n ≥ 6), met een mate van verontreiniging die op twee derde van het maximumgehalte of de actiedrempel ligt, gebaseerd op de waarneming dat dit niveau op ongeveer de overeenkomstig punt 7.3.1 of 7.3.2 vastgestelde afkapwaarde ligt:
Berekening van de afkapwaarden op basis van een betrouwbaarheidsniveau van 95 %, hetgeen betekent dat het fout-conformcijfer < 5 % bedraagt, en op een RSDR < 25 %:
- 1.
aan de hand van het onderste deel van het 95 %-voorspellingsinterval bij de beslissingsgrens van de bevestigingsmethode,
- 2.
aan de hand van meervoudige analysen van monsters (n > 6), met een mate van verontreiniging die rond de beslissingsgrens van de bevestigingsmethode ligt, als onderste eindpunt van de gegevensverdeling (in Figuur 1 een gausskromme) bij de desbetreffende gemiddelde BEQ-waarde.
Figuur 1
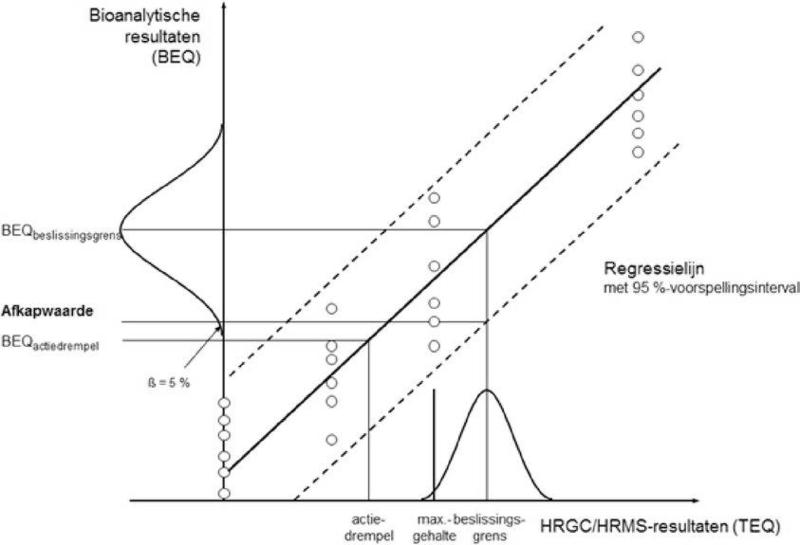
7.3.4. Beperkingen van afkapwaarden
De afkapwaarden op basis van BEQ, die zijn berekend aan de hand van de bij de validering met behulp van een beperkt aantal monsters met verschillende matrices/congeneerpatronen verkregen RSDR, kunnen hoger zijn dan de maximumgehalten of actiedrempels op basis van TEQ, omdat de precisie in dat geval groter is dan mogelijk is bij een routineonderzoek waarbij een onbekend spectrum van mogelijke congeneerpatronen moet worden gecontroleerd. In dat geval moet de afkapwaarde worden berekend op basis van RSDR = 25 %, of worden gesteld op twee derde van het maximumgehalte of de actiedrempel.
7.4. Prestatiekenmerken
- 7.4.1.
Aangezien bij bioanalytische methoden geen interne standaarden kunnen worden gebruikt, moeten herhaalbaarheidstests voor bioanalytische methoden worden uitgevoerd om gegevens te verkrijgen over de standaardafwijking binnen een testreeks en tussen testreeksen. De herhaalbaarheid moet onder de 20 % liggen en de intralaboratoriumreproduceerbaarheid onder de 25 %. Dit moet worden gebaseerd op de berekende BEQ-niveaus na correctie voor blanco en terugvinding.
- 7.4.2.
Als onderdeel van het valideringsproces moet worden aangetoond dat met de test een onderscheid kan worden gemaakt tussen een blancomonster en een gehalte gelijk aan de afkapwaarde, zodat monsters die boven de desbetreffende afkapwaarde liggen, kunnen worden herkend (zie punt 7.1.2).
- 7.4.3.
De doelverbindingen, de mogelijke storingen en de maximaal toelaatbare blancowaarden moeten worden vastgesteld.
- 7.4.4.
De procentuele standaardafwijking van de respons of van de op grond van de respons berekende concentratie (alleen mogelijk in het werkbereik) mag bij een triplobepaling van een monsterextract niet meer dan 15 % bedragen.
- 7.4.5.
De niet-gecorrigeerde resultaten van het referentiemonster of de referentiemonsters in BEQ (blanco en maximumgehalte of actiedrempel) moeten worden gebruikt voor de evaluatie van de prestaties van de bioanalytische methode gedurende een constant tijdsinterval.
- 7.4.6.
Voor procedureblanco's en voor elk type referentiemonster moeten kwaliteitscontrolekaarten (QC-kaarten) worden bijgehouden en gecontroleerd om na te gaan of de prestatie van de analyse in overeenstemming is met de voorschriften; dit geldt met name voor procedureblanco's met betrekking tot het vereiste minimumverschil met het ondereind van het werkbereik en voor referentiemonsters met betrekking tot de intralaboratoriumreproduceerbaarheid. Procedureblanco's moeten zodanig worden gecontroleerd dat fout-conforme resultaten worden vermeden wanneer zij worden afgetrokken.
- 7.4.7.
De met bevestigingsmethoden verkregen resultaten van verdachte monsters en 2–10 % van de conforme monsters (minimaal 20 monsters per matrix) moeten worden verzameld en gebruikt om de prestaties van de screeningsmethode en het verband tussen BEQ en TEQ te evalueren. Deze gegevensbasis kan worden gebruikt voor een nieuwe evaluatie van afkapwaarden die van toepassing zijn op routinemonsters voor de gevalideerde matrices.
- 7.4.8.
Een succesvolle prestatie van de methode kan ook worden aangetoond door deelneming aan ringonderzoeken. De resultaten van in ringonderzoeken geanalyseerde monsters met een concentratiebereik tot bijvoorbeeld tweemaal het maximumgehalte kunnen ook deel uitmaken van de evaluatie van het fout-conformcijfer indien een laboratorium de succesvolle prestaties ervan kan aantonen. De monsters moeten de meest voorkomende congeneerpatronen, van diverse bronnen, bestrijken.
- 7.4.9.
Bij incidenten kunnen de afkapwaarden opnieuw worden geëvalueerd, zodat zij overeenkomen met de specifieke matrix- en congeneerpatronen van alleen dat incident.
8. Rapportage van de resultaten
8.1. Bevestigingsmethoden
- 8.1.1.
De analyseresultaten moeten de concentratieniveaus van de afzonderlijke PCDD/PCDF- en dioxineachtige-pcb-congeneren omvatten en de TEQ-waarden moeten worden gerapporteerd als ‘ondergrens’, ‘bovengrens’ en ‘middenwaarde’, teneinde zo veel mogelijk details te verstrekken om de resultaten naargelang de gestelde eisen te kunnen interpreteren.
- 8.1.2.
In het rapport moet ook worden vermeld welke methode voor de extractie van PCDD's/PCDF's en dioxineachtige pcb's is gebruikt.
- 8.1.3.
De terugvindingen van de verschillende interne standaarden moeten beschikbaar worden gesteld wanneer zij buiten het in punt 6.2.5 bedoelde bereik liggen, wanneer het maximumgehalte wordt overschreden (in dit geval de terugvindingen voor een van beide duploanalysen) en in andere gevallen op verzoek.
- 8.1.4.
Daar de uitgebreide meetonzekerheid bij de beslissing of het monster aan de eisen voldoet, in aanmerking moet worden genomen, moet deze parameter ter beschikking worden gesteld. Derhalve moeten de analyseresultaten worden vermeld als x ± U, waarbij x het analyseresultaat is en U de uitgebreide meetonzekerheid, met een dekkingsfactor 2, zodat een betrouwbaarheidsniveau van ongeveer 95 % wordt verkregen. Bij een afzonderlijke bepaling van PCDD's/PCDF's en dioxineachtige pcb's moet de som van de geschatte uitgebreide onzekerheid van de afzonderlijke analyseresultaten van PCDD's/PCDF's en dioxineachtige pcb's worden gebruikt voor de som van PCDD's/PCDF's en dioxineachtige pcb's.
- 8.1.5.
De resultaten moeten in dezelfde eenheden en met minimaal hetzelfde aantal significante cijfers worden weergegeven als de in Richtlijn 2002/32/EG vastgestelde maximumgehalten.
8.2. Bioanalytische screeningsmethoden
- 8.2.1.
Het resultaat van de screening moet als hetzij ‘conform’, hetzij ‘verdacht niet-conform’ (‘verdacht’) worden opgegeven.
- 8.2.2.
Daarnaast kan een indicatief resultaat voor PCDD's/PCDF's en/of dioxineachtige pcb's worden gegeven in BEQ en niet in TEQ.
- 8.2.3.
Monsters met een respons onder de rapportagegrens moeten als zodanig worden aangegeven. Monsters met een respons boven het werkbereik moeten als dusdanig worden gerapporteerd, en het gehalte dat overeenstemt met het boveneind van het werkbereik moet worden gegeven in BEQ.
- 8.2.4.
Voor elk type monstermatrix moet in het rapport worden vermeld op welk maximumgehalte of welke actiedrempel de evaluatie gebaseerd is.
- 8.2.5.
In het rapport moeten het toegepaste testtype, het eraan ten grondslag liggende testbeginsel en de wijze van ijking worden vermeld.
- 8.2.6.
In het rapport moet ook worden vermeld welke methode voor de extractie van PCDD's/PCDF's en dioxineachtige pcb's is gebruikt.
- 8.2.7.
In het geval van verdacht niet-conforme monsters moet het rapport vermelden welke maatregelen moeten worden genomen. De concentratie van PCDD's/PCDF's en de som van PCDD's/PCDF's en dioxineachtige pcb's in die monsters met verhoogde gehalten moeten worden bepaald of bevestigd met behulp van een bevestigingsmethode.
- 8.2.8.
Niet-conforme resultaten moeten alleen worden gerapporteerd als zij aan de hand van een bevestigingsanalyse zijn verkregen.
8.3. Fysisch-chemische screeningsmethoden
- 8.3.1.
Het resultaat van de screening moet als hetzij ‘conform’, hetzij ‘verdacht niet-conform’ (‘verdacht’) worden opgegeven.
- 8.3.2.
Voor elk type monstermatrix moet in het rapport worden vermeld op welk maximumgehalte of welke actiedrempel de evaluatie gebaseerd is.
- 8.3.3.
Bovendien mogen de concentratieniveaus van de afzonderlijke PCDD/PCDF- en/of dioxineachtige-pcb-congeneren en de als ‘ondergrens’, ‘bovengrens’ en ‘middenwaarde’ gerapporteerde TEQ-waarden worden vermeld. De resultaten moeten in dezelfde eenheden en met minimaal hetzelfde aantal significante cijfers worden weergegeven als de in Richtlijn 2002/32/EG vastgestelde maximumgehalten.
- 8.3.4.
De terugvindingen van de verschillende interne standaarden moeten beschikbaar worden gesteld wanneer zij buiten het in punt 6.2.5 bedoelde bereik liggen, wanneer het maximumgehalte wordt overschreden (in dit geval de terugvindingen voor een van beide duploanalysen) en in andere gevallen op verzoek.
- 8.3.5.
In het rapport moet de toegepaste GC-MS-methode worden vermeld.
- 8.3.6.
In het rapport moet ook worden vermeld welke methode voor de extractie van PCDD's/PCDF's en dioxineachtige pcb's is gebruikt.
- 8.3.7.
In het geval van verdacht niet-conforme monsters moet het rapport vermelden welke maatregelen moeten worden genomen. De concentratie van PCDD's/PCDF's en de som van PCDD's/PCDF's en dioxineachtige pcb's in die monsters met verhoogde gehalten moeten worden bepaald of bevestigd met behulp van een bevestigingsmethode.
- 8.3.8.
Niet-conformiteit kan alleen na een bevestigingsanalyse worden vastgesteld.
Hoofdstuk III. Monstervoorbereiding en voorschriften voor de analysemethoden die worden gebruikt voor de officiële controle op het gehalte aan niet-dioxineachtige PCB'S in diervoeders
1. Toepassingsgebied
De voorschriften in dit hoofdstuk gelden voor de analyse van diervoeders in verband met de officiële controle op het gehalte aan niet-dioxineachtige pcb's en betreffen de monstervoorbereiding en voorschriften voor de analyse voor andere doeleinden in verband met de regelgeving, met inbegrip van de controles die de exploitant van het diervoederbedrijf uitvoert teneinde te zorgen voor naleving van de bepalingen van Verordening (EG) nr. 183/2005.
2. Toe te passen detectiemethoden
Gaschromatografie/elektronenvangstdetectie (GC-ECD), GC-LRMS, GC-MS/MS, GC-HRMS of gelijkwaardige methoden.
3. Identificatie en bevestiging van de te bepalen analyten
- 3.1.
Retentietijd ten opzichte van interne of referentiestandaarden (aanvaardbare afwijking ± 0,25 %).
- 3.2.
Gaschromatografische scheiding van de niet-dioxineachtige pcb's van storende stoffen, en vooral co-eluerende pcb's, in het bijzonder als het gehalte in de monsters in de buurt van de wettelijke grenswaarden ligt en niet-conformiteit moet worden bevestigd (13).
- 3.3.
Voorschriften voor GC-MS technieken
Monitoring van ten minste het volgende aantal molecuulionen of karakteristieke ionen uit de moleculaire cluster:
- a)
twee specifieke ionen voor HRMS;
- b)
drie specifieke ionen voor LRMS;
- c)
twee specifieke precursorionen, elk met één specifiek corresponderend overgangsproduct-ion voor MS-MS.
Maximaal toegestane toleranties voor isotopenverhoudingen voor geselecteerde massafragmenten:
relatieve afwijking van de isotopenverhouding van geselecteerde massafragmenten van de theoretische abundantie of de ijkstandaard voor het doelion (gemonitord ion met de grootste abundantie) en voor qualifier-ion(en): ± 15 %.
- 3.4.
Voorschriften voor GC-ECD technieken
Bevestiging van resultaten boven het maximumgehalte, aan de hand van twee GC-kolommen met stationaire fasen van verschillende polariteit.
4. Aantonen van de prestaties van de methode
De prestaties van de methode moeten worden gevalideerd binnen het relevante concentratiebereik (0,5 tot 2 maal het maximumgehalte) met een aanvaardbare variatiecoëfficiënt voor herhaalde analyse (zie de voorschriften voor de intermediaire precisie in punt 9).
5. Bepaalbaarheidsgrens
De som van de LOQ's (14) van niet-dioxineachtige pcb's mag niet hoger zijn dan een derde van het maximumgehalte (15).
6. Kwaliteitscontrole
Regelmatige blancocontroles, analyse van verrijkte monsters, monsters voor kwaliteitscontrole, deelname aan interlaboratoriumonderzoeken voor relevante matrices.
7. Controle van de terugvinding
- 7.1.
Gebruik van geschikte interne standaarden met fysisch-chemische eigenschappen die vergelijkbaar zijn met die van de betrokken analyten.
- 7.2.
Toevoeging van interne standaarden:
toevoeging aan producten (vóór extractie en opzuivering).
- 7.3.
Voorschriften voor methoden waarbij alle zes met een isotoop gelabelde niet-dioxineachtige pcb-congeneren worden gebruikt:
- a)
correctie van de resultaten voor de terugvinding van de interne standaarden;
- b)
terugvindingen van met een isotoop gelabelde interne standaarden tussen 60 en 120 %;
- c)
geringere of grotere terugvindingen voor afzonderlijke congeneren die minder dan 10 % van de som van niet-dioxineachtige pcb's uitmaken, zijn aanvaardbaar.
- 7.4.
Voorschriften voor methoden waarbij niet alle zes met een isotoop gelabelde interne standaarden dan wel andere interne standaarden worden gebruikt:
- a)
controle van de terugvinding van de interne standaard(en) voor elk monster;
- b)
aanvaardbare terugvindingen van de interne standaard(en) tussen 60 en 120 %;
- c)
correctie van de resultaten voor de terugvinding van de interne standaarden.
- 7.5.
De terugvindingen van ongelabelde congeneren moeten worden gecontroleerd met behulp van verrijkte monsters of kwaliteitscontrolemonsters met een concentratie rond het maximumgehalte. Aanvaardbare terugvindingen voor deze congeneren liggen tussen 60 en 120 %.
8. Voorschriften voor laboratoria
Ingevolge Verordening (EU) 2017/625 moeten de laboratoria door een erkende instantie die werkt volgens ISO/IEC-handleiding 58 geaccrediteerd zijn om te garanderen dat zij kwaliteitsborging op hun analysen toepassen. De laboratoria moeten geaccrediteerd zijn overeenkomstig de norm EN-ISO/IEC 17025. Bovendien moeten de beginselen zoals beschreven in de ‘Technical Guidelines for the estimation of measurement uncertainty and limits of quantification for PCB analysis’ worden nageleefd (16).
9. Prestatiekenmerken: criteria voor de som van niet-dioxineachtige pcb's bij het maximumgehalte
Massaspectrometrie met isotopenverdunning (*1) | Overige technieken | |
|---|---|---|
Juistheid | −20 tot en met +20 % | −30 tot en met +30 % |
Intermediaire precisie (RSD %) | ≤ 15 % | ≤ 20 % |
Verschil tussen berekening boven- en ondergrens | ≤ 20 % | ≤ 20 % |
10. Rapportage van de resultaten
- 10.1.
De analyseresultaten moeten de concentratieniveaus van de afzonderlijke niet-dioxineachtige pcb's en de som van die niet-dioxineachtige pcb-congeneren omvatten, gerapporteerd als ‘ondergrens’, ‘bovengrens’ en ‘middenwaarde’, teneinde zo veel mogelijk details te verstrekken om de resultaten naargelang de gestelde eisen te kunnen interpreteren.
- 10.2.
In het rapport moet worden vermeld welke methode voor de extractie van pcb's en lipiden is gebruikt.
- 10.3.
De terugvindingen van de verschillende interne standaarden moeten beschikbaar worden gesteld wanneer zij buiten het in punt 7 bedoelde bereik liggen, wanneer het maximumgehalte wordt overschreden en in andere gevallen op verzoek.
- 10.4.
Daar de uitgebreide meetonzekerheid bij de beslissing of het monster aan de eisen voldoet, in aanmerking moet worden genomen, moet deze parameter ook ter beschikking worden gesteld. Derhalve moeten de analyseresultaten worden vermeld als x ± U, waarbij x het analyseresultaat is en U de uitgebreide meetonzekerheid, met een dekkingsfactor 2, zodat een betrouwbaarheidsniveau van ongeveer 95 % wordt verkregen.
- 10.5.
De resultaten moeten in dezelfde eenheden en met minimaal hetzelfde aantal significante cijfers worden weergegeven als de in Richtlijn 2002/32/EG vastgestelde maximumgehalten.
(B) En-normen
Voor de toepassing van artikel 34, lid 2, punt a), van Verordening (EU) 2017/625 zijn de volgende EN-normen van belang:
EN 17194 Diervoeders: Methoden voor analyse en monsterneming — Bepaling van Deoxynivalenol, Aflatoxine B1, Fumonisine B1 & B2, T-2 & HT-2 toxinen, Zearalenon en Ochratoxine A in voedermiddelen en mengvoeders door LC-MS/MS
EN 17270 Diervoeders: bemonsterings- en analysemethoden — Bepaling van theobromine in voedermiddelen en mengvoeders, met inbegrip van ingredienten afkomstig uit cacao, door middel van vloeibare chromatografie — Aanvullend element
EN 17504 Animal feeding stuffs: Methods of sampling and analysis. Determination of gossypol in cotton seed and feeding stuff by LC-MS/MS
EN 17362 Diervoeders — Methoden voor bemonstering en analyse — Bepaling van pentachloorfenol (PCP) in voedermiddelen en mengvoeders door LC-MS/MS
EN 16279: Diervoeders — Bepaling van de fluoride inhoud na zoutzuur behandeling door ion-selectieve elektrodemethode (ISE)
EN 17053: Diervoeders: Methoden van bemonstering en analyse — Bepaling van sporenelementen, zware metalen en andere elementen in diervoeders door ICP-MS (multi-methode)
EN 15550 Diervoeders: Methoden voor analyse en monsterneming — Bepaling van het gehalte aan cadmium en lood door atomaireabsorptiespectrometrie met grafietoven (GF-AAS) na ontsluiting onder druk
EN 16206 Diervoeders — Bepaling van arseen met behulp van hydride generatie atomaire absorptie spectrometrie (HGAAS) na ontsluiting met microgolven (extractie met 65 % salpeterzuur en 30 % waterstofperoxide)
EN 16277 Diervoeders — Bepaling van het kwikgehalte door koude-damp-atomaireabsorptiespectrometrie (CVAAS) na magnetron-ontsluiting (extractie met 65 % salpeterzuur en 30 % waterstofperoxide)
EN 16278 Diervoeders — Bepaling van de anorganische arseen door hydride generatie door atomaireabsorptiespectrometrie na magnetronextractie en gescheiden door vaste extractie stadium (SPE)
EN 17374 Diervoeders: Bemonsterings- en analysemethoden — Bepaling van anorganisch arseen in diervoeders door middel van anionenwisseling HPLC-ICPMS.
Voetnoten
Uitvoeringsverordening (EU) 2021/808 van de Commissie van 22 maart 2021 betreffende de prestaties van analysemethoden voor residuen van farmacologisch werkzame stoffen die bij voedselproducerende dieren worden gebruikt, betreffende de interpretatie van de resultaten en betreffende de toe te passen methoden voor bemonstering, en tot intrekking van de Beschikkingen 2002/657/EG en 98/179/EG (PB L 180 van 21.5.2021, blz. 84).
De beginselen beschreven in het ‘Guidance Document on Measurement Uncertainty for Laboratories performing PCDD/F and PCB Analysis using Isotope Dilution Mass Spectrometry’ (https://food.ec.europa.eu/system/files/2017-05/animal-feed-guidance_document_pcdd-f_pcb_en.pdf) moeten in voorkomend geval worden nageleefd.
Om de bovengrens te berekenen wordt de bijdrage van elke niet-bepaalde congeneer gelijkgesteld aan de bepaalbaarheidsgrens. Om de ondergrens te berekenen wordt de bijdrage van elke niet-bepaalde congeneer gelijkgesteld aan nul. Om de middenwaarde te berekenen wordt de bijdrage van elke niet-bepaalde congeneer gelijkgesteld aan de helft van de bepaalbaarheidsgrens.
Tweede bepaling: afzonderlijke analyse van de betrokken analyten met behulp van een tweede aliquot van hetzelfde gehomogeniseerde monster. In het algemeen zijn de vereisten voor de tweede bepaling in bijlage II, hoofdstuk C, punt 3, van toepassing. Voor methoden met gebruikmaking van een 13C-gelabelde interne standaard voor de desbetreffende analyten is de tweede bepaling echter alleen noodzakelijk als het resultaat van de eerste bepaling niet in overeenstemming met de eisen is. Om de ondergrens te berekenen wordt de bijdrage van elke niet-bepaalde congeneer gelijkgesteld aan nul. Om de middenwaarde te berekenen wordt de bijdrage van elke niet-bepaalde congeneer gelijkgesteld aan de helft van de bepaalbaarheidsgrens.
Om de bovengrens te berekenen wordt de bijdrage van elke niet-bepaalde congeneer aan de TEQ (toxisch equivalent) gelijkgesteld aan de bepaalbaarheidsgrens. Om de ondergrens te berekenen wordt de bijdrage van elke niet-bepaalde congeneer aan de TEQ gelijkgesteld aan nul. Om de middenwaarde te berekenen wordt de bijdrage van elke niet-bepaalde congeneer aan de TEQ gelijkgesteld aan de helft van de bepaalbaarheidsgrens.
In het algemeen zijn de vereisten voor de tweede bepaling in hoofdstuk C, punt 3, van bijlage II van toepassing. Voor bevestigingsmethoden met gebruikmaking van een 13C-gelabelde interne standaard voor de desbetreffende analyten is de tweede bepaling echter alleen noodzakelijk als het resultaat van de eerste bepaling niet in overeenstemming met de eisen is. Om de ondergrens te berekenen wordt de bijdrage van elke niet-bepaalde congeneer gelijkgesteld aan nul. Om de middenwaarde te berekenen wordt de bijdrage van elke niet-bepaalde congeneer gelijkgesteld aan de helft van de bepaalbaarheidsgrens.
Toelichting en vereisten voor de tweede bepaling ter controle van actiedrempels als in voetnoot 33 voor maximumgehalten.
Verordening (EG) nr. 183/2005 van het Europees Parlement en de Raad van 12 januari 2005 tot vaststelling van voorschriften voor diervoederhygiëne (PB L 35 van 8.2.2005, blz. 1).
Bioanalytische methoden zijn niet specifiek voor de in het TEF-schema opgenomen congeneren. Er kunnen zich in het monsterextract andere, structureel verwante AhR-actieve verbindingen bevinden die ook bijdragen tot de algehele respons. Daarom kunnen bioanalytische resultaten niet als schatting worden aangemerkt, maar geven zij veeleer een indicatie van het TEQ-gehalte van het monster.
‘Guidance Document on Measurement Uncertainty for Laboratories performing PCDD/F and PCB Analysis using Isotope Dilution Mass Spectrometry’ (https://food.ec.europa.eu/system/files/2017-05/animal-feed-guidance_document_pcdd-f_pcb_en.pdf), ‘Guidance Document on the Estimation of LOD and LOQ for Measurements in the Field of Contaminants in Feed and Food’ [https://food.ec.europa.eu/system/files/2016-10/cs_contaminants_sampling_analysis-report_2004_en.pdf].
Met betrekking tot de maximumgehalten.
De eisen zijn nu gebaseerd op de TEF's die zijn gepubliceerd in: M. Van den Berg e.a., Toxicol. Sci. 93 (2), 223–241 (2006).
Congeneren die vaak co-elueren zijn bijvoorbeeld PCB 28/31, PCB 52/69 en PCB 138/163/164. Bij GC-MS moet ook rekening worden gehouden met eventuele storingen van fragmenten van hoger gechloreerde congeneren.
De beginselen zoals beschreven in het ‘Guidance Document on the Estimation of LOD and LOQ for Measurements in the Field of Contaminants in Feed and Food’ [https://data.europa.eu/doi/10.2787/8931], moeten in voorkomend geval worden nageleefd.
Een geringere bijdrage van het blancogehalte van het reagens aan het verontreinigingsgehalte van het monster is zeer aan te bevelen. Het laboratorium moet de variatie van de blancogehalten controleren, vooral als deze worden afgetrokken.
Zie voetnoot 37.
Gebruik van alle zes 13C-gelabelde analoga als interne standaarden vereist.