Rb. Den Haag, 10-04-2018, nr. AWB - 17 , 3955
ECLI:NL:RBDHA:2018:4081
- Instantie
Rechtbank Den Haag
- Datum
10-04-2018
- Zaaknummer
AWB - 17 _ 3955
- Vakgebied(en)
Bestuursrecht algemeen (V)
- Brondocumenten en formele relaties
ECLI:NL:RBDHA:2018:4081, Uitspraak, Rechtbank Den Haag, 10‑04‑2018; (Eerste aanleg - meervoudig)
Uitspraak 10‑04‑2018
Inhoudsindicatie
Octrooi; Aanvullend beschermingscertificaat (ABC) combinatieproduct; Interpretatie arresten van het Europese Hof van Justitie (HvJEU) van 12 december 2013 in de zaak C-443/12, EU:C:2013:833 (hierna: Actavis/Sanofi) en van 12 maart 2015 in de zaak C-577/13, ECLI:EU:C:2015:165, (hierna: Actavis-Boehringer): Uit de door het HvJEU gegeven uitleg aan artikel 3 in Actavis/Sanofi en Actavis/Boeringer volgt dat in deze situatie, waarin het combinatieproduct bestaat uit enerzijds een werkzame stof die als zodanig (‘as such’) wordt beschermd door het basisoctrooi en het voorwerp (‘subject matter’) uitmaakt van de geoctrooieerde uitvinding en anderzijds uit een werkzame stof - deel uitmakend van een niet gelimiteerde groep biosyntheseremmers - die niet als zodanig wordt beschermd door datzelfde basisoctrooi en niet het voorwerp van de uitvinding vormt, geen plaats is voor verlening van een ABC voor het combinatieproduct, nu voor de eerste werkzame stof op basis van een eerdere handelsvergunning al een op hetzelfde basisoctrooi gegrond ABC is verleend. De rechtbank verwijst in het bijzonder naar par. 36-38 van Actavis/Boehringer en de verwijzing daarin naar par. 41 en 30 in Actavis/Sanofi.
Partij(en)
RECHTBANK DEN HAAG
Bestuursrecht
zaaknummer: SGR 17/3955
uitspraak van de meervoudige kamer van 10 april 2018 in de zaak tussen
de rechtspersoon naar buitenlands recht [bedrijf], te [plaats] , Verenigde Staten van Amerika, eiseres
(gemachtigden: mr. K.A.J. Bisschop en mr. C. van der Beek),
en
Octrooicentrum Nederland, verweerder
(gemachtigde: mr. C. Witteman en dr. M.W. de Lange).
Procesverloop
Bij besluit van 3 mei 2016 (het primaire besluit) heeft verweerder de aanvraag van eiseres met nummer [nummer] om een aanvullend beschermingscertificaat (hierna: ABC of certificaat) voor ezetimibe, desgewenst in de vorm van een farmaceutisch aanvaardbaar zout, en rosuvastatine afgewezen.
Bij besluit van 28 april 2017 (bestreden besluit) heeft verweerder het bezwaar van eiseres tegen het primaire besluit ongegrond verklaard.
Eiseres heeft tegen het bestreden besluit beroep ingesteld.
Verweerder heeft een verweerschrift ingediend.
Het onderzoek ter zitting heeft plaatsgevonden op 14 december 2017.
Eiseres heeft zich laten vertegenwoordigen door haar gemachtigden voornoemd,
[persoon 1] , [persoon 2] , bijgestaan door de tolk in de Engelse taal L.K. Mitzman, en [octrooigemachtigde] , octrooigemachtigde. Verweerder heeft zich laten vertegenwoordigen door zijn gemachtigden voornoemd, [persoon 3] en [persoon 4] .
Overwegingen
Toepasselijk (Unie)recht
1.1.
Van toepassing is de Verordening (EG) nr. 469/2009 van het Europees Parlement en de Raad van 6 mei 2009 betreffende het aanvullende beschermingscertificaat voor geneesmiddelen (PB L 152) (hierna: de Verordening).
1.2.
Ingevolge artikel 1 van de Verordening – voor zover thans van belang – wordt in deze verordening verstaan onder:
a. a) “geneesmiddel”: elke enkelvoudige of samengestelde substantie, aangediend als hebbende therapeutische of profylactische eigenschappen met betrekking tot ziekten bij [de] mens [...];
b) “product”: de werkzame stof of de samenstelling van werkzame stoffen van een geneesmiddel;
c) “basisoctrooi”: een octrooi waardoor een product als zodanig dan wel een werkwijze voor de verkrijging van een product of een toepassing van een product beschermd wordt en dat door de houder ervan aangewezen wordt met het oog op de procedure voor de verkrijging van een certificaat;
d) “certificaat”: het aanvullende beschermingscertificaat;
[...].
1.3.
Ingevolge artikel 2 van de Verordening kan ieder op het grondgebied van een lidstaat door een octrooi beschermd product dat, voordat het in de handel wordt gebracht, volgens richtlijn 2001/83/EG van het Europees Parlement en de Raad van 6 november 2001 tot vaststelling van een communautair wetboek betreffende geneesmiddelen voor menselijk gebruik of richtlijn 2001/82/EG van het Europees Parlement en de Raad van 6 november 2001 tot vaststelling van een communautair wetboek betreffende geneesmiddelen voor diergeneeskundig gebruik als geneesmiddel aan een administratieve vergunningsprocedure onderworpen is, onder de voorwaarden van en in overeenstemming met de in de Verordening vervatte regels voorwerp van een certificaat zijn.
1.4.
Ingevolge artikel 3 van de Verordening wordt het certificaat afgegeven indien in de lidstaat waar de in artikel 7 van de Verordening bedoelde aanvraag wordt ingediend en op de datum van die aanvraag:
a. a) het product wordt beschermd door een van kracht zijnd basisoctrooi;
b) voor het product als geneesmiddel een van kracht zijnde vergunning voor het in de handel brengen is verkregen overeenkomstig richtlijn 2001/83/EG of richtlijn 2001/82/EG, naargelang van het geval;
c) voor het product niet eerder een certificaat is verkregen;
d) de onder b) genoemde vergunning de eerste vergunning is voor het in de handel brengen van het product als geneesmiddel.
1.5.
Het Europese Hof van Justitie (HvJEU) heeft bij arrest van 12 december 2013 in de zaak C-443/12, EU:C:2013:833 (hierna: Actavis/Sanofi) en bij arrest van 12 maart 2015 in de zaak C-577/13, ECLI:EU:C:2015:165, (hierna: Actavis-Boehringer) artikel 3 (meer in het bijzonder artikel 3 aanhef en sub c resp. sub c en sub a jo. artikel 1 aanhef en sub b en c) van de Verordening nader uitgelegd, met betrekking tot gevallen waarin, nadat al een certificaat voor een product met één werkzame stof (monoproduct) was verleend, op grond van hetzelfde basisoctrooi was verzocht om een certificaat voor een combinatie van die werkzame stof met een andere werkzame stof (combinatieproduct). Relevante overwegingen zijn hieronder in de procestaal weergegeven.
1.5.1.
In Actavis/Sanofi heeft het HvJEU onder meer overwogen:
26 By its second question, which it is appropriate to examine first of all, the referring court asks,
in essence, whether, in circumstances such as those in the main proceedings, in which, on the basis of a
patent protecting an innovative active ingredient and an MA [marketing authorisation, Rb] for a
medicinal product containing that ingredient as the single active ingredient, the holder of that patent has
already obtained an SPC for that active ingredient, Article 3(c) of Regulation No 469/2009 must be
interpreted as precluding the holder of that patent from obtaining, on the basis of that same patent but an
MA for a different medicinal product containing that active ingredient in combination with another
active ingredient which is not protected as such by the patent, a second SPC relating to that combination
of active ingredients.
(…)
28 (…) the main proceedings (…) entail a situation in which the same patent may be regarded as protecting a number of products within the meaning of Article 3(a) of Regulation No 469/2009, thus raising [the] question whether such a patent may permit its holder to obtain more than one SPC.
29 In that regard, it is possible, on the basis of a patent which protects several different ‘products’, to obtain several SPCs in relation to each of those different products, provided, inter alia, that each of those products is ‘protected’ as such by that ‘basic patent’ within the meaning of Article 3(a) of Regulation No 469/2009, in conjunction with Article 1(b) and (c) of that regulation (Case C-482/12 Georgetown University [2013] ECR, paragraph 30).
30 However, in circumstances such as those in the main proceedings, even if the condition laid down in Article 3(a) of Regulation No 469/2009 were satisfied, for the purpose of the application of Article 3(c) of that regulation, it cannot be accepted that the holder of a basic patent in force may obtain a new SPC, potentially for a longer period of protection, each time he places on the market in a Member State a medicinal product containing, on the one hand, the principle active ingredient, protected as such by the holder’s basic patent and constituting, according to the statements of the referring court, the core inventive advance of that patent, and, on the other, another active ingredient which is not protected as such by that patent.
(…)
32In the main proceedings, Sanofi’s patent, which protects the active ingredient irbesartan as such within the meaning of Article 3(a) of Regulation No 469/2009, has already enabled its holder to obtain an SPC relating to that active ingredient. Moreover, it is common ground that hydrochlorothiazide, an active ingredient that is a member of a class of diuretics, is not protected as such by that patent or indeed by any other patent.
33 In accordance with Article 5 of Regulation No 469/2009, an SPC granted in connection with a product confers, upon the expiry of the basic patent, the same rights as were conferred by that patent in relation to the product, within the limits of the protection conferred by the basic patent, as provided for in Article 4 of the regulation. Accordingly, if, during the period in which the patent was valid, the patent holder could oppose, on the basis of his patent, the use or certain uses of his product in the form of a medicinal product consisting of such a product or containing it, the SPC granted in relation to that product would confer on the holder the same rights for all uses of the product, as a medicinal product, which were authorised before the expiry of that certificate (see the judgments in Medeva, paragraph 39, and Georgetown University and Others, paragraph 32, and the orders in University of Queensland and CSL, paragraph 34, and Daiichi Sankyo, paragraph 29).
34 Thus, in the main proceedings, since it is common ground that, during the period in which the first SPC was valid, Sanofi was entitled to oppose, on the basis of its basic patent, the use or certain uses of irbesartan in the form of a medicinal product consisting of such a product or containing it, the SPC (now expired) granted for that product also conferred on Sanofi the same rights for all uses of the product, as a medicinal product, which were authorised before the expiry of that certificate.
35 It follows that that first SPC permitted Sanofi to oppose the marketing of a medicinal product containing irbesartan in combination with hydrochlorothiazide for a similar therapeutic use to that of Aprovel, so that if one of that pharmaceutical laboratory’s competitors had marketed a medicinal product similar to CoAprovel for similar therapeutic use, Sanofi would have been able to oppose the marketing of such a product by invoking its SPC for irbesartan (see, to that effect, with regard to the use of the active ingredient valsartan and hydrochlorothiazide, the orders of 9 February 2012 in Case C‑442/11 Novartis, paragraph 23, and Case C‑574/11 Novartis, paragraph 20).
36 In such a situation, Article 13 of Regulation No 469/2009 dictates that, upon expiry of the initial SPC, the holder thereof may no longer, in connection with the basic patent used as the basis for the grant of the SPC, oppose the marketing by third parties of the active ingredient which was the subject of the protection conferred by that SPC. This means that, after that date, it must be possible for third parties to place on the market not only medicinal products consisting of the formerly protected active ingredient but also any medicinal product containing that active ingredient in combination with another active ingredient that is not protected as such by the basic patent or any other patent.
(…)
40 Bearing in mind the objective of Regulation No 469/2009, as referred to at paragraph 31 above – namely, to compensate the patent holder for the delay to the commercial exploitation of his invention by providing him with an additional period of exclusivity – first, the grant of the first SPC in respect of the single active ingredient irbesartan has already afforded the holder such compensation and, second, the objective of that regulation is not to compensate the holder fully for the delay to the marketing of his invention or to compensate for such delay in connection with the marketing of that invention in all its possible forms, including in the form of combinations based on that active ingredient.
41 It should be recalled that the basic objective of Regulation No 469/2009 is to compensate for the delay to the marketing of what constitutes the core inventive advance that is the subject of the basic patent, namely, in the main proceedings, irbesartan. In the light of the need, referred to in recital 10 in the preamble to that regulation, to take into account all the interests at stake, including those of public health, if it were accepted that all subsequent marketing of that active ingredient in conjunction with an unlimited number of other active ingredients, not protected as such by the basic patent but simply referred to in the wording of the claims of the patent in general terms, such as, in the case of the patent in the main proceedings, ‘beta-blocking compound’, ‘calcium antagonist’, ‘diuretic’, ‘non-steroidal anti-inflammatory’ or ‘tranquilizer’, conferred entitlement to multiple SPCs, that would be contrary to the requirement to balance the interests of the pharmaceutical industry and those of public health as regards the encouragement of research within the European Union by the use of SPCs.
42 It follows that, in such a situation, Article 3(c) of Regulation No 469/2009 precludes a patent holder from obtaining, on the basis of one and the same basic patent, more than one SPC in connection with irbesartan, since such SPCs would in fact be connected, wholly or in part, with the same product (see, to that effect, with regard to plant protection products, Case C-258/99 BASF [2001] ECR I-3643, paragraphs 24 and 27). On the other hand, if a combination consisting of an innovative active ingredient in respect of which an SPC has already been granted and another active ingredient, which is not protected as such by the patent in question, is the subject of a new basic patent within the meaning of Article 1(c) of that regulation, the new patent could, in so far as it covered a totally separate innovation, confer entitlement to an SPC for that new combination that is subsequently placed on the market.
Het HvJEU heeft in dit arrest voor recht verklaard:
In circumstances such as those in the main proceedings, where, on the basis of a patent protecting an innovative active ingredient and a marketing authorisation for a medicinal product containing that ingredient as the single active ingredient, the holder of that patent has already obtained a supplementary protection certificate for that active ingredient entitling him to oppose the use of that active ingredient, either alone or in combination with other active ingredients, Article 3(c) of Regulation (EC) No 469/2009 of the European Parliament and of the Council of 6 May 2009 concerning the supplementary protection certificate for medicinal products must be interpreted as precluding that patent holder from obtaining – on the basis of that same patent but a subsequent marketing authorisation for a different medicinal product containing that active ingredient in conjunction with another active ingredient which is not protected as such by the patent – a second supplementary protection certificate relating to that combination of active ingredients.
1.5.2.
In het latere arrest Actavis-Boehringer heeft het HvJEU onder meer overwogen:
25 By its second and third questions, which it is appropriate to examine together and in the first place, the national court is asking, in essence, whether Article 3(a) and (c) of Regulation No 469/2009 must be interpreted as meaning that, where a basic patent includes a claim to a product comprising an active ingredient for which the holder of that patent has already obtained an SPC, as well as a subsequent claim to a product comprising a combination of that active ingredient and another substance, that provision precludes the holder from obtaining a second SPC for that combination. If that question is answered in the negative, the national court is also seeking to ascertain how the duration of the ‘combination SPC’ is to be determined, for the purpose of Article 13(1) of that regulation.
26 That question is raised in connection with an application for a second SPC for a product comprising a combination of the active ingredients telmisartan and hydrochlorothiazide. In that regard, it is common ground in the main proceedings that, in that combination, telmisartan, which is the innovative active ingredient of Boehringer’s basic patent, is the sole subject-matter of the invention. Boehringer did not, in any event, contribute to the discovery of hydrochlorothiazide, which is a molecule within the public domain, and the claim relating to that substance does not constitute the subject-matter of the invention.
(…)
32 For the purposes of providing a useful answer to Questions 2 and 3, it should be noted that the expression ‘as such’, as used in Article 1(c) of Regulation No 469/2009, must be given an autonomous interpretation in the light of the objectives pursued by that regulation and the overall scheme of which that expression forms part.
33 It should be recalled in that regard, first, that it is possible, in principle, on the basis of a patent which protects several different ‘products’, to obtain several SPCs in relation to each of those different products, provided, inter alia, that each of those products is ‘protected’ as such by that ‘basic patent’ within the meaning of Article 3(a) of Regulation No 469/2009, in conjunction with Article 1(b) and (c) of that regulation (see, to that effect, judgments in [Actavis/Sanofi], paragraph 29, and Georgetown University, C‑484/12, EU:C:2013:828, paragraph 30).
34 Second, it should be noted that, according to recitals 4, 5 and 9 in the preamble to Directive No 469/2009, the SPC is designed to re-establish a sufficient period of effective protection of a basic patent by permitting the holder to enjoy an additional period of exclusivity on the expiry of his patent, which is intended to compensate, at least in part, for the delay to the commercial exploitation of his invention by reason of the time which has elapsed between the date on which the application for that patent was filed and the date on which the first marketing authorisation in the European Union was granted (see, to that effect, judgment in [Actavis/Sanofi], paragraph 31 and the case-law cited).
35 However, the Court has also held that the objective pursued by Regulation No 469/2009 is not to compensate the holder fully for the delay to the marketing of his invention or to compensate for such delay in connection with the marketing of that invention in all its possible commercial forms, including in the form of combinations based on the same active ingredient (see, to that effect, judgment in [Actavis/Sanofi], paragraph 40).
36 In the light of the need, referred to, inter alia, in recital 10 in the preamble to Regulation No 469/2009, to take into account all the interests at stake, including those of public health, if it were accepted that all subsequent marketing of an active ingredient in conjunction with an unlimited number of other active ingredients which do not constitute the subject-matter of the invention covered by the basic patent would confer entitlement to multiple SPCs, that would be contrary to the requirement to balance the interests of the pharmaceutical industry and those of public health as regards the encouragement of research within the European Union by the use of SPCs (see, to that effect, judgment in [Actavis/Sanofi], paragraph 41).
37 Accordingly, in view of the interests referred to in recitals 4, 5, 9 and 10 in the preamble to Directive 469/2009, it cannot be accepted that the holder of a basic patent in force may obtain a new SPC, potentially for a longer period of protection, each time he places on the market in a Member State a medicinal product containing, on the one hand, an active ingredient, protected as such by the holder’s basic patent and constituting the subject-matter of the invention covered by that patent, and, on the other, another substance which does not constitute the subject-matter of the invention covered by the basic patent (see, to that effect, [Actavis/Sanofi], paragraph 30).
38 It follows that, in order for a basic patent to protect ‘as such’ an active ingredient within the meaning of Articles 1(c) and 3(a) of Regulation No 469/2009, that active ingredient must constitute the subject-matter of the invention covered by that patent.
39 In the light of the foregoing considerations, the answer to Questions 2 and 3 is that Article 3(a) and (c) of Regulation No 469/2009 must be interpreted as meaning that, where a basic patent includes a claim to a product comprising an active ingredient which constitutes the sole subject-matter of the invention, for which the holder of that patent has already obtained an SPC, as well as a subsequent claim to a product comprising a combination of that active ingredient and another substance, that provision precludes the holder from obtaining a second SPC for that combination.
Het HvJEU heeft in dit arrest voor recht verklaard:
Article 3(a) and (c) of Regulation (EC) No 469/2009 of the European Parliament and of the Council of 16 May 2009 concerning the supplementary protection certificate for medicinal products must be interpreted as meaning that, where a basic patent includes a claim to a product comprising an active ingredient which constitutes the sole subject-matter of the invention, for which the holder of that patent has already obtained a supplementary protection certificate, as well as a subsequent claim to a product comprising a combination of that active ingredient and another substance, that provision precludes the holder from obtaining a second supplementary protection certificate for that combination.
Feiten
2.1.
Op 8 september 2014 heeft eiseres een aanvraag ingediend om afgifte van een ABC voor een product omschreven als ezetimibe, desgewenst in de vorm van een farmaceutisch aanvaardbaar zout, en rosuvastatine. Eiseres heeft bij deze aanvraag verwezen naar de op 11 augustus 2014 door het College ter beoordeling van Geneesmiddelen voor het geneesmiddel Ultrizor verleende handelsvergunningen onder nummers [handelsvergunningen] en de voor het geneesmiddel Ridutrin verleende handelsvergunningen onder nummers [handelsvergunningen] . Volgens paragraaf 2 van de samenvatting van de productkenmerken van Ultrizor en Ridutrin zijn de werkzame stoffen in deze geneesmiddelen ezetimibe en rosuvastatine.
2.2.
Eiseres heeft haar aanvraag gebaseerd op het Europees Octrooi 0 720 599 B1 (hierna: EP 599 of het basisoctrooi) met de titel Hydroxy-substituted azetidinone compounds useful as hypocholesterolemic agents (Hydroxy-gesubstitueerde azetidinonverbindingen, bruikbaar als hypocholesterolemische middelen). Dit octrooi is op 14 september 2014 vervallen.
De conclusies 1, 8, 9, 16 en 17 van EP 599 luiden in de oorspronkelijke Engelse taal:

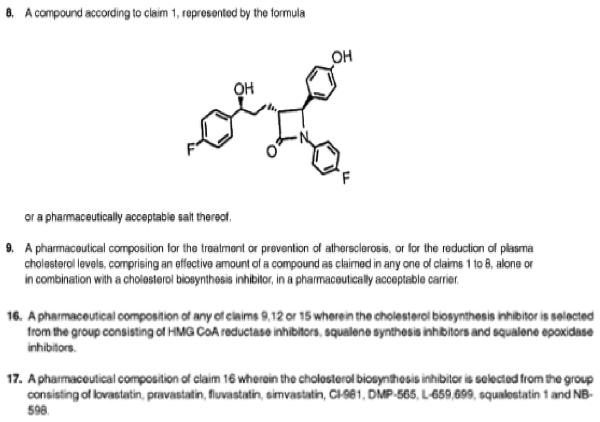
In de beschrijving van het octrooi is onder meer het volgende opgenomen:

(…)

(…)

(…)

[formule als opgenomen in conclusie 1]
(…)
2.3.
Ezetimibe voldoet aan de Markush-formule van conclusie 1 van EP 599 octrooi en komt, meer specifiek, overeen met de verbinding in conclusie 8.
2.4.
Conclusies 9 en 16 hebben (mede) betrekking op combinaties van (o.a.) ezetimibe met een cholesterol biosynthese remmer. In conclusie 17 is een aantal biosynthese remmers specifiek genoemd.
2.5.
Rosuvastatine is een cholesterol biosynthese remmer, meer specifiek een HMG CoA reductase remmer.
2.6.
Eiseres heeft op grond van het basisoctrooi eerder een ABC (met nummer [nummer]) verkregen voor het monoproduct ‘ezetimibe, desgewenst in de vorm van een farmaceutisch aanvaardbaar zout’. Dit ABC verloopt op 16 april 2018.
Bestreden besluit
3.1.
Het bestreden besluit berust op het standpunt dat nu eiseres op basis van
EP 599 al een certificaat voor het monoproduct ezetimibe heeft verkregen zij op basis van EP 599 geen ABC voor de combinatie ezetimibe en rosuvastatine kan verkrijgen. Volgens verweerder staan artikel 3, aanhef en onder a en artikel 3, aanhef en onder c, van de Verordening, zoals uitgelegd in de arresten Acatavis/Sanofi en Actavis/Boehringer daaraan in de weg. Uit overwegingen 30, 40-42 van resp. 38-39 van deze arresten volgt dat het niet mogelijk is een certificaat te verkrijgen voor een combinatie als het monoproduct het enige voorwerp van de uitvinding vormt, ook al is er een aparte conclusie op de combinatie gericht. Er kan alleen een ABC voor de combinatie worden afgegeven als de combinatie, los van het monoproduct, ook voorwerp van de uitvinding vormt (‘a totally separate innovation’). Daarvan is hier geen sprake, aldus verweerder.
Beoordeling
4.1.
In geschil is of artikel 3 (sub a en/of c) van de Verordening eraan in de weg staat dat eiseres naast een ABC voor het monoproduct ezetimibe, een ABC voor het combinatieproduct ezetimibe en rosuvastatine verkrijgt.
4.2.
Het basisoctrooi in deze zaak ziet op een nieuwe groep azetidinonverbindingen die kunnen worden gebruikt voor de preventie van arteriosclerose en/of als cholesterol verlagende middelen. Het is deze materie die in de terminologie van Actavis/Sanofi kan worden aangemerkt als ‘the core inventive advance’ van het octrooi. Ezetimibe is één van die nieuwe verbindingen en daarmee als vernieuwende werkzame stof (‘innovative active ingredient’) aan te merken, die als zodanig (‘as such’) door EP 599 wordt beschermd.
4.3.
Cholesterol biosynthese remmers zijn in EP 599 niet als zodanig onder bescherming gesteld. Cholesterol biosynthese remmers vormen in het kader van EP 599 dan ook geen ‘innovative active ingrediënt’ en als zodanig ook niet het voorwerp (subject matter) van EP 599. Een aantal biosyntheseremmers is nader aangeduid (vgl. conclusie 17) maar (de groep(en)) biosyntheseremmers zijn in EP 599 niet gelimiteerd. Rosuvastatine wordt in EP 599 niet genoemd.
4.4.
Uit de door het HvJEU gegeven uitleg aan artikel 3 in Actavis/Sanofi en Actavis/Boeringer volgt dat in deze situatie, waarin het combinatieproduct bestaat uit enerzijds een werkzame stof die als zodanig (‘as such’) wordt beschermd door het basisoctrooi en het voorwerp (‘subject matter’) uitmaakt van de geoctrooieerde uitvinding en anderzijds uit een werkzame stof - deel uitmakend van een niet gelimiteerde groep biosyntheseremmers - die niet als zodanig wordt beschermd door datzelfde basisoctrooi en niet het voorwerp van de uitvinding vormt, geen plaats is voor verlening van een ABC voor het combinatieproduct, nu voor de eerste werkzame stof op basis van een eerdere handelsvergunning al een op hetzelfde basisoctrooi gegrond ABC is verleend. De rechtbank verwijst in het bijzonder naar par. 36-38 van Actavis/Boehringer en de verwijzing daarin naar par. 41 en 30 in Actavis/Sanofi.
4.5.
Daarbij neemt de rechtbank in aanmerking dat eiseres zich binnen de geldigheidsperiode van het eerste, op basis van EP 599 verkregen ABC voor ezetimibe, mede kon verzetten tegen het gebruik van geneesmiddelen bestaande uit een combinatie van ezetimibe met een biosyntheseremmer (waaronder rosuvastatine) voor dezelfde therapeutische toepassing. Zij heeft dus na expiratie van EP 599 reeds een aanvullende periode effectieve bescherming van haar uit dit basisoctrooi voortvloeiende rechten genoten, ook waar het gaat om het combinatieproduct (vgl. par. 35 en 40 Actavis/Sanofi).
4.6.
De beroepsgronden van eiseres hebben - met uitzondering van de in 4.7. genoemde grond - betrekking op de toets(en) en bewijsstukken die verweerder heeft gehanteerd ten aanzien van de vraag of de combinatie ezetimibe en rosuvastatine (los van ezetimibe) op uitvinderswerkzaamheid berust en of voor de combinatie een afzonderlijk octrooi zou kunnen zijn verkregen. Naar het oordeel van de rechtbank behoeft die vraag, die volgens partijen voortvloeit uit par. 42 van Actavis/Sanofi, geen bespreking. Het HvJEU heeft in par. 42 overwogen dat een ‘new basic patent, in so far as it covered a totally separate innovation’ aanspraak op een ABC zou kunnen geven, maar die situatie doet zich niet voor. Hier is aan de orde of eiseres op grond van hetzelfde basisoctrooi meerdere ABC’s kan verkrijgen door het (op basis van verschillende vergunningen) opeenvolgend in de handel brengen van de in het octrooi beschermde stof ezetimibe en combinaties van die stof met een (steeds andere) niet door het octrooi beschermde biosyntheseremmer voor dezelfde therapeutische toepassing. Gegeven de uitleg van het HvJEU, is dat in strijd met de Verordening. Verweerder heeft het ABC voor de combinatie van ezetimibe en rosuvastatine daarom terecht geweigerd. Dat verweerder in het bestreden besluit tevens is ingegaan op de uitvinderswerkzaamheid van de combinatie, maakt niet dat het bestreden besluit geen stand kan houden. De gronden van eiseres missen doel.
4.7.
Anders dan eiseres aanvoert is de rechtbank ten slotte van oordeel dat het bestreden besluit niet aan een motiveringsgebrek lijdt omdat verweerder niet op alle bezwaargronden afzonderlijk is ingegaan. Verweerder is ingegaan op de kern van de bezwaren van eiseres en heeft deze in onderlinge samenhang besproken (vgl. Centrale Raad van Beroep 15 december 2016, ECLI:NL:CRVB:2016:4946). Het feit dat verweerder het standpunt van eiseres niet huldigt en daar een eigen standpunt tegenover plaatst is op zichzelf niet aan te merken als een gebrekkige motivering.
4.8.
Het beroep is ongegrond.
4.9.
Voor een proceskostenveroordeling bestaat geen aanleiding.
Beslissing
De rechtbank verklaart het beroep ongegrond.
Deze uitspraak is gedaan door mr. J.TH. van Walderveen, voorzitter, en mr. G.P. Kleijn en mr. C.T. Aalbers, leden, in aanwezigheid van mr. J.A. Leijten, griffier. De beslissing is in het openbaar uitgesproken op 10 april 2018.
griffier Bij verhindering van de voorzitter
getekend door mr. G.P. Kleijn
Afschrift verzonden aan partijen op:
Rechtsmiddel
Tegen deze uitspraak kan binnen zes weken na de dag van verzending daarvan hoger beroep worden ingesteld bij de Afdeling bestuursrechtspraak van de Raad van State. Als hoger beroep is ingesteld, kan bij de voorzieningenrechter van de hogerberoepsrechter worden verzocht om het treffen van een voorlopige voorziening of om het opheffen of wijzigen van een bij deze uitspraak getroffen voorlopige voorziening.