Wetboek van Burgerlijke Rechtsvordering
Rb. Den Haag, 27-07-2016, nr. C/09/513437 / KG ZA 16-779
ECLI:NL:RBDHA:2016:8700
- Instantie
Rechtbank Den Haag
- Datum
27-07-2016
- Zaaknummer
C/09/513437 / KG ZA 16-779
- Vakgebied(en)
Intellectuele-eigendomsrecht (V)
- Brondocumenten en formele relaties
ECLI:NL:RBDHA:2016:8700, Uitspraak, Rechtbank Den Haag, 27‑07‑2016
Uitspraak 27‑07‑2016
Inhoudsindicatie
Octrooirecht; octrooi voor een fulvestrant formulering vooralsnog geldig geacht; verbod op inbreuk door generiek product
Partij(en)
vonnis
RECHTBANK DEN HAAG
Team handel
Zittingsplaats Den Haag
zaaknummer / rolnummer: C/09/513437 / KG ZA 16-779
Vonnis in kort geding van 27 juli 2016
in de zaak van
de vennootschap naar buitenlands recht
ASTRAZENECA AB,
gevestigd te Södertälje (Zweden),
eiseres in conventie,
verweerster in reconventie,
advocaat mr. W.A. Hoyng te Amsterdam,
tegen
de besloten vennootschap met beperkte aansprakelijkheid
SANDOZ B.V.,
gevestigd te Almere,
gedaagde in conventie,
eiseres in reconventie,
advocaat mr. O.P. Swens te Amsterdam.
Partijen zullen hierna AstraZeneca en Sandoz genoemd worden.
De procedure is voor AstraZeneca mede behandeld door mr. ir. T.M. Blomme en
mr. J.M.J.A. Krens en voor Sandoz door mr. R. Dijkstra en mr. T.D. Stigterman, allen advocaat te Amsterdam.
1. De procedure
1.1.
Het verloop van de procedure blijkt uit:
- -
de dagvaarding van 27 juni 2016 met producties 1-7;
- -
de conclusie van antwoord in kort geding, tevens conclusie van eis in reconventie tevens akte overlegging producties 1-20 van Sandoz;
- -
de akte houdende overlegging aanvullende producties van AstraZeneca, met producties 8 - 21, met een latere aanvulling op de producties 14 en 15;
- -
de akte overlegging aanvullende producties 21-22 van Sandoz;
- -
de akte houdende overlegging verdere aanvullende producties van AstraZeneca, met producties 22 - 23;
- -
de mondelinge behandeling op 6 juli 2016;
- -
de pleitnota van AstraZeneca;
- -
de pleitnota van Sandoz;
- -
het verkorte proces-verbaal van de mondelinge behandeling.
1.2.
Na afsluiting van de mondelinge behandeling is aan Sandoz een inbreukverbod opgelegd voor de duur van het kort geding, zoals vermeld in het van de zitting opgemaakte verkorte proces-verbaal.
1.3.
Vonnis is bepaald op heden.
2. Procedurele beslissingen
Toelaatbaarheid van producties
2.1.
De voorzieningenrechter heeft, mede gezien de korte termijn tot de zitting, bepaald dat de producties van AstraZeneca uiterlijk op 27 juni 2016 dienden te worden ingestuurd en die van Sandoz uiterlijk 1 juli 2016. Niettemin hebben beide partijen op een later tijdstip nog nadere producties ingestuurd. Partijen hebben over en weer geen bezwaar gemaakt. De voorzieningenrechter heeft vervolgens ter zitting aan de orde gesteld dat de termijnen mede zijn gesteld met het oog op de ordelijke voorbereiding van de zitting door de voorzieningenrechter. Partijen is meegedeeld dat producties ambtshalve zullen worden geweigerd indien mocht blijken dat deze relevant zijn maar door de late toezending ter zitting onvoldoende zijn besproken. Dit is echter niet het geval gebleken zodat alle producties worden toegelaten.
Verbod op mededelingen
2.2.
Door AstraZeneca is voorafgaand aan de mondelinge behandeling verzocht de door haar overgelegde verklaring van dr. [X] ter zitting te behandelen met gesloten deuren gelet op het vertrouwelijke karakter van de in die verklaring verstrekte informatie. Zij heeft tevens verzocht dat zal worden bepaald dat aan Sandoz een mededelingverbod zal worden opgelegd met betrekking tot die verklaring en het in dat verband ter zitting verhandelde. Ter zitting heeft AstraZeneca aangegeven de behandeling met gesloten deuren niet langer nodig te vinden.
2.3.
Sandoz heeft zich niet verzet tegen het verzoek van AstraZeneca om aan haar, Sandoz een verbod op te leggen tot het doen van mededelingen over de inhoud van de door AstraZeneca overlegde verklaring van dr. [X] (met bijlagen) en wat daarover ter zitting door AstraZeneca is meegedeeld. Het is de voorzieningenrechter voorts bij bestudering van deze verklaring gebleken dat inhoud als vertrouwelijk moet worden aangemerkt en schadelijk kan zijn voor de belangen van AstraZeneca indien derden daarvan kennisnemen. Het gevraagde verbod wordt daarom aan Sandoz opgelegd met toepassing van artikel 29 lid 1 onder b Rv1..
3. De feiten
3.1.
AstraZeneca is een internationale farmaceutische onderneming die zich richt op het onderzoek, de ontwikkeling en het op de markt brengen van farmaceutische producten, in het bijzonder op het gebied van de oncologie.
3.2.
AstraZeneca brengt onder meer het geneesmiddel FASLODEX op de markt. Dit geneesmiddel wordt toegepast bij de behandeling van oestrogeenafhankelijke typen borstkanker. FASLODEX bevat als actieve stof fulvestrant. Deze stof heeft als effect dat wordt verhinderd dat oestrogeen de kankercellen bereikt, als gevolg waarvan de groei van de kankercellen geremd of zelfs gestopt wordt.
3.3.
AstraZeneca is houdster van Europese Octrooi EP 1 250 138 B2 (hierna ook: EP 138 of het octrooi) dat ziet op een Fulvestrant formulation. De aanvraag voor het Octrooi werd ingediend op 8 januari 2001 met beroep op de prioriteitsdata 10 januari 2000 en 12 april 2000 op basis een tweetal Engelse octrooiaanvragen. De verlening van het octrooi is gepubliceerd op 19 oktober 2005.
3.4.
Na de verlening van het octrooi is oppositie ingesteld bij het Europees Octrooi Bureau. De oppositieafdeling heeft aanvankelijk het octrooi in ongewijzigde vorm in stand gehouden. Van die beslissing is beroep ingesteld. Na terugverwijzing door de technische kamer van beroep naar de oppositieafdeling is de oppositie ingetrokken. AstraZeneca heeft vervolgens haar conclusies gewijzigd. De oppositieafdeling heeft bij beslissing van 11 februari 2015 het octrooi in die gewijzigde vorm wederom in stand gehouden. Daarbij zijn de hierna te bespreken publicaties uit de stand van de techniek mede in aanmerking genomen.
3.5.
Conclusie 1 van het octrooi luidt in de authentieke Engelse versie:
1. Use of fulvestrant in the preparation of a pharmaceutical formulation for the treatment of a benign or malignant disease of the breast or reproductive tract by intra-muscular administration, wherein the formulation comprises fulvestrant in a ricinoleate vehicle, a pharmaceutically acceptable non-aqueous ester solvent, and a pharmaceutically acceptable alcohol, and wherein the formulation is adapted for attaining a therapeutically significant blood plasma fulvestrant concentration for at least 2 weeks.
3.6.
In de onbestreden Nederlandse vertaling luidt conclusie 1 als volgt:
Toepassing van fulvestrant bij de bereiding van een farmaceutische formulering
voor de behandeling van een benigne of maligne ziekte van de borst of
voortplantingstractus door intramusculaire toediening waarbij de formulering
fulvestrant in een ricinoleaatmedium, een farmaceutisch aanvaardbaar niet-waterig
esteroplosmiddel en een farmaceutisch aanvaardbare alcohol omvat, waarbij de
formulering aangepast is voor het verkrijgen van een therapeutisch significante
bloedplasmaconcentratie aan fulvestrant gedurende ten minste 2 weken.
3.7.
De navolgende publicaties behoren voor het octrooi tot de stand van de techniek.
3.7.1.
Howell e.a., Pharmacokinetics, pharmacological and anti-tumour effects of the specific anti-oestrogen ICI 182780 in women with advanced breast cancer, British Journal of Cancer, [1996] 74, pagina 300-308, (hierna: Howell), betreft een onderzoek naar de effecten van ICI 182,780 (een andere aanduiding van fulvestrant) bij de behandeling van borstkanker patiënten die resistentie hebben ontwikkeld tegen het geneesmiddel tamoxifen. Het artikel concludeert dat ICI 182,780 bij langdurige behandeling goed wordt verdragen en actief is tegen tumoren. Het artikel vermeldt voorts: ICI 182780 was administered as a longacting formulation contained in a castor oil2.-based vehicle by monthly i.m.3. injection (5 ml) into the buttock.
3.7.2.
McLeskey e.a., Tamoxifen-resistant Fibroblast Growth Factor-transfected MCF-7 Cells Are Cross-Resistant in Vivo to the Antiestrogen ICI 182,780 and Two Aromatase Inhibitors, Clinical Cancer Research, Vol. 4, maart 1998, pagina 697 – 711, (hierna: McLeskey), vermeldt op pagina’s 697, 698, 700 en 701 het volgende (markeringen toegevoegd door de voorzieningenrechter).



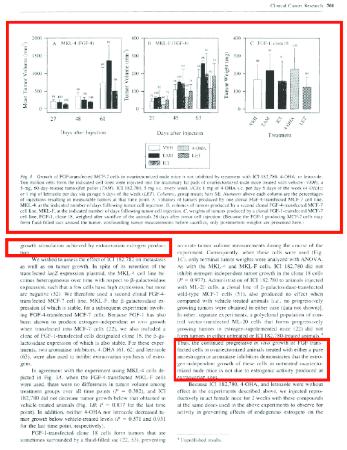
3.8.
Sandoz is eveneens actief op de geneesmiddelenmarkt. Sandoz heeft op 6 oktober 2015 een marktvergunning verkregen voor een fulvestrant formulering "Fulvestrant Sandoz 50 mg/ml, oplossing voor injectie in een voorgevulde spuit" (hierna: ook fulvestrant Sandoz). De generieke fulvestrant-formulering van Sandoz maakt inbreuk op, in ieder geval, conclusie 1 van het octrooi.
3.9.
Op 21 juni 2016 heeft Sandoz fulvestrant Sandoz laten opnemen in de zogenaamde G-Standaard. Vervolgens heeft AstraZeneca Sandoz aangeschreven, waarna Sandoz heeft toegezegd tot en met de dag van de mondelinge behandeling van het kort geding (6 juli 2016) niet met fulvestrant Sandoz op de Nederlandse markt te zullen komen.
3.10.
AstraZeneca heeft in Duitsland tegen een aan Sandoz gelieerde vennootschap, Hexal AG, een voorlopige voorziening ter zake een inbreuk op het octrooi gevorderd. Daarbij is bij wijze van verweer de geldigheid van het octrooi betwist. Bij beslissing in hoger beroep van 19 februari 2016 heeft het Oberlandesgericht Düsseldorf, na beschouwing van onder meer Howell en McLeskey, als voorlopig oordeel gegeven dat het octrooi geldig is. Ook in Zwitserland en Spanje zijn procedures aanhangig met als inzet de inbreuk op en/of de geldigheid van EP 138.
4. Het geschil in conventie
4.1.
Stellende dat Sandoz inbreuk dreigt te maken op, onder meer, conclusie 1 van het octrooi door het rechtstreeks verkregen voortbrengsel van de werkwijze op de Nederlandse markt te brengen, heeft AstraZeneca gevorderde dat de voorzieningenrechter:
A. bij wijze van provisioneel vonnis in kort geding, uitvoerbaar bij voorraad:
1. Sandoz verbiedt om in Nederland op enigerlei wijze betrokken te zijn bij (directe en/of indirecte) inbreuk op het Europese octrooi EP (NL) 1 250 138 B2, onder meer door het betrokken zijn bij het in het verkeer brengen, verder verkopen, afleveren of anderszins verhandelen, of voor dit een en ander (verder) aanbieden van generieke "Fulvestrant Sandoz 50 mg/ml, oplossing voor injectie in een voorgevulde spuit" of andere fulvestrant formuleringen die onder de beschermingsomvang van het octrooi vallen, zulks op straffe van een dwangsom van € 50.000,- per overtreding van het provisioneel verbod, dan wel, ter keuze van AstraZeneca, van € 25.000,- per betrokken product of per dag, een gedeelte van een dag voor een hele gerekend, waarop de betrokkenheid van Sandoz bij directe of indirecte inbreuk op het octrooi na de betekening van het provisionele vonnis zal voortduren, een en ander met een maximum van € 1.000.000,- , waarbij het provisioneel verbod gelding zal hebben voor de duur van het geding, en in ieder geval tot daarin vonnis zal zijn gewezen;
2. Sandoz te veroordelen in de kosten van het geding met betrekking tot de provisionele voorziening, met inachtneming van hetgeen is bepaald in artikel 1019h Rv;
B. alsmede bij vonnis in kort geding, uitvoerbaar bij voorraad:
1. Sandoz te verbieden om in Nederland op enigerlei wijze betrokken te zijn bij (directe en/of indirecte) inbreuk op het Europese Octrooi EP (NL) 1 250 138 B2 onder meer door het betrokken zijn bij het in het verkeer brengen, verder verkopen, afleveren of anderszins verhandelen, of voor dit een en ander (verder) aanbieden van generieke "Fulvestrant Sandoz 50 mg/ml, oplossing voor injectie in een voorgevulde spuit" of andere fulvestrant formuleringen die onder de beschermingsomvang van het octrooi vallen;
2. Sandoz te gebieden om "Fulvestrant Sandoz 50 mg/ml, oplossing voor injectie in een voorgevulde spuit", geregistreerd onder de nummer RVG 115994, per de eerstvolgende keer dat dit redelijkerwijze mogelijk is uit de G-Standaard te (laten) verwijderen;
3. Sandoz te bevelen in de eerstvolgende uitgave van het Pharmaceutisch Weekblad een advertentie te plaatsen zoals omschreven in de dagvaarding;
4. Sandoz te bevelen binnen twee weken na betekening van het vonnis aan AstraZeneca schriftelijke opgave te verstrekken van alle afnemers aan wie Sandoz producten heeft verkocht, afgeleverd en/of daartoe heeft aangeboden, die vallen onder de beschermingsomvang van het octrooi;
5. Sandoz te bevelen binnen twee weken na betekening van het vonnis aan ieder van de onder sub 4 bedoelde afnemers een aangetekende brief te zenden met een inhoud als door AstraZeneca aangegeven (strekkende tot recall van geleverde producten), een en ander onder de verplichting om gelijktijdig kopieën van alle te verzenden brieven te verschaffen aan AstraZeneca;
6. Sandoz te bevelen aan AstraZeneca per overtreding van het sub 1 bedoelde verbod en voor iedere niet (gehele c.q. deugdelijke) nakoming van de sub 2, 3, 4 en/of 5 bedoelde bevelen aan AstraZeneca een dwangsom te betalen van
€ 50.000,- dan wel, ter keuze van AstraZeneca, aan AstraZeneca een dwangsom te betalen van € 25.000,- per betrokken product, of per dag, een gedeelte van een dag voor een gehele gerekend, dat de betrokkenheid van Sandoz bij directe of indirecte inbreuk op het octrooi na de betekening van het vonnis zal voortduren of de sub 2, 3, 4 en/of 5, bedoelde bevelen na de betekening van het vonnis niet geheel en deugdelijk worden nagekomen, waarbij de dwangsommen verschuldigd zijn per niet (geheel en deugdelijk) nagekomen verbod of bevel;
7. Sandoz te veroordelen in de kosten van dit geding, met inachtneming van hetgeen is bepaald in artikel 1019h Rv.
4.2.
Sandoz stelt zich op het standpunt dat de door AstraZeneca gevraagde
voorzieningen moeten worden geweigerd omdat een serieuze, niet te verwaarlozen kans bestaat dat het Nederlandse deel van EP 138 in een bodemprocedure zal worden vernietigd. Haar verweer houdt zakelijk weergegeven en meer in het bijzonder het navolgende in.
Nieuwheid
4.2.1.
Conclusie 1 van EP 138 is niet nieuw in het licht van McLeskey. McLeskey openbaart een te injecteren formulering die fulvestrant omvat in een concentratie van 50 mg/ml, 10% ethanol, 15% benzylbenzoaat, 10% benzylalcohol en tot volume gebracht met ricinusolie.
4.2.2.
De vakman zal direct begrijpen dat die formulering geschikt is voor de behandeling van borstkanker omdat al langer bekend was dat fulvestrant daarbij effectief is. McLeskey openbaart dat fulvestrant werkt als alternatieve hormonale therapie bij de behandeling van borstkanker bij patiënten die resistent zijn geworden voor tamoxifen. De activiteit van de fulvestrant-formulering wordt ook bevestigd door de in McLeskey beschreven uterustest waaruit volgt dat de fulvestrant-formulering een oestrogeen-blokkerende werking heeft die in de klinische onderzoeken, waarnaar McLeskey verwijst, leidt tot behandeling van borstkanker.
4.2.3.
De vakman weet voorts dat bij muizen een injectie in de regel subcutaan plaatsvindt gezien de zeer kleine spieren van de muis, maar dat bij mensen een formulering in castorolie in de regel intramusculair wordt toegediend omdat het volume dat subcutaan kan worden geïnjecteerd klein is. De vakman zal de intramusculaire toediening dus in McLeskey meelezen.
4.2.4.
De vakman zal tot slot op grond van zijn algemene vakkennis verwachten dat deze formulering effectief zal zijn voor het verkrijgen van een therapeutisch significante bloedplasmaconcentratie aan fulvestrant voor de behandeling van borstkanker gedurende ten minste twee weken. De fulvestrant-formulering wordt namelijk omschreven als een alternatief voor tamoxifen en vermeld is dat het een preformulering betreft die verkregen is van Zeneca (de rechtsvoorganger van AstraZeneca). De vakman zal er van uitgaan dat de formulering bedoeld is voor sustained release.
Voorwaardelijk: nawerkbaarheid
4.2.5.
Voor zover AstraZeneca zou stellen dat McLeskey enkel tests heeft uitgevoerd op muizen en daarom niet aantoont dat de omschreven formulering effectief is bij de behandeling van mensen gedurende ten minste twee weken, beroept Sandoz zich op niet-nawerkbaarheid van de conclusies van EP 138. Ook in EP 138 wordt de formulering slechts getest op konijnen en is de bloedplasmaconcentratie gemeten in een periode van slechts vijf dagen.
Inventiviteit
4.2.6.
Conclusie 1 van EP 138 is niet inventief uitgaande van Howell als meest nabij gelegen stand van de techniek. Howell openbaart het therapeutisch effect van fulvestrant bij de behandeling van patiënten met borstkanker. De gebruikte formulering bevat fulvestrant in een concentratie van 50 mg/ml in castorolie. Overige excipiënten worden niet geopenbaard. De dosering fulvestrant bedraagt 250 mg per maand.
4.2.7.
Het enige verschil met de tweede medische indicatieconclusie in EP 138 is de openbaarmaking van de exacte formulering, inclusief de overige excipiënten. Het op te lossen probleem kan worden geformuleerd als: het verschaffen van een formulering voor fulvestrant voor de (intramusculaire) behandeling van een benigne of maligne ziekte van4. de borst of voortplantingstractus.
4.2.8.
De gemiddelde formuleerder die op zoek gaat naar een oplossing voor dit probleem, zou een literatuuronderzoek (laten) verrichten, gericht op artikelen en publicaties over fulvestrant / ICI 182,870. Dit onderzoek zou uitkomen bij McLeskey. De formuleerder zou vervolgens op basis van McLeskey tot de in conclusie 1 van EP 138 geclaimde formulering komen omdat hij een redelijke verwachting van succes heeft dat die formulering geschikt is voor de behandeling van borstkanker. Bedenkingen of zorgen die de vakman mocht hebben maken dit onderzoek niet inventief zolang geen sprake is van een vooroordeel, wat niet het geval is.
4.2.9.
Ook kan worden uitgegaan van McLeskey als meest nabij gelegen stand van de techniek. Daarvan uitgaande is geen objectief technisch probleem te formuleren omdat er geen verschil is tussen McLeskey en de formulering van conclusie 1 van EP 138. Subsidiair, voor zover wordt geoordeeld dat EP 138 explicieter stelt dat de formulering kan worden gebruikt voor de behandeling van borstkanker, is het probleem te formuleren als het de vakman meer zekerheid verschaffen over de toepassing van de specifieke formulering van fulvestrant bij de behandeling van borstkanker5.. De vakman zou vanuit McLeskey zonder enige inventieve arbeid tot de conclusie komen dat er een redelijke verwachting van succes is dat de door haar gebruikte formulering kan worden toegepast bij mensen met borstkanker, zeker na raadpleging van Howell, naar wie McLeskey in voetnoot 19 verwijst.
4.2.10.
De conclusies 2 – 31 zijn eveneens nietig vanwege gebrek aan nieuwheid dan wel inventiviteit.
4.3.
AstraZeneca heeft de stellingen van Sandoz gemotiveerd betwist. Op die stellingen wordt hierna, voor zover van belang, nader ingegaan.
5. Het geschil in reconventie
5.1.
Sandoz vordert dat de voorzieningenrechter bij vonnis uitvoerbaar bij voorraad:
A. AstraZeneca beveelt te gehengen en te gedogen dat Sandoz in Nederland de in artikel 53 ROW6.bedoelde voorbehouden handelingen verricht ten aanzien van het product fulvestrant Sandoz;
B. AstraZeneca verbiedt, totdat de bodemrechter in het onderhavige geschil een einduitspraak heeft gedaan, de navolgende juridische of feitelijke acties te ondernemen die de verkoop van het product fulvestrant Sandoz kunnen schaden:
i. bij Sandoz zelf of bij derden (conservatoir) beslag te (doen) leggen op voorraden van het product fulvestrant Sandoz;
ii. sommaties te sturen aan wederverkopers van het product fulvestrant Sandoz, zonder daarbij te verwijzen naar dit vonnis en een kopie daarvan bij te sluiten;
iii. rechtsmaatregelen te treffen door het vragen van een verkoopverbod tegen wederverkopers van het product fulvestrant Sandoz, of daarmee te dreigen;
C. AstraZeneca veroordeelt tot betaling van een niet voor rechterlijke matiging vatbare dwangsom van € 100.000,- voor iedere overtreding van de onder A en B vermelde verboden en bevelen, alsmede een dwangsom van € 50.000,- voor iedere dag, een gedeelte van een dag als geheel te rekenen, dat een overtreding van de te geven verboden en/of bevelen mocht voortduren;
D. AstraZeneca veroordeelt in de kosten van het geding ex artikel 1019h Rv.
5.2.
Sandoz beroept zich ook in reconventie op de nietigheid van EP 138. Sandoz stelt, zakelijk weergegeven, dat indien zij in conventie in het gelijk wordt gesteld, AstraZeneca mogelijk een tweetal verwante octrooien (EP 1 669 073 en NL 1017075) zal willen inzetten tegen fulvestrant Sandoz. Volgens Sandoz zijn ook deze beide octrooien nietig. AstraZeneca heeft echter geweigerd te verklaren dat zij op deze twee octrooien geen beroep zal doen. Sandoz stelt dat zij daarom een spoedeisend belang heeft bij de vorderingen in reconventie.
6. De beoordeling in conventie en in reconventie
Bevoegdheid
6.1.
Deze rechtbank is internationaal bevoegd kennis te nemen van het geschil in de hoofdzaak op grond van de artikel 4 lid 1 en 24 lid 4 EEX II-Vo7.. Daarom bestaat tevens bevoegdheid tot het treffen van voorlopige maatregelen als door AstraZeneca gevorderd. De bevoegdheid in reconventie berust op onder meer artikel 7 lid 2 en 24 lid 4 EEX II-Vo.
Spoedeisend belang
6.2.
Gezien de gestelde dreigende inbreuk op haar octrooi, heeft AstraZeneca een spoedeisend belang bij het gevorderde.
Nieuwheid
6.3.
McLeskey openbaart onder Material and methods, Drugs twee formuleringen van ICI 182,780 (fulvestrant), waarvan één op basis van peanut oil is gebruikt voor het experiment weergegeven in figuur 18.en het andere op basis van castor oil (hierna: de castorolie-formulering) voor de experimenten weergegeven in figuren 1B en 1C. In deze drie experimenten zijn steeds verschillende cellijnen gebruikt (MKL-4, MKL-F en FGF-1 clone 18). De experimenten zijn uitgevoerd op muizen waarvan de eierstokken verwijderd waren (ovariectomized mice), die als gevolg (sterk) verminderd oestrogeen aanmaken. Partijen zijn het erover eens dat de bestanddelen van de castorolie-formulering dezelfde zijn als die genoemd in conclusie 1 van het octrooi.
6.4.
McLeskey beschrijft verder een experiment met muizen waarvan de eierstokken niet waren verwijderd. Deze muizen werden eveneens geïnjecteerd met, onder meer, ICI 182,780 om de remmende activiteit van ICI 182,780 op de invloed van oestrogeen te testen (aangeduid als anti-oestrogene activiteit). Oestrogeen beïnvloedt de groei van het endometrium (baarmoederslijmvlies). Partijen verwijzen naar deze test als de uterustest. De anti-oestrogene activiteit van fulvestrant was al geruime tijd bekend. De uterustest was, zoals Sandoz aanvoert9., een geaccepteerde test om anti-oestrogene activiteit te testen.
6.5.
McLeskey betreft een onderzoek naar mechanismen die leiden tot tamoxifen-resistentie. ICI 182,780 wordt weliswaar genoemd als een alternatieve therapie voor de behandeling van borstkanker10., maar wordt in dit onderzoek gebruikt als anti-oestrogeen om het effect van oestrogeen, dat niet door eierstokken maar op andere plekken in het lichaam van de muis wordt geproduceerd, op de groei van de tumor te testen (To test the hypothesis that growth of the FGF-transfected cells in ovariectomized or tamoxifen-treated nude mice is due to increased sensitivity to the small amounts of estrogens still present in ovariectomized nude mice, we tested the ability of a pure antiestrogen, ICI 182,780, and two aromatase inhibitors, 4-0HA and letrozole, to inhibit the estrogen-independent tumor growth produced by these FGF-transfected cell lines).11.Behandeling met ICI 182,780 leidde daarbij niet tot verminderde tumorgroei. McLeskey komt aldus tot de conclusie dat de tumorgroei niet wordt veroorzaakt door oestrogeen dat buiten de eierstokken wordt geproduceerd.12.
6.6.
Een therapeutisch effect van ICI 182,780 (de castorolie-formulering) bij de behandeling van een benigne of maligne ziekte (volgens partijen moet hieronder worden verstaan: kanker) van de borst of voorplantingstractus is uit McLeskey niet af te leiden. Eerder volgt daaruit dat ICI 182,780 in zoverre geen therapeutisch effect heeft. De voorzieningenrechter is er vooralsnog niet van overtuigd dat de gemiddelde vakman (hierna: de vakman) de effectiviteit van de castorolie-formulering bij de behandeling van kanker plausibel zou achten op grond van de uterustest, waarmee anti-oestrogene activiteit wordt getest. Sandoz stelt dat deze test voor de vakman de oestrogeen-remmende activiteit van de gebruikte formulering aantoont, maar dat de vakman op grond van de test de therapeutische werking tegen kanker plausibel zou achten wordt door AstraZeneca bestreden en is door Sandoz niet aannemelijk gemaakt13., zodat daar niet van uit kan worden gegaan.
6.7.
Voorts blijkt niet dat de door McLeskey gebruikte castorolie-formulering is aangepast om een therapeutisch significante bloedplasmaconcentratie aan fulvestrant gedurende ten minste twee weken te verkrijgen. Voor zover al iets met betrekking tot de sustained release-eigenschappen van de castorolie-formulering uit McLeskey kan worden afgeleid, wijst dit in een andere richting. In de door McLeskey uitgevoerde test werden de muizen namelijk wekelijks ingespoten met ICI 182,780. Volgens Sandoz zal de vakman op grond van zijn algemene vakkennis verwachten dat de castorolie-formulering van McLeskey effectief zal zijn voor het verkrijgen van een therapeutisch significante bloedplasmaconcentratie aan fulvestrant gedurende ten minste twee weken. Waarom zijn vakkennis de vakman tot die verwachting zou brengen heeft Sandoz echter niet duidelijk gemaakt.
6.8.
Gezien al het voorgaande moet vooralsnog worden geoordeeld dat McLeskey niet nieuwheidsschadelijk is voor het octrooi.
Inventiviteit
6.9.
Partijen zijn het erover eens dat een formulering van uitsluitend fulvestrant in castorolie zoals geopenbaard in Howell niet kan worden toegepast en dat de door Howell gebruikte formulering nog andere excipiënten moet bevatten. Uitgaande van Howell en gezien de verschillen met de materie van conclusie 1 van het octrooi, kan het door Sandoz geformuleerde objectieve technische probleem worden gevolgd.14.
6.10.
De vraag is allereerst of de vakman – volgens Sandoz bestaande uit een team van een oncoloog en een formuleerder, eventueel aangevuld met een farmacoloog – bij een literatuuronderzoek op McLeskey zou stuiten nu het daarin gerapporteerde onderzoek niet gericht is op het gebruik van fulvestrant, formuleringen van fulvestrant of formuleringen van wat dan ook, maar op mechanismen die leiden tot tamoxifen-resistentie. Het door Sandoz overgelegde verslag van een gesimuleerd literatuuronderzoek in de database Medline overtuigt voorshands niet. Dat onderzoek brengt weliswaar McLeskey in beeld als een van de, naar zes teruggebrachte zoekresultaten, maar daarbij speelt mogelijk een rol dat het aanzienlijk makkelijker zoekt naar datgene wat al gevonden is. Gezien het onderwerp van McLeskey, waarin de castorolie-formulering (naast de formulering op basis van pindaolie) wordt gebruikt als anti-oestrogeen en slechts terloops aan de orde wordt gesteld, niet in de samenvatting of de introductie maar uitsluitend in de tekst zelf, acht de voorzieningenrechter voorts, evenals de oppositieafdeling, twijfelachtig of de vakman beide documenten zou combineren.
6.11.
Zo de vakman Howell en McLeskey zou combineren, zou dat nog niet tot de maatregelen van conclusie 1 leiden. De vakman zou verder onderzoek moeten doen, in ieder geval om vast te stellen of de castorolie-formulering van McLeskey het gewenste therapeutische effect heeft bij intramusculaire toediening bij mensen. Sandoz stelt met verwijzing naar de verklaring van de deskundige dr. H. Vromans dat hij daarbij een redelijke verwachting van succes heeft. Die verklaring vermeldt op dit punt over de in McLeskey gebruikte castorolie-formulering het volgende:
‘65.
This preformulated formulation supplied vy Zeneca would have been of great interest to any formulator, for the following reasons:
- a)
The formulation has the desired concentration of fulvestrant;
- b)
The formulation is a castor oil-based vehicle, just as the formulation administered to breast cancer patients in the Howell study;
- c)
The formulation was supplied preformulated, which indicates that the formulation is used or supplied in some frequency;
- d)
The formulation was supplied by an employee of Zeneca, the company that was developing fulvestrant;
- e)
The formulation appears to have been thoroughly elaborated with regard to the specific relative concentration of the substances used;
- f)
The combination of the excipients ethanol, benzyl benzoate and benzyl alcohol was well known and was used in (castor) oil based parenteral formulation for human patients already for quite some time.’
‘66.
I would have assumed that this was a formulation designed for human use that McLeskey happened to use in mice in her research. I would actually have assumed that the formulation was in fact the formulation that was administered to patients in the Howell study. After all, the amount of fulvestrant in the formulation, 50 mg/ml, is exactly the same amount as the amount in the formulation used in breast cancer patients in the Howell study.’
6.12.
De verklaring bespreekt vervolgens een aantal omstandigheden die mogelijk afbreuk zouden doen aan de succesverwachting van de vakman om te concluderen, zakelijk weergegeven, dat die omstandigheden de succesverwachting niet negatief beïnvloeden. De door AstraZeneca geconsulteerde deskundigen dr. K. Schaupp en prof. D.J.A. Crommelin menen daarentegen dat bij de vakman geen succesverwachting zou bestaan.
6.13.
In de opvatting van de deskundige Vromans lijkt vooral van belang dat hij ervan uit gaat dat de vakman zou veronderstellen dat de door McLeskey gebruikte formulering dezelfde is als die in het onderzoek van Howell is gebruikt. Het gaat er echter om of de vakman op grond van zijn technische kennis reden had te verwachten dat hij de anti-oestrogene castorolie-formulering van McLeskey met succes zou kunnen gebruiken voor de gewenste toepassing tegen kanker. Die verwachting zou de vakman moeten baseren op de hiervoor onder a, b en f genoemde omstandigheden.
6.14.
Hoewel de voorzieningenrechter wil aannemen dat, indien de vakman met de castorolie-formulering van McLeskey zou zijn geconfronteerd, zijn interesse zou zijn gewekt, overtuigt de door Sandoz overgelegde verklaring van de deskundige Vromans op dit punt vooralsnog niet. Met name de navolgende door de deskundigen van AstraZeneca genoemde en door Sandoz niet weersproken omstandigheden doen twijfel ontstaan over de succesverwachting van de vakman.
6.15.
De vakman was ermee bekend dat in onderzoeken als dat van McLeskey formuleringen gebruikt kunnen worden die uitsluitend zijn bestemd voor dierproeven, zoals de door McLeskey gebruikte tamoxifen-pellets die bij de muis onder de huid dienden te worden aangebracht. De vakman dient er aldus rekening mee te houden dat de door McLeskey gebruikte castorolie-formulering niet zonder meer geschikt is voor toepassing bij mensen bij de behandeling van kanker, te meer omdat het onderzoek van McLeskey daar niet op is gericht. Dat volgt ook daaruit dat de door McLeskey gebruikte dosering fulvestrant in verhouding tot het gewicht van de muis vele malen (een factor 70) hoger is dan de door Howell in zijn onderzoek bij mensen gebruikte dosering. Sandoz heeft voorts beaamd dat de castorolie-formulering van McLeskey een ongebruikelijke hoge concentratie alcoholen bevat (10% ethanol en 10% benzylalcohol). Volgens de deskundige van Sandoz is deze concentratie niet zodanig toxisch dat de vakman om die reden zou menen dat de formulering niet bij mensen gebruikt kan worden, maar zijn verwachting op succes zou daardoor zeker naar beneden worden bijgesteld.
6.16.
Gezien het voorgaande bestaat teveel twijfel dat de materie van conclusie 1 van het octrooi in een bodemprocedure niet-inventief zal worden geoordeeld, wanneer wordt uitgegaan van Howell als meest nabije stand van de techniek, in combinatie met McLeskey.
6.17.
De voorzieningenrechter acht voorts, evenals de oppositieafdeling, McLeskey een verder verwijderd uitgangspunt omdat, zoals hiervoor overwogen, dit onderzoek op een geheel ander doel is gericht dan het octrooi. McLeskey openbaart niet het therapeutisch effect van de als anti-oestrogeen gebruikte castorolie-formulering bij de behandeling van kanker. Indien de vakman, die naar een (verdere) therapeutische toepassing zoekt, er al toe zou komen Howell te raadplegen kan, zoals hiervoor overwogen, voorshands niet worden geoordeeld dat bij hem een redelijke verwachting bestaat dat hij de anti-oestrogene castorolie-formulering van McLeskey met succes zou kunnen gebruiken voor de behandeling van (borst)kanker.
Nawerkbaarheid
6.18.
De nawerkbaarheid van het octrooi behoeft niet te worden onderzocht omdat aan de aan dit bezwaar door Sandoz gestelde voorwaarde niet is voldaan.
Conclusie
6.19.
Nu Sandoz niet bestrijdt dat inbreuk dreigt op, in ieder geval, conclusie 1 van het octrooi en vooralsnog onvoldoende aanleiding bestaat te veronderstellen dat het octrooi in een bodemprocedure zal worden vernietigd, dient het in conventie gevorderde verbod te worden toegewezen.
6.20.
Van enige (dreigende) onrechtmatige betrokkenheid bij inbreuk of indirecte inbreuk is niet gebleken, zodat het verbod als hierna vermeld wordt beperkt. Sandoz heeft voorts bestreden dat AstraZeneca spoedeisend belang heeft bij het gevorderde onder 3, 4 en 5 omdat zij, Sandoz, tot op heden geen voorbehouden handelingen heeft verricht. AstraZeneca heeft de spoedeisendheid daarop niet nader toegelicht, zodat deze vorderingen worden afgewezen.
6.21.
Ter voorkoming van executiegeschillen wordt de gevorderde dwangsom anders bepaald dan gevorderd.
6.22.
Partijen hebben een afspraak gemaakt over de proceskosten (€ 175.000,- waarvan 5% toe te rekenen aan het geschil in reconventie). De proceskosten zullen in overeenstemming met deze afspraak worden vastgesteld en ten laste worden gebracht van Sandoz als voornamelijk in het ongelijk gestelde partij.
6.23.
Daargelaten de geldigheid of nietigheid van EP 1 669 073 en NL 1017075 is het in reconventie gevorderde, gelet op het voorlopige oordeel in conventie over de geldigheid van EP 138, niet toewijsbaar. AstraZeneca kan namelijk niet worden verboden in ieder geval EP 138 tegen fulvestrant Sandoz in te zetten. De vorderingen in reconventie moeten derhalve worden afgewezen met veroordeling van Sandoz als de in het ongelijk gestelde partij in de proceskosten.
7. De beslissing in conventie
De voorzieningenrechter:
7.1.
verbiedt Sandoz om inbreuk te maken op het Nederlandse deel van Europees Octrooi EP 1 250 138 B2, onder meer door het in het verkeer brengen, verkopen, afleveren of anderszins verhandelen, of voor dit een en ander aan te bieden, van generieke "Fulvestrant Sandoz 50 mg/ml, oplossing voor injectie in een voorgevulde spuit";
7.2.
gebiedt Sandoz om "Fulvestrant Sandoz 50 mg/ml, oplossing voor injectie in een voorgevulde spuit" geregistreerd onder de nummer RVG 115994 per de eerstvolgende keer dat dit redelijkerwijze mogelijk is uit de G-Standaard te (laten) verwijderen;
7.3.
beveelt Sandoz bij overtreding van het sub 7.1 bedoelde verbod of bij niet nakoming van het sub 7.2 bedoelde gebod aan AstraZeneca een dwangsom te betalen van € 25.000,- per betrokken product of, zulks ter keuze van AstraZeneca, per dag, een gedeelte van een dag voor een gehele gerekend, dat de overtreding voortduurt, met een maximum van € 10.000.000,-;
7.4.
veroordeelt Sandoz in de proceskosten, met inbegrip van de kosten van het geding met betrekking tot de provisionele voorziening, tot aan dit vonnis aan de zijde van AstraZeneca begroot op € 166.250,-;
7.5.
verklaart dit vonnis tot zover uitvoerbaar bij voorraad;
7.6.
wijst af het meer of anders gevorderde;
7.7.
stelt de termijn als bedoeld in artikel 1019i Rv op zes maanden na heden;
8. De beslissing in reconventie
De voorzieningenrechter:
8.1.
wijst het gevorderde af;
8.2.
veroordeelt Sandoz in de proceskosten, tot dit vonnis aan de zijde van AstraZeneca begroot op € 8.750,-;
8.3.
verklaart de proceskostenveroordeling uitvoerbaar bij voorraad.
Dit vonnis is gewezen door mr. P.G.J. de Heij en in het openbaar uitgesproken op 27 juli 2016.
Voetnoten
Voetnoten Uitspraak 27‑07‑2016
Naar de rechtbank begrijpt een ricinoleaat.
intramusculair
Sandoz vermeldt in haar pleitnota – naar de voorzieningenrechter aanneemt bij vergissing ‘voor’ in plaats van ‘van’.
Bij pleidooi heeft Sandoz nog een alternatief probleem genoemd: het vinden van een intramusculaire toepassing van fulvestrant.
Rijksoctrooiwet 1995
Verordening (EU) 1215/2012 van het Europees Parlement en de Raad van 12 december 2012 betreffende de rechterlijke bevoegdheid, de erkenning en de tenuitvoerlegging van beslissingen in burgerlijke en handelszaken
Naar de rechtbank uit het vervolg van het artikel afleidt zal hier bedoeld zijn IA; zie de voorlaatste alinea op pagina 700.
pleitnota randnummer 44
pagina 697, rechter kolom
pagina 700, rechter kolom
pagina 701, voorlaatste alinea
De door Sandoz overgelegde verklaring van haar deskundige Dr. H. Vromans zwijgt hierover.
Anders dan de oppositieafdeling en de Duitse rechter wordt hier dus niet uitgegaan van een gewenste alternatieve formulering maar van überhaupt een formulering van fulvestrant.