Verordening (EU) 1215/2012 van het Europees Parlement en de Raad van 12 december 2012 betreffende de rechterlijke bevoegdheid, de erkenning en de tenuitvoerlegging van beslissingen in burgerlijke en handelszaken
Rb. Den Haag, 11-05-2016, nr. C/09/508351 / KG ZA 16-404
ECLI:NL:RBDHA:2016:5093
- Instantie
Rechtbank Den Haag
- Datum
11-05-2016
- Zaaknummer
C/09/508351 / KG ZA 16-404
- Vakgebied(en)
Intellectuele-eigendomsrecht (V)
- Brondocumenten en formele relaties
ECLI:NL:RBDHA:2016:5093, Uitspraak, Rechtbank Den Haag, 11‑05‑2016
Uitspraak 11‑05‑2016
Inhoudsindicatie
Kort geding; Intellectueel eigendomsrecht, octrooi, inbreukverbod afgewezen, aangezien naar voorlopig oordeel sprake is van gerede twijfel over de geldigheid van het ingeroepen octrooi.
Partij(en)
vonnis
RECHTBANK DEN HAAG
Team handel
zaaknummer / rolnummer: C/09/508351 / KG ZA 16-404
Vonnis in kort geding van 11 mei 2016
in de zaak van
de vennootschap naar vreemd recht
LEO PHARMA A/S,
gevestigd te Bellerup (Denemarken),
eiseres,
advocaat mr. A.E. Heezius te Amsterdam,
tegen
de besloten vennootschap met beperkte aansprakelijkheid
SANDOZ B.V.,
gevestigd te Weesp,
gedaagde,
advocaat mr. D.F. de Lange te Amsterdam.
Partijen zullen hierna Leo Pharma en Sandoz genoemd worden.
Voor Sandoz is de zaak mede behandeld door mr. ir. R. Broekstra, advocaat te Amsterdam.
1. De procedure
1.1.
Het verloop van de procedure blijkt uit:
- -
de dagvaarding van 5 april 2016, met producties 1 tot en met 15;
- -
de op 15 april 2016 ingekomen conclusie van antwoord, met producties 1 tot en met 22;
- -
de op 15 april 2016 om 18:39 uur per e-mail ingekomen akte van Sandoz, met productie 23;
- -
de e-mail van 18 april 2016 van Sandoz met daarin een aanvulling op productie 21;
- -
de op 19 april 2016 ingekomen brief van Sandoz met daarbij een bijlage (een CV) bij productie 21;
- -
het op 19 april 2016 ingekomen (aanvullende) proceskostenoverzicht van Leo Pharma, tevens aankondiging van een bezwaar tegen productie 23 van Sandoz;
- -
het ook op 19 april 2016 ingekomen (aanvullende) proceskostenoverzicht van Sandoz;
- -
de eveneens op 19 april 2016 (om 14:51 uur) ingekomen e-mail van Sandoz met daarin een reactie op het bezwaar van Leo Pharma tegen productie 23, met daarbij twee bijlagen bij die productie 23;
- -
de mondelinge behandeling gehouden op 20 april 2016;
- -
de pleitnota van Leo Pharma;
- -
de pleitnota’s van Sandoz.
1.2.
Ter zitting heeft de advocaat van Leo Pharma bezwaar gemaakt tegen overlegging van productie 23 van Sandoz (een verklaring van dr. Luzar), aangezien deze in strijd met de door de voorzieningenrechter vastgestelde voorwaarden niet vóór vrijdag 15 april 2016 12:00 uur was ingediend. De advocaat van Leo Pharma heeft gesteld dat zij mede gelet op de specialistische inhoud van productie 23 niet in staat was om binnen twee werkdagen adequaat op deze productie te reageren, mede omdat zij daarover geen overleg meer kon voeren met de juiste personen binnen Leo Pharma. De advocaat van Sandoz heeft daartegenover aangevoerd dat het kort geding op korte termijn was bepaald en dat hij niet op kortere termijn een statisticus heeft kunnen vinden. Daarbij is dr. Luzar gevoed door informatie waarover Leo Pharma reeds in het kader van het in deze procedure betrokken octrooi beschikte, zodat Leo Pharma geacht moet worden hierop te kunnen reageren, aldus Sandoz. Hierop heeft de voorzieningenrechter beslist dat productie 23 wordt toegelaten, aangezien de gestelde termijn slechts met enkele uren is overschreden, zodat ook de belangen van Leo Pharma maar in beperkte mate zijn geschaad. Bij deze beslissing heeft de voorzieningenrechter mede in aanmerking genomen dat dit een kort geding betreft dat op korte termijn is gepland en dat de periode tussen vrijdagavond/maandagochtend en woensdagmiddag voldoende moet worden geacht om inhoudelijk op de betreffende productie te kunnen reageren, hetgeen Leo Pharma overigens ook heeft gedaan. De op 19 april 2016 in de namiddag toegezonden bijlagen bij productie 23 (die volgens Sandoz overigens enkel bedoeld waren ter verduidelijking van productie 23) worden evenwel niet toegestaan, aangezien deze minder dan 24 uur voor de zitting zijn ingediend.
1.3.
Vonnis is bepaald op heden.
2. De feiten
2.1.
Leo Pharma is een wereldwijd opererende geneesmiddelenproducent. Zij brengt onder meer geneesmiddelen op de markt voor de uitwendige behandeling van psoriasis met daarin calcipotriol als actief bestanddeel. Psoriasis is een ziekte waarbij cellen in de huid te snel worden aangemaakt, waardoor rode plekken en schilfers ontstaan. Een van de door Leo Pharma in Nederland op de markt gebrachte geneesmiddelen is Dovobet, een zalf van een combinatie van de actieve bestanddelen calcipotriol en betamethason (in de vorm van het diproprionaat-zout) en een oplosmiddel (Arlamol-E).
2.2.
Sandoz is onderdeel van de Novartis-groep en producent van generieke geneesmiddelen in Nederland.
2.3.
Leo Pharma is houdster van het Europese octrooi EP 2 455 083 B1 (hierna EP 083 of het octrooi). Dit octrooi is getiteld “Pharmaceutical composition for dermal use comprising calcipotriol and betamethasone”. Het octrooi is verleend op 18 september 2013 op een aanvrage daartoe van 27 januari 2000, onder inroeping van prioriteit van 23 april 1999 op basis van nationale Deense aanvrage met nummer DK 56199 (hierna: DK 561). Het octrooi heeft onder meer gelding in Nederland. De conclusies luiden in de oorspronkelijke Engelse taal als volgt:
1. A non-aqueous topical pharmaceutical composition in the form of an ointment, a cream, a lotion, a liniment or other spreadable liquid or semi-liquid preparation for dermal use in the treatment of psoriasis, sebopsoriasis or seborrheic dermatitis in humans and other mammals, said composition comprising a first pharmacologically active component A consisting of calcipotriol and a second pharmacologically active component B consisting of betamethasone or an ester thereof and at least one pharmaceutically acceptable carrier, solvent, or diluent.
2. A pharmaceutical composition for use according to claim 1, wherein component B consists of a betamethasone ester, such as the 17-valerate or 17,21-dipropionate.
3. A pharmaceutical composition for use according to any one of the preceding claims in the form of a mono-phase composition.
4. A pharmaceutical composition for use according to the preceding claim which is an ointment.
5. A pharmaceutical composition for use according to claim 1 characterised in that the difference between the optimum stability pH of said first component A and the optimum pH of said second component B is at least 1 further comprising at least one solvent component C selected from the group consisting of:
(i) compounds of the general formula R3(OCH2C(R1)H)xOR2 (I) wherein x is in the range of 2-60, R1 in each of the x units independently is CH3, R2 is straight chain or branched C1-20 alkyl or benzoyl, and R3 is H or phenylcarbonyloxy;
(ii) di-(straight or branched)-C4-10 alkyl esters of C4-C8 dicarboxylic acids;
(iii) straight or branched C12-18-alkyl benzoates;
(iv) straight or branched C2-4-alkyl esters of straight or branched C10-18-alkanoic or alkenoic acids;
(v) propylenglycol diesters with C8-14-alkanoic acids; and
(vi) branched primary C18-24 alkanols.
6. A composition for use according to the preceding claim, wherein said component C is selected from compounds of the general formula H(OCH2C(R1)H)xOR2 (II) where R1, x, and R2 are as defined in claim 5, and mixtures thereof.
7. A composition for use according to claim 6, wherein said component C is polyoxypropylene-15-stearyl ether.
8. A pharmaceutical composition for use according to claim 5, containing 0.0001 to 0.025% w/w of said component A, 0.005 to 0.1% w/w of said component B, and 1 to 20% w/w of said solvent component C.
9. A pharmaceutical composition for use according to claim 1, wherein, in the treatment, the composition is applied topically once or twice daily in a medically sufficient dosage.
De conclusies luiden in de niet-bestreden Nederlandse vertaling als volgt:
1. Niet-waterig topisch farmaceutisch preparaat in de vorm van een zalf, een crème, een lotion, een smeersel of ander smeerbaar vloeibaar of half-vloeibaar preparaat voor
dermaal gebruik bij de behandeling van psoriasis, sebopsoriasis of seborroïsche dermatitis bij mensen en andere zoogdieren, welk preparaat omvat een eerste farmacologisch actieve component A bestaande uit calcipotriol en een tweede farmacologisch actieve component B bestaande uit betamethason of een ester daarvan en ten minste één farmaceutisch aanvaardbare drager, oplosmiddel of verdunningsmiddel.
2. Farmaceutisch preparaat voor gebruik volgens conclusie 1, waarbij component B bestaat uit een betamethasonester, zoals het 17-valeraat of 17,21-dipropionaat.
3. Farmaceutisch preparaat voor gebruik volgens één van de voorgaande conclusies in de vorm van een monofasepreparaat.
4. Farmaceutisch preparaat voor gebruik volgens de voorgaande conclusie, dat een zalf is.
5. Farmaceutisch preparaat voor gebruik volgens conclusie 1, met het kenmerk dat het verschil tussen de pH voor optimale stabiliteit van de eerste component A en de optimale pH van de tweede component B ten minste 1 is, verder omvattende ten minste één oplosmiddelcomponent C gekozen uit de groep bestaande uit:
(i) verbindingen met de algemene formule R3 (OCH2C(R1)H)xOR2 (I) waarin x ligt in het traject van 2-60, R1 in elk van de x eenheden onafhankelijk CH3 is, R2 recht of vertakt C1-20 -alkyl of benzoyl is, en R3 H of fenylcarbonyloxy is;
(ii) di- (recht of vertakt) -C4-10-alkylesters van C4-C8dicarbonzuren;
(iii) rechte of vertakte C12-18-alkylbenzoaten;
(iv) rechte of vertakte C2-4 -alkylesters van rechte of vertakte C10-18-alkaan- of alkeenzuren;
(v) propyleenglycoldiesters met C8-14 alkaanzuren; en
(vi) vertakte primaire C18-24 alkanolen.
6. Preparaat voor gebruik volgens de voorgaande conclusie, waarbij de component C gekozen is uit verbindingen met de algemene formule H(OCH2C(R1 )H)xOR2 (II) waarin R1, x en R2 zijn zoals gedefinieerd in conclusie 5, en mengsels daarvan.
7. Preparaat voor gebruik volgens conclusie 6, waarbij de component C polyoxypro-pyleen-15-stearylether is.
8. Farmaceutisch preparaat voor gebruik volgens conclusie 5, dat 0,0001 tot 0,025% w/w van de component A, 0,005 tot 0,1% w/w van de component B en 1 tot 20% w/w van de oplosmiddelcomponent C bevat.
9. Farmaceutisch preparaat voor gebruik volgens conclusie 1, waarbij het preparaat bij de behandeling één of twee maal per dag in een medisch voldoende dosering wordt
aangebracht.”
2.4.
De beschrijving van EP 083 bevat onder meer de navolgende passages:
“[0002] In the treatment of a number of conditions using dermal application, e.g. in the treatment of psoriasis, it is often indicated to employ a combination treatment incorporating two or even more different pharmacologically active compounds. Thus, in the treatment of e.g. psoriasis, it is common to use a combination treatment involving a steroid compound, such as a corticosteroid compound, and a vitamin D analogue such as calcipotriol, and where each of the active compounds are formulated in separate preparations.
[0003] Clinical studies have been conducted in psoriasis patients wherein calcipotriol was administered in the morning and betamethasone dipropionate or valerate in the evening. Combination therapy was more effective than monotherapy. (…)
[0004] Until now a topical pharmaceutical composition comprising a combination of a vitamin D analogue and a topical steroid has not been described. Moreover, these two types of compounds often have optimum stability values of pH that differ significantly from one another making it non-obvious to attempt to prepare a topical pharmaceutical preparation containing a steroid compound together with a vitamin D analogue. (…)
[0005] The following example describes the difficulties encountered when the skilled person wishes to prepare a combination composition for topical use comprising both a vitamin D or a vitamin D analogue or derivative and a topical steroid: The vitamin D analogue calcipotriol, as well as other examples of vitamin D analogues, requires a pH value above 8 for maximum stability, whereas corticosteroids such as Betamethasone (9- fluoro-11, 17, 21-trihydroxy- 16- methylpregna- 1, 4- diene- 3, 20- dione) require pH values in the range of 4- 6 for maximum stability. Since the base auxiliary materials and additives traditionally used in preparing topical formulations, such as creams and/or ointments, involve having some kind of acid or alkaline nature or reaction ability, it has therefore hitherto not been possible to combine the two active compounds in one single formulation while maintaining good stability of the active compounds.
[0006] Consequently, physicians have had to resort to letting patients under this type of two- component regimen perform sequential application of two creams/ointments, each containing one of the compounds formulated at its maximum stability pH. This may lead to incompatibility of the preparations so that patients must, e.g., apply one cream/ointment in the morning and the other in the evening. Needless to say, patient compliance as well as correct administration dosage is a problem under such circumstances. Richards, H.L. et al. report in J Am Acad Dermatol 1999 Oct; 41(4):581-3 on a study of patients with psoriasis and their compliance with medication. They report that poor compliance with treatment advice in chronic conditions, such as psoriasis, represents a major challenge to health care professionals: Thirty-nine percent of participants reported that they did not comply with the treatment regimen recommended. The noncompliant group had a higher self-rated severity of psoriasis, were younger, and had a younger age at onset than those who were compliant. The noncompliant group reported that psoriasis had a greater impact on daily life.
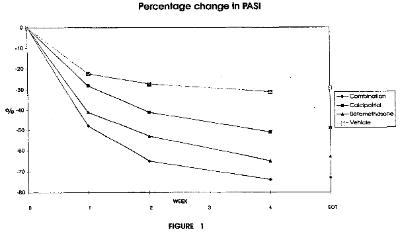
(…)
[0012] Fig. 1 is a graphic illustration of the percentage change in PASI score obtained during 4 weeks of clinical trial where the efficacy of a preparation according to the invention containing calcipotriol hydrate (52.2μ.g/g) and betamethasone dipropionate (0.643mg/g) is compared to that of a preparation in the same vehicle containing only calcipotriol hydrate (52.2μg/g) and a preparation in the same vehicle of betamethasone dipropionate (0.643mg/g). Fig. 1 shows an efficacy of the preparation of the invention which by far exceeds the efficacy obtainable by the two single component preparations. The change in PASI score reflects in the group of patients treated with the preparation of the invention a success of treatment of psoriasis hitherto unattainable by treatment with commercial preparations containing either calcipotriol or betamethasone, or by alternating treatment with such commercial preparations (cf.) thus proving the advantage of having the two active components present in the same preparation. (EOT=end of treatment).
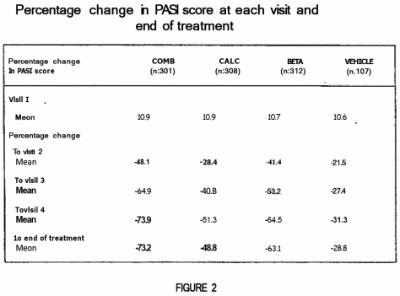
Fig. 2 is a table showing the figures for percentage change in PASI score at each visit and end of treatment for the same clinical trial as described for Fig. 1. (…)
(…)
[0022] The composition of the invention, which combines a vitamin D analogue and a topical steroid, provides synergy in the form of additional benefit to the patient apart from the direct therapeutic value of the active substances. It has been shown that the skin irritative side effects of a vitamin D analogue, such as calcipotriol, is alleviated by the simultaneous application of a steroid, such as betamethasone, onto psoriatic skin, an effect that is only attainable using a two- component or multi- component treatment regimen where a vitamin D analogue and a steroid cannot be applied simultaneously to affected skin due to incompatibility of the praparations. When both a vitamin D analogue and a topical steroid are used in a combination treatment of psoriasis it has hitherto been necessary to use separate applications, typically one in the morning and the other in the evening, making it impossible to obtain any synergistic effect of the two types of active compounds (cf. Ortonne, J.P., Nouv. Dermatol., 1994, 13 (10), p. 746- 751), or where a certain degree of synergistic effect, such as less skin irritation, has been reported for a two- component regiment (cf. Kragballe, K. et al. Br J Dermatol 1998 Oct; 139 (4): 649- 54, and Ruzicka, T. et Lorenz, B. Br J Dermatol 1998, 138 (2), 254- 58) a substantial proportion of psoriasis patients will not benefit due to non- compliance with the treatment regimen.”
2.5.
EP 083 bevat onder meer de navolgende figuren 1 en 2:
2.6.
EP 083 is verleend naar aanleiding van een afgesplitste aanvrage van EP 1 178 808 (hierna: EP 808 of het oplosmiddelenoctrooi) dat is verleend op 30 mei 2012. EP 808 ziet op een ‘Non-aqueous pharmaceutical composition for dermal use to treat psoriasis comprising a vitamin D, a corticosteroid and a solvent component’.
Na een tegen EP 808 gevoerde oppositieprocedure heeft de oppositieafdeling van het Europees Octrooibureau (OD) het octrooi in stand gehouden conform het eerste hulpverzoek, waarbij de definitie van het oplosmiddel is beperkt tot Arlamol-E. De OD overwoog onder meer als volgt:
(3.3.2)
“The selection of the solvent component C as defined in claim 1 (dit is dezelfde oplosmiddelcomponent C als in conclusie 5 van EP 083, vzr) of the contested patent is however obvious in view of the teaching of D12 in combination with D20a for solving the problem posed. In D20a, the skilled person finds a clear indication to use the compounds C(ii), (iv) and (v), in particular isopropyl myristate, for dissolving calcipotriol in non-aqueous formulations in order to provide stable formulations of the vitamin D analogue with a lipophilic base. lsopropyl myristate belongs to the group of compound C(iv) of claim 1 as granted and is used in all the examples of D20a.
Compound C of claim 1 comprises six large groups of solvents, each belonging to a different group of compounds. Even if experimental data have been provided for embodiments falling within the groups of compound C(i),(ii),(iv),(v) and (vi) to show that the problem has been solved, the skilled person would have been prompted to try, according to the teaching of D20a, any of the proposed solvents falling within the definition of compound C(ii), (iv) and (v) and to select the preferred isopropyl myristate as solvent for providing a stable composition comprising components A and B with a reasonable expectation of success and without the involvement of an inventive merit.
Thus, the requirements of art. 56 EPC of claim 1 of the MR are not fulfilled.”
En voorts ten aanzien van het eerste hulpverzoek met beperking tot Arlamol-E:
(4.2.2.2)
“It is common general knowledge that combining corticosteroids and vitamin D analogues in a single formulation for treating psoriasis provides better patient compliance and results in less side effects (in D11 and in D60, page 132). Moreover, it is known that calcipotriol is instable in acidic media (D20a and D12). In D20a, it is further suggested to formulate the instable vitamin D analogue in a hydrophobic or anhydrous solvent selected from fatty acid esters, higher alcohols and propylene carbonate and a lipophilic base such as white petrolatum or a mixture of white petrolatum and liquid paraffin (claim 1 of 020a). The examples show stable non-aqueous ointments using isopropyl myristate as solvent.”
Tegen dit besluit heeft Leo Pharma alsmede een aantal opposanten beroep ingesteld. Op dit beroep is nog niet beslist.
2.7.
De aanvragen voor zowel EP 083 als EP 808 zijn gebaseerd op de aanvrage WO 00/64450 (hierna WO 450). Conclusie 1 van WO 450 luidt als volgt:
“1. A pharmaceutical composition for dermal use, said composition comprising a first pharmacologically active component A consisting of at least one vitamin D or vitamin D analogue and a second pharmacologically active component B consisting of at least one corticosteroid.”
In volgconclusie 6 van WO 450 wordt component A beperkt tot calcipotriol (of het hydraat), in volgconclusie 7 wordt voor component B onder meer betamethason genoemd. In conclusie 18 van WO 450 worden ter stabilisatie dezelfde 6 groepen oplosmiddel C genoemd als in conclusie 5 van EP 083. WO 450 bevatte net als het octrooi figuur 1 met de resultaten van een vergelijkend onderzoek en dezelfde toelichting op figuur 1 als in [00012] van het octrooi.
2.8.
In DK 561, ingediend op 23 april 1999 en aangeduid in EP 083 als het prioriteitsdocument, wordt een oplossing geclaimd voor het stabiliteitsprobleem dat optreedt bij het maken van een gecombineerde toepassing van een vitamine D-analoog en een corticosteroïde. DK 561 verschaft in conclusie 1 een niet-waterige samenstelling met voormelde bestanddelen (A en B) en ten minste één oplosmiddel uit een zestal aangewezen klassen (C, zie wederom conclusie 5 van EP 083). In de volgconclusies worden specifiek calcipotriol en betamethason genoemd. DK 561 bevatte geen figuur 1 met de resultaten van een vergelijkend onderzoek en evenmin de toelichting als bedoeld in [0012] van het octrooi. Conclusie 1 van DK 561 luidt als volgt:
“1. A non-aqueous pharmaceutical composition for dermal use, said composition
comprising
a first pharmacologically active component A consisting of at least one vitamin D analogue;
a second pharmacologically active component B consisting of at least one
corticosteroid,
the difference between the optimum stability pH of a first pharmacologically active compound A and the optimum stability pH of a second pharmacologically active
component B being at least 1; and
at least one solvent component t selected from the group consisting of:
(i) compounds of the general formula R3(OCH2C(R1)H)xOR2 (I) wherein x is in the range of 2-60, R1 in each of the x units independently is CH3, R2 is straight chain or branched C1-20 alkyl or benzoyl, and R3 is H or phenylcarbonyloxy;
(ii) di-(straight or branched)-C4-10 alkyl esters of C4-C8 dicarboxylic acids;
(iii) straight or branched C12-18-alkyl benzoates;
(iv) straight or branched C2-4-alkyl esters of straight or branched C10-18-alkanoic or alkenoic acids;
(v) propylenglycol diesters with C8-14-alkanoic acids; and
(vi) branched primary C18-24 alkanols.”
2.9.
Tegen EP 083 is oppositie ingesteld bij het EOB. Op 13/15 april 2016 is Sandoz in deze procedure tussengekomen. In de oppositieprocedure is door de OD een hoorzitting gepland op 7 juli 2016. In haar voorlopige opinie van 2 december 2015 heeft de OD partijen ten behoeve van de hoorzitting gewezen op de aan inventiviteitsbezwaren te stellen eisen en het aanhoudingsverzoek van Leo Pharma in verband met de beslissing van de Grote Kamer van Beroep op G1/15 (toxic divisional). Daarnaast schrijft de oppositieafdeling met betrekking tot de ingeroepen prioriteit het volgende:
“the priority document of the parent application (DKA 56 199) [ vzr: DK 561] (…) would not appear to anticipate the subject-matter of claims 1-9 since there is no disclosure of the specific formulations claimed in connection with the specific use for the treatment of psoriasis, sebo-psoriasis in the passages cited by O1 and O3 (…) in that document.”
2.2.
Voor de maand april 2016 heeft Sandoz haar generieke geneesmiddel “Calcipotriol/Betamethason Sandoz 50 microgram/g + 0,5 mg/g, zalf” voor de behandeling van psoriasis doen opnemen in de G-standaard. Dit product bevat een ander oplosmiddel dan Arlamol-E, namelijk oleyl alcohol.
2.11.
Bij brief van 17 maart 2016 heeft Leo Pharma Sandoz erop gewezen dat voormeld product inbreuk maakt op EP 083. Hierop heeft Sandoz bij brief van 22 maart 2016 aan Leo Pharma geantwoord dat zij het standpunt inneemt dat EP 083 in Nederland nietig is en dat, ook indien de nietigheid van EP 083 zou worden geheeld, haar product daarop geen inbreuk maakt.
2.12.
Bij akte ingeschreven op 5 april 2016 heeft Leo Pharma gedeeltelijk afstand gedaan van het Nederlandse deel van het octrooi. Hierbij is conclusie 2 van het octrooi beperkt tot betamethason diproprionaat. Conclusie 2 luidt thans als volgt:
“2 . Farmaceutisch preparaat voor gebruik volgens conclusie 1, waarbij component B bestaat uit de 17,21- dipropionaatester van betamethason.”
2.13.
De in paragraaf [0022] van de beschrijving en in deze procedure aangehaalde publicaties luiden – voor zover hier van belang – als hieronder opgenomen.
2.13.1.
Met betrekking tot de mogelijkheid van het combineren van calcipotriol met andere bestanddelen is in de aangehaalde publicaties het volgende opgenomen:
Patel et al.: (juni 1998)
“Specifically, hydrocortisone-17-valerate 0,2% ointment, 12% ammonium lactate lotion and 6% salicylic acid can result in its degradation. Refrigeration may slow the degradation of calcipotriene but does not prevent it completely.”
Lebwohl: (1997)
“In combining calcipotriene with other agents, it should be stressed that both medications should be applied at different times. If calcipotriene is mixed with other agents, the two must be proven to be compatible because calcipotriene is easily inactivated.”
Kragballe (1995):
“Because calcipotriol, like other D3 vitamins, requires a relatively high pH to be stable, the topical calcipotriol formulations in general should not be mixed with other drugs or vehicles.”
2.13.2.
In de publicatie van Ruzicka et al. (1998) wordt een studie beschreven, waarbij calcipotriol monotherapie is vergeleken met een combinatiebehandeling met calcipotriol en betamethason valeraat. Deze publicatie bevat de navolgende passages:
“The combination therapy was more effective, as assessed by all evaluated variables; moreover, patients showing insufficient response to calcipotriol alone after 2 weeks showed a regression of psoriatic lesions using the combination regimen. Thus, the combination of calcipotriol and topical steroids is recommended as the therapy of first choice for patients who do not respond well to treatment with 2 weeks of calcipotriol alone. Furthermore, this combination reduces the hazards associated with the long-term use of topical corticosteroids (atrophy and rebound) as well as the irritation associated with calcipotriol”.
(…)
“As calcipotriol and betamethasone valerate work by interacting with different receptor subtypes (vitamin D or glucocorticoid receptors), an additive or synergistic effect could theoretically be expected. Therefore, the combination of topical calcipotriol and betamethasone valerate was assessed to determine whether there is such an effect in those patients who do not respond to calcipotriol alone. The results clearly show that the combination of both drugs leads to an additive
clinical effect in terms of reduced psoriatic symptoms.”
2.13.3.
In de publicatie van Ortonne et al. (1994) wordt een studie beschreven waarin alternerende monotherapie (calcipotriol-zalf in de morgen en betamethason diproprionaat-zalf in de avond versus calcipotriol-zalf in de morgen en de avond) van psoriasis is onderzocht. In deze publicaties is met betrekking tot de tijdens de betreffende studie waargenomen therapietrouw in de Franse tekst en de Engelse vertaling het volgende opgenomen:
“Observance thérapeutique:
Pour l’ensemble des patients, il n'a pas été observé d'écarts au schéma thérapeutique. Aucune différence n’a été mise en évidence entre les groupes en ce qui concerne le nombre de grammes de pommade utilisés. En aucun cas, leur utilisation n’a dépassé 100g par semaine.”
Medical Adherence:
“All patients adhered to the treatment regimen, with no deviations in the study protocol. There was no statistical difference highlighted between the two groups with regard to the number of grams of ointment used. There were no instances where their use exceeded 100 g per week.”
2.13.4.
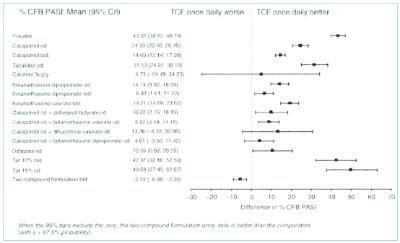
In 2011 heeft Van de Kerkhof et al. (2011) de resultaten van een literatuurstudie gepubliceerd, waarbij de effectiviteit van verschillende behandelingen van psoriasis met elkaar zijn vergeleken. Hierbij staat de afkorting PASI voor ‘Psoriasis Area and Severity Index’, waarbij de index de omvang en de ernst van de ziekte aangeeft. TCF (‘Two-Compound Formulation’) staat voor de combinatiebehandeling van calcipotriol met betamethason. Deze publicatie bevat onder meer figuur 6 met bijbehorende passage (van belang is vooral het lijntje bij “calcipotriol od + betamethasone dipropionate od”):

2.14.
Tussen partijen is een bodemprocedure aanhangig inzake een ander geschil met betrekking tot een calcipotriol (het monohydraat) gerelateerd octrooi. In deze bodemprocedure (hierna: de schadeprocedure) vordert Sandoz van Leo Pharma een schadevergoeding van € 8.864.479,63 voor een in 2009 ten uitvoer gelegd en in 2013 vernietigd inbreukverbod. Aan deze vordering heeft Sandoz onder meer ten grondslag gelegd dat zij pas in januari 2020 met een calcipotriolhoudend combinatieproduct op de markt kan komen. Zij stelt onder meer (in par. 37 dagvaarding van 26 juni 2015):
“De eerstvolgende gelegenheid voor Sandoz om toe te treden tot de calcipotriolmarkt dient zich aan wanneer Leo’s octrooi op combinatieproducten verloopt, in januari 2020. Op dat moment kan Sandoz een generiek combinatieproduct introduceren waar nog een markt voor bestaat, aangezien Leo met deze producten nog wel op de markt is”. […] De periode waarin Sandoz schade lijdt eindigt op 31 december 2019 […].”
2.15.
De Engelse delen van EP 808 en EP 083 zijn onderwerp geweest van een procedure in het Verenigd Koninkrijk tussen Teva en Leo Pharma. In de procedure in eerste aanleg heeft Justice Birss bij vonnis van 6 oktober 2014 geoordeeld dat beide octrooien nietig zijn wegens gebrek aan inventiviteit. Op 28 juli 2015 is in hoger beroep het vonnis van Justice Birss vernietigd. Conclusie 1 van EP 083 werd in die procedure door Leo Pharma slechts verdedigd in beperkte zin tot tevens bevattende de component C volgens een subgroep van (i).
2.16.
Sandoz heeft haar generieke calcipotriol/betamethasonproduct inmiddels in Nederland op de markt gebracht.
3. Het geschil
3.1.
Leo Pharma vordert, bij vonnis uitvoerbaar bij voorraad, dat de voorzieningenrechter:
I. Sandoz verbiedt om inbreuk te maken op het octrooi EP 2 455 083 B1, in het bijzonder door middel van Calcipotriol/Betamethason Sandoz 50 microgram/g + 0,5 mg/g, zalf, op straffe van een onmiddellijk opeisbare dwangsom van € 500.000 voor iedere overtreding van dit verbod, te vermeerderen met een dwangsom van € 50.000 voor iedere dag of gedeelte van een dag dat de overtreding voortduurt, met een maximum van € 5.000.000 per gebeurtenis;
II. Sandoz gebiedt om, binnen vier (4) weken na betekening van het in dezen te wijzen vonnis, een door een register accountant gecontroleerde opgaaf te doen aan de advocaat van Leo Pharma, van alle bedrijven en/of personen aan wie zij inbreuk makende producten Calcipotriol/Betamethason Sandoz 50 microgram/g + 0,5 mg/g, zalf, heeft verkocht en/of geleverd, met een specificatie van de ontvangen inkomsten en de hiermee gemaakte winst, een en ander op straffe van een door Sandoz te verbeuren onmiddellijk opeisbare dwangsom van € 50.000 voor iedere overtreding van dit gebod, te vermeerderen met een dwangsom van € 10.000 voor iedere dag of gedeelte van een dag dat de overtreding voortduurt, met een maximum van € 100.000 per gebeurtenis;
III. Sandoz gebiedt om, binnen één (1) dag na betekening van het in dezen te wijzen vonnis, een rectificatietekst te versturen en daarmee alle inbreukmakende producten terug te roepen, met uitsluitend de navolgende inhoud (of een andere, door de voorzieningenrechter in goede justitie te bepalen tekst), afgedrukt op het briefpapier van Sandoz in de gebruikelijke huisstijl, zonder verdere toevoegingen, aan alle bedrijven en/of personen aan wie zij de onderhavige producten Calcipotriol/Betamethason Sandoz 50 microgram/g + 0,5 mg/g, zalf heeft verkocht en/of offertes heeft gedaan, ter attentie van hun directie, een en ander op straffe van een door Sandoz te verbeuren onmiddellijk opeisbare dwangsom van € 50.000 voor iedere overtreding van dit gebod, te vermeerderen met een dwangsom van € 10.000 voor iedere dag of gedeelte van een dag dat deze overtreding voortduurt; alsmede om het bewijs van verzenden tegelijk aan de advocaat van Leo Pharma over te leggen, op straffe van een door Sandoz te verbeuren onmiddellijk opeisbare dwangsom van € 10.000 voor de overtreding van dit laatste gebod; tezamen met een maximum van € 150.000 per gebeurtenis:
“[datum]
DRINGEND!
Geachte heer, mevrouw,
De voorzieningenrechter van de rechtbank Den Haag heeft in diens vonnis van [datum] geoordeeld dat wij inbreuk hebben gemaakt op het octrooi EP 2 455 083 B1 van de firma LEO Pharma, onder andere door het aan uw bedrijf aanbieden en/of leveren van Calcipotriol/Betamethason Sandoz 50 microgram/g + 0,5 mg/g, zalf. Wij zijn veroordeeld om deze inbreuk met onmiddellijke ingang te staken en de genoemde producten terug te roepen. Wij zullen u volledig schadeloosstellen.
Sandoz B.V.
De Directie”
IV. Sandoz veroordeelt in de redelijke en evenredige proceskosten van deze procedure op grond van 1019h Rv, een en ander te vermeerderen met de wettelijke rente vanaf 14 dagen, althans vanaf een door de Voorzieningenrechter redelijk geachte termijn, na het te dezen te wijzen vonnis, indien en voor zover Sandoz deze kosten niet voordien heeft voldaan;
V. Sandoz veroordeelt in de nakosten ten bedrage van respectievelijk € 131 zonder betekening en € 199 met betekening, laatstbedoeld bedrag te vermeerderen met de wettelijke rente indien en voor zover Sandoz dit niet binnen (de wettelijk vereiste termijn van) twee dagen, althans binnen een door de rechtbank redelijk geachte termijn na betekening van het in dezen te wijzen vonnis, heeft voldaan.
3.2.
Aan deze vordering legt Leo Pharma het volgende ten grondslag.
EP 083 ziet op een specifiek farmaceutisch product met verbeterde therapeutische werking.
Het objectieve technische probleem dat met dit octrooi wordt opgelost is “het verschaffen van een farmaceutische samenstelling voor toepassing op de huid, die therapeutisch verbeterde (o.a. effectievere) behandeling van psoriasis biedt.” De verbeterde werking is gelegen in het synergetisch effect van het combinatieproduct en niet (alleen) in de (door het product) verbeterde therapietrouw. Deze verbeterde werking is in het octrooi plausibel gemaakt door de vergelijking met de alternerende monotherapie (figuur 1). Na de aanvraagdatum is dit verbeterde effect bovendien verder aannemelijk gemaakt, zoals ook blijkt uit de studie van Van de Kerkhof, waaruit volgt dat er 85% kans is dat de combinatietherapie (ook) beter werkt dan alternerende monotherapie.
De combinatie van calcipotriol en betamethason in één zalf was niet voor de hand liggend, aangezien de gemiddelde vakman (een dermatoloog) juist tegen combinatie werd gewaarschuwd. Er was dus geen “reasonable expectation of succes”. Verder is het octrooi geldig en kan WO 450 niet als fictieve stand van de techniek in de beoordeling betrokken worden.
Met de verhandeling van haar generieke product maakt Sandoz inbreuk op conclusie (1 en) 2 van EP 083. Nu Sandoz inmiddels met haar generieke product op de (Nederlandse) markt is gekomen, heeft Leo Pharma een spoedeisend belang bij de toewijzing van haar vorderingen.
Een en ander klemt temeer nu Sandoz zich in de schadeprocedure nadrukkelijk op het standpunt heeft gesteld dat zij pas in januari 2020 (dus na expiratie van EP 083) opnieuw met een calcipotriolhoudend product op de Nederlandse markt kan komen. Zij heeft daarmee de geldigheid van en inbreuk op EP 083 erkend.
3.3.
Sandoz voert de volgende verweren.
3.3.1.
Conclusie 1 en de andere door Leo Pharma ingeroepen conclusies van EP 083 zijn nietig. Nu Leo Pharma het stabiliteitsprobleem heeft verlaten, beroept zij zich nog enkel op een combinatieproduct dat een verbeterd effect zou hebben. Dat therapietrouw verbetert door een combinatieproduct was evenwel algemeen bekend. Dit effect is (in ieder geval deels) te herleiden tot een (te verwachten) verbeterde therapietrouw.
3.3.2.
Het door Leo Pharma ingeroepen synergetisch effect kan hoogstens een bonuseffect zijn van een niet-inventieve maatregel en het wordt bovendien niet in de oorspronkelijke stukken noch in het octrooi plausibel gemaakt. De studie van Van de Kerkhof is van 11 jaar na de relevante data en mag niet meetellen om het geclaimde effect te onderbouwen. Het verbeterde/synergetische effect kan daar overigens evenmin uit worden afgeleid. Niet alleen kan Van de Kerkhof de oorzaak van een eventuele verbetering niet koppelen aan een synergetisch effect, het is niet eens zeker dat er een verbetering is en de mate van die eventuele verbetering is ook nog eens gering. Dit volgt uit de verklaring van dr. Luzar.
3.3.3.
Subsidiair merkt Sandoz op dat de gevorderde recall dient te worden afgewezen, aangezien voor een dergelijke maatregel de medewerking van derde partijen noodzakelijk is. Voorts is de gevorderde dwangsom excessief en vordert Sandoz dat, indien een inbreukverbod wordt opgelegd, daaraan de voorwaarde wordt verbonden dat Leo Pharma dan (kennelijk op de voet van artikel 233 Wetboek van Burgerlijke Rechtsvordering (Rv)) zekerheid stelt voor een bedrag van € 150.000,- per maand.
3.4.
Op de stellingen van partijen wordt hierna, voor zover van belang, nader ingegaan.
4. De beoordeling
Bevoegdheid
4.1.
De voorzieningenrechter van deze rechtbank is bevoegd op grond van het bepaalde in artikel 4, 24, 26 en/of 35 EEX-II verordening1.en artikel 80 lid 2 onder a Rijksoctrooiwet 1995. De bevoegdheid is niet bestreden.
Geldigheid EP 083
4.2.
De voorzieningenrechter is voorshands van oordeel dat aan gerede twijfel onderhevig is of EP 083 een in te stellen bodemprocedure dan wel de reeds ingestelde oppositieprocedure zal overleven. Hiertoe is het volgende redengevend.
Inventiviteit
4.3.
De voorzieningenrechter zal de problem-solution approach toepassen. Als met Leo Pharma uitgegaan wordt van Ortonne (zie r.o. 2.13.3) als meest nabije stand van de techniek, is als verschilmaatregel te definiëren dat in plaats van beurtelings een zalf met calcipotriol of met betamethasondipropionaat in de morgen of avond ter behandeling van psoriasis toe te passen thans beide stoffen in één niet-waterige zalf/product zijn verwerkt. Het technische effect van die maatregel is dat de therapietrouw wordt verbeterd.
4.4.
Leo Pharma heeft aangevoerd dat er tevens een synergetisch effect is dat bijdraagt aan het technische effect en aldus aan de inventiviteit van het octrooi. Die stelling wordt voorshands verworpen. Volgens (inmiddels) vaste jurisprudentie van deze rechtbank en hof is immers dan wel benodigd dat dit synergetische effect in het octrooi (of beter: in de (prioriteits)aanvrage) plausibel of aannemelijk is gemaakt.2.Daarvan is evenwel geen spoor. Leo Pharma wijst op figuren 1 en 2 bij het octrooi maar daarin is slechts het effect van de beide respectievelijke monotherapieën afgezet tegen het combinatieproduct. Er valt zodoende niet uit af te leiden dat het combinatieproduct een betere PASI score heeft dan de alternerende behandeling zoals in paragrafen [0012] en [0022] van het octrooi wel gesuggereerd wordt. Aangezien het synergetische effect niet in het octrooi (of de aanvrage) plausibel is gemaakt, kan de studie van Van de Kerkhof (zie r.o. 2.13.4) niet mee worden gewogen. Zou dit immers wel zo zijn, dan zou de octrooihouder een ongerechtvaardigd voordeel krijgen door zich te beroepen op een (ruim) na de relevante data gepubliceerde studie voor zijn op speculatie gebaseerde stelling (in paragraaf [0012] en [0022]) dat er een synergetisch effect is bij het combinatieproduct.
4.5.
Zelfs echter als de studie van Van de Kerkhof wel in de beoordeling zou kunnen worden betrokken, valt daaruit niet met voldoende zekerheid enig synergetische effect af te leiden. De voorzieningenrechter stelt voorop dat Van de Kerhof die conclusie niet trekt uit de door hem bestudeerde publicaties. Op basis van een vergelijking van de voorhanden zijnde cijfers uit een aantal studies stelt Van de Kerkhof dat er 85-93% kans is dat het combinatiepreparaat een verbeterde PASI-score heeft dan de alternerende behandeling. Niet alleen wijst Sandoz er terecht op dat er dan nog steeds een (weliswaar niet heel grote maar toch nog) behoorlijke kans is dat het combinatiepreparaat geen verbeterde PASI-score heeft. Het staat evenmin vast dat dit aan een synergetisch effect is te wijten. Terecht noemt Sandoz dat een verbeterde therapietrouw, die inherent is aan een combinatiepreparaat, even goed of zelfs waarschijnlijker de oorzaak van de door Van de Kerkhof waargenomen verbeterde PASI-score kan zijn. Uit de hierboven in r.o. 2.13.3 opgenomen opmerkingen in Ortonne (één van de door Van de Kerkhof in zijn onderzoek betrokken studies) kan met onvoldoende zekerheid worden afgeleid dat de therapietrouw bij die studie inderdaad 100% was, zeker indien in acht wordt genomen de opmerking in het octrooi [0006] dat 39% van de patiënten bij chronische aandoeningen als psoriasis de behandeling ontrouw is. Bovendien zeggen de opmerkingen in Ortonne nog niets over hoe de therapietrouw in de andere door Van de Kerkhof meegewogen studies was. Hierbij komt dat de door Van de Kerkhof gesignaleerde verbeterde werking gemiddeld uitkwam op 4% (mediaan van -3.5-11.42%). Dat is slechts een zeer beperkte toename. Om dan therapietrouw als oorzaak statistisch uit te sluiten dient daarop duidelijk in de onderzoeken gerapporteerd te zijn, hetgeen niet is gebeurd, ook niet in Ortonne waar kennelijk enkel de gebruikte tubes gewogen zijn. Een klein beetje toegenomen therapietrouw kan immers al een toename van (slechts) 4% verklaren.
4.6.
Uitgaande derhalve van voormelde verschilmaatregel met het technische effect van verbeterde therapietrouw, is het aan het octrooi ten grondslag te leggen probleem: hoe kan de therapietrouw verbeterd worden van (met name: psoriasis)patiënten die de morgen-avond behandeling volgen van alternerend calcipotriol- en betamethason(dipropionaat)-zalf. Ten eerste zij opgemerkt dat Leo Pharma’s betoog dat de gemiddelde vakman slechts de kennis van een arts bezit moet worden gepasseerd. Dat betoog is gebaseerd op de verworpen stelling dat er een synergetisch effect zou zijn. De gemiddelde vakman moet daarom tevens deskundigheid op formuleringsgebied worden toegeschreven, zoals door Sandoz bepleit en overigens gebruikelijk als er op zoek wordt gegaan naar een nieuwe formulering (om therapietrouw te verbeteren). Terecht heeft Sandoz aangevoerd dat de oplossing van conclusie 1 (en 2) van EP 083 om beide producten in één zalf te brengen voor die gemiddelde vakman voor de hand lag. Het is volgens de OD zelfs algemene vakkennis (zie het tweede citaat in r.o. 2.62.6). De niet onderbouwde stelling van Leo Pharma dat een formuleringsdeskundige niet geïnteresseerd zou zijn in klinische studies met bestaande geneesmiddelen, kan niet worden gevolgd. Het gaat immers om verbetering van de therapietrouw waarbij bekend was dat er mogelijk stabiliteitsproblemen zouden zijn bij de formulering van de monopreparaten in een combinatiepreparaat.
4.7.
Leo Pharma werpt hier nog tegenin dat sprake zou zijn van een vooroordeel omdat de twee ingrediënten calcipotriol en betamethason(dipropionaat) incompatibel zijn vanwege hun afwijkende optimale pH voor stabiliteit. Zij wijst daarbij op de opmerkingen in publicaties als hiervoor opgenomen in r.o. 2.13.1. Ten eerste staat in die publicaties niet dat het combineren van beide producten niet kan maar slechts dat er bij combinatie goed naar de stabiliteit moet worden gekeken. Ten tweede zijn opmerkingen in slechts drie publicaties voorshands onvoldoende om de hoge bewijsdrempel te halen die is te leggen aan een vooroordeel (zie r.o. 4.3.2 rechtbank Den Haag 4 juni 2008, Actavis/Novartis (fluvastatine), BIE 2009, 67 ECLI:NL:RBSGR:2008:BL0145). Ten derde is uit de uitspraak van de OD inzake EP 808 (zie het eerste citaat in r.o. 2.62.6) af te leiden dat het vinden van een geschikt oplosmiddel om calcipotriol en betamethason in één zalf samen te brengen niet op een inventieve gedachte berust. De voorzieningenrechter laat nog daar dat conclusie 1 en 2 van EP 083 geen oplosmiddel voorschrijven en de daarom te stellen vraag of die conclusies dan wel inventiviteit kunnen ontlenen aan de manier waarop het vooroordeel is overwonnen (en over de hele breedte van de claim nawerkbaar zijn, ook voor preparaten die niet de in het octrooi bedoelde oplosmiddelcomponent C bevatten maar een andere).
4.8.
Leo Pharma heeft niets gesteld tegenover de gemotiveerde stelling van Sandoz dat de voorts nog ingeroepen conclusies 3, 4 en 9 geen inventieve maatregelen toevoegen, zodat deze evenmin een basis voor een verbod kunnen vormen.
Nieuwheid/prioriteit
4.9.
Voorts is voor het voorlopig oordeel tot afwijzing van de vordering van belang dat er de nodige twijfel is of de ingeroepen conclusies 1 en 2 van het octrooi prioriteit kunnen baseren op DK 561 en of WO 450 dan de nieuwheid van die conclusies wegneemt.
4.10.
Het argument van Sandoz is als volgt:
- -
conclusie 1 (en 2) van EP 083 kunnen geen prioriteit ontlenen aan DK 561 omdat volgens (conclusie 1 van) DK 561 toepassing van een oplosmiddel C (gekozen uit de specifieke groepen i-vi) noodzakelijk is voor de stabiliteit van het combinatiepreparaat.
- -
WO 450 openbaart onder meer in voorbeeld 1 een combinatiepreparaat met Arlamol-E.
- -
Voorbeeld 1 is tevens opgenomen in DK 561 zodat WO 450 voor de materie geopenbaard in dat voorbeeld wel prioriteit toekomt.
- -
Aangezien WO 450 tevens heeft gediend ter aanvrage van EP 808, is het voor EP 083 als fictieve stand van de techniek te beschouwen in de zin van 54 lid 3 EOV waar het voorbeeld 1 betreft.
- -
Voorbeeld 1 van WO 450 neemt daarmee de nieuwheid van conclusies 1 en 2 weg, nu dat combinatiepreparaat valt onder deze bredere conclusies.
4.11.
De voorzieningenrechter overweegt dat Leo Pharma niet inhoudelijk heeft bestreden dat EP 083 geen beroep op prioriteit toekomt ofschoon Sandoz dit onderbouwd heeft gesteld door verwijzing naar onder meer de in de Guidelines van het EOB wel gehanteerde drie-stappen-toets (oplosmiddel C is als essentieel en “indispensable” gepresenteerd) voor het weglaten van een kenmerk. De vragen of WO 450 vervolgens als fictieve stand van de techniek is te kenschetsen en of dit kan worden gerepareerd door een partiële prioriteit te erkennen, liggen (in een andere zaak) voor bij de Grote Kamer van het EOB (G 1/15). Het is bekend dat TKB’s hier verschillend over hebben geoordeeld. Voor de hier aan de orde zijnde zogenaamde generieke “OR” claims (conclusies 1 en 2 omvatten immers alle denkbare stoffen als oplosmiddel C, zelfs helemaal geen, en zijn zodoende als generiek te beschouwen ten opzichte van de conclusies met het oplosmiddel C), is bij de TKB’s vooralsnog geen consensus. Naar aanleiding van de proviso in r.o. 6.7 van G 2/98 (“provided it gives rise to the claiming of a limited number of clearly defined alternative subject-matters”) is er in een aanzienlijk aantal TKB-uitspraken een tamelijk letterlijke aanpak toegepast. Opsplitsing van de conclusie in enerzijds alles met het gedefinieerde oplosmiddel C (dat wel prioriteit kan claimen en zo nieuw is) en anderzijds alles zonder oplosmiddel C (dat geen prioriteit heeft maar waarvoor voorbeeld 1 ook niet nieuwheidschadend is) is volgens die uitspraken geen oplossing. In een minderheid van de TKB uitspraken op dit punt is een meer conceptuele aanpak aangenomen, waarin voornoemde opsplitsing met gedeeltelijke prioriteit wel een oplossing zou zijn. Het laatste woord is hier nog niet over gezegd (ter zitting is er door Leo Pharma ook na vragen erg weinig aandacht aan besteed) maar het behoeft weinig betoog dat deze problematiek bijdraagt aan de kans dat conclusies 1 en 2 (en de andere ingeroepen conclusies) van het octrooi niet zullen overleven in oppositie of in een bodemprocedure.
Erkenning Sandoz
4.12.
De voorzieningenrechter vermag uit de opmerking die Leo Pharma van de schadeprocedure heeft geciteerd (zie r.o. 2.14) niet af te leiden dat Sandoz de geldigheid van en de inbreuk op EP 083 heeft erkend. Dat staat er niet. Bovendien zou, gesteld dat Leo Pharma in deze procedure gelijk zou hebben gekregen en inderdaad tot geldigheid en inbreuk zou zijn geconcludeerd, de in de opmerking te lezen vrees van Sandoz bewaarheid zijn geworden. Hierbij komt dat deze opmerking niet los kan worden gezien van de zaak waarin deze is gemaakt, namelijk ter vergoeding van de schade wegens onrechtmatige executie van een later vernietigd vonnis. Het ging in die zaak om een ander octrooi (op calcipotriol monohydraat) en het is niet onlogisch dat Sandoz in dat kader geen uitputtend onderzoek naar de geldigheid van en inbreuk op EP 083 heeft gedaan. Het is niet juist aan die uitlating thans de zeer vergaande conclusie te verbinden dat Sandoz het recht wordt ontzegd zich nog op ongeldigheid van het octrooi kunnen beroepen, zeker als – zo blijkt uit het voorgaande – dit argument in deze zaak doel treft.
Slotsom en proceskosten
4.13.
De vorderingen zullen worden afgewezen omdat er een gerede kans is dat de ingeroepen conclusies van het octrooi geen stand zullen houden. Leo Pharma zal als de in het ongelijk gestelde partij worden veroordeeld in de kosten van deze procedure. Sandoz maakt aanspraak op vergoeding van haar volledige proceskosten overeenkomstig artikel 1019h Rv en zij heeft specificaties van haar kosten (inclusief verschotten en exclusief BTW) ten bedrage van in het totaal € 121.658,99 overgelegd. Ter zitting hebben partijen met het oog op de conclusie van de Advocaat-Generaal bij het HvJ EU in de zaak United Videos Properties/Telenet NV3.desgevraagd verklaard dat zij beide toepassing van artikel 1019h Rv wensen op de wijze die thans hier te lande gebruikelijk is.
4.14.
Leo Pharma heeft bezwaar gemaakt tegen de hoogte van de door Sandoz opgegeven kosten. Zij heeft daartoe betoogd dat € 30.000,- aan kosten gemaakt tussen januari 2016 en 17 maart 2016 (de verzending van de waarschuwingsbrief van Leo Pharma) die gespecificeerd zijn als ‘pre-lauch documents’ buiten beschouwing moeten worden gelaten omdat deze niet zijn aan te merken als kosten in verband met dit kort geding en dat het voorts ook onduidelijk is welke werkzaamheden het betreft. Hierop heeft Sandoz verklaard dat de betreffende werkzaamheden wel betrekking hebben op dit kort geding maar dat zij vanwege geheimhouding hierover niet meer kan verklaren.
4.15.
De door Leo Pharma betwiste kosten ten bedrage van € 30.000,- zien op werkzaamheden met betrekking tot ‘pre launch documents’ die ruim voor het aanbrengen van dit kort geding zijn uitgevoerd, zodat deze niet zonder meer zijn aan te merken als kosten die in het kader van de onderhavige procedure zijn gemaakt. Hoewel dat vervolgens wél op haar weg lag, heeft Sandoz niet aannemelijk gemaakt dat deze kosten voor vergoeding in dit kort geding in aanmerking komen. De voorzieningenrechter zal de kosten aan de zijde van Sandoz daarom (inclusief verschotten en exclusief BTW) begroten op € 91.658,99.
5. De beslissing
De voorzieningenrechter:
5.1.
wijst de vorderingen af;
5.2.
veroordeelt Leo Pharma in de proceskosten, tot dusver aan de zijde van Sandoz begroot op € 91.658,99;
5.3.
verklaart de proceskostenveroordeling uitvoerbaar bij voorraad.
Dit vonnis is gewezen door mr. E.F. Brinkman en in het openbaar uitgesproken op 11 mei 2016.
Voetnoten
Voetnoten Uitspraak 11‑05‑2016
Zie onder meer rechtbank Den Haag 17 januari 2007, ECLI:NL:RBSGR:2007:BB2074 (Angiotech/Conor), r.o. 4.17; Hof Den Haag, 27 januari 2015, ECLI:NL:GHDHA:2015:1769 (Novartis/Sun), r.o. 4.1; Hof Den Haag 2 november 2010, ECLI:NL:GHSGR:2010:BO4380 (Glaxo/Pharmachemie), r.o. 28-31; rechtbank Den Haag 2 oktober 2013, ECLI:NL:RBDHA:2013:15067 (irbesartan/HCTZ), r.o. 4.6
A-G HvJ EU 5 april 2016, zaak C‑57/15, ECLI:EU:C:2016:201