In de zin van Verordening (EG) nr. 469/2009 van het Europees Parlement en de Raad van 6 mei 2009 betreffende het aanvullende beschermingscertificaat voor geneesmiddelen (hierna: ABC-verordening).
Rb. Utrecht, 15-08-2012, nr. 324094 / KG ZA 12-319
ECLI:NL:RBUTR:2012:7331
- Instantie
Rechtbank Utrecht
- Datum
15-08-2012
- Zaaknummer
324094 / KG ZA 12-319
- Vakgebied(en)
Civiel recht algemeen (V)
- Brondocumenten en formele relaties
ECLI:NL:RBUTR:2012:7331, Uitspraak, Rechtbank Utrecht, 15‑08‑2012
Uitspraak 15‑08‑2012
Inhoudsindicatie
IE-zaak
Partij(en)
vonnis
RECHTBANK UTRECHT
Sector civiel recht
zaaknummer / rolnummer Utrecht: 324094 / KG ZA 12-319
zaaknummer / rolnummer ’s-Gravenhage: 420290 / KG ZA 12-559
Vonnis in kort geding van 15 augustus 2012
in de zaak van
de vennootschap naar vreemd recht
BOEHRINGER INGELHEIM PHARMA GMBH & CO.KG,
gevestigd te Ingelheim am Rhein , Duitsland,
eiseres,
advocaat: mr. J.J. Allen te Amsterdam,
tegen
1. de besloten vennootschap met beperkte aansprakelijkheid TEVA PHARMA B.V.,
gevestigd te Utrecht,
2. de besloten vennootschap met beperkte aansprakelijkheidTEVA PHARMACEUTICALS EUROPE B.V.,
gevestigd te Utrecht,
3. de besloten vennootschap met beperkte aansprakelijkheid PHARMACHEMIE B.V.,
gevestigd te Haarlem,
gedaagden,
advocaat: mr. L.L. Huisman te ‘s-Gravenhage.
Eiseres zal hierna worden aangeduid als BI DE. Gedaagden zullen afzonderlijk Teva Pharma NL, Teva Europe en Pharmachemie worden genoemd. Gezamenlijk zullen zij worden aangeduid als Teva c.s. Voor BI DE is opgetreden de advocaat voornoemd en mr. ir. P. van Dongen, advocaat te Amsterdam, met bijstand van drs. [A] , Europees octrooigemachtigde. Teva c.s. is bijgestaan door de advocaat voornoemd alsmede door mr. M.A.A. van [B] , advocaat te ’s-Gravenhage, met bijstand vandr. ir. H. Prins, Europees octrooigemachtigde.
1. De procedure
1.1.
Het verloop van de procedure blijkt uit:
1. de dagvaarding van 15 mei 2012;
2. de akte houdende overlegging van producties zijdens BI DE met de producties 1 t/m 13;
3. de akte houdende overlegging van producties zijdens Teva c.s. met de producties A t/m H;
4. de akte houdende overlegging van reactieve producties zijdens BI DE met de producties 14 t/m 16;
5. de akte houdende overlegging van reactieve producties zijdens Teva c.s. met de producties I en J;
6. de akte houdende overlegging van nadere reactieve producties zijdens BI DE met de producties 17 en 18;
7. de opgaven en specificaties van de proceskosten door partijen (door BI DE overgelegd als productie 19).
1.2.
De mondelinge behandeling was oorspronkelijk gepland voor 6 juni 2012 in een van de lokalen van het gerechtsgebouw te Utrecht. Na overleg met partijen is ingestemd met de behandeling van de zaak door een rechter-plaatsvervanger van de rechtbank Utrecht in een van de lokalen van het paleis van justitie te’s-Gravenhage op 6 juli 2012. De advocaten hebben pleitnotities gehanteerd, waarbij door Teva c.s. nog een tweetal producties zijn overgelegd waartegen BI DE geen bezwaar heeft gemaakt.
1.3.
BI DE heeft ter zitting haar eis gewijzigd en een op schrift gesteld exemplaar van het petitum overhandigd. Tegen deze eiswijziging is door Teva c.s. bezwaar gemaakt.
1.4.
Na verder debat heeft de voorzieningenrechter partijen in de gelegenheid gesteld zich bij akte uit te laten over het door het Hof van Justitie van de Europese Unie op 12 juli 2012 gewezen arrest in de zaak Solvay SA v. Honeywell c.s. (C-616/10). De aktes zijn genomen op 19 juli 2012.
1.5.
Bij e-mail van 23 juli 2012 is namens mr. Huisman voornoemd verzocht de akte zijdens BI DE te weigeren nu die, in weerwil van de op de zitting gegeven instructies, is aangegrepen om na te pleiten. BI DE heeft op deze e-mail niet gereageerd.
1.6.
Het vonnis is nader bepaald op heden.
2. De feiten
2.1.
De Boehringer Ingelheim -groep is een internationaal farmaceutisch bedrijf dat zich bezighoudt met onderzoek en ontwikkeling, productie en verhandeling van geneesmiddelen. BI DE is één van de tot die groep behorende ondernemingen.
2.2.
BI DE was, naast Boehringer Ingelheim Pharmaceuticals , Inc (hierna: BI US), mede-houdster van Europees octrooi EP 0 429 987 (hierna: EP 987) betrekking hebbende op ‘5, 11-Dihydro-6H-dipyrido[3,2-b:2’, 3’-e] [1,4]diazepines and their use in the prevention or treatment of HIV infection’. EP 987 is verleend op 17 maart 1999 op een aanvrage daartoe van 16 november 1990, onder inroeping van prioriteit van 17 november 1989, 6 september 1990, en 19 oktober 1990 op basis van respectievelijk US 438,923, US 579,001 en US 600,390. De nationale delen van EP 987 zijn vervallen wegens de afloop van de maximale beschermingsduur.
2.3.
BI DE is, samen met BI US, mede-houdster van het Portugese nationale octrooi PT 95919 (hierna: PT 919 of het octrooi), dat een zusteroctrooi is van EP 987. PT 919 heeft betrekking op een ‘processo para a preparação de 5,11-dihydro-6H-dipirido [3,2-b:2’,3’-e][1,4]diazepinas e de composições farmacêuticas que os contêm’. PT 919 is op een aanvrage daartoe van 16 november 1990 verleend op 22 oktober 1997 en is geldig tot 22 oktober 2012. Het roept prioriteit in van 28 juni 1989 op basis van US 372,974.
2.4.
PT 919 telt 5 conclusies, waarvan de conclusies 1 en 5 onafhankelijk zijn. De conclusies luiden in de niet bestreden Engelse vertaling als volgt:
1. Process for the preparation of a compound with formula I
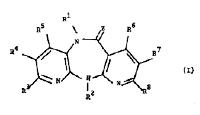
wherein,
Z is oxygen, sulfur, =NCN, or a group with the formula =NOR9, wherein R9 is
alkyl with 1 to 3 carbon atoms;
R1 is hydrogen, alkyl with 1 to 6 carbon atoms, fluoroalkyl with 1 to 6 carbon
atoms and 1 to 3 fluorine atoms, cycloalkyl with 3 to 6 carbon atoms, alkenyl or
alkynyl with 2 to 6 carbon atoms, 2-halo-2-propen-1-yl, mono- or di-halovinyl, aryl
or arylmethyl (wherein the aryl moiety is phenyl, thienyl or furanyl, which is either
unsubstituted or substituted with methyl, methoxy or halogen), alkanoyl with 2 to
4 carbon atoms, aminoethyl, mono- or dialkylaminoethyl wherein each alkyl
moiety contains 1 to 2 carbon atoms, alkyloxyalkyl or alkylthioalkyl with 2 to 4
carbon atoms, alkyloxycarbonyl wherein the alkyl moiety contains 1 to 4 carbon
atoms, alkenyloxy- or alkynyloxycarbonyl wherein each alkenyl or alkynyl moiety
contains 2 to 4 carbon atoms, hydroxy, alkyloxy with 1 to 4 carbon atoms, amino,
mono- or di-alkylamino wherein each alkyl moiety contains 1 to 4 carbon atoms,
aminocarbonylmethyl, or cyanoalkyl wherein the alkyl moiety contains 1 to 4
carbon atoms;
R2 is hydrogen (with the proviso that R1 is not hydrogen), alkyl with 1 to 6 carbon
atoms, fluoroalkyl with 1 to 6 carbon atoms and 1 to 3 fluorine atoms, cycloalkyl
with 3 to 6 carbon atoms, oxethanyl, thiethanyl, tetrahydrofuranyl or
tetrahydrothienyl, alkenyl or alkynyl with 2 to 6 carbon atoms, alkyloxyalkyl or
alkylthioalkyl with 2 to 5 carbon atoms, alkanoyl with 2 to 5 carbon atoms, cyano,
hydroxyalkyl with 2 to 6 carbon atoms, aryl or arylmethyl (wherein the aryl moiety
is phenyl, thienyl or furanyl, which is either unsubstituted or substituted by alkyl
or alkyloxy with 1 to 3 carbon atoms, hydroxyl or halogen), or
alkyloxycarbonylmethyl wherein the alkyl moiety contains 1 to 5 carbon atoms;
and
one of R3, R4 and R5 is alkyl with 1 to 6 carbon atoms, cycloalkyl with 3 to 6
carbon atoms, alkenyl or alkynyl with 2 to 6 carbon atoms, trihalomethyl,
hydroxyalkyl with 1 to 6 carbon atoms, alkyloxyalkyl or alkylthioalkyl with 2 to 5
carbon atoms, alkyloxycarbonylalkyl wherein the alkyl moieties each contain 1 to
2 carbon atoms, hydroxyl, alkyloxy or alkylthio with 1 to 5 carbon atoms,
hydroxyalkyloxy with 2 to 4 carbon atoms, alkanoyloxy with 2 to 4 carbon atoms,
alkylsulfinyl or alkylsulfonyl with 1 to 4 carbon atoms, alkanoyl with 2 to 6 carbon
atoms, alkyloxycarbonyl wherein the alkyl moiety contains 1 to 3 carbon atoms,
mono- or di-alkylaminocarbonyl wherein each alkyl moiety contains 1 to 3 carbon
atoms, aminoalkyl with 1 to 4 carbon atoms, mono- or di-alkylaminoalkyl wherein
each alkyl moiety contains 1 to 3 carbon atoms, aryl or arylmethyl (wherein the
aryl moiety is phenyl, thienyl or furanyl, which is either unsubstituted or
substituted with alkyl or alkyloxy with 1 to 3 carbon atoms, hydroxyl or halogen),
a group with the formula -NR10R11, halogen, cyano, nitro, azido or carboxyl, with
the other two substituents being hydrogen, methyl or chloro; or,
two of R3, R4 and R5 are independently alkyl or hydroxyalkyl with 1 to 2 carbon
atoms, trihalomethyl, alkyloxy or alkylthio with 1 to 2 carbon atoms, halogen or a
group with the formula –NR10R11, with the other substituent being hydrogen or
methyl; or,
R3, R4 and R5 are each hydrogen;
one of R6, R7 and R8 is alkyl with 1 to 4 carbon atoms, alkenyl with 2 to 4 carbon
atoms, trihalomethyl, hydroxyalkyl with 1 to 4 carbon atoms, alkyloxyalkyl or
alkylthioalkyl with 2 to 4 carbon atoms, alkyloxycarbonylalkyl wherein the alkyl
moieties contain 1 to 2 carbon atoms, hydroxyl, alkyloxy or alkylthio with 1 to 4
carbon atoms, hydroxyalkyloxy with 2 to 4 carbon atoms, alkanoyloxy with 2 to 4
carbon atoms, alkylsulfinyl or alkylsulfonyl with to 4 carbon atoms, alkanoyl with 2
to 6 carbon atoms, alkoxycarbonyl wherein the alkyl moiety contains 1 to 3
carbon atoms, aminoalkyl with 1 to 4 carbon atoms, mono- or di-alkylaminoalkyl
wherein the alkyl moiety contains 1 to 2 carbon atoms, a group with the formula
-NR12R13, halogen, cyano, nitro, azido or carboxyl, with the other two substituents
being hydrogen, or two of R6, R7 and R8 are independently alkyl with 1 to 2
carbon atoms, trihalomethyl, alkyloxy or alkylthio with 1 to 2 carbon atoms,
halogen or a group with the formula -NR12R13, with the other substituent being
hydrogen or,
R6, R7 and R8 are each hydrogen and,
R10, R11, R12 and R13 are each independently hydrogen, alkyl with 1
to 4 carbon atoms, alkenylmethyl or alkynylmethyl with 2 to 4 carbon atoms, aryl or
arylmethyl (wherein the aryl moiety is phenyl, thienyl or furanyl, which is either
unsubstituted or substituted with methyl, methoxy or halogen), mono- or
dihydroxyalkylmethyl with 2 to 4 carbon atoms, alkoxy with 1 to 3 carbon atoms,
hydroxy, alkyloxyethyl or alkylthioethyl with 3 to 4 carbon atoms,
aminoalkylmethyl with 2 to 4 carbon atoms, mono- or dialkylaminoalkylmethyl
wherein each alkyl moiety contains 1 or 2 carbon atoms, or alkanoyl with 1 to 4
carbon atoms; or,
R10 and R11, R12 and R13, together with the nitrogen atoms between them,
respectively and independently form azetidin-1-yl or 5, 6 or 7-membered ring
which is either saturated or unsaturated, which optionally contains up to one
additional heteroatom which may be selected from O, S or N, or which optionally
contains in place of the carbon atom a group with the formula =R14 wherein R14 is
hydrogen or alkyl with 1 to 2 carbon atoms, and which ring is optionally and
independently substituted by hydroxymethyl, aminomethyl, 1 to 4 methyl groups
and 1 to 2 hydroxy groups; with the proviso that when
a) Z is oxygen or sulphur
b) R2 is hydrogen, alkyl with 1 to 5 carbon atoms, alkenyl or alkynyl with 2 to 5
carbon atoms, alkoxyalkyl or alkylthioalkyl with 2 to 4 carbon atoms, alkanoyl with
2 to 4 carbon atoms, hydroxyalkyl with 2 to 5 carbon atoms, phenyl (optionally
substituted with alkyl or alkoxy with 1 to 3 carbon atoms, hydroxyl or halogen) or
alkoxycarbonylmethyl wherein the alkyl moiety contains 1 to 5 carbon atoms,
c) i) R3, R4, R5, R6, R7 and R8 are each hydrogen or
ii) one of R3, R4, R5, R6, R7 and R8 is alkyl with 1 to 4 carbon atoms,
hydroxyalkyl with 1 to 4 carbon atoms, alkyloxycarbonylalkyl wherein the alkyl moieties each contain 1 to 2 carbon atoms, hydroxyl, alkoxy or alkylthio with 1 to 4 carbon atoms, alkanoyloxy of up to 4 carbon atoms, amino, aminoalkyl with up to 4 carbon atoms, mono- or di-alkylaminoalkyl wherein each alkyl moiety contains 1 to 2 carbon atoms, halogen, cyano, nitro, azido, or carboxyl, and the remaining five of R3, R4, R5, R6, R7 and R8 are each hydrogen, or
iii) R3, R4 and R5 are independently hydrogen or alkyl with 1 to 3 carbon atoms, provided that at least one is hydrogen, or one of R3, R4 and R5 is butyl with the remaining two being hydrogen and R6, R7 and R8 are independently hydrogen or alkyl with 1 to 3 carbon atoms, provided that at least one is hydrogen, or one of R6, R7 and R8 is butyl with the remaining two being hydrogen,
then R1 can not be hydrogen, alkyl with 1 to 5 carbon atoms, alkenyl or alkynyl
with 3 to 5 carbon atoms, 2-halo-2-propen-1-yl, arylmethyl (wherein the aryl
moiety is phenyl, thienyl or furanyl, which is either unsubstituted or substituted by
methyl, methoxy or (halogen), alkanoyl containing 2 or 3 carbon atoms,
alkoxyalkyl or alkylthioalkyl with 2 to 4 carbon atoms;
or of a compound with the formula I wherein Z is oxygen and
i) R1 is methyl, R2 is ethyl and or
R1 is azido, amino or nitro and R3 to R6 and R8 are hydrogen, or
R3 is ethylamino or diethyamino and R4 to R8 are hydrogen, or
R6 to R8 are methyl and R3 to R5 and R7 are hydrogen, or
R3 and R4 are methyl and R5 to R8 are hydrogen, or
ii) R1 is methyl, R2 is ethyl, t-butyl, s-butyl or isopropyl
and R3 to R8 are hydrogen, or
iii) R1 and R2 are methoxymethyl, R5 is methyl, and R3, R4, and R6, R7 and R8
are hydrogen, or
iv) R1 is hydrogen, R2 is ethyl, and R3 to R8 are hydrogen or of a
pharmaceutical acceptable acid addition salt thereof, characterized in that
it comprises,
at least, one of the following phases:
(A) for the preparation of compounds with the Formula I wherein R2 is different of
hydrogen and Z is oxygen, cyclizing one carboxylic acid amide of the General
Formula II
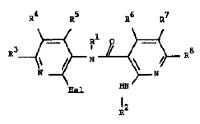
in which R1, R3 and R8 are as defined above, R2’ is as defined for R2 with the
exception of hydrogen, and Hal represents a fluorine, chlorine, bromine or iodine
atom,
(B) for the preparation of compounds with the Formula I wherein R2 is hydrogen
and Z is oxygen, hydrolytically cleaving an arylmethyl group of a compound with
the Formula III
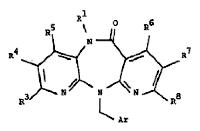
wherein R1, R3 to R8 are as defined above and Ar represents a aryl group,
(C) for the preparation of compounds with the Formula I wherein R1 is different
from hydrogen and Z is oxygen in a corresponding 5-alkaline or alkaline-earth
metal compound and subsequently reacting the referred compound of alkaline or
alkaline-earth metal with a compound with the formula V
R1’ X (V)
in which R1’ is as defined above for R1 with the exception of hydrogen and X is
the radical of a reactive ester, a halogen atom, a OSO2OR1’ group, a
methanesulphonyloxy or ethanesulphonyloxy group or an aromatic sulphonyloxy
group,
(C’) for the preparation of compounds with the Formula I wherein R1 is different
from hydrogen and Z is oxygen, reacting a compound with the Formula I wherein
R1 is hydrogen and Z is oxygen with a compound with the Formula V, as defined
above, in the presence of one amine or a carbonate or bicarbonate of alkaline
metal,
(D) for the preparation of a compound with the Formula I wherein Z is oxygen, to
convert a compound of Formula I wherein R2 is hydrogen in a corresponding
metal salt with the formula VIa or,
when R1 represents hydrogen, VIb
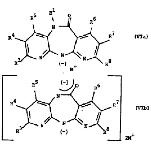
wherein M represents a alkaline metal, as for example, lithium, sodium,
potassium, rubidium or cesium, or M represents the MgHal+ group, wherein Hal
is chlorine, bromine or iodine and subsequently alkylating with a compound with
the Formula VII
R2X (VII)
wherein X is as defined above, and R2 is as defined for R2,
(E) for preparing a compound with the formula I, wherein Z is sulfur, reacting a
compound with the Formula I, wherein Z is oxygen with a sulphurating agent,
(F) for preparing a compound with the Formula I wherein R1 is hydrogen, R2 to R8
are as defined above and Z is a group with the Formula =NCN, reacting a
compound with the Formula XI
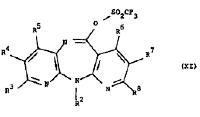
with cyanamide
(G) for preparing a compound with the Formula I wherein R1 is hydrogen and R2
to R8 are as defined above and Z is a group with the Formula =NOR9, reacting a
compound with the Formula XI as defined above with a suitable alkoxylamine
(O-alkylhydroxylamine) or a salt thereof: and isolate the compound with the
Formula I as is or under the form of acid addition salt thereof.
[vet en onderstreping toegevoegd, vzr]
2. Process according to claim 1, characterized in that it is obtained a compound
in which
Z is oxygen, sulfur or a group with the Formula =NOR9, wherein R9 is alkyl with
one to two carbon atoms,
R1 is hydrogen, alkyl with 1 to 4 carbon atoms, fluoroalkyl with 1 to 4 carbon
atoms, cyclopropyl, alkenylmethyl or alkynylmethyl with 3 to 4 carbon atoms,
2-halo-2-propen-1-yl, alkanoyl with 2 to 3 carbon atoms, alkyloxyalkyl or
alkylthioalkyl with 2 to 3 carbon atoms or cyanoalkyl wherein the alkyl moiety
contains 1 to 3 carbon atoms,
R2 is hydrogen, (with the proviso that R1 is not hydrogen, alkyl with 1 to 5 carbon
atoms, fluoroalkyl with 1 to 5 carbon atoms, cycloalkyl with 3 to 5 carbon atoms,
oxetanyl, thietanyl, alkenylmethyl or alkynylmethyl with 3 to 5 carbon atoms,
alkyloxyalkyl or alkylthioalkyl with 2 to 4 carbon atoms, hydroxyalkyl with 2 to 5
carbon atoms, aryl or arylmethyl wherein the aryl moiety is phenyl, thienyl or
furanyl, which is either unsubstituted or substituted by alkyl or alkyloxy with 1 to 3
carbon atoms, hydroxyl or halogen, or alkyloxycarbonylmethyl wherein the alkyl
moiety contains I to 4 carbon atoms;
one of R3, R4 and R5 is alkyl with 1 to 4 carbon atoms, alkenyl or alkynyl with 2 to
4 carbon atoms, trihalomethyl, hydroxyalkyl with 1 to 4 carbon atoms,
alkyloxyalkyl or alkylthioalkyl with 2 to 4 carbon atoms, alkyloxycarbonylalkyl
wherein the alkyl moieties contain 1 to 2 carbon atoms, hydroxyl, alkyloxy or
alkylthio with 1 to 3 carbon atoms, hydroxyalkyloxy with 2 to 3 carbon atoms,
alkanoyloxy with 2 to 3 carbon atoms, alkylsulfinyl or alkylsulfonyl with 1 to 3
carbon atoms, alkanoyl with 2 to 4 carbon atoms, alkyloxycarbonyl wherein the
alkyl moiety contains 1 to 2 carbon atoms, aminoalkyl with 1 to 3 carbon atoms,
mono- or di-alkylamino wherein each alkyl moiety contains 1 to 4 carbon atoms,
azetidin-1-yl, pyrrol-1-yl, pyrrolin-1-yl, pyrrolidin-1-yl, pyrazol-1-yl, pyrazolin-1-yl,
pyrazolidin-1-yl, imidazol-1-yl, imidazolin-1-yl, imidazolidin-1-yl, tetrahydropiridin-
1-yl, piperidin-1-yl, morpholin-1-yl, (4-methyl)piperazin-1-yl, piperazin-1-yl,
N, N-bis(2-hydroxyethyl)amino, N,N-bis(2-methoxyethyl)amino or halogen, with
the other two substituents being hydrogen, methyl, or chloro, or
two of R3, R4 and R5 are independently alkyl with 1 to 2 carbon atoms, alkyloxy or
alkylthio with 1 to 2 carbon atoms, amino, mono- or di-alkylamino wherein each
alkyl moiety contains 1 to 3 carbon atoms, azetidin-1-yl, pyrrol-1-yl, pyrrolin-1-yl,
pyrrolidin-1-yl, pyrazol-1-yl, pyrazolin-1-yl, pyrazolidin-1-yl, imidazol-1-yl,
imidazolin-1-yl, imidazolidin-1-yl, tetrahydropyridin-1-yl, piperidin-1-yl, morpholin-
1-yl, (4-methyl) piperazin-1-yl, piperazin-1-yl, N,N-bis(2-hydroxyethyl)amino,
N,N-bis(2-methoxyethyl)amino, or halogen with the other two substituents being
hydrogen, methyl or chloro, or R3, R4 and R5 are hydrogen
one of R6, R7 and R8 is alkyl with 1 to 2 carbon atoms, vinyl, trifluoromethyl,
hydroxyalkyl with 1 to 2 carbon atoms, hydroxyl, alkyloxy or alkylthio with 1 to 2
carbon atoms, hydroxyalkyloxy with 2 to 3 carbon atoms, alkanoyloxy with 2 to 3
carbon atoms, amino, mono- or di-alkylamino wherein each alkyl moiety contains
1 to 2 carbon atoms, azetidin-1-yl, pyrrol-1-yl, pyrrolin-1-yl, pyrrolidin-1-yl,
pyrazol-1-yl, pyrazolin-1-yl, pyrazolidin-1-yl, imidazol-1-yl, imidazolin-1-yl,
imidazolidin-1-yl, tetrahydropyridin-1-yl, piperidin-1-yl, morpholin, 1, yl,
(4-methyl)piperazin-1-yl, piperazin-1-yl, N,N-bis(2-hydroxyethyl)amino,
N,N-bis(2-methoxyethyl)amino, or halogen, with the other two substituents being
hydrogen; or,
R6, R7 and R8 are each hydrogen;
or a pharmaceutically acceptable acid addition salt thereof.
3. Process according to claim 1, characterized in that it is obtained a compound
in which Z is oxygen or sulfur; R1 is hydrogen, alkyl with 1 to 3 carbon atoms or
alkyl; R2 is alkyl with 2 to 3 carbon atoms, or cycloalkyl with 3 to 4 carbon atoms;
R3 is hydrogen, methyl, alkyloxy or alkylthio with 1 to 3 carbon atoms, chloro,
amino, mono- or di-alkylamino wherein each alkyl moiety contains 1 to 3 carbon
atoms, allylamino, azetidin-1-yl, pyrrol-1-yl, pyrrolin-1-yl, pyrrolidin-1-yl, pyrazol-1 -
yl, pyrazolin-1-yl, pyrazolidin-1-yl, imidazol-1-yl, imidazolin-1-yl, imidazolidin-1-yl,
tetrahydropyridin-1-yl, piperidin-1-yl, morpholin-1-yl, (4-methyl)piperazin-1-yl,
piperazin-1-yl, N,N-bis(2-hydroxyethyl)amino,
R4 is hydrogen, methyl or chloro
R5 is hydrogen, methyl, ethyl, chloro, or trifluoromethyl;
R6 and R8 are hydrogen; and
R7 is hydrogen or amino;
or a pharmaceutically acceptable acid addition salt thereof.
4. Process according to claim 1, characterized in that it is obtained a compound
in which Z is oxygen or sulfur; R1 is hydrogen, alkyl with 1 to 3 carbon atoms or
allyl; R2 is alkyl with 2 to 3 carbon atoms, or cycloalkyl with 3 to 4 carbon atoms;
R3 is hydrogen, methyl, chloro, methoxy, ethoxy, amino, mono- or di-alkylamino
wherein each alkyl moiety contains 1 to 2 carbon atoms, allylamino,
allylmethylamino, pyrrolin-1-yl, pyrrolidin-1-yl, tetrahydropyridin-1-yl, piperidin-1-yl
or morpholin-1-yl;
R4 is hydrogen;
R5 is hydrogen, methyl, ethyl, chloro, or trifluoromethyl;
R6 and R8 are hydrogen; and
R7 is hydrogen or amino;
or a pharmaceutically acceptable salt thereof.
5. Process for the preparation of a pharmaceutical composition characterized by
incorporating as active ingredient a compound when prepared according to claims 1 to 4, in association with a pharmaceutically acceptable carrier.
2.5.
In de oorspronkelijke aanvrage van PT 919 is een groot aantal voorbeelden opgenomen. Voorbeeld 12 luidt als volgt:

2.6.
BI DE is in Portugal, samen met BI US, mede-houdster van het aanvullend beschermingscertificaat1.met nummer 12 voor het product nevirapine (hierna: het certificaat). Het certificaat werd op een aanvrage met nummer 14871 van 4 augustus 1998 verleend bij besluit van het Portugese Instituto Nacional da Propriedade Industrial (hierna: INPI) van 16 september 1998. Het in de aanvrage ingeroepen basisoctrooi is PT 919. Het certificaat is verlengd met 6 maanden pediatrische exclusiviteit in de zin van Verordening (EG) 1901/2006.2.In een uittreksel uit het Portugese octrooiregister wordt vermeld dat de geldigheid van het certificaat loopt tot 30 mei 2015.
2.7.
Teva c.s. is onderdeel van een concern dat zich wereldwijd bezighoudt met de productie van en handel in farmaceutische producten. Teva Europe maakt haar bedrijf van de groothandel in farmaceutische producten en houdt de volledige aandelen in Teva Pharma NL. Teva Pharma NL houdt zich onder meer bezig met de im- en export van, de handel in en de fabricage van famaceutische producten. Pharmachemie houdt zich onder meer bezig met de im- en export van, de groothandel in, en de fabricage van farmaceutische producten. Pharmachemie is een 100% dochter van Teva Pharma NL (via de vennootschap Pharmachemie Holding B.V.).
2.8.
Teva Pharma NL heeft op 30 november 2009 een Europese handelsvergunning verkregen voor een geneesmiddel met als werkzame stof nevirapine. Het referentiegeneesmiddel is het Boehringer -geneesmiddel Viramune® 200 mg tabletten.
2.9.
Het generieke geneesmiddel wordt in Portugal verhandeld door Teva Pharma – Produtos Farmacêuticos Lda (hierna: Teva Pharma PT) onder de naam Nevirapina Teva. De aandelen in Teva Pharma PT worden voor 98% gehouden door Teva Europe. De resterende 2% aandelen worden gehouden door Orpahell B.V., een entiteit die een volle dochter is van Teva Europe. Aan Teva Pharma NL is in Portugal een registratienummer toegekend.3.In de bijsluiter en op de verpakking van Nevirapina Teva staat Teva Pharma NL als vergunninghoudster vermeld.
2.10.
BI US heeft op 22 December 2011 voor de rechtbank in Portimão, Portugal, een (civiele) bodemprocedure tegen Teva Pharma PT en Teva Pharma NL aanhangig gemaakt ter zake van inbreuk op PT 919. Op 18 mei 2012 hebben Teva Pharma PT en Teva Pharma NL geantwoord. Zij hebben aangekondigd een reconventionele vordering in te stellen strekkende tot een verklaring voor recht dat PT 919 en het certificaat nietig zijn. Omdat alleen BI US als procespartij optreedt, hebben Teva Pharma PT en Teva Pharma NL de rechtbank verzocht BI DE als mede-houdster van PT 919 en het certificaat in de procedure te betrekken als gevoegde partij. De zaak is nog lopend.
2.11.
BI US heeft op 14 juli 2010 bij de Tribunal Administrativo de Círculo de Lisboa te Lissabon, Portugal, een voorlopige voorziening tegen INFARMED, de Portugese bevoegde autoriteit, ingesteld strekkende tot schorsing van de registratie in Portugal van de Europese handelsvergunning van Teva Pharma NL. Teva Pharma NL is in deze procedure opgetreden als belanghebbende partij. Het bezwaar van BI US is op 8 oktober 2010 ongegrond verklaard en de registratie van de handelsvergunning is in stand gelaten. Het tegen deze beslissing door BI op 2 november 2010 bij de Tribunal Central Administrativo Sul te Lissabon ingestelde beroep is op 30 juni 2011 verworpen. De hiertegen op 8 augustus 2011 ingestelde cassatie bij de Supremo Tribunal Administrativo is op 19 januari 2012 afgewezen. BI US heeft de hoofdzaak tegen INFARMED als gedaagde en Teva Pharma NL als belanghebbende partij aanhangig gemaakt op 10 november 2010 bij de Tribunal Administrativo de Círculo de Lisboa te Lissabon. Teva Pharma NL heeft op 18 februari 2011 geantwoord. De zaak is nog lopend.
2.12.
Tot de (fictieve) stand van de techniek ten opzichte van PT 919 behoort de eerdere Portugese octrooiaanvrage PT 94521 (hierna: PT 521), ook op naam van Boehringer Ingelheim , welke volgens de in de Engelse taal gestelde niet-bestreden Europese parallelle aanvrage EP 0 410 148 A1 betrekking heeft op ‘Novel 5,11-dihydro-6H-dipyrido[3,2-b:2’,3’-e][1,4]diazepin-6-ones and –thiones and their use in the prevention or treatment of AIDS’. De aanvrage is ingediend op 27 juni 1990 onder inroeping van prioriteit van 28 juni 1989 op basis van US 372,974. De aanvrage is gepubliceerd op 8 februari 1991.
In de beschrijving is de onderstaande tabel opgenomen met de resultaten van voorbeelden 3 – 54.

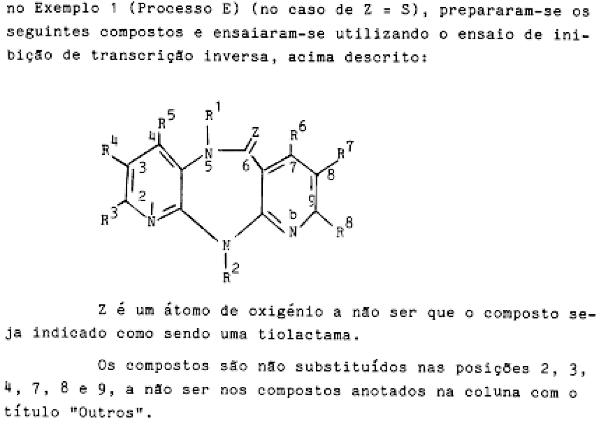
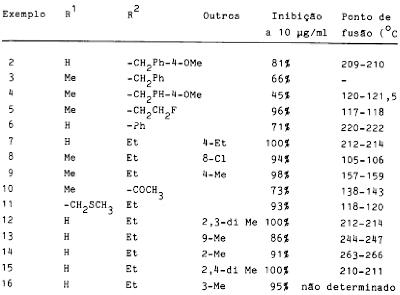


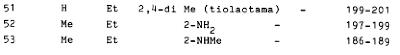
2.13.
Artikel 51 van de Portugese Cógido da Propriedade Industrial (Intellectual Property Code – hierna: IPC) volgens de versie uit 19954.luidt in de Engelse vertaling als volgt:
(State of the Art)
Art. 51.-
(1) The state of the art shall be held to comprise everything which, in Portugal or elsewhere, is available to the public before the date of the patent application by means of a description, by use or by any other means, in such a way as to be understood and worked by those skilled in the art.
(2) The contents of patent and utility model applications filed in Portugal before the date mentioned in this Article but not yet published shall also be considered as included in the state of the art.
3. Het geschil
3.1.
Na wijziging van eis vordert BI DE primair – samengevat – dat de voorzieningenrechter bij vonnis, uitvoerbaar bij voorraad, Teva c.s. verbiedt, in Nederland, enige onrechtmatige handeling jegens BI DE te verrichten, meer in het bijzonder door betrokken te zijn bij inbreuk op de exclusieve rechten van BI DE voortvloeiend uit de nationale delen van EP 987 en/of op PT 919, althans handelingen te verrichten (waaronder het nalaten van redelijke maatregelen om dergelijke inbreuken te voorkomen en/of te beëindigen) of voort te zetten met het oogmerk of gevolg dat dergelijke inbreukmakende handelingen voortduren en/of plaatsvinden, een en ander op straffe van betaling aan BI DE van een onmiddellijk opeisbare – hoofdelijk verschuldigde – dwangsom van € 100.000,00 voor iedere dag dat of, ter keuze van BI DE, € 10.000,00 voor iedere inbreukmakende eenheid waarmee dit verbod zal zijn overtreden. Subsidiair vordert BI DE hetzelfde maar dan beperkt tot inbreuk op PT 919;
Voorts vordert BI DE dat het Teva c.s. wordt bevolen om binnen twee weken na betekening van dit vonnis, ieder voor zich dan wel namens alle, aan de raadsman van BI DE, een schriftelijk volledige, en door een registeraccountant (RA), onafhankelijk van partijen, naar keuze van Teva c.s., van KPMG, PriceWaterhouseCoopers of Deloitte Touche Tohmatsu, met inachtneming van COS 4400 (Control and Other Standards) geaccordeerde en gecertificeerde opgave te verstrekken van al hetgeen Teva c.s. bekend is omtrent de herkomst en distributiekanalen, de namen en adressen van fabrikanten en de namen en adressen van commerciële klanten van Nevirapine Teva en het werkzame bestanddeel nevirapine, dat wordt verhandeld in Europa, waaronder uitdrukkelijk Portugal, tezamen met documentatie die de juistheid en compleetheid van de informatie aantoont, één en ander op straffe van betaling aan BI DE van een onmiddellijk opeisbare – hoofdelijk verschuldigde – dwangsom van € 100.000,00 voor iedere dag dat (een of meer) gedaagden dit bevel niet (daaronder begrepen: niet-volledig) nakomt/nakomen en die niet-nakoming voortduurt, daarbij ieder gedeelte van een dag als een hele gerekend,
met veroordeling van Teva c.s. in de kosten van de procedure ex artikel 1019h Rv.
3.2.
BI DE legt aan haar vorderingen ten grondslag dat Teva c.s. onrechtmatig jegens haar handelt door betrokken te zijn bij inbreuk op de aan haar toekomende intellectuele eigendomsrechten voortvloeiend uit de nationale delen van EP 987 en/of op PT 919, waaronder ook, zo althans begrijpt de voorzieningenrechter de vorderingen van BI DE ter zake (en kennelijk heeft Teva c.s. gelet op het door haar gevoerde verweer die vorderingen ook zo begrepen), het in 2.6. genoemde certificaat. Teva c.s. is volgens BI DE bekend met de inbreuk door Teva Pharma PT in Portugal en coördineert, bevordert en faciliteert die inbreuk vanuit Nederland, althans laat na die inbreuk te beëindigen of te voorkomen.
3.3.
Teva c.s. voert gemotiveerd verweer. Op de stellingen van partijen wordt hierna, voor zover van belang, nader ingegaan.
4. De beoordeling
bevoegdheid
4.1.
Ofschoon deze zaak niet een typische Gat/Luk5.-situatie betreft omdat BI DE geen inbreuk op aan haar toekomende intellectuele eigendomsrechten aan haar vorderingen ten grondslag legt maar onrechtmatig handelen van Teva c.s. in Nederland door – kort gezegd – betrokken te zijn bij inbreuk op intellectuele eigendomsrechten in het buitenland, speelt niettemin ook in dit geding de geldigheidsvraag een rol nu de vorderingen van BI DE door Teva c.s. met een geldigheidsverweer worden begroet. Onzeker is of artikel 22 lid 4 EEX-Vo6.hier toepassing vindt. Indien daarvan wordt uitgegaan, komt de voorzieningenrechter in ieder geval op grond van artikel 31 EEX-Vo internationale bevoegdheid toe van de vorderingen strekkende tot het nemen van voorlopige maatregelen kennis te nemen. Anders dan Teva c.s. heeft aangevoerd is er, gezien de vestigingsplaats van Teva c.s., ook sprake van een voldoende reële band met de Nederlandse rechtssfeer. Dat ten aanzien van het gestelde onrechtmatig handelen in Nederland een beoordeling naar vreemd recht noodzakelijk zal zijn ten aanzien van de vraag of er op de (respectieve) intellectuele eigendomsrechten in het buitenland inbreuk wordt gemaakt en in dat kader de geldigheid van die rechten moet worden onderzocht, doet aan de bevoegdheid niet af. Artikel 22 lid 4 EEX-Vo staat daaraan niet in de weg nu uit HvJ EU 12 juli 2012 (zaak C-616/10, Solvay v. Honeywell c.s.) volgt dat artikel 31 EEX-Vo een autonome draagwijdte heeft ten opzichte van eerstgenoemd artikel. Het gevaar voor tegenstrijdige beslissingen ontbreekt nu de voorlopige beslissing in dit geding geenszins vooruit zal lopen op de beslissing ten gronde van de op grond van artikel 22 lid 4 EEX-Vo bevoegde (Portugese) rechter.
4.2.
De voorzieningenrechter is op grond van de hoofdregel van artikel 99 lid 1 Rv tevens de relatief bevoegde rechter nu Teva Pharma NL en Teva Europe in dit arrondissement zijn gevestigd. De relatieve bevoegdheid ten aanzien van Pharmachemie volgt uit artikel 107 Rv. Het verweer van Teva c.s. dat de zaak verkapte octrooiinbreuk betreft en de Utrechtse voorzieningenrechter gezien artikel 80 Rijksoctrooiwet 1995 (hierna: ROW) geen relatieve bevoegheid zou toekomen (volgens Teva c.s. is de Haagse voorzieningenrechter relatief bevoegd), slaagt niet. Aan de vorderingen is geen inbreuk op de aan BI DE als zodanig toekomende octrooirechten ten grondslag gelegd maar onrechtmatig handelen in Nederland. Een dergelijke vordering valt buiten het toepassingsbereik van de uitsluitende bevoegdheidsregeling van artikel 80 lid 2 ROW.
spoedeisend belang
4.3.
Het spoedeisend belang bij het primair en subsidiair gevorderde verbod volgt uit het gestelde voortdurende karakter van de onrechtmatige handelingen. Dat, zoals Teva c.s. heeft aangevoerd, al enkele procedures in Portugal aanhangig zijn (geweest), doet aan het belang van BI DE niet af nu onweersproken is gesteld dat zij eerst in december 2011 op de hoogte is geraakt van de verhandeling van Nevirapina Teva in Portugal en niet gezegd kan worden dat zij door in mei 2012 in Nederland een kort geding dagvaarding uit te brengen zodanig talmend is opgetreden dat enig spoedeisend belang aan haar vorderingen thans moet worden ontzegd. Daar komt bij dat het gros van de Portugese procedures administratiefrechtelijk van aard is en ziet op de (praktisch gesproken gepasseerde) vraag of Teva Pharma NL op goede grond een Portugese registratie van haar Europese handelsvergunning heeft verkregen. In de bij de rechtbank van Portimão aanhangige hoofdzaak valt op korte termijn geen uitspraak te verwachten, zodat, gelet op het feit dat het octrooi als zodanig op 22 oktober 2012 expireert, ook in dat opzicht een spoedeisend belang bij een voorlopige voorziening van deze voorzieningenrechter inzichtelijk is. Dat die voorziening mogelijk ook bij de in de hoofdzaak bevoegde rechter had kunnen worden ingesteld, doet daaraan niet af.
eiswijziging
4.4.
Het bezwaar tegen de ter zitting door BI DE gedane eiswijziging wordt afgewezen. Daartoe geldt dat de geherformuleerde eis i) is ingegeven door ter zitting gestelde vragen van de voorzieningenrechter ten aanzien van de aanvankelijke eis, ii) op schrift is gesteld en in kopie aan Teva c.s. en de voorzieningenrechter is verstrekt en iii) niet valt in te zien hoe Teva c.s. in haar belangen is geschaad nu de gewijzigde eis slechts een precisering is van de aanvankelijk geformuleerde eis. De in de gewijzigde eis voorkomende termen ‘voorkomen en/of beëindigen’, waartegen Teva c.s. in het bijzonder bezwaren uit, kwamen weliswaar niet in de aanvankelijk geformuleerde eis voor doch zij diende gelet op het lichaam van de dagvaarding en de ter zitting gegeven toelichting7.wel als zodanig te worden begrepen.
bezwaar tegen akte BI DE (‘napleiten’)
4.5.
De voorzieningenrechter heeft partijen gelegenheid gegeven zich uit te laten over het in 1.4. bedoelde arrest. Teva c.s. maakt terecht bezwaar tegen het feit dat BI DE zich in haar akte – in weerwil van de ter zitting gegeven instructie – daartoe niet heeft beperkt. De akte zal mitsdien worden geweigerd voor zover het meer omvat dan de paragrafen 1 en 2 (eerste zin), 3 t/m 5, 9 en 14.
geschikt voor kort geding
4.6.
Anders dan Teva c.s. heeft aangevoerd is de onderhavige zaak niet ongeschikt voor kort geding. De wetgever dient naar hedendaagse rechtsopvatting behoedzaam van de in artikel 256 Rv gegeven bevoegdheid gebruik te maken. Dit in aanmerking nemend kan niet gezegd worden dat het voorliggende feitencomplex niet tot voldoende klaarheid is gebracht. Evenmin is er sprake van een situatie waarin de gevolgen van een door de voorzieningenrechter te geven voorziening niet kan worden overzien.
onrechtmatige betrokkenheid bij inbreuk?
4.7.
Voorop wordt gesteld dat BI DE de gestelde betrokkenheid van Teva c.s. bij inbreuk op haar exclusieve rechten in het buitenland alleen gemotiveerd heeft onderbouwd ten aanzien van PT 919 en het in 2.6. genoemde certificaat. Wat de (dreigende) inbreuk op de nationale delen van EP 987 betreft, heeft BI DE het betoog van Teva c.s. dat die delen reeds zijn geëxpireerd en zij daaraan geen rechten meer kan ontlenen, niet weersproken. Dat BI DE in andere landen dan Portugal nog over aanvullende beschermingscertificaten zou beschikken waarop inbreuk wordt gemaakt, is niet door haar gesteld. Dit betekent dat reeds om die reden de vorderingen, voor zover zij betrekking hebben op onrechtmatig handelen bestaande in betrokkenheid bij inbreuk op (andere) nationale delen van EP 987 (dan zusteroctrooi PT 9198.en het certificaat), dienen te worden afgewezen.
4.8.
Wat PT 919 betreft heeft Teva c.s. aangevoerd dat van inbreuk geen sprake is omdat de werkwijzeconclusies van het octrooi geen bescherming bieden voor de door toepassing daarvan te verkrijgen stof nevirapine en het octrooi nietig is. Volgens Teva c.s. zal de Portugese bodemrechter het octrooi dan ook niet in stand houden.
4.9.
Nu van enig onrechtmatig handelen naar Nederlands recht reeds geen sprake zou zijn indien Teva c.s. op PT 919 om voornoemde argumenten geen inbreuk zou maken, zal de voorzieningenrechter eerst voorshands de beschermingomvang en de geldigheid van PT 919 dienen te onderzoeken en wel naar het toepasselijke Portugees recht.
wordt nevirapine door PT 919 door de werkwijzeconclusies onder bescherming gesteld?
4.10.
De conclusies 1 t/m 4 van PT 919 hebben betrekking op werkwijzen voor het bereiden van diazepine derivaten met de basisstructuurformule als weergegeven in conclusie 1 (vgl. 2.4.).9.Conclusie 5 heeft betrekking op een werkwijze voor het bereiden van een farmaceutische compositie gebruikmakend van een product van de werkwijzen volgens conclusie 1 t/m 4 als actief ingrediënt.
4.11.
Door toepassing van de werkwijzeconclusies van PT 919 kan (onder meer) de stof nevirapine worden verkregen. Nevirapine is niet expliciet in de conclusies van PT 919 geopenbaard. De stof wordt in de beschrijving van PT 919 onder voorbeeld 12 genoemd (vgl. 2.5.10.).
4.12.
Nevirapine is een zogenaamde non-nucleoside reverse transcriptase (RT) inhibitor. Het is het actieve ingrediënt van het innovatieve geneesmiddel Viramune® van Boehringer Ingelheim alsook van het generieke geneesmiddel Nevirapina Teva. Het geneesmiddel is geïndiceerd voor de behandeling (in combinatie met andere anti-retrovirale middelen) van personen die geïnfecteerd zijn met het HIV-1 virus.
4.13.
In conclusie 1 is een disclaimer opgenomen (vgl. opnieuw 2.4.) om af te bakenen, zo neemt ook BI DE aan (vgl. rapport Bijvank d.d. 22 juni 2012, pagina 4, regels 8-9), van de eerdere Portugese octrooiaanvrage PT 521 (vgl. 2.12.), welke aanvrage eerst is gepubliceerd na de aanvraagdatum van PT 919. Het voor het geschil relevante deel van de disclaimer luidt:
with the proviso that when
a) […]
b) R2 is […], alkyl with 1 to 5 carbon atoms, […] [vet toegevoegd, vzr]
c) […]
then
R1 can not be hydrogen, alkyl with 1 to 5 carbon atoms, alkenyl or alkynyl with 3 to 5 carbon atoms, 2-halo-2-propen-1-yl, arylmethyl (wherein the aryl moiety is phenyl, thienyl or furanyl, which is either unsubstituted or substituted by methyl, methoxy or (halogen), alkanoyl containing 2 or 3 carbon atoms, alkoxyalkyl or alkylthioalkyl with 2 to 4 carbon atoms;
4.14.
Kort gezegd komt de disclaimer hierop neer dat de R1-groep niet een van de in de disclaimer genoemde verbindingen mag zijn wanneer aan de in a, b en c genoemde cumulatieve condities is voldaan.
4.15.
De chemische benaming van nevirapine luidt 11-cyclopropyl-4-methyl-5,11-dihydro-6H-dipyrido[3,2-b:2,3-e]-[1,4]diazepin-6-one en heeft de hierna weergegeven structuurformule. De voor de stof kenmerkende variabelen staan onder de formule opgesomd. In dit geding is alleen de substituent op positie R2 relevant:
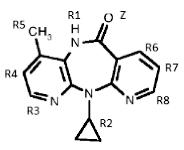
Z = O (zuurstof)
R1 = H (waterstof)
R2 = cycloalkyl met 3 koolstof atomen (cyclopropyl)
R3 = H
R4 = H
R5 = CH3 (methyl)
R6 = H (waterstof)
R7 = H (waterstof)
R8 = H (waterstof)
4.16.
Teva c.s. stelt nu dat de werkwijze volgens conclusie 1 en de daarvan afhankelijke conclusies van PT 919 niet ook zou zien op de bereiding van de stof nevirapine omdat een van de kenmerken van deze verbinding, te weten cyclopropyl op positie R2, door de disclaimer van conclusie 1 (vgl. 4.13.), meer in het bijzonder het vet gemarkeerde onderdeel b) wordt gedisclaimd en dus buiten de beschermingsomvang van PT 919 zou vallen.
4.17.
De beschermingsomvang van een Portugees octrooi dient op grond van artikelen 93 lid 1 IPC 1995 en/of artikel 97 lid 1 IPC 2003 te worden vastgesteld aan de hand van de inhoud van de conclusies, waarbij de beschrijving en tekeningen dienen tot uitleg van de conclusies.
4.18.
De in conclusie 1 van PT 919 opgenomen disclaimer betreft een zogenaamde disclosed disclaimer, een disclaimer derhalve die in de oorspronkelijke aanvrage ook al was geopenbaard en niet eerst na de aanvrage is gedaan (de zogenaamde undisclosed disclaimer). Voor een disclosed disclaimer, in feite een negatief geformuleerd kenmerk van de conclusie, geldt dat deze op dezelfde, hiervoor aangehaalde, wijze moeten worden uitgelegd als ieder ander (positief geformuleerd) conclusiekenmerk.
4.19.
In de conclusies van PT 919 wordt door de octrooihouder een duidelijk onderscheid gemaakt tussen alkyl enerzijds en cycloalkyl anderzijds. Zie bijvoorbeeld conclusie 1:
R1 is hydrogen, alkyl with 1 to 6 carbon atoms, fluoralkyl with 1 to 6 carbon atoms and 1 to 3 fluorine atoms, cycloalkyl with 3 to 6 carbon atoms, alkenyl or alkynyl with 2 to 6 carbon atoms […] [onderstreping toegevoegd, vzr]
R2 is hydrogen (with the proviso that R1 is not hydrogen), alkyl with 1 to 6 carbon atoms, fluoralkyl with 1 to 6 carbon atoms and 1 to 3 fluorine atoms, cycloalkyl with 3 to 6 carbons atoms, oxethanyl […] [onderstreping toegevoegd, vzr]
Wanneer in de disclaimer van PT 919, binnen dezelfde conclusie, wordt gesproken over alkyl, zou de gemiddelde vakman begrijpen dat alleen wordt bedoeld het eerder geclaimde alkyl te disclaimen en niet om ook het eerder geclaimde cycloalkyl te disclaimen. Dit in de conclusies gemaakte onderscheid tussen alkyl en cycloalkyl sluit ook bij het technische onderscheid tussen beide koolwaterstofverbindingen, te weten de alifatische alkylgroepen (met rechte en vertakte verbindingen) en alicyclische of cyclische alkylgroepen (met een cyclische verbinding). Bovendien blijkt ook uit de tekst van de disclaimer dat het niet om cycloalkyl kán gaan omdat daar gesproken wordt over een ‘alkyl with 1 to 5 carbon atoms’: een cyclische groep kan immers niet uit maar 1 of 2 koolstofatomen bestaan. Dat dit, zoals partijdeskundige [X] van Teva c.s. heeft verklaard, ook opgaat voor rechte of vertakte alkylgroepen, is, wat daarvan ook zij, in die zin niet relevant nu zich bij nevirapine geen rechte of vertakte alkylgroepen voordoen en bedoelde groepen in PT 919 ook niet worden geclaimd of beschreven.
4.20.
In het argument van [X] dat voor de betekenis van de in PT 919 gebruikte terminologie te raden zou moeten worden gegaan bij PT 521, waarvan het octrooi afbakent, kan niet worden meegegaan. De octrooihouder is immers zijn eigen lexicograaf en de gemiddelde vakman zou in beginsel afgaan op de in het octrooischrift gebruikte terminologie. De door [X] aangehaalde uitspraak van de Enlarged Board of Appeal van het Europees octrooibureau in de zaak G1/03, waarop hij zijn argument kennelijk baseert, ziet op undisclosed disclaimers en niet ook op, zoals hier, disclosed disclaimers (vgl. G 2/10), en is reeds daarom niet relevant.11.
4.21.
Nu in de disclaimer alleen bepaalde reguliere alkylgroepen worden gedisclaimd, maar niet cycloalkyl-groepen, valt de door toepassing van de in conclusie 1 en de daarvan afhankelijke conclusies geclaimde werkwijze rechtstreeks te verkrijgen stof nevirapine naar voorlopig oordeel onder de beschermingsomvang van PT 919.
nieuwheid werkwijze voor bereiding van nevirapine
4.22.
Met BI DE neemt de voorzieningenrechter aan dat – en zulks is in feite ook door Teva c.s. erkend (vgl. paragraaf 85 pleitnota Teva c.s.) – nevirapine niet direct en ondubbelzinnig in PT 521 wordt geopenbaard. De in PT 521 geclaimde diazepine derivaten hebben op de R2 positie immers geen cycloalkyl-groep, laat staan een cyclopropyl-groep zoals bij nevirapine. Dit betekent dat de werkwijze van PT 919, in ieder geval voor zover deze ziet op de bereiding van nevirapine, als nieuw moet worden aangemerkt. Of, zoals Teva c.s. nog heeft aangevoerd, de disclaimer van conclusie 1 te ‘smal’ is, deze niet zonder uitbreiding van materie kan worden geamendeerd en de werkwijzeconclusies van PT 919 voor de bereiding van bepaalde verbindingen anderszins worden geanticipeerd door PT 521 zal de voorzieningenrechter in het bestek van dit geding buiten beschouwing laten nu de gestelde inbreuk uitsluitend ziet op de verhandeling van de (met toepassing van de werkwijze verkregen) verbinding nevirapine en aangenomen moet worden dat BI DE haar octrooi ‘worst case’ daartoe in de Portugese bodemprocedure (op de voet van artikel 114 lid 2 IPC 2003) zou kunnen beperken. Daarvoor is, zoals BI DE naar voorlopig oordeel terecht heeft aangevoerd, ook voldoende basis in de oorspronkelijke aanvrage te vinden waar in ‘exemplo 12’ de verbinding nevirapine wordt geopenbaard (vgl. 2.5.).
inventiviteit werkwijze voor de bereiding van nevirapine
4.23.
Teva c.s. heeft ter zitting aangegeven dat de wetgeving in Portugal op het gebied van inventiviteitschadelijke prior art in die zin van het Europese en Nederlandse systeem verschilt dat fictieve stand van de techniek ‘shall also be considered as included in the state of the art’ (vgl. 2.13.), anders gezegd dat PT 521 ook voor de beoordeling van inventiviteit van belang is. Daarvan voorshands uitgaande zal de voorzieningenrechter zich bij de beoordeling van de inventiviteit, om de hiervoor opgemelde redenen, opnieuw beperken tot de vraag of de werkwijzen van de conclusie 1 en de daarvan afhankelijke conclusies, in het bijzonder conclusie 4, voor de bereiding van de verbinding nevirapine voldoende uitvindingshoogte heeft. Dat is naar voorlopig oordeel het geval.
4.24.
Teva c.s. neemt als vertrekpunt PT 521, waarvan niet in geschil is dat dit document als meest nabije stand van de techniek heeft te gelden. Zij wijst op de daarin geopenbaarde tabel (vgl. 2.12.) waarin de verbindingen uit de voorbeelden in relatie tot hun RT HIV-1 remmende werking staan weergegeven en stelt dat verbinding 44 qua structuur nagenoeg gelijk is aan nevirapine. Daarmee miskent zij echter dat, zoals bij de beoordeling van de nieuwheid al aan de orde kwam, nevirapine met de verbinding van PT 521 hierin verschilt dat bij nevirapine op positie R2 een cyclopropyl-groep zit in plaats van een isopropyl-groep. Als uitgangspunt geldt dat kleine verschillen in chemische structuur kunnen leiden tot grote veranderingen in reactiviteit. In de tabel van PT 521 worden meetgegevens met betrekking tot de effectiviteit ten aanzien van RT HIV-1 remmende werking van verbinding 44 met isopropyl (anders dan van een groot aantal andere verbindingen) niet geopenbaard, noch heeft Teva c.s. anderszins aangegeven waaruit de mate van effectiviteit zou blijken. Zij heeft bovendien – mogelijk ook omdat zij ter zitting heeft aangegeven eerst de dag voor het pleidooi bekend te zijn geworden met de mogelijke relevantie van PT 521 voor inventiviteit onder Portugees recht – geen secundaire stand van de techniek overgelegd waaruit zou volgen dat de gemiddelde vakman een incentive zou hebben om de isopropyl-groep uit PT 521 te vervangen door een cyclopropyl-groep en dat hij daarbij een redelijke verwachting van succes zou hebben dat het vervangen van genoemde groepen in het samenstel van de andere elementen van de in 2.12. weergegeven algemene structuurformule van een diazepine derivaat zou leiden tot een verbinding met een verbeterde RT HIV-1 remmende werking. Bij gebreke daarvan is er naar voorlopig oordeel vooralsnog niet van uit te gaan dat de gemiddelde vakman op basis van PT 521 tot de uitvinding van PT 919 zou (‘would’) zijn gekomen.
niet nawerkbaarheid
4.25.
Teva c.s. heeft aan het begin van haar pleidooi nog gesteld dat PT 919 ook nietig is omdat de werkwijze niet nawerkbaar zou zijn geopenbaard, doch die stelling heeft zij nadien in het geheel niet onderbouwd, zodat daaraan voorbij wordt gegaan.
‘formele argumenten’
4.26.
Ten slotte heeft Teva c.s. bij wijze van verweer nog een aantal argumenten naar voren gebracht die ook in de Portugese civiele procedure aan de orde zijn, welke mogelijk naar Nederlands recht wat ‘exotisch’ overkomen. Deze argumenten zullen hierna niettemin op hun merites naar Portugees recht worden beoordeeld.
PT 919 is aangevraagd in strijd met het onder de IPC 1940 geldende verbod op stofoctrooien
4.27.
PT 919 is aangevraagd onder de oude IPC 1940. Omdat onder de vigeur van de IPC 1940 geen stofbescherming mogelijk was in Portugal en PT 919 volgens Teva c.s. in feite geen werkwijzeoctrooi is maar een productoctrooi, is het octrooi volgens haar nietig. De voorzieningenrechter volgt Teva c.s. hierin niet. In de eerste plaats worden in de conclusies van het octrooi werkwijzen onder bescherming gesteld voor het bereiden van diazepine derivaten en voor het bereiden van een farmaceutische compositie gebruikmakend van een product van de werkwijzen volgens conclusie 1 t/m 4 als actief ingrediënt. Voorshands is dan ook niet sprake van een productoctrooi, zodat het door Teva c.s. opgeworpen probleem hier niet relevant is. Zelfs indien dat anders zou zijn geldt in de tweede plaats dat het verbod op stofbescherming met de inwerkingtreding van de IPC 1995 is komen te vervallen. Partijen hebben een overgangsrechtelijke discussie gevoerd en over en weer verklaringen van Portugese advocaten ter zake in het geding gebracht, doch ter zitting heeft Teva c.s. desgevraagd erkend dat het arrest van de Supremo Tribunal de Justiça van 27 januari 2010 (vgl. productie B bijlage 3 Teva c.s.) de meest recente en op het hoogste niveau gegeven oordeel is over deze kwestie. In dit arrest is naar de kern genomen geoordeeld dat de IPC 1995 ook van toepassing is op voor de inwerkingtreding van die wet op 1 juni 1995 ingediende maar nadien verleende octrooien. De voorzieningrechter zal hiervan voorshands dan ook uit gaan. Ook om deze reden slaagt het betoog van Teva c.s. niet.
de titel van PT 919 correspondeert niet met de materie ervan
4.28.
Het in het verlengde hiervan gevoerde betoog dat PT 919 nietig is omdat de titel van het octrooi niet zou zien op de in het octrooi geopenbaarde materie, staat of valt met de vraag of in PT 919 werkwijzen onder beschermd zijn gesteld of stofconclusies. Nu hiervoor al is geoordeeld dat van dit laatste voorshands niet is uit te gaan, strandt het betoog reeds om die reden.
slotsom
4.29.
Uit het vorenstaande volgt dat PT 919 naar Portugees recht naar voorlopig oordeel in ieder geval geldig is voor zover het de daarin onder bescherming gestelde (door toepassing van de werkwijze rechtstreeks te verkrijgen) verbinding nevirapine betreft, zodat van een serieuze, niet te verwaarlozen kans dat de Portugese bodemrechter het octrooi ook in zoverre zou vernietigen, geen sprake is. Nu zij het gestelde onrechtmatig handelen niet met andere dan de hiervoor ongegrond geoordeelde (niet-inbreuk)argumenten heeft bestreden, moet voorshands worden aangenomen dat Teva Pharma NL naar Nederlands recht, als houdster van de vergunning om het generieke geneesmiddel in Europa, meer in het bijzonder in Portugal, in het verkeer te brengen, en voorts ook als de in Portugal (separaat) geregistreerde vergunninghoudster van bedoeld geneesmiddel, jegens BI DE in strijd handelt met de maatschappelijke zorgvuldigheid. Zij moet geacht worden met de uitsluitende rechten van BI DE in Portugal bekend te zijn althans behoort dit te zijn. Het bevorderen of faciliteren van of deelnemen in Nederland aan de inbreuk door een gelieerde concern-maatschappij in Portugal, te weten Teva Pharma PT, die noodzakelijkerwijs van Teva Pharma NL als vergunninghouder direct of indirect toestemming voor het aldaar op de markt brengen van Nevirapina Teva moet hebben gekregen, dient voorshands als onrechtmatig te worden beschouwd.
4.30.
Het gevorderde verbod zal gelet op een en ander worden toegewezen, zij het dat het dictum, omwille van de praktische uitvoerbaarheid en ter voorkoming van executiegeschillen, zal afwijken van de ter zitting geherformuleerde eis.
4.31.
Eveneens ter voorkoming van executiegeschillen zij nog het volgende opgemerkt. Partijen hebben gedebatteerd over de maximale duur van het certificaat. Teva Pharma NL heeft aan de hand van een verklaring van twee Portugese advocaten (productie A en bijlage 6 daarbij, zijnde het antwoord in de civiele procedure bij de rechtbank van Portimão) onderbouwd gesteld dat het certificaat, dat in Portugal bij expiratie van PT 919 op 22 oktober 2012 van kracht wordt, in duur beperkt is tot uiterlijk 22 december 2012. Als uitgegaan zou worden van de door BI DE genoemde datum van 30 mei 2015, zou de door de ABC-verordening (in de considerans onder 9) bepaalde maximale beschermingsduur van 15 jaar gerekend vanaf de afgifte van de eerste vergunning worden overschreden, zo heeft zij betoogd. Desgevraagd heeft BI DE deze stelling ter zitting niet voldoende gemotiveerd kunnen weerspreken, zodat aangenomen wordt dat het certificaat eerder vervalt dan de door BI DE genoemde datum. Teva Pharma NL heeft echter op haar beurt weer niet betwist dat, zoals BI DE heeft gesteld (vgl. 2.6. / positum 10 dagvaarding), het certificaat op grond van de pediatrische verordening met zes maanden is verlengd. Op deze verlenging heeft Teva Pharma NL in haar berekening ten onrechte geen acht geslagen. Gelet op een en ander dient ervan uit te worden gegaan dat het certificaat niet expireert op 22 december 2012 maar, zes maanden later, op 22 juni 2013.
4.32.
Hoewel in dit geding aan de gevorderde opgave geen inbreuk op een intellectueel eigendomsrecht ten grondslag is gelegd, zal de vordering, nu die niet anders is weersproken dan dat de opgave beperkt dient te blijven tot de verhandeling van Nevirapina Teva in Portugal, worden toegewezen.
4.33.
De dwangsommen zullen worden gematigd en gemaximeerd.
vorderingen tegen Teva Europe en Pharmachemie
4.34.
De positie van Teva Europe en Pharmachemie is anders.
4.35.
Pharmachemie heeft een verklaring van haar CEO in het geding gebracht waarin hij verklaart dat Nevirapina Teva niet door Pharmachemie wordt vervaardigd. Deze verklaring is zijdens BI DE onweersproken gelaten. Nu ook anderszins niet is gebleken van onrechtmatige betrokkenheid van Pharmachemie bij inbreuk op PT 919, dienen de vorderingen voor zover ingesteld tegen Pharmachemie te worden afgewezen.
4.36.
Hetzelfde geldt voor de vorderingen tegen Teva Europe. Alleen bij zeer bijzondere omstandigheden die maken dat aan de aangesproken bestuurder een ernstig persoonlijk verwijt kan worden gemaakt, kan doorbraak van aansprakelijkheid aan de orde komen. Dergelijke omstandigheden zijn gesteld noch gebleken. Het enkele feit dat Teva Europe bestuurder is van Teva Pharma NL en daarin de aandelen houdt alsmede dat zij direct en indirect de aandelen houdt in Teva Pharma PT is daartoe in ieder geval onvoldoende.
proceskosten
4.37.
In de procedure tegen Teva Pharma NL zal Teva Pharma NL als de in het ongelijk gestelde partij in de proceskosten worden veroordeeld. Partijen hebben beide de stelling betrokken dat het onderhavige geschil onder het materiële toepassingsbereik van de artikelen 1019 e.v. Rv valt. Zoals het hof ’s-Gravenhage bij zijn arrest van 17 januari 2012 heeft geoordeeld (LJN BV1072), dient de rechter dat evenwel ambtshalve te beoordelen. De vorderingen van BI DE zijn uitsluitend gebaseerd op onrechtmatige daad (en niet op een aan BI DE toekomend intellectueel eigendomsrecht). Zij stelt immers dat Teva Pharma NL door betrokken te zijn bij octrooiinbreuk, althans nalaat die inbreuk te voorkomen, handelt in strijd met de maatschappelijke zorgvuldigheid. Dat is naar voorlopig oordeel niet een situatie waarin de octrooihouder de hem als zodanig toekomende intellectuele eigendomsrechten handhaaft en deze situatie kan mitsdien niet onder het genoemde bereik worden geschaard. Dat in de procedure materieel gezien ook de inbreuk en geldigheid van het Portugese deel van het Europese octrooi voorligt, doet daaraan niet af.
4.38.
De kosten aan de zijde van BI DE zullen aan de hand van het liquidatietarief begroot worden op (1/3 x tarief vastrecht ad € 575,00 = € 191,67 + 90,64 kosten uitbrengen dagvaarding =) € 282,31 aan verschotten en (1/3 x € 816,00 =) € 272,00 aan salaris advocaat.
4.39.
In de procedure tegen Teva Europe en Pharmachemie zal BI DE als de in het ongelijk gestelde partij worden veroordeeld. De kosten aan de zijde van Teva Europe en Pharmachemie worden begroot op (2/3 x tarief vastrecht ad € 575,00 =) € 383,33 aan verschotten en (2/3 x € 816,00 =) € 544,00 aan salaris advocaat. Nu Teva Europe en Pharmachemie zulks niet hebben gevorderd, zal de proceskostenveroordeling niet uitvoerbaar bij voorraad worden verklaard. Voor een ambtshalve toepassing op de voet van artikel 258 Rv ziet de voorzieningenrechter geen aanleiding.
5. De beslissing
De voorzieningenrechter
in de procedure tegen Teva Pharma NL:
5.1.
verbiedt Teva Pharma NL om binnen 2 werkdagen na betekening van dit vonnis onrechtmatig jegens BI DE te handelen, meer in het bijzonder door betrokken te zijn bij inbreuk door Teva Pharma PT op PT 919 in Portugal of die inbreuk te faciliteren, waaronder mede wordt verstaan het niet volledig en onvoorwaardelijk intrekken van direct of indirect gegeven toestemming aan Teva Pharma PT om Nevirapina Teva in Portugal in het verkeer te brengen, op straffe van een dwangsom van € 100.000,00 voor iedere dag, of ter keuze van BI DE, € 5.000,00 voor ieder product (waaronder is te verstaan: een patiëntenverpakking van Nevirapina Teva, ongeacht het aantal daarin voorkomende tabletten) waarmee dit verbod zal zijn overtreden;
5.2.
beveelt Teva Pharma NL om binnen 4 weken na betekening van dit vonnis aan mr. J.J. Allen, raadsman van BI DE, een schriftelijk volledige, en door een onafhankelijke registeraccountant (RA) van, naar keuze van Teva Pharma NL, KPMG, PriceWaterhouseCoopers of Deloitte Touche Tohmatsu, met inachtneming van COS 4400 (Control and Other Standards) geaccordeerde en gecertificeerde opgave te verstrekken van al hetgeen Teva Pharma NL bekend is omtrent de herkomst en distributiekanalen, de namen en adressen van fabrikanten en de namen en adressen van commerciële klanten van Nevirapina Teva en het werkzame bestanddeel nevirapine, dat wordt verhandeld in Portugal, tezamen met documentatie die de juistheid en compleetheid van de informatie aantoont, een en ander op straffe van een dwangsom van € 100.000,00 voor iedere dag dat Teva Pharma NL dit bevel niet of niet volledig nakomt en die niet-nakoming of niet-volledige nakoming voortduurt, waarbij ieder gedeelte van een dag als een hele wordt gerekend;
5.3.
bepaalt het maximum aan de onder 5.1. en 5.2. gezamenlijk te verbeuren dwangsommen op € 10.000.000,00;
5.4.
veroordeelt Teva Pharma NL in de proceskosten, aan de zijde van BI DE tot op heden begroot op € 282,31 aan verschotten en € 272,00 aan salaris advocaat;
5.5.
verklaart dit vonnis tot zover uitvoerbaar bij voorraad;
5.6.
wijst af het meer of anders gevorderde.
in de procedure tegen Teva Europe en Pharmachemie:
5.7.
wijst de vorderingen af;
5.8.
veroordeelt BI DE in de proceskosten, aan de zijde van Teva Europe en Pharmachemie tot op heden begroot op € 383,33 aan verschotten en € 544,00 aan salaris advocaat;
Dit vonnis is gewezen door mr. J.Th. van Walderveen en bij zijn ontstentenis op 15 augustus 2012 in het openbaar uitgesproken door mr. Chr.A.J.F.M. Hensen.
Voetnoten
Voetnoten Uitspraak 15‑08‑2012
Verordening (EG) nr. 1901/2006 van het Europees Parlement en de Raad van 12 december 2006 betreffende geneesmiddelen voor pediatrisch gebruik en tot wijziging van Verordening (EEG) nr. 1768/92, Richtlijn 2001/20/EG, Richtlijn 2001/83/EG en Verordening (EG) nr. 726/2004 (hierna: pediatrische verordening)
Een Europese handelsvergunning heeft een Portugees registratienummer nodig voordat deze van kracht is in Portugal.
Ambtshalve is vastgesteld dat deze bepaling (thans: artikel 56) volgens de laatstelijk gewijzigde versie (in werking getreden op 1 oktober 2008) in hoofdzaak niet is veranderd.
HvJ EG 13 juli 2006, zaak C-4/03.
Verordening (EG) nr. 44/2001 van de Raad van 22 december 2000 betreffende de rechterlijke bevoegdheid, de erkenning en de tenuitvoerlegging van beslissingen in burgerlijke en handelszaken.
Zie positum 17, 19, 38 dagvaarding (controle over de verhandeling van nevirapine in Portugal) en paragraaf 7, 12, 13, 148, 150, 152 pleitnota mrs. Allen en Van Dongen.
Onder de oude Portugese wetgeving bestond een beschermingsduur van 15 jaar gerekend vanaf de datum van verlening.
Voor nevirapine zijn alleen de werkwijzen A en D van conclusie 1 relevant.
In 2.5. is de tekst van de oorspronkelijke aanvrage opgenomen. De tekst van PT 919 zoals verleend is daaraan gelijk omdat octrooiaanvragen door het Portugese octrooibureau INPI niet inhoudelijk werden (en worden) beoordeeld.
Of uit G1/03 een regel als door [X] voorgestaan kan worden afgeleid, wat BI DE weerspreekt, kan hier onbesproken blijven.