Hof Den Haag, 09-04-2013, nr. 200.028.838/02
ECLI:NL:GHDHA:2013:BZ6268
- Instantie
Hof Den Haag
- Datum
09-04-2013
- Zaaknummer
200.028.838/02
- LJN
BZ6268
- Roepnaam
Leo Pharma/Sandoz
- Vakgebied(en)
Ondernemingsrecht (V)
Intellectuele-eigendomsrecht (V)
- Brondocumenten en formele relaties
ECLI:NL:GHDHA:2013:BZ6268, Uitspraak, Hof Den Haag, 09‑04‑2013
Cassatie: ECLI:NL:HR:2014:2900, Bekrachtiging/bevestiging
Uitspraak 09‑04‑2013
Inhoudsindicatie
Intellectuele eigendom; octrooirecht. Pharmachemisch octrooi vernietigd wegens gebrek aan inventiviteit.
Partij(en)
GERECHTSHOF DEN HAAG
Afdeling civiel recht
Zaaknummer : 200.028.838/02
Zaak/rolnummer Rb : 306029/HA ZA 08-733
arrest van 9 april 2013
inzake
SANDOZ B.V.,
gevestigd te Weesp,
appellante,
hierna te noemen: Sandoz,
advocaat: mr. D. Knottenbelt te Rotterdam,
tegen
de rechtspersoon naar Deens recht
LEO PHARMACEUTICAL PRODUCTS LTD A/S,
gevestigd te Ballerup, Denemarken,
geïntimeerde,
hierna te noemen: Leo Pharma,
advocaat: mr. L.Ph.J. van Utenhove te Den Haag.
Verloop van het geding
Voor het procesverloop tot aan het arrest van het hof van 28 september 2010 verwijst het hof naar dat arrest. Bij dat arrest is de incidentele vordering van Sandoz afgewezen. Vervolgens heeft Sandoz een memorie van grieven genomen, waarin zij veertien grieven tegen het vonnis waarvan beroep heeft aangevoerd. Deze zijn door Leo Pharma bij memorie van antwoord bestreden.
Op 1 november 2013 hebben partijen de zaak doen bepleiten, Sandoz door mrs. P. Burgers en D.F. de Lange, advocaten te Amsterdam, en Leo Pharma door mr. A.E. Heezius, advocaat te Amsterdam, aan de hand van pleitnotities die aan het procesdossier zijn toegevoegd. Door beide partijen zijn voorafgaand aan het pleidooi aanvullende stukken ingediend, die in het van de pleitzitting opgemaakte proces-verbaal zijn gespecificeerd.
Vervolgens hebben partijen arrest gevraagd.
Beoordeling van het beroep
1. Tussen partijen is in geschil de geldigheid van na te melden octrooi van Leo Pharma en de vraag of Sandoz daarop inbreuk maakt.
2. Mede op grond van de door de rechtbank in rov. 2.1 tot en met 2.16 van het vonnis vastgestelde feiten, die, behoudens de eerste zin van rov. 2.10, in hoger beroep niet zijn bestreden, gaat het hof van het volgende uit.
2.1
Leo Pharma brengt onder meer geneesmiddelen op de markt voor de uitwendige behandeling van psoriasis met als actief bestanddeel 'calcipotriol', onder andere onder het merk Daivonex(r). Psoriasis is een ziekte waarbij cellen in de huid te snel worden aangemaakt, waardoor rode plekken en schilfers ontstaan. Het geneesmiddel wordt afhankelijk van de toepassing aangeboden in verschillende vormen, zoals lotions, zalven en crèmes.
2.2
Leo Pharma is houdster van Europees octrooi 0 679 154 (hierna: het octrooi of EP 154) dat betrekking heeft op een 'New crystalline form of a Vitamin D Analogue' (in de niet-bestreden Nederlandse vertaling: 'Nieuwe kristallijne vorm van een analogon van vitamine D'). Het octrooi is verleend op 29 oktober 1997 op een aanvrage daartoe van 7 januari 1994, onder inroeping van prioriteit van 15 januari 1993 op basis van de Britse octrooiaanvrage GB 9300763. Het octrooi heeft onder meer gelding in Nederland.
2.3
In de niet bestreden Nederlandse vertaling luiden de conclusies als volgt:
- 1.
Calcipotriol-monohydraat (1a, 3ß, 5Z, 7E, 22E, 24S)-24-cyclopropyl-9,10-secochola- 5,7,10(19),22-tetraeen-1,3,24-triol-monohydraat).
- 2.
Farmaceutisch preparaat bevattende de verbinding volgens conclusie 1.
3.
Farmaceutisch preparaat volgens conclusie 2, dat een crème is.
4.
Farmaceutisch preparaat volgens conclusie 2, dat een gel is.
5.
Farmaceutisch preparaat volgens één der conclusies 2 tot 4, met een gehalte aan de actieve component van 1-100 µg/g van het preparaat.
Bij het octrooi behoren geen figuren.
Tegen de verlening van het octrooi is geen oppositie ingesteld.
- 2.4.
Het octrooi is afgebakend van de PCT-aanvrage WO 87/00834 (hierna: 'WO 834'), eveneens op naam van Leo Pharma.
In WO 834 is voor het eerst de stof calcipotriol (een 'analogon': een aan vitamine D analoge verbinding) in de vorm van het kristallijn anhydraat beschreven, daarin aangeduid als 'compound 59' en bereid volgens voorbeelden 5, 6 of 7. De structuurformule van calcipotriol anhydraat kan als volgt worden weergegeven:
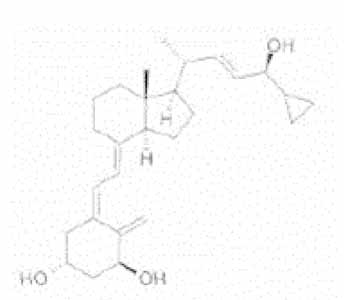
Op WO 834 is Europees octrooi EP 0 227 826 B1 (hierna: EP 826) verleend, dat op 14 juli 2006 is geëxpireerd. Er is geen ABC verleend voor calcipotriol op grond van EP 826.
- 2.5.
Calcipotriol anhydraat is biologisch actief en zeer bruikbaar in topische behandeling van psoriasis. Vanwege de geringe stabiliteit van de stof calcipotriol is het wenselijk deze niet in een formulering op te lossen, maar in suspensie (kleine vaste deeltjes) aan een formulering toe te voegen.
- 2.6.
Het onderhavige octrooi EP 154 voorziet in een kristallijne vorm van de stof calcipotriol: calcipotriol monohydraat. Calcipotriol anhydraat en calcipotriol monohydraat zijn (pseudo)polymorfen. Polymorfen zijn vaste stoffen met eenzelfde chemische samenstelling, maar met een verschillend kristalrooster. Bij pseudopolymorfen of solvaten zijn in het kristalrooster een of meer oplosmiddelmoleculen opgenomen. Calcipotriol monohydraat omvat in het kristalrooster per eenheid één watermolecuul.
Het calcipotriol monohydraat bezit ten opzichte van het anhydraat enkele gunstige eigenschappen. Het monohydraat bleek beter te verwerken tot uniforme kristallijne deeltjes, is stabieler tijdens opslag, minder gevoelig voor degradatie en geschikter voor grootschalige productie omdat een hogere opbrengst en betere zuiverheid worden verkregen.
In de beschrijving van het octrooischrift wordt uitgelegd hoe het monohydraat bereid kan worden (p. 2, regels 31-32):
Calcipotriol, monohydrate may be prepared by dissolving crystalline or non-crystalline calcipotriol in an organic solvent, e.g. ethyl acetate or acetone, followed by the addition of water and optionally a non polar solvent, e.g. hexane.
- 2.7.
De kristallijne structuur van een vaste stof kan met verschillende technieken worden geanalyseerd, bijvoorbeeld IR spectroscopie (absorptie van infrarood licht) en Ramanspectroscopie (inelastische strooiing van monochromatisch licht). Doordat deze analysemethoden zijn gebaseerd op verschillende effecten, is de daardoor verkregen informatie complementair.
- 2.8.
Sandoz verkoopt onder meer in Nederland geneesmiddelen voor topische toepassing op de huid bedoeld voor de behandeling van psoriasis, die het actieve bestanddeel calcipotriol bevatten. Deze producten worden in de vorm van een zalf op de markt gebracht. Sandoz heeft aangegeven ook de crème te willen verhandelen in Nederland.
- 2.9.
Behalve in Nederland, heeft Leo Pharma ook inbreukacties tegen Sandoz ingesteld in Engeland, Duitsland en België. Sandoz heeft op haar beurt nietigheidsprocedures aangespannen in Zweden, Italië en Duitsland.
3. Sandoz heeft twee grieven gericht tegen de feitenvaststelling door de rechtbank.
In grief 1 stelt zij dat, anders dan de rechtbank in rov. 2.10 heeft overwogen, calcipotriol monohydraat niet nieuw was. Deze grief houdt verband met de stelling van Sandoz dat het octrooi nietig is wegens niet-nieuwheid. Nu het hof, zoals uit het hierna volgende zal blijken, niet aan beoordeling van die stelling toekomt, behoeft de grief op deze plaats geen bespreking.
In grief 2 verwijt Sandoz de rechtbank in rov. 2.16 niet tevens melding te hebben gemaakt van de nietigheidsprocedure in Duitsland.
Mede in verband met deze grief overweegt het hof dat in hoger beroep is komen vast te staan dat het octrooi in de Engelse en Zweedse procedure in stand is gelaten en in de procedures in Italië en Duitsland in twee instanties is vernietigd op grond van gebrek aan inventiviteit. In rov. 25 zal het hof nader op de betreffende uitspraken ingaan. Aldus wordt tevens tegemoet gekomen aan het in grief 2 geformuleerde bezwaar. Op zichzelf kan die grief niet tot vernietiging leiden.
4. Leo Pharma vordert in conventie, stellend dat Sandoz met haar calcipotriol bevattende producten (crème en zalf) inbreuk maakt op de conclusies 1, 2, 3 en 5 van het octrooi, een inbreukverbod en diverse andere voorzieningen. Sandoz vordert in reconventie de vernietiging van het Nederlandse deel van EP 154, op de grond dat het octrooi niet nieuw is, niet inventief is en/of niet nawerkbaar. In eerste aanleg heeft zij die vordering bij pleidooi verbonden aan de voorwaarde dat een inbreuk wordt vastgesteld. De rechtbank heeft het octrooi geldig bevonden, geoordeeld dat Sandoz daarop inbreuk maakt en de vorderingen in conventie grotendeels toegewezen.
5. De grieven 1 tot en met 11 zijn gericht tegen het oordeel van de rechtbank dat het octrooi geldig is. Daarbij zien de grieven 1en 3 tot en met 6 op de nieuwheid, de grieven 2 en 7 tot en met 9 op de inventiviteit en grief 10 op de nawerkbaarheid van het octrooi. Grief 11 betreft de slotconclusie met betrekking tot de geldigheid van het octrooi. In de grieven 12 tot en met 14 bestrijdt Sandoz het oordeel van de rechtbank dat zij inbreuk maakt op het octrooi.
6. Leo Pharma heeft bij pleidooi aangevoerd dat Sandoz in haar hoger beroep niet-ontvankelijk moet worden verklaard omdat zij - in het kader van haar verweer tegen de gestelde inbreuk - in strijd met de waarheidsplicht heeft verzwegen dat het Amerikaanse bedrijf Tolmar in opdracht van en exclusief voor Sandoz een monohydraatvrije calcipotriol crème produceert, waaruit blijkt dat, anders dan Sandoz tot dan toe had gesteld, het wel degelijk mogelijk is inbreuk op het octrooi te vermijden. Volgens Leo Pharma dient dit ertoe te leiden dat Sandoz niet-ontvankelijk wordt verklaard in haar beroep, ook wat betreft de nietigheidsvordering, die Sandoz immers voorwaardelijk heeft ingesteld. Leo Pharma stelt dit niet eerder te hebben kunnen aanvoeren.
Het hof verwerpt dit verweer. Uit het petitum in de memorie van grieven blijkt dat Sandoz haar vordering tot vernietiging van het octrooi in hoger beroep niet langer afhankelijk stelt van de voorwaarde dat wordt geoordeeld dat zij inbreuk maakt op het octrooi. Voor zover het laten vallen van die voorwaarde als een eiswijziging moet worden aangemerkt, heeft Sandoz deze dus tijdig naar voren gebracht.
Bij pleidooi heeft zij de onvoorwaardelijkheid van haar vordering nog eens uitdrukkelijk bevestigd. Hetgeen door Leo Pharma met betrekking tot de inbreuk wordt gesteld heeft derhalve geen consequenties voor het belang van Sandoz bij beoordeling van de geldigheid van het octrooi en daarmee voor haar ontvankelijkheid in het hoger beroep.
Wat betreft het verweer van Sandoz tegen de gestelde inbreuk geldt dat een eventuele schending van de waarheidsplicht niet zonder meer de niet-ontvankelijkheid tot gevolg heeft: ingevolge art. 21 Rv. kan de rechter daaruit (zo nodig) de gevolgtrekking maken die hij geraden acht.
7. Leo Pharma voert voorts aan dat zij in haar verdediging is geschaad door de wijze waarop Sandoz haar memorie van grieven heeft ingericht, te weten: door een inleiding van 36 pagina's te schrijven over nieuwheid en inventiviteit en vervolgens veertien grieven te formuleren die naar diverse onderdelen van de inleiding verwijzen. Het hof verwerpt dit bezwaar. Voor het hof en ook voor Leo Pharma, getuige de inhoud van haar memorie van antwoord, is voldoende kenbaar op welke gronden Sandoz vernietiging van het vonnis waarvan beroep bepleit.
8. Het hof zal eerst de geldigheid van het octrooi beoordelen. Het hof ziet daarbij aanleiding eerst de grieven betreffende de inventiviteit van het octrooi te behandelen.
Inventiviteit
9. Anders dan Leo Pharma betoogt, dient het hof bij de beoordeling van de inventiviteit van het octrooi niet slechts acht te slaan op de inhoud van de als zodanig aangeduide grieven 7 tot en met 9, maar tevens op hetgeen in de inleiding op de (als zodanig benoemde) grieven naar voren is gebracht. In hoger beroep dient immers elk als zodanig voldoende kenbaar gemaakt bezwaar tegen het vonnis waarvan beroep te worden getoetst.
10. Hoewel dat niet altijd is aangewezen, kan de inventiviteit van het octrooi in dit geval worden beoordeeld met toepassing van de zogenaamde problem solution approach. Beide partijen bepleiten de (niet-)inventiviteit met toepassing van deze methode. Ook de rechtbank heeft haar toegepast, waartegen geen van beide partijen bezwaar heeft gemaakt.
11. Partijen zijn het eens over de in dat kader aan te wijzen meest nabije stand van de techniek, te weten: WO 834 waarin voor het eerst de stof calcipotriol in een kristallijne vorm (te weten: anhydraat) is beschreven. Dit octrooi is gepubliceerd op 12 februari 1987 en heeft als prioriteitsdatum 2 augustus 1985.
12. De rechtbank heeft, daarvan uitgaand, in rov. 4.12 als het objectieve probleem dat het octrooi beoogt op te lossen omschreven: het zoeken naar een kristallijne vorm van calcipotriol die voor therapeutisch gebruik geschikt is en die stabieler is dan het anhydraat gedurende opslag, dat wil zeggen: minder degradeert. De rechtbank heeft daaraan toegevoegd dat niet in geschil is dat calcipotriol anhydraat op zichzelf thermodynamisch stabiel is.
13. In haar memorie van grieven onderschrijft Sandoz het aldus gedefinieerde probleem, zij het zonder uitdrukkelijk aan te geven dat het bij het op te lossen probleem om de opslagstabiliteit gaat (zie memorie van grieven 93-95). Leo Pharma wijst daar terecht op (memorie van antwoord 329). Echter, uit de omstandigheid dat Sandoz geen grief heeft gericht tegen de vaststelling van de rechtbank dat niet in geschil is dat calcipotriol anhydraat thermodynamisch stabiel is, volgt dat Sandoz inderdaad het oog heeft op de opslagstabiliteit. Dat dit juist is volgt uit de pleitnota van Sandoz in appel, onder 20, en heeft zij tijdens het pleidooi desgevraagd nog eens uitdrukkelijk bevestigd.
14. Ook Leo Pharma onderschrijft het door de rechtbank gedefinieerde objectieve technische probleem (zie memorie van antwoord 79, 126, 128, 322, 323 en 352). Daarbij maakt zij wel de kanttekening dat vóór de ontdekking van calcipotriol monohydraat slechts één kristallijne vorm van calcipotriol bekend was en dat men deze vorm pas toen 'anhydraat' is gaan noemen (ter onderscheiding van monohydraat). Voor de definiëring van het objectieve probleem maakt dat evenwel geen verschil. Leo Pharma stelt nog wel dat de rechtbank ook 'de onverwachte eigenschap dat calcipotriol monohydraat, anders dan het tot dan toe bekende kristallijne calcipotriol, bij wet ball milling geen stabiel schuim vormt' en dat volgens Leo Pharma 'een verrassend voordeel' van het monohydraat blijkt te zijn, in de formulering van het objectieve technische probleem had moeten betrekken.
Waar Leo Pharma enerzijds niet aangeeft hoe de rechtbank dat had moeten doen en anderzijds herhaaldelijk benadrukt dat het door de rechtbank geformuleerde probleem in hoger beroep vaststaat, ziet ook Leo Pharma het door haar genoemde voordeel van het gebrek aan schuimvorming kennelijk als een zogenaamd bonuseffect (zie dienovereenkomstig de pleitnota van Sandoz in appel, onder 44, waarop Leo Pharma niet meer is ingegaan). Het hof neemt derhalve het door de rechtbank geformuleerde objectieve technische probleem tot uitgangspunt. Wel acht het hof het minder juist om in de probleemstelling te verwerken 'het zoeken naar een kristallijne vorm (van calcipotriol)'. Of de vakman naar een (andere) kristallijne vorm van calcipotriol zou zijn gaan zoeken is een (deel)vraag die geen onderdeel uitmaakt van het probleem, maar van de daarop volgende inventiviteitsbeoordeling, en partijen verschillen dan ook van mening over het antwoord op die vraag. Het hof definieert het objectieve technische probleem als volgt: hoe kan de opslagstabiliteit van calcipotriol in een voor therapeutisch gebruik geschikte vorm, ten opzichte van het bekende calcipotriol anhydraat worden verbeterd? Overigens komt dat overeen met het objectieve technische probleem zoals vastgesteld in de Italiaanse procedure (vgl. hof van Turijn (prod. 48 Sandoz), blz. 25). In de Duitse procedure werd een tweeledig probleem gezien; één daarvan was verbetering van de opslagstabiliteit (Bundesgerichtshof (prod. 42 Sandoz), rov. 32 en 33).
Het hof zal later nog op het voornoemde bonus-effect ingaan.
15. Derhalve moet, zoals ook Leo Pharma stelt (memorie van antwoord 128), onderzocht worden of het voor de gemiddelde vakman (hierna ook 'de vakman') op de prioriteitsdatum (15 januari 1993) voor de hand lag om, uitgaand van het kristallijne anhydrate calcipotriol van WO 834, te zoeken naar een kristallijne vorm van calcipotriol die voor therapeutisch gebruik geschikt is en stabieler is dan het anhydraat gedurende opslag, dat wil zeggen minder degradeert, en of hij calcipotriol monohydraat zou hebben gevonden.
16. De vakman op het onderhavige vakgebied van vitamine D-derivaten bestaat in dit geval uit een team van een formuleringsdeskundige die ervaring heeft met topische formuleringen en een analytisch farmaceutisch chemicus (pleitnota Sandoz in appel onder 2; vgl. ook Bundesgerichtshof (prod. 42 Sandoz), rov. 34, en High Court of Justice, Chancery Division, Patents Court (Justice Floyd) (prod. 42 Leo Pharma), rov. 21 en 22; rechtbank van Turijn (prod. 47 Sandoz)).
17. Deze vakman opereerde begin jaren '90 in een omgeving waarin het belang van het zoeken naar (pseudo)polymorfen van werkzame stoffen bij de ontwikkeling van geneesmiddelen bekend was. De vakman was zich ervan bewust dat polymorfisme invloed heeft op de eigenschappen van een werkzame stof, waaronder de biologische beschikbaarheid van die stof, maar ook de (diverse vormen van) stabiliteit daarvan. Zo was de vakman bekend met de publicatie 'Solid State Chemistry of Drugs' van S.R. Byrn (1982) 79-148 (bijlage bij de verklaring van dr. I. M. Cunningham, prod. 41 Sandoz), waarin valt te lezen (blz.79):
"Compounds that crystallize in polymorphs can show a wide range of physical and chemical properties, including different melting points and spectral properties. Polymorphism is particularly important for pharmaceuticals, where the polymorph present can alter the dissolution rate, bioavailability, chemical stability, and physical stability."
De vakman was ook bekend met de 'Guideline for submitting supporting documentation in drug applications for the manufacture of drug substances' (1987) blz.31-34, van de 'Food and Drug Aministration' (prod. 40 Sandoz), waarin het belang van onderzoek naar de verschillende verschijningsvormen van een werkzame stof in verband met de daaraan verbonden farmceutische en chemische eigenschappen tot uiting komt (vgl. ook de door het Bundesgerichtshof benoemde deskundige Prof. Dr. G. Kutz (prod. 43 Sandoz), blz. 12 e.v.).
Dat onderzoek naar polymorfisme ook in het begin van de jaren '90 de aandacht had van farmaceutische bedrijven blijkt voorts uit de publicatie 'Crystal polymorphism of pharmaceuticals' van L. Borka en J.K. Haleblian in 'Acta Pharm. Jugosl., 40 (1990) 71-94, waarin op blz.71 is vermeld (prod. 17 Sandoz):
"The discovery of polymorphism among pharmaceutical substances however, initiated a growing interest in this field. The synthetic and analytic departments of leading pharmaceutical companies nowadays carry out systematic work to detect polymorphism of their drugs and to find intelligent applications of this phenomenon. Drug registration documents submitted by leading pharmaceutical companies to regulatory bodies will today, almost without exception, have a section on polymorphism when describing the physico-chemical properties of the active substance."
Of het uitvoeren van een volledig polymorfie-onderzoek begin 1993 tot de standaard procedures behoorde (in het bijzonder ten aanzien van vitamine D-derivaten) - zoals Sandoz stelt, maar Leo Pharma betwist - is niet doorslaggevend. Waar het om gaat is dat de vakman bekend was met onderzoek naar polymorfisme en het belang daarvan.
18. Daarvan uitgaand zou de vakman, geconfronteerd met het hiervoor gedefinieerde probleem, naar 's hofs overtuiging, onderzoek hebben gedaan naar het bestaan van andere kristallijne verschijningsvormen van calcipotriol, met een mogelijk grotere opslagstabiliteit. Het hof verwerpt in dit verband de stelling van Leo Pharma dat de vakman geen enkele aanleiding had om te zoeken naar andere kristallijne vormen aangezien het zoeken naar andere kristallijne vormen destijds geen routine was en daartoe ook geen concrete aanleiding bestond omdat het calcipotriol anhydraat goed bruikbaar en voldoende stabiel was. Leo Pharma ziet hierbij over het hoofd dat het vertrekpunt is het hiervoor genoemde objectieve technische probleem, namelijk of de opslagstabiliteit van het bekende calcipotriol (anhydraat) zou kunnen worden verbeterd. Het hof gaat voorts voorbij aan het betoog van Leo Pharma dat de vakman geen volledig polymorfie-onderzoek zou hebben uitgevoerd omdat dat begin 1993 (in de farmaceutische industrie) niet gebruikelijk was. Het gaat immers niet om een onderzoek naar alle mogelijke kristallijne vormen van calcipotriol, maar om het zoeken naar een kristallijne vorm die een betere opslagstabiliteit zou hebben dan het anhydraat. Zoals in rov. 17 is overwogen, was de vakman zich er, ook begin 1993, terdege van bewust dat het onderzoek naar (andere) (pseudo)polymorfe verschijningsvormen van een werkzame stof, mede met het oog op de opslagstabiliteit daarvan, zinvol was.
19. Aangezien calcipotriol een vitamine D-analogon voor topische toepassing is, zou de vakman hebben gezocht naar andere documenten over dergelijke vitamine D-verbindingen (vgl. Prof. Kutz (blz. 39, voorlaatste alinea): ' ... eine suche nach strukturell ähnlichen Wirkstoffmolekülen, die in den gleichen Darreichungsform eingesetzt werden, bzw. dafür geeignet sein sollen (spiegelt) eine Standardvorgehensweise im Rahmen der Pharmazeutisch-technologischen Arzneimittelentwicklung wieder.') Daarbij zou hij zijn gestuit op de Amerikaanse octrooischriften US 3.883.622 (3 september 1974) en US 4.435.325 (6 maart 1984), alsmede de ter inzage gelegde Japanse octrooiaanvrage JP 59-104358 (16 juni 1984), hierna te noemen: respectievelijk US 622, US 325 en JP 358. In deze documenten wordt, kort gezegd, de vorming van een (mono)hydraat van de vitamine D-analoga 25-hydroxycholecalciferol (US 622), 1a,25-dihydroxycholecalciferol (US 325) en 1a,24-dihydroxycholecalciferol (JP 358) beschreven. In deze octrooien worden de gunstige eigenschappen van (mono)hydraten genoemd, waaronder een grote stabiliteit, terwijl ook melding wordt gemaakt van de geschiktheid tot gebruik in therapeutische werkzame formuleringen.
US 622 beschrijft een groep van kristallijne, op vitamine D gelijkende hydraten, aldaar aangeduid met de algemene structuurformule VI, waaronder in het bijzonder kristallijn 25-hydroxycholecalciferol monohydraat (smeltpunt 81-83 0C, 'Example 8'). Het 25-hydroxycholecalciferol monohydraat wordt bereid door oplossen van 25-hydroxycholecalciferolanhydraat (als amorfe olie) in een organisch oplosmiddel, zoals watervrij methyleenchloride, benzeen, ethanol en aceton, gevolgd door toevoegen van water ('a drop of water', 'Example 15') waarbij het kristallijne monohydraat neerslaat (in de vorm van 'nice crystals'). De kristallijne hydraten met algemene formule VI, waaronder het monohydraat van 25-hydroxycholecalciferol 'are more readily purified, and more stable and less sensitive to autoxidation' (dan de anhydraten) (kolom 3, regels 25-50). Deze hydraten kunnen worden toegepast in 'common unit dosage forms, e.g. oil solution, aqueous suspension ...' (kolom 6, regels 51-62)
US 325 heeft meer specifiek betrekking op de bereiding van kristallijn monohydraat van 1a,25-dihydroxycholecalciferol (met vitamine D activiteit) in zuivere vorm. Hierbij wordt uitgegaan van watervrij amorf 1a,25-dihydroxycholecalciferol (of 1a,25-dihydroxycholecalciferol in solvaatvorm), waarbij deze verbinding wordt opgelost in een (watervrij) organisch oplosmiddel, zoals methanol, ethanol en, bij voorkeur, aceton , gevolgd door de toevoeging van water, waarbij het monohydraat van 1a,25-dihydroxycholecalciferol wordt verkregen 'which is perfectly crystalline, very stable and is easily obtained in a pure form' (kolom 1, regels 46-51).
Het 1a,25-dihydroxycholecalciferol monohydraat kan worden geformuleerd in uiteenlopende farmaceutische toepassingen, waaronder suspensies (kolom 2, regels 4-9).
JP 358 heeft betrekking op zuiver 1a,24-dihydroxycholecalciferol monohydraat in kristalvorm. Deze verbinding met vitamine D-activiteit (blz. 2, eerste alinea en blz.3, laatste alinea) wordt verkregen door het 1a,24-dihydroxycholecalciferol anhydraat ('a very unstable substance') op te lossen in een lagere alcohol, zoals methanol of ethanol, gevolgd door de toevoeging van water, waarbij het monohydraat neerslaat in de vorm van kristallijne naaldjes.
In het document wordt voorts gerefereerd aan de Japanse octrooiaanvraag
JP 55-160758, waarin is vermeld dat 1a,25-dihydroxycholecalciferol, een analoog van 1a,24-dihydroxycholecalciferol, gemakkelijk kan worden gekristalliseerd als monohydraat door de stof (als anhydraat) op te lossen in een organisch oplosmiddel als aceton of ethylether, gevolgd door de toevoeging van water.
De structuurformules van deze vitamine D-analoga, alsmede die van calcipotriol, zijn als volgt:
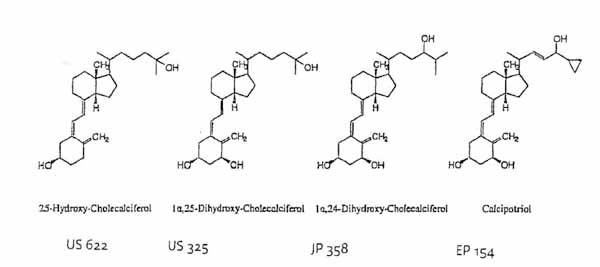
Deze vitamine D-analoga bezitten alle twee gefuseerde ringen, een cyclohexaanring met daaraan één of twee hydroxylgroepen en een zijgroep, met daaraan een OH-groep.
20. Voorts zou de vakman hebben kennis genomen van het artikel van K. Kragballe, getiteld "Vitamin D Analogues in the Treatment of Psoriasis" in 'Journal of Cellular Biochemistry' 49, (1992) 46-52 (productie 35 Sandoz). In dit artikel vergelijkt Kragballe de geschiktheid van calcipotriol voor de topische behandeling van psoriasis met die van de stoffen 1a,25-dihydroxycholecalciferol (1,25-(OH)2-D3) en 1a,24-dihydroxycholecalciferol (1,24-(OH)2-D3) de vitamine D (D3)-analoga die onderwerp zijn van de zojuist besproken documenten US 325 en JP 358). In figuur 1 zijn de structuurformules van 1a,25-dihydroxycholecalciferol (1,25-(OH)2-D3) en calcipotriol naast elkaar gezet. Zoals ook uit de in rov. 19 weergegeven formules blijkt, vertonen deze grote gelijkenis. Hetzelfde geldt voor calcipotriol in vergelijking met 1a,24-dihydroxycholecalciferol (1,24-(OH)2-D3). Ook Prof. Kutz (t.a.p., blz. 37-39) en dr. Freyria Fava (de deskundige in de Italiaanse procedure, prod. 29B Sandoz, blz. 37-38) constateren dat de betreffende stoffen qua structuur grote gelijkenis vertonen.
21. Uitgaande van het objectieve technische probleem zou de vakman in voornoemde documenten naar het oordeel van het hof een sterke aansporing hebben gevonden om, met toepassing van de werkwijzen beschreven in US 622, US 325 en
JP 358, monohydraat van calcipotriol te verkrijgen. Tijdens het pleidooi voor het hof heeft Sandoz er nogmaals op gewezen dat het gaat om eenvoudige, routinematige proeven. De deskundigen Prof. Kutz (blz. 40) en dr. Freyria Fava (blz.38), bevestigen dat het gaat om eenvoudige, niet kostbare proeven, die tot het standaard gereedschap van de vakman behoren (Prof. Kutz: '...sehr einfach durchzuführendes, Kristallisationsverfahren...'). Leo Pharma heeft dat ook onvoldoende gemotiveerd bestreden. De omstandigheid dat, zoals Leo Pharma stelt, op basis van de theorie geen voorspelling kan worden gedaan over de uitkomst van een dergelijk polymorfie-onderzoek, zou de vakman niet hebben weerhouden van het uitvoeren van bedoelde proeven, juist omdat het doen daarvan eenvoudig en niet kostbaar is (en was, ook op de prioriteitsdatum). Om dezelfde reden zouden ook de door Leo Pharma genoemde omstandigheden i) dat van de in US 622, US 325 en JP 358 beschreven vitamine D-derivaten nog helemaal geen kristallijne vorm beschikbaar was, doch slechts de amorfe stof en ii) dat kristallisatie van vitamine D-derivaten moeilijk is en iii) dat er op de prioriteitsdatum meer dan 600 vitamine D-derivaten bekend waren, waarvan slechts 3 als monohydraat waren geregistreerd, de vakman, geconfronteerd met de beperkte opslagstabiliteit van calcipotriol anhydraat en opererend in de in rov. 17 beschreven omgeving, er niet van hebben weerhouden bedoelde experimenten uit te voeren. Uit WO 834 was al bekend dat calcipotriol wél te kristalliseren was en uit US 622, US 325 en JP 358 was het de vakman bekend dat het mogelijk was bij deze drie, qua structuur op calcipotriol gelijkende vitamine D-analoga, een monohydraat te vormen en wel op een vrij simpele manier. Hieraan ontleende de vakman een voldoende verwachting van succes om tot het doen van proeven over te gaan.
22. Het hof gaat voorbij aan de voor het eerst bij pleidooi door Leo Pharma aangevoerde stelling dat niet zeker is dat de vakman het monohydraat zou hebben gevonden. Leo Pharma voert aan dat de vakman had moeten kiezen uit een reeks variabelen, waaronder het soort oplosmiddel, de temperatuur, de hoeveelheden en de mate van roeren. Zij verwijst daarbij naar de door haar als bijlage 3 bij productie 70 overgelegde opinie van Prof. Bernstein. Het hof hecht echter meer waarde aan de verklaring van dr. Rasmussen, werkzaam bij Leo Pharma, in de cross examination voor Justice Floyd (prod. 42 Leo Pharma), weergeven in rov. 139 en 140:
"(...)
- Q.
I mean, you are not suggesting if a polymorph screen had been carried out on calcipotriol, that the hydrate would not have been found?
- A.
It would probably have been found, yes.
- Q.
I thought you agreed that you are not suggesting that the monohydrate would not have been found in the screen?
- A.
It is likely it would because as we also agreed yesterday, acetone and water are pretty common solvents in crystallization experiments."
In rov. 141 overweegt Justice Floyd dat het als eerste aangehaalde antwoord betrekking heeft op de uitvoering van een 'polymorph screen' en het tweede op het gebruik van een combinatie van aceton en water, 'a combination of solvents now known to produce the monohydrate'. Judge Floyd acht echter niet aannemelijk dat de vakman een dergelijke combinatie zou hebben geprobeerd (rov. 142).
In de procedure in het Verenigd Koninkrijk zijn US 622, US 325 en JP 358 evenwel niet overgelegd. Naar het oordeel van het hof zou de vakman, die kennis had genomen van deze documenten, de combinatie van aceton en water zeker hebben geprobeerd: in US 325 is reeds vermeld (kolom 1, regels 60-67) dat het organische oplosmiddel dat de voorkeur verdient aceton is, waarbij water wordt gebruikt om de stof neer te slaan. Uit de verklaring van Rasmussen volgt dat de vakman daarbij het monohydraat van calcipotriol zou hebben gevonden. Zo ook: dr. Freyria Fava, t.a.p., blz. 38. Terzijde merkt het hof op dat het in voorbeeld 1 van het onderhavige octrooi toegepaste ethylacetaat ook reeds als oplosmiddel is voorgesteld in US 622 (kolom 3, regels 38-44 en 56) waaraan vervolgens water wordt toegevoegd.
23. Tot slot zou de vakman op de prioriteitsdatum de vorming van calcipotriol monohydraat hebben kunnen vaststellen. Leo Pharma weerspreekt niet dat dit mogelijk was door middel van IR-spectroscopie en Raman spectroscopie, welke technieken op de prioriteitsdatum tot de algemene vakkennis van de vakman behoorden (memorie van antwoord 21).
24. Uit het voorgaande volgt dat conclusie 1 naar het oordeel van het hof inventiviteit ontbeert. De vakman zou zonder uitvinderswerkzaamheid tot de bereiding van calcipotriol monohydraat zijn gekomen. Het in rov. 14 genoemde bonuseffect, dat calcipotriol monohydraat, anders dan het bekende kristallijne calcipotriol anhydraat, bij wet ball milling geen stabiel schuim vormt, leidt bij die stand van zaken niet tot het oordeel dat het octrooi alsnog als inventief moet worden aangemerkt (vgl. Guidelines EOB G-VII, 10.2; zo ook het gerechtshof van Turijn (prod. 48 Sandoz), blz. 25 en 26).
25. Het oordeel van het hof komt overeen met dat van het Duitse Bundespatentgericht van 17 maart 2009 (prod. 38 Leo Pharma en vertaald prod. 28 Sandoz) en het Bundesgerichtshof van 15 mei 2012 (prod. 42 Sandoz), alsmede met het oordeel van de rechtbank van Turijn van 11 februari 2011 en het gerechtshof van Turijn van 29 mei 2012 (prod. 47 en 48 Sandoz). Het wijkt af van de beslissing van het District Court of Stockholm van 20 mei 2011 (prod. 64 Leo Pharma). In die procedure werd evenwel het "wet milling" probleem centraal gesteld. Het wijkt ook af van het oordeel van het High Court of Justice, Chancery Division, Patents Court (Justice Floyd) van 15 mei 2009 (prod. 42 Leo Pharma), bekrachtigd door het Court of Appeal op 17 november 2009 (prod. 46 Leo Pharma). In die procedure zijn, naar Sandoz onweersproken heeft gesteld, US 622, US 325 en JP 358 echter niet overgelegd, evenmin als het artikel van Kragballe.
26. Bij conclusie van antwoord in reconventie (nr. 103) en memorie van antwoord (nrs. 336-338 en 391) stelt Leo Pharma dat in elk geval de conclusies 2 tot en met 5 geldig zijn, omdat het maken van een verbeterde formulering op basis van calcipotriol monohydraat volgens deze conclusies, te weten als suspensie met daarin kristallen die een voldoende kleine en uniforme deeltjesgrootte verdeling hebben, niet voor de hand lag, ook niet indien de vakman calcipotriol monohydraat zou kennen. In dat kader wijst Leo Pharma erop dat er geen commercieel beschikbare farmaceutische formuleringen bekend waren waarin een vitamine D-analogon als actief bestanddeel in suspensie aanwezig was. Voorbeeld 4 van WO 807 is volgens haar nooit in de praktijk toegepast. Voorts wijst Leo Pharma erop dat Sandoz verzuimd heeft met betrekking tot de conclusies 2, 3 en 5 een objectieve probleemstelling te formuleren.
27. Bij conclusie van antwoord in conventie/van eis in reconventie heeft Sandoz aangevoerd dat zij haar calcipotriol crème bereidt overeenkomstig voorbeeld 4 van WO 807 (CvA/CvE 24 en 25). Voorts heeft zij gesteld dat de conclusies 2-5 voor de hand lagen omdat WO 834 reeds voorstelde farmaceutische samenstellingen van calcipotriol te bereiden in conventionele vorm voor topische toepassing, zoals crèmes of gels in een voorkeursdosis van 10-500 µg calcipotriol per gram preparaat (CvA/CvE 68).
28. WO 807 is de verkorte aanduiding van de PCT-aanvrage WO 91/12807. Dit octrooi op naam van Leo Pharma is gepubliceerd voor de prioriteitsdatum van EP 154, namelijk op 5 september 1991, met als prioriteitsdatum 1 maart 1990 (prod. 7 Sandoz). Het heeft betrekking op het gebruik van bepaalde vitamine D-analogen bij de bereiding van farmaceutische preparaten voor de behandeling van acné. Eén van die vitamine D-analogen die wordt aangewezen als actieve stof is MC903, bekend uit WO 834. MC903 is de aanduiding van calcipotriol. In de beschrijving van WO 807 valt te lezen (blz. 3, regels 6-31):
"The preparations may conveniently be prepared by any of the methods well known in the art of pharmacy. (....). Preparations suitable for topical administration include liquid or semi-liquid preparations such as liniments, lotions, applicants, oil-in-water or water-in-oil emulsions such as creams, ointments or pastes; or solutions or suspensions such as drops. (...). In the topical treatment, ointments, creams, or lotions containing from 1-100 µg of the vitamin D analogues or metabolics are administered."
In voorbeeld 4 (blz. 6) wordt de bereidingswijze voor een crème bevattend 100 µg MC903/g beschreven. De betreffende stof (calcipotriol) wordt als suspensie aan de (op conventionele wijze bereide) emulsie toegevoegd. In de stand van de techniek was de bereiding van farmaceutische preparaten als die welke onderwerp zijn van de conclusies 2-5 van EP 154, met calcipotriol als werkzame stof, derhalve reeds bekend. Bij de door Leo Pharma zelf gesuggereerde objectieve probleemstelling voor de conclusies 2-5, te weten: het verschaffen van een verbeterde farmaceutische formulering (conclusie van antwoord in reconventie 103 en memorie van antwoord 391), lag toepassing van calcipotriol monohydraat, met de gevonden voordelen ten opzichte van calcipotriol anhydraat, in farmaceutische bereidingen als omschreven in WO 807, derhalve voor de hand voor de vakman. Dat voorbeeld 4 van WO 807 (volgens Leo Pharma) nooit in de praktijk was toegepast doet daaraan niet af. Ook de conclusies 2-5 zijn derhalve niet inventief.
Slotsom
29. Het voorgaande brengt mee dat de vordering tot vernietiging van het Nederlandse deel van EP 154 toewijsbaar is. Bij die stand van zaken behoeft het beroep op niet-nieuwheid en niet-nawerkbaarheid van het octrooi geen beoordeling. Uitgaande van de ongeldigheid van het octrooi is van inbreuk daarop door Sandoz geen sprake. De vorderingen van Leo Pharma dienen dus alsnog te worden afgewezen.
30. Sandoz vordert in haar memorie van grieven tevens voor recht te verklaren dat Leo Pharma onrechtmatig heeft gehandeld door het vonnis waarvan beroep in eerste aanleg ten uitvoer te doen leggen en Leo Pharma te veroordelen tot vergoeding van de schade die Sandoz daardoor heeft geleden. In haar memorie van grieven onder 16 licht Sandoz deze vorderingen aldus toe dat zij haar calcipotriol houdende zalf sinds de tenuitvoerlegging van het vonnis niet meer op de Nederlandse markt heeft kunnen brengen. Leo Pharma heeft de betreffende stelling en vorderingen niet bestreden, althans niet anders dan door aan te voeren dat het vonnis juist is. Nu het hof daar anders over oordeelt en voorts aannemelijk is dat Sandoz door de tenuitvoerlegging van het vonnis schade heeft geleden, zal het hof de vorderingen toewijzen.
31. Leo Pharma zal als de in het ongelijk gestelde partij in de kosten van beide instanties worden veroordeeld. Sandoz maakt - evenals Leo Pharma - aanspraak op vergoeding van haar proceskosten met toepassing van artikel 1019h Rv. Het hof heeft in de gedingstukken van Sandoz geen specificatie van haar kosten in eerste aanleg aangetroffen. Het hof heeft echter ook geen specificatie aangetroffen van de kosten die Leo Pharma in eerste aanleg heeft gemaakt, terwijl de rechtbank deze wel heeft begroot. Aan te nemen valt derhalve dat partijen de rechtbank ter zitting over hun kosten hebben geïnformeerd. Uit de pleitnota's van partijen voor de zitting van de rechtbank blijkt niet van enig bezwaar tegen de over en weer gevorderde kosten. Ook in hoger beroep hebben partijen het hof hierover niets gemeld. Gelet op een en ander zal het hof de door Sandoz in eerste aanleg gemaakte kosten begroten op het bedrag waarop Sandoz deze in eerste aanleg heeft begroot.
Voorts zal worden toegewezen de vordering tot terugbetaling van de door Sandoz aan Leo Pharma vergoede kosten van de procedure in eerste aanleg, te weten
€ 140.000,-.
De kosten van het hoger beroep heeft Sandoz begroot op € 358.921,57 exclusief BTW. Leo Pharma maakt daartegen slechts bezwaar voor wat betreft de in die begroting opgenomen kosten van het incident, waarvan zij stelt dat deze € 81.000,- exclusief BTW bedragen. Sandoz heeft dat laatste niet betwist. Leo Pharma grondt haar bezwaar tegen toewijzing van de door Sandoz voor het incident gemaakte kosten klaarblijkelijk op de afwijzing van de incidentele vordering van Sandoz.
Nu de vordering tot schorsing van de tenuitvoerlegging van het vonnis waarvan beroep op de door Sandoz daartoe aangevoerde gronden niet toewijsbaar was, acht het hof het niet redelijk de daaraan verbonden kosten van Sandoz voor rekening van Leo Pharma te brengen. Anderzijds acht het hof het ook niet redelijk de door Leo Pharma in het incident gemaakte kosten voor rekening van Sandoz te brengen. Immers, thans is gebleken dat de vorderingen van Leo Pharma door de rechtbank ten onrechte zijn toegewezen. Het hof zal de over en weer in het incident gemaakte kosten dan ook compenseren. Een en ander leidt ertoe dat het hof Leo Pharma zal veroordelen om ter zake van in hoger beroep gemaakte kosten een bedrag van
€ 277.921,57 te voldoen.
Beslissing
Het hof
vernietigt het vonnis waarvan beroep en opnieuw recht doende:
in conventie
wijst de vorderingen af;
in reconventie
vernietigt het Nederlandse deel van het Europees octrooi 0 679 154 B1;
verklaart voor recht dat Leo Pharma onrechtmatig heeft gehandeld door het vonnis waarvan beroep ten uitvoer te doen leggen en veroordeelt Leo Pharma tot vergoeding aan Sandoz van de schade die Sandoz daardoor heeft geleden;
in conventie en in reconventie
veroordeelt Leo Pharma in de door Sandoz in eerste aanleg gemaakte kosten van het geding en stelt deze vast op het bedrag waarop Sandoz deze kosten in eerste aanleg heeft begroot;
veroordeelt Leo Pharma om de door Sandoz aan Leo Pharma voldane proceskosten in eerste aanleg ad € 140.000,- aan Sandoz terug te betalen;
veroordeelt Leo Pharma in de door Sandoz in hoger beroep gemaakte kosten, begroot op
€ 277.921,57;
in het incident
compenseert de kosten van het incident aldus dat iedere partij de eigen kosten draagt;
verklaart dit arrest voor zover mogelijk uitvoerbaar bij voorraad.
Dit arrest is gewezen door mrs. A.D. Kiers-Becking, T.H. Tanja-van den Broek en R.A. Grootoonk, en is uitgesproken ter openbare terechtzitting van 9 april 2013 in aanwezigheid van de griffier.