Hof Den Haag, 07-11-2017, nr. 200.195.459/01
ECLI:NL:GHDHA:2017:4029
- Instantie
Hof Den Haag
- Datum
07-11-2017
- Zaaknummer
200.195.459/01
- Vakgebied(en)
Intellectuele-eigendomsrecht (V)
- Brondocumenten en formele relaties
ECLI:NL:GHDHA:2017:4029, Uitspraak, Hof Den Haag, 07‑11‑2017; (Hoger beroep)
- Vindplaatsen
BIE 2018/2
Uitspraak 07‑11‑2017
Inhoudsindicatie
Intellectuele eigendom; octrooirecht; octrooi op farmaceutisch preparaat voor de behandeling van psoriasis; inventiviteit; plausibiliteit van effect; verhouding kort geding en oppositieprocedure
Partij(en)
GERECHTSHOF DEN HAAG
Afdeling Civiel recht
Zaaknummer : 200.195.459/01
Zaaknummer rechtbank : C/09/508351/ KG ZA 16-404
arrest van 7 november 2017
inzake
LEO PHARMA A/S,
gevestigd te Ballerup, Denemarken,
appellante in principaal beroep, geïntimeerde in incidenteel beroep,
hierna te noemen: Leo,
advocaat: mr. T.M. Blomme te Amsterdam,
tegen
SANDOZ B.V.,
gevestigd te Weesp,
geïntimeerde in principaal beroep, appellante in incidenteel beroep,
hierna te noemen: Sandoz,
advocaat: mr. J.A. Dullaart te Naaldwijk.
1. Het geding
1.1.
Bij exploot van 7 juni 2016 is Leo in hoger beroep gekomen van een door de voorzieningenrechter in de rechtbank Den Haag tussen partijen gewezen vonnis van 11 mei 2016. Bij memorie van grieven met producties heeft Leo zeven genummerde grieven en een algemene grief aangevoerd. Bij memorie van antwoord tevens memorie van grieven in incidenteel appel met producties heeft Sandoz de grieven bestreden en tevens incidenteel appel ingesteld en daartoe één grief geformuleerd. Leo heeft hierop gereageerd bij memorie van antwoord in incidenteel appel. De advocaat van Leo heeft bij e-mailbericht van 19 juni 2017 laten weten dat partijen een afspraak hebben gemaakt omtrent de proceskosten in hoger beroep. Volgens die afspraak bedragen deze in totaal € 200.000,-, volledig toe te rekenen aan het principaal appel.
1.2.
Vervolgens hebben partijen op 29 juni 2017 de zaak doen bepleiten, Leo door haar hiervoor genoemde advocaat en mr. W.A. Hoyng, advocaat te Amsterdam, bijgestaan door octrooigemachtigde dr. J.H.J. den Hartog en Sandoz door mr. D.F. de Lange en mr. R. Broekstra, advocaten te Amsterdam, allen aan de hand van overgelegde pleitnotities. Op diezelfde datum heeft Leo een akte houdende overlegging aanvullende producties genomen, met producties 24 tot en met 27, en heeft Sandoz een akte houdende overlegging producties genomen, met producties 31 tot en met 35, en een aanvullende productie 36 ingediend. Ten slotte hebben partijen arrest gevraagd.
2. De feiten
2.1.
De door de voorzieningenrechter in het vonnis van 11 mei 2016 vastgestelde feiten zijn niet in geschil. Ook het hof zal daarvan uitgaan.
2.2.
Leo is een wereldwijd opererende geneesmiddelenproducent. Zij brengt onder meer geneesmiddelen op de markt voor de uitwendige behandeling van psoriasis met daarin calcipotriol als actief bestanddeel. Psoriasis is een ziekte waarbij cellen in de huid te snel worden aangemaakt, waardoor rode plekken en schilfers ontstaan. Een van de door Leo in Nederland op de markt gebrachte geneesmiddelen is Dovobet, een zalf van een combinatie van de actieve bestanddelen calcipotriol en betamethason (in de vorm van het diproprionaat-zout) en een oplosmiddel (Arlamol-E).
2.3.
Sandoz is onderdeel van de Novartis-groep en producent van generieke geneesmiddelen in Nederland.
2.4.
Leo is houdster van het Europese octrooi EP 2 455 083 B1 (hierna EP 083 of het octrooi). Dit octrooi is getiteld “Pharmaceutical composition for dermal use comprising calcipotriol and betamethasone for treating psoriasis”. Het octrooi is verleend op 18 september 2013 op een aanvrage daartoe van 27 januari 2000, onder inroeping van prioriteit op basis van de nationale Deense aanvrage van 23 april 1999 met nummer DK 1999 00561(hierna: DK 561). Het octrooi heeft onder meer gelding in Nederland. De conclusies luiden in de oorspronkelijke Engelse taal als volgt:
1. A non-aqueous topical pharmaceutical composition in the form of an ointment, a cream, a lotion, a liniment or other spreadable liquid or semi-liquid preparation for dermal use in the treatment of psoriasis, sebopsoriasis or seborrheic dermatitis in humans and other mammals, said composition comprising a first pharmacologically active component A consisting of calcipotriol and a second pharmacologically active component B consisting of betamethasone or an ester thereof and at least one pharmaceutically acceptable carrier, solvent, or diluent.
2. A pharmaceutical composition for use according to claim 1, wherein component B consists of a betamethasone ester, such as the 17-valerate or 17,21-dipropionate.
3. A pharmaceutical composition for use according to any one of the preceding claims in the form of a mono-phase composition.
4. A pharmaceutical composition for use according to the preceding claim which is an ointment.
5. A pharmaceutical composition for use according to claim 1 characterised in that the difference between the optimum stability pH of said first component A and the optimum pH of said second component B is at least 1 further comprising at least one solvent component C selected from the group consisting of:
(i) compounds of the general formula R3(OCH2C(R1)H)xOR2 (I) wherein x is in the range of 2-60, R1 in each of the x units independently is CH3, R2 is straight chain or branched C1-20 alkyl or benzoyl, and R3 is H or phenylcarbonyloxy;
(ii) di-(straight or branched)-C4-10 alkyl esters of C4-C8 dicarboxylic acids;
(iii) straight or branched C12-18-alkyl benzoates;
(iv) straight or branched C2-4-alkyl esters of straight or branched C10-18-alkanoic or alkenoic acids;
(v) propylenglycol diesters with C8-14-alkanoic acids; and
(vi) branched primary C18-24 alkanols.
6. A composition for use according to the preceding claim, wherein said component C is selected from compounds of the general formula H(OCH2C(R1)H)xOR2 (II) where R1, x, and R2 are as defined in claim 5, and mixtures thereof.
7. A composition for use according to claim 6, wherein said component C is polyoxypropylene-15-stearyl ether.
8. A pharmaceutical composition for use according to claim 5, containing 0.0001 to 0.025% w/w of said component A, 0.005 to 0.1% w/w of said component B, and 1 to 20% w/w of said solvent component C.
9. A pharmaceutical composition for use according to claim 1, wherein, in the treatment, the composition is applied topically once or twice daily in a medically sufficient dosage.
2.5.
De conclusies luiden in de niet-bestreden Nederlandse vertaling als volgt:
1. Niet-waterig topisch farmaceutisch preparaat in de vorm van een zalf, een crème, een lotion, een smeersel of ander smeerbaar vloeibaar of half-vloeibaar preparaat voor dermaal gebruik bij de behandeling van psoriasis, sebopsoriasis of seborroïsche dermatitis bij mensen en andere zoogdieren, welk preparaat omvat een eerste farmacologisch actieve component A bestaande uit calcipotriol en een tweede farmacologisch actieve component B bestaande uit betamethason of een ester daarvan en ten minste één farmaceutisch aanvaardbare drager, oplosmiddel of verdunningsmiddel.
2. Farmaceutisch preparaat voor gebruik volgens conclusie 1, waarbij component B bestaat uit een betamethasonester, zoals het 17-valeraat of 17,21-dipropionaat.
3. Farmaceutisch preparaat voor gebruik volgens één van de voorgaande conclusies in de vorm van een monofasepreparaat.
4. Farmaceutisch preparaat voor gebruik volgens de voorgaande conclusie, dat een zalf is.
5. Farmaceutisch preparaat voor gebruik volgens conclusie 1, met het kenmerk dat het verschil tussen de pH voor optimale stabiliteit van de eerste component A en de optimale pH van de tweede component B ten minste 1 is, verder omvattende ten minste één oplosmiddelcomponent C gekozen uit de groep bestaande uit:
(i) verbindingen met de algemene formule R3 (OCH2C(R1)H)xOR2 (I) waarin x ligt in het traject van 2-60, R1 in elk van de x eenheden onafhankelijk CH3 is, R2 recht of vertakt C1-20 -alkyl of benzoyl is, en R3 H of fenylcarbonyloxy is;
(ii) di- (recht of vertakt) -C4-10-alkylesters van C4-C8dicarbonzuren;
(iii) rechte of vertakte C12-18-alkylbenzoaten;
(iv) rechte of vertakte C2-4 -alkylesters van rechte of vertakte C10-18-alkaan- of alkeenzuren;
(v) propyleenglycoldiesters met C8-14 alkaanzuren; en
(vi) vertakte primaire C18-24 alkanolen.
6. Preparaat voor gebruik volgens de voorgaande conclusie, waarbij de component C gekozen is uit verbindingen met de algemene formule H(OCH2C(R1 )H)xOR2 (II) waarin R1, x en R2 zijn zoals gedefinieerd in conclusie 5, en mengsels daarvan.
7. Preparaat voor gebruik volgens conclusie 6, waarbij de component C polyoxypro-pyleen-15-stearylether is.
8. Farmaceutisch preparaat voor gebruik volgens conclusie 5, dat 0,0001 tot 0,025% w/w van de component A, 0,005 tot 0,1% w/w van de component B en 1 tot 20% w/w van de oplosmiddelcomponent C bevat.
9. Farmaceutisch preparaat voor gebruik volgens conclusie 1, waarbij het preparaat bij de behandeling één of twee maal per dag in een medisch voldoende dosering wordt aangebracht.
2.6.
De beschrijving van EP 083 bevat onder meer de navolgende passages:
[0002] In the treatment of a number of conditions using dermal application, e.g. in the treatment of psoriasis, it is often indicated to employ a combination treatment incorporating two or even more different pharmacologically active compounds. Thus, in the treatment of e.g. psoriasis, it is common to use a combination treatment involving a steroid compound, such as a corticosteroid compound, and a vitamin D analogue such as calcipotriol, and where each of the active compounds are formulated in separate preparations.
[0003] Clinical studies have been conducted in psoriasis patients wherein calcipotriol was administered in the morning and betamethasone dipropionate or valerate in the evening. Combination therapy was more effective than monotherapy. (…)
[0004] Until now a topical pharmaceutical composition comprising a combination of a vitamin D analogue and a topical steroid has not been described. Moreover, these two types of compounds often have optimum stability values of pH that differ significantly from one another making it non-obvious to attempt to prepare a topical pharmaceutical preparation containing a steroid compound together with a vitamin D analogue. (…)
[0005] The following example describes the difficulties encountered when the skilled person wishes to prepare a combination composition for topical use comprising both a vitamin D or a vitamin D analogue or derivative and a topical steroid: The vitamin D analogue calcipotriol, as well as other examples of vitamin D analogues, requires a pH value above 8 for maximum stability, whereas corticosteroids such as Betamethasone (9- fluoro-11, 17, 21-trihydroxy- 16- methylpregna- 1, 4- diene- 3, 20- dione) require pH values in the range of 4- 6 for maximum stability. Since the base auxiliary materials and additives traditionally used in preparing topical formulations, such as creams and/or ointments, involve having some kind of acid or alkaline nature or reaction ability, it has therefore hitherto not been possible to combine the two active compounds in one single formulation while maintaining good stability of the active compounds.
[0006] Consequently, physicians have had to resort to letting patients under this type of two- component regimen perform sequential application of two creams/ointments, each containing one of the compounds formulated at its maximum stability pH. This may lead to incompatibility of the preparations so that patients must, e.g., apply one cream/ointment in the morning and the other in the evening. Needless to say, patient compliance as well as correct administration dosage is a problem under such circumstances. Richards, H.L. et al. report in J Am Acad Dermatol 1999 Oct; 41(4):581-3 on a study of patients with psoriasis and their compliance with medication. They report that poor compliance with treatment advice in chronic conditions, such as psoriasis, represents a major challenge to health care professionals: Thirty-nine percent of participants reported that they did not comply with the treatment regimen recommended. The noncompliant group had a higher self-rated severity of psoriasis, were younger, and had a younger age at onset than those who were compliant. The noncompliant group reported that psoriasis had a greater impact on daily life.
(…)
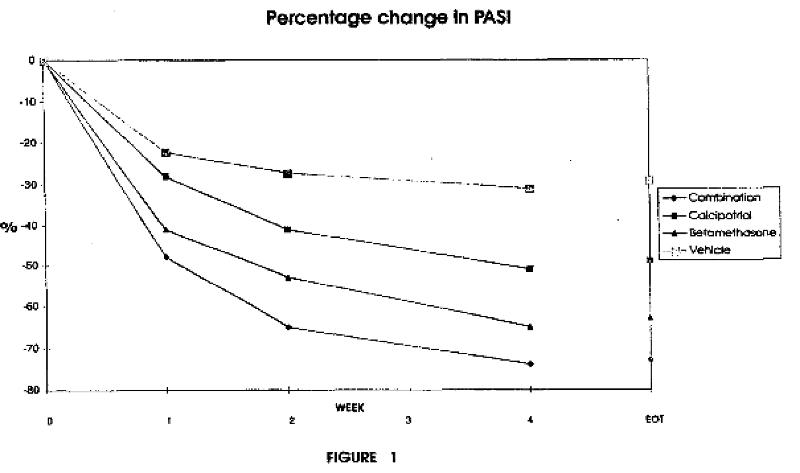
[0012] Fig. 1 is a graphic illustration of the percentage change in PASI score obtained during 4 weeks of clinical trial where the efficacy of a preparation according to the invention containing calcipotriol hydrate (52.2μ.g/g) and betamethasone dipropionate (0.643mg/g) is compared to that of a preparation in the same vehicle containing only calcipotriol hydrate (52.2μg/g) and a preparation in the same vehicle of betamethasone dipropionate (0.643mg/g). Fig. 1 shows an efficacy of the preparation of the invention which by far exceeds the efficacy obtainable by the two single component preparations. The change in PASI score reflects in the group of patients treated with the preparation of the invention a success of treatment of psoriasis hitherto unattainable by treatment with commercial preparations containing either calcipotriol or betamethasone, or by alternating treatment with such commercial preparations (cf.) thus proving the advantage of having the two active components present in the same preparation. (EOT=end of treatment).
Fig. 2 is a table showing the figures for percentage change in PASI score at each visit and end of treatment for the same clinical trial as described for Fig. 1. (…)
(…)
[0020] The composition according to the invention provides the following therapeutic advantages in the treatment of skin diseases, such as psoriasis, sebo-psoriasis and related disorders, compared to the single compound therapy or combination therapy of the prior art:
[0021] A clinical investigation has showed that treatment of psoriasis patients with a composition according to the invention comprising calcipotriol and betamethasone resulted in a faster onset of healing and a more effective healing of plaques than patients treated with only one of the active compounds.
[0022] The composition of the invention, which combines a vitamin D analogue and a topical steroid, provides synergy in the form of additional benefit to the patient apart from the direct therapeutic value of the active substances. It has been shown that the skin irritative side effects of a vitamin D analogue, such as calcipotriol, is alleviated by the simultaneous application of a steroid, such as betamethasone, onto psoriatic skin, an effect that is only attainable using a two- component or multi- component treatment regimen where a vitamin D analogue and a steroid cannot be applied simultaneously to affected skin due to incompatibility of the praparations. When both a vitamin D analogue and a topical steroid are used in a combination treatment of psoriasis it has hitherto been necessary to use separate applications, typically one in the morning and the other in the evening, making it impossible to obtain any synergistic effect of the two types of active compounds (cf. Ortonne, J.P., Nouv. Dermatol., 1994, 13 (10), p. 746- 751), or where a certain degree of synergistic effect, such as less skin irritation, has been reported for a two- component regiment (cf. Kragballe, K. et al. Br J Dermatol 1998 Oct; 139 (4): 649- 54, and Ruzicka, T. et Lorenz, B. Br J Dermatol 1998, 138 (2), 254- 58) a substantial proportion of psoriasis patients will not benefit due to non- compliance with the treatment regimen.
[0023] Satisfactory medical treatment of skin disorders, such as psoriasis, can be attained in a shorter period of time using the composition according to the invention resulting in a reduction of steroid side effects, such as skin atrophy and rebound. Besides, it can be anticipated that even a milder acting steroid of group I, such as hydrocortisone which is presently not administered for psoriasis treatment, will be efficient in reducing or even eliminating the skin irritation which often follows calcipotriol treatment.
[0024] Thus, the tolerance of the treatment will be considerably improved due to reduction of side effects of the active compounds.
2.7.
EP 083 bevat onder meer de navolgende figuren 1 en 2:

2.8.
EP 083 is verleend naar aanleiding van een afgesplitste aanvrage van EP 1 178 808 (hierna: EP 808) dat is verleend op 30 mei 2012. EP 808 ziet op een ‘Non-aqueous pharmaceutical composition for dermal use to treat psoriasis comprising a vitamin D, a corticosteroid and a solvent component’.
2.9.
Na een tegen EP 808 gevoerde oppositieprocedure heeft de oppositieafdeling van het Europees Octrooibureau (OD) het octrooi in stand gehouden conform het eerste hulpverzoek, waarbij de definitie van het oplosmiddel is beperkt tot Arlamol-E. De OD overwoog onder meer als volgt:
(3.3.2)
The selection of the solvent component C as defined in claim 1 (dit is dezelfde oplosmiddelcomponent C als in conclusie 5 van EP 083, hof) of the contested patent is however obvious in view of the teaching of D12 in combination with D20a for solving the problem posed. In D20a, the skilled person finds a clear indication to use the compounds C(ii), (iv) and (v), in particular isopropyl myristate, for dissolving calcipotriol in non-aqueous formulations in order to provide stable formulations of the vitamin D analogue with a lipophilic base. Isopropyl myristate belongs to the group of compound C(iv) of claim 1 as granted and is used in all the examples of D20a.
Compound C of claim 1 comprises six large groups of solvents, each belonging to a different group of compounds. Even if experimental data have been provided for embodiments falling within the groups of compound C(i),(ii),(iv),(v) and (vi) to show that the problem has been solved, the skilled person would have been prompted to try, according to the teaching of D20a, any of the proposed solvents falling within the definition of compound C(ii), (iv) and (v) and to select the preferred isopropyl myristate as solvent for providing a stable composition comprising components A and B with a reasonable expectation of success and without the involvement of an inventive merit.
Thus, the requirements of art. 56 EPC of claim 1 of the MR are not fulfilled.
En voorts ten aanzien van het eerste hulpverzoek met beperking tot Arlamol-E:
(4.2.2.2)
It is common general knowledge that combining corticosteroids and vitamin D analogues in a single formulation for treating psoriasis provides better patient compliance and results in less side effects (in D11 and in D60, page 132). Moreover, it is known that calcipotriol is instable in acidic media (D20a and D12). In D20a, it is further suggested to formulate the instable vitamin D analogue in a hydrophobic or anhydrous solvent selected from fatty acid esters, higher alcohols and propylene carbonate and a lipophilic base such as white petrolatum or a mixture of white petrolatum and liquid paraffin (claim 1 of 020a). The examples show stable non-aqueous ointments using isopropyl myristate as solvent.
2.10.
Tegen dit besluit van de OD heeft Leo alsmede een aantal opposanten beroep ingesteld. Op dit beroep is nog niet beslist.
2.11.
De aanvragen voor zowel EP 083 als EP 808 zijn gebaseerd op de aanvrage WO 00/64450 (hierna WO 450). Conclusie 1 van WO 450 luidt als volgt:
1. A pharmaceutical composition for dermal use, said composition comprising a first pharmacologically active component A consisting of at least one vitamin D or vitamin D analogue and a second pharmacologically active component B consisting of at least one corticosteroid.
2.12.
In volgconclusie 6 van WO 450 wordt component A beperkt tot calcipotriol (of het hydraat), in volgconclusie 7 wordt voor component B onder meer betamethason genoemd. In conclusie 18 van WO 450 worden ter stabilisatie dezelfde 6 groepen oplosmiddel C genoemd als in conclusie 5 van EP 083. WO 450 bevatte net als het octrooi figuur 1 met de resultaten van een vergelijkend onderzoek en dezelfde toelichting op figuur 1 als in [00012] van het octrooi.
2.13.
In DK 561, ingediend op 23 april 1999 en aangeduid in EP 083 als het prioriteitsdocument, wordt een oplossing geclaimd voor het stabiliteitsprobleem dat optreedt bij het maken van een gecombineerde toepassing van een vitamine D-analoog en een corticosteroïde. DK 561 verschaft in conclusie 1 een niet-waterige samenstelling met voormelde bestanddelen (A en B) en ten minste één oplosmiddel uit een zestal aangewezen klassen (C, zie wederom conclusie 5 van EP 083). In de volgconclusies worden specifiek calcipotriol en betamethason genoemd. DK 561 bevatte geen figuur 1 met de resultaten van een vergelijkend onderzoek en evenmin de toelichting als bedoeld in [0012] van het octrooi. Conclusie 1 van DK 561 luidt als volgt:
1. A non-aqueous pharmaceutical composition for dermal use, said composition comprising
a first pharmacologically active component A consisting of at least one vitamin D analogue;
a second pharmacologically active component B consisting of at least one corticosteroid,
the difference between the optimum stability pH of a first pharmacologically active compound A and the optimum stability pH of a second pharmacologically active
component B being at least 1; and at least one solvent component t selected from the group consisting of:
(i) compounds of the general formula R3(OCH2C(R1)H)xOR2 (I) wherein x is in the range of 2-60, R1 in each of the x units independently is CH3, R2 is straight chain or branched C1-20 alkyl or benzoyl, and R3 is H or phenylcarbonyloxy;
(ii) di-(straight or branched)-C4-10 alkyl esters of C4-C8 dicarboxylic acids;
(iii) straight or branched C12-18-alkyl benzoates;
(iv) straight or branched C2-4-alkyl esters of straight or branched C10-18-alkanoic or alkenoic acids;
(v) propylenglycol diesters with C8-14-alkanoic acids; and
(vi) branched primary C18-24 alkanols.
2.14.
Tegen EP 083 is oppositie ingesteld bij het EOB. In april 2016 is Sandoz in deze procedure tussengekomen. Bij schriftelijke uitspraak van 6 oktober 2016 heeft de OD het octrooi ongewijzigd in stand gelaten. De relevante overwegingen van de OD over inventiviteit luiden als volgt:
6.1
The invention concerns a non-aqueous topical pharmaceutical composition for dermal use in the treatment of psoriasis, sebo-psoriasis or seborrheic dermatitis which comprises calcipotriol (component A) and betamethasone or an ester thereof (component B) and at least one pharmaceutically acceptable
carrier, solvent, or diluent.
6.2
The problem defined in the patent is the provision of stable combination therapy of psoriasis (sebo-psoriasis or seborrheic dermatitis) in the form of a pharmaceutical composition for dermal use comprising calcipotriol (comp. A) and betamethasone (comp. B). According to the patent, said composition has a higher patient compliance (page 4, [0022]) and results in a substantial
improvement in quality of life of the patients treated by this therapy (page 2, [007]). In addition, it is stated that the composition provides therapeutic advantages over single compound therapy or combination therapy disclosed in the art (page 4, [020]).
6.3
In view of the technical problem defined in the patent, 08 and 021 are the most relevant documents cited in the proceedings which can equally qualify as closest prior art for assessing inventive step. They address the same purpose as the present patent and has the two active components of claim 1: only these two documents disclose an effective topical treatment of psoriasis using calcipotriol and an ester of betamethasone (betamethasone valerate in 08, betamethasone dipropionate in 021). Documents D7, D9-D10, D12, D16-D17 cannot qualify as closest prior art for the following reasons: D9 is not dedicated to the treatment of psoriasis and has a different purpose. D7, D10, D12, D16-D17 have the same purpose
(treatment of psoriasis) but less features in common with the present invention than D8 or D21. D7, D10, D12 disclose a treatment by monotherapies. D16 and D17 disclose combination therapies which do not explicitly include the two specific active agents defined in the claims.
6.4
Problem solution approach starting from D21
The distinguishing features with D21 is the use of same components A and B (betamethasone dipropionate) administered as a single topical formulation (first difference) which is non aqueous (second difference). The effect identified in the patent is linked to the provision of a better
treatment of psoriasis using a fixed administration of components A and B. Starting from D21 as closest prior art, the technical problem to be solved may be formulated as the provision of an improved topical combination treatment of psoriasis.
The solution as proposed in claim 1 is characterized by the use of components A and B administered as a single topical formulation (first difference) which is non aqueous (second difference).
6.4.1
First, it has to be assessed whether the subject-matter of claim 1 plausibly solves the problem identified above. Example 1 of the patent discloses the preparation of a non-aqueous ointment
comprising calcipotriol as hydrate (A) and betamethasone as dipropionate (B) and specific excipients. Drawings 1-4 comprise the results of a clinical trial wherein a composition comprising betamethasone dipropionate and calcipotriol (hydrate) was more effective than the respective monotherapies in
patients suffering from psoriasis. The percentage change in PASI score (psoriasis area and severity index) was very high for the fixed combination. Therefore it is already credible from the disclosure of the application that an effect is linked to the administration of A and B as a fixed (single)
composition.
Post published document D11 is regarded to be relevant to back-up the teaching already present in the original application concerning an improved therapeutic effect in the treatment of psoriasis. The data of D11 are not a direct comparative data over the prior art D21 (e.g. based on a randomised
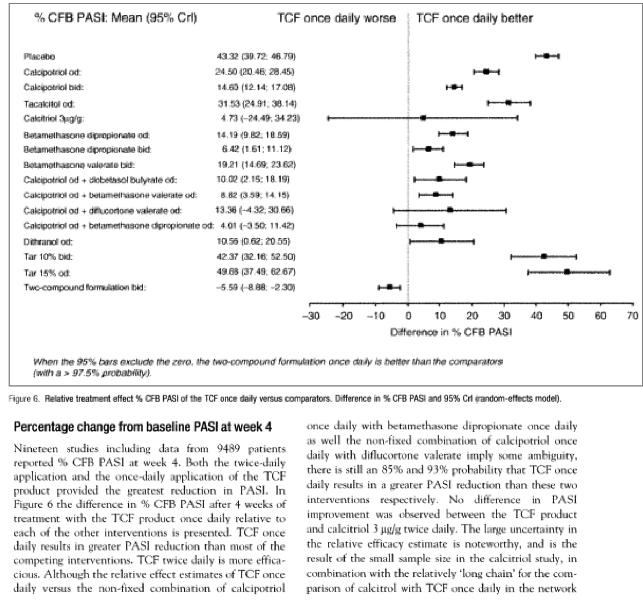
clinical trial) but provide a "meta-analysis" which compares the results of a phase III clinical trial with a two-compound formulation product ("TCF" in D11) with the results of known topical treatment of psoriasis (including monotherapies and combination treatment) and based on different clinical trials reported in the literature. An improvement over the combination used in D21, namely sequential administration of calcipotriol (Daivonex in the morning) and betamethasone dipropionate (Diprosone in the evening) is derivable from D11 (page 232, table 3, 12th column).
The Patentee made plausible that this meta-analysis is a valid model for comparing existing clinical trials based on the declaration of Dr. Ryttov (D31, page 2, section 6). Concerning the outcome of this analysis, D11 provides sufficient evidence that the once daily use of the fixed composition (TCF) has
a greater efficacy than all the other common topical treatment of psoriasis involving calcipotriol and/or betamethasone esters as mono or combination therapies, including these of D21 (see i.a. page 236, conclusion together with figure 4, page 233 and figure 6, page 234).
As indicated by the parties, no synergy can be attributed to the composition claimed over the combination known from D21. The OD, in the present case, is of the opinion that a synergy is not required. In the present case, the unexpected effect is linked to a better efficacy using the fixed composition, either once or twice daily, over all the existing therapies over 4 weeks of use
(see D11, figures 4 and 6; page 235, left-hand col., lines 6-9). Concerning the arguments that the improvement is not statistically significant due to the very slight improvement obtained or to the margin of errors present in the data, the OD cannot agree. There is no serious reason to question the statistically significance of the data analyzed in D11. On the contrary, a clear trend to a therapeutic improvement is confirmed by D11, namely a better and unpredictable efficacy combined with a simpler treatment when using the fixed composition over all the existing therapies. As the result of this improvement, a better patient compliance is plausibly obtained. The effect cannot be seen as a mere bonus effect and D11 backs up all the preliminary teaching originally disclosed in the application.
For sake of completeness, the feature "non-aqueous" does not contribute to the solution of the posed problem. The posed problem can still be solved by immediate application of any fresh (aqueous or non-aqueous) preparation comprising the two active agents.
6.4.2
Concerning the scope of the claims, there are no sound reasons to doubt that the results can be transferred to combinations comprising betamethasone or other betamethasone esters than betamethasone dipropionate as corticosteroid component, or to the treatment of the other related diseases (sebo-psoriasis, seborrhoeic dermatitis).
Moreover, the OD is satisfied that the claims contain all the essential features which contribute to the solution of the posed problem. It was contested that specific solvent component C was mandatory to stabilize the fixed composition. This view cannot be followed since it appears that component C
improves the long-term stability of the fixed compositions, but does not contribute to the enhanced anti-psoriatic efficacy. This feature is therefore not essential and the posed problem can still be solved without solvent C (e.g. by immediate application of a fresh preparation comprising the two incompatible active agents).
As a conclusion, claim 1 comprises all the essential features which are necessary to solve the problem defined previously over its whole scope.
6.4.3
The present solution is inventive since it was not rendered obvious by any of the cited prior art documents taken alone or in combination, that the simultaneous administration of calcipotriol and betamethasone as a fixed (non-aqueous) composition as covered by claim would provide a therapeutic
effect which is superior to a treatment wherein both components are administered sequentially at different times of the day. A fortiori further restriction of the compositions claimed to "non aqueous "compositions was not suggested in the art.
P pointed out that D28 discouraged a skilled practitioner to combine the two active agents of D21 into a single formulation due to the instability of the fixed composition comprising a corticosteroid and a vitamin D analogue/derivative. Although not necessary in the present assessment of the obviousness of the solution, D28 could be seen as a further pointer that a skilled person facing the problem defined previously would not have chosen the fixed composition of the claims as an obvious solution to the problem mentioned above.
The same reasoning applies mutatis mutandis to claims 2-9.
2.15.
Voor de maand april 2016 heeft Sandoz haar generieke geneesmiddel “Calcipotriol/Betamethason Sandoz 50 microgram/g + 0,5 mg/g, zalf” voor de behandeling van psoriasis doen opnemen in de G-standaard. Dit product bevat een ander oplosmiddel dan Arlamol-E, namelijk oleyl alcohol.
2.16.
Bij brief van 17 maart 2016 heeft Leo Sandoz erop gewezen dat voormeld product inbreuk maakt op EP 083. Hierop heeft Sandoz bij brief van 22 maart 2016 aan Leo geantwoord dat zij het standpunt inneemt dat EP 083 in Nederland nietig is en dat, ook indien de nietigheid van EP 083 zou worden geheeld, haar product daarop geen inbreuk maakt.
2.17.
Bij akte ingeschreven op 5 april 2016 heeft Leo gedeeltelijk afstand gedaan van het Nederlandse deel van het octrooi. Hierbij is conclusie 2 van het octrooi beperkt tot betamethasondiproprionaat. Conclusie 2 luidt thans als volgt:
2 . Farmaceutisch preparaat voor gebruik volgens conclusie 1, waarbij component B bestaat uit de 17,21- dipropionaatester van betamethason.
2.18.
De in paragraaf [0022] van de beschrijving en in deze procedure aangehaalde publicaties luiden – voor zover hier van belang – als hieronder opgenomen.
2.18.1.
Met betrekking tot de mogelijkheid van het combineren van calcipotriol met andere bestanddelen is in de aangehaalde publicaties het volgende opgenomen:
Patel et al.: (juni 1998)
Specifically, hydrocortisone-17-valerate 0,2% ointment, 12% ammonium lactate lotion and 6% salicylic acid can result in its degradation. Refrigeration may slow the degradation of calcipotriene but does not prevent it completely.
Lebwohl: (1997)
In combining calcipotriene with other agents, it should be stressed that both medications should be applied at different times. If calcipotriene is mixed with other agents, the two must be proven to be compatible because calcipotriene is easily inactivated.
Kragballe (1995):
Because calcipotriol, like other D3 vitamins, requires a relatively high pH to be stable, the topical calcipotriol formulations in general should not be mixed with other drugs or vehicles.
2.18.2.
In de publicatie van Ruzicka et al. (1998) wordt een studie beschreven, waarbij calcipotriol monotherapie is vergeleken met een combinatiebehandeling met calcipotriol en betamethason valeraat. Deze publicatie bevat de navolgende passages:
The combination therapy was more effective, as assessed by all evaluated variables; moreover, patients showing insufficient response to calcipotriol alone after 2 weeks showed a regression of psoriatic lesions using the combination regimen. Thus, the combination of calcipotriol and topical steroids is recommended as the therapy of first choice for patients who do not respond well to treatment with 2 weeks of calcipotriol alone. Furthermore, this combination reduces the hazards associated with the long-term use of topical corticosteroids (atrophy and rebound) as well as the irritation associated with calcipotriol.
(…)
As calcipotriol and betamethasone valerate work by interacting with different receptor subtypes (vitamin D or glucocorticoid receptors), an additive or synergistic effect could theoretically be expected. Therefore, the combination of topical calcipotriol and betamethasone valerate was assessed to determine whether there is such an effect in those patients who do not respond to calcipotriol alone. The results clearly show that the combination of both drugs leads to an additive clinical effect in terms of reduced psoriatic symptoms.
2.18.3.
In de publicatie van Ortonne et al. (1994) wordt een studie beschreven waarin alternerende monotherapie (calcipotriol-zalf in de morgen en betamethason diproprionaat-zalf in de avond versus calcipotriol-zalf in de morgen en de avond) van psoriasis is onderzocht. In deze publicaties is met betrekking tot de tijdens de betreffende studie waargenomen therapietrouw in de Franse tekst en de Engelse vertaling het volgende opgenomen:
Observance thérapeutique:
Pour l’ensemble des patients, il n'a pas été observé d'écarts au schéma thérapeutique. Aucune différence n’a été mise en évidence entre les groupes en ce qui concerne le nombre de grammes de pommade utilisés. En aucun cas, leur utilisation n’a dépassé 100g par semaine.”
Medical Adherence:
All patients adhered to the treatment regimen, with no deviations in the study protocol. There was no statistical difference highlighted between the two groups with regard to the number of grams of ointment used. There were no instances where their use exceeded 100 g per week.
2.18.4.
In 2011 heeft Van de Kerkhof et al. (2011) de resultaten van een literatuurstudie gepubliceerd, waarbij de effectiviteit van verschillende behandelingen van psoriasis met elkaar zijn vergeleken. Hierbij staat de afkorting PASI voor ‘Psoriasis Area and Severity Index’, waarbij de index de omvang en de ernst van de ziekte aangeeft. TCF (‘Two-Compound Formulation’) staat voor de combinatiebehandeling van calcipotriol met betamethason. Deze publicatie bevat onder meer figuur 6 met bijbehorende passage (van belang is vooral het lijntje bij “calcipotriol od + betamethasone dipropionate od”):
2.19.
De Engelse delen van EP 808 en EP 083 zijn onderwerp geweest van een procedure in het Verenigd Koninkrijk tussen Teva en Leo. In de procedure in eerste aanleg heeft de rechter bij vonnis van 6 oktober 2014 geoordeeld dat beide octrooien nietig zijn wegens gebrek aan inventiviteit. Dit vonnis is op 28 juli 2015 in hoger beroep vernietigd. Conclusie 1 van EP 083 werd in die procedure door Leo slechts verdedigd in beperkte zin tot tevens bevattende de component C volgens een subgroep van (i).
2.20.
Sandoz heeft haar generieke calcipotriol/betamethasonproduct inmiddels in Nederland op de markt gebracht.
3. Het geschil
3.1.
In eerste aanleg heeft Leo gevorderd dat de voorzieningenrechter, bij vonnis uitvoerbaar bij voorraad:
I. Sandoz verbiedt om inbreuk te maken op het octrooi EP 083, in het bijzonder door middel van Calcipotriol/Betamethason Sandoz 50 microgram/g + 0,5 mg/g, zalf, op straffe van een onmiddellijk opeisbare dwangsom van € 500.000 voor iedere overtreding van dit verbod, te vermeerderen met een dwangsom van € 50.000 voor iedere dag of gedeelte van een dag dat de overtreding voortduurt, met een maximum van € 5.000.000 per gebeurtenis;
II. Sandoz gebiedt om, binnen vier (4) weken na betekening van het in dezen te wijzen vonnis, een door een registeraccountant gecontroleerde opgaaf te doen aan de advocaat van Leo, van alle bedrijven en/of personen aan wie zij inbreukmakende producten Calcipotriol/Betamethason Sandoz 50 microgram/g + 0,5 mg/g, zalf, heeft verkocht en/of geleverd, met een specificatie van de ontvangen inkomsten en de hiermee gemaakte winst, een en ander op straffe van een door Sandoz te verbeuren onmiddellijk opeisbare dwangsom van € 50.000 voor iedere overtreding van dit gebod, te vermeerderen met een dwangsom van € 10.000 voor iedere dag of gedeelte van een dag dat de overtreding voortduurt, met een maximum van € 100.000 per gebeurtenis;
III. Sandoz gebiedt om, binnen één (1) dag na betekening van het in dezen te wijzen vonnis, een rectificatietekst te versturen en daarmee alle inbreukmakende producten terug te roepen, met uitsluitend de navolgende inhoud (of een andere, door de voorzieningenrechter in goede justitie te bepalen tekst), afgedrukt op het briefpapier van Sandoz in de gebruikelijke huisstijl, zonder verdere toevoegingen, aan alle bedrijven en/of personen aan wie zij de onderhavige producten Calcipotriol/
Betamethason Sandoz 50 microgram/g + 0,5 mg/g, zalf heeft verkocht en/of offertes heeft gedaan, ter attentie van hun directie, een en ander op straffe van een door Sandoz te verbeuren onmiddellijk opeisbare dwangsom van € 50.000 voor iedere overtreding van dit gebod, te vermeerderen met een dwangsom van € 10.000 voor iedere dag of gedeelte van een dag dat deze overtreding voortduurt; alsmede om het bewijs van verzenden tegelijk aan de advocaat van Leo over te leggen, op straffe van een door Sandoz te verbeuren onmiddellijk opeisbare dwangsom van € 10.000 voor de overtreding van dit laatste gebod; tezamen met een maximum van € 150.000 per gebeurtenis:
[datum]
DRINGEND!
Geachte heer, mevrouw,
De voorzieningenrechter van de rechtbank Den Haag heeft in diens vonnis van [datum] geoordeeld dat wij inbreuk hebben gemaakt op het octrooi EP 2 455 083 B1 van de firma LEO Pharma, onder andere door het aan uw bedrijf aanbieden en/of leveren van Calcipotriol/Betamethason Sandoz 50 microgram/g + 0,5 mg/g, zalf. Wij zijn veroordeeld om deze inbreuk met onmiddellijke ingang te staken en de genoemde producten terug te roepen. Wij zullen u volledig schadeloosstellen.
Sandoz B.V.
De Directie
IV. Sandoz veroordeelt in de redelijke en evenredige proceskosten van deze procedure op grond van artikel 1019h van het Wetboek van Burgerlijke Rechtsvordering (hierna: Rv), een en ander te vermeerderen met de wettelijke rente vanaf 14 dagen, althans vanaf een door de Voorzieningenrechter redelijk geachte termijn, na het te dezen te wijzen vonnis, indien en voor zover Sandoz deze kosten niet voordien heeft voldaan;
V. Sandoz veroordeelt in de nakosten ten bedrage van respectievelijk € 131 zonder betekening en € 199 met betekening, laatstbedoeld bedrag te vermeerderen met de wettelijke rente indien en voor zover Sandoz dit niet binnen (de wettelijk vereiste termijn van) twee dagen, althans binnen een door de rechtbank redelijk geachte termijn na betekening van het in dezen te wijzen vonnis, heeft voldaan.
3.2.
Aan deze vorderingen heeft Leo ten grondslag gelegd dat Sandoz met de verhandeling van haar generieke product inbreuk maakt op conclusies 1, 2, 3, 4 en 9 van EP 083. Nu Sandoz inmiddels met haar generieke product op de (Nederlandse) markt is gekomen, heeft Leo Pharma een spoedeisend belang bij de toewijzing van haar vorderingen.
3.3.
Sandoz heeft onder meer de volgende verweren aangevoerd. Conclusie 1 en de andere door Leo ingeroepen conclusies van EP 083 zijn nietig vanwege een gebrek aan inventiviteit. Nu Leo het stabiliteitsprobleem heeft verlaten, beroept zij zich nog enkel op een combinatieproduct dat een verbeterd effect zou hebben. Dit effect is (in ieder geval deels) te herleiden tot een (te verwachten) verbeterde therapietrouw. Dat therapietrouw verbetert door een combinatieproduct was evenwel algemeen bekend. Het door Leo ingeroepen synergetisch effect kan hoogstens een bonuseffect zijn van een niet-inventieve maatregel en het wordt bovendien niet in de oorspronkelijke stukken noch in het octrooi plausibel gemaakt. De studie van Van de Kerkhof is van 11 jaar na de relevante data en mag niet meetellen om het geclaimde effect te onderbouwen. Het verbeterde/
synergetische effect kan daar overigens evenmin uit worden afgeleid. Niet alleen kan Van de Kerkhof de oorzaak van een eventuele verbetering niet koppelen aan een synergetisch effect, het is niet eens zeker dat er een verbetering is en de mate van die eventuele verbetering is ook nog eens gering.
3.4.
Bij vonnis van 11 mei 2015 heeft de voorzieningenrechter de vorderingen van Leo afgewezen. Hij was voorshands van oordeel dat aan gerede twijfel onderhevig is of EP 083 een in te stellen bodemprocedure dan wel de reeds ingestelde oppositieprocedure zal overleven. Naar zijn oordeel lag de oplossing van conclusie 1 en 2 van EP 083 om calcipotriol en betamethason(dipropionaat) in één zalf te brengen voor die gemiddelde vakman voor de hand ter verbetering van therapietrouw. Het betoog van Leo dat er tevens een synergetisch effect is dat bijdraagt aan het technische effect en aldus aan de inventiviteit van het octrooi, heeft hij voorshands verworpen omdat dit effect niet plausibel is gemaakt in het octrooi en ook niet vaststaat op basis van studie van Van de Kerkhof.
3.5.
In principaal beroep vordert Leo dat het hof het vonnis van de voorzieningenrechter vernietigt en opnieuw rechtdoende haar vorderingen alsnog toewijst, met veroordeling van Sandoz in de kosten van het hoger beroep, waaronder begrepen de nakosten, te vermeerderen met de wettelijke rente. Leo heeft één algemene grief en zeven genummerde grieven tegen het vonnis naar voren gebracht. De grieven zullen hierna meer in detail worden beschreven voor zover van belang. Sandoz heeft de grieven gemotiveerd bestreden.
3.6.
In incidenteel beroep vordert Sandoz dat het hof het vonnis van de voorzieningenrechter vernietigt voor zover het de kostenveroordeling betreft en opnieuw rechtdoende Leo veroordeelt tot betaling van € 121.658,00, met veroordeling van Leo in de redelijke en evenredige kosten van het appèl conform artikel 1019h Rv, te vermeerderen met de wettelijke rente ex artikel 6:119 BW over dit bedrag vanaf 14 dagen na de datum van het arrest tot aan de dag der voldoening. Sandoz heeft één grief naar voren gebracht, inhoudende dat de voorzieningenrechter ten onrechte een bedrag van € 30.000,00 niet heeft toegewezen op de grond dat Sandoz onvoldoende aannemelijk had gemaakt dat die kosten waren gemaakt in het kader van deze procedure. Leo heeft de grief gemotiveerd bestreden.
4. De beoordeling
grief 1: nieuwheid
4.1.
Leo heeft op zich terecht gegriefd tegen het oordeel van de voorzieningenrechter dat de ingeroepen conclusies niet nieuw zijn ten opzichte van de moederaanvraag WO 450. Leo heeft onbestreden aangevoerd dat dit nietigheidsargument geen stand kan houden in het licht van de beslissing van de Grote Kamer van Beroep over partiële prioriteit (GKvB 29 november 2016, G 0001/15, ECLI:EP:BA:2016:G000115.20161129). Tot een vernietiging van het bestreden vonnis kan dit niet leiden omdat, zoals hierna zal worden toegelicht, de inventiviteitsaanval van Sandoz wel slaagt. In zoverre treft ook grief 1 van Leo geen doel.
grieven 2 en 5: inventiviteit
4.2.
Het hof deelt de conclusie van de voorzieningenrechter dat de vorderingen van Leo moeten worden afgewezen omdat een gerede kans bestaat dat de TKB, anders dan de OD, de door Leo ingeroepen conclusies van het octrooi in hoger beroep zal herroepen. Naar voorlopig oordeel vloeit de in die conclusies geclaimde materie namelijk voor de gemiddelde vakman op voor de hand liggende wijze voort uit Ortonne (zie hiervoor r.o. 2.18.3). Dat zal hierna worden toegelicht aan de hand van de zogeheten problem-and-solution-approach, die beide partijen ook hanteren in hun argumentatie. Daarbij gaat het hof er met partijen van uit dat de peildatum voor de beoordeling van de inventiviteit in dit geval de datum van aanvraag van het octrooi is (Leo doet in het kader van de inventiviteitsaanval uitdrukkelijk geen beroep op prioriteit). Overigens is gesteld noch gebleken dat het in dit geval voor de beoordeling van de inventiviteit relevant zou zijn of wordt uitgegaan van de aanvraagdatum of prioriteitsdatum.
4.3.
Dat Ortonne een geschikt uitgangspunt vormt voor de beoordeling van de inventiviteit van EP 083 staat niet ter discussie. Leo zelf gaat ervan uit dat Ortonne de meest nabije stand van de techniek is (paragraaf 6.5 van de inleidende dagvaarding en paragraaf 22 van de pleitnota in hoger beroep).
4.4.
Evenmin in geschil is dat er twee verschillen zijn tussen Ortonne en de in de conclusies 1 en 2 van EP 083 geclaimde materie. Ten eerste worden de actieve stoffen calcipotriol en betamethason(dipropionaat) toegediend in één combinatieproduct in plaats van alternerend, dat wil zeggen een zalf met slechts één actieve stof in de ochtend en een andere zalf met uitsluitend de andere actieve stof in de avond. Ten tweede is dat combinatieproduct niet-waterig.
4.5.
Daarnaast staat buiten kijf dat een positief effect van de eerstgenoemde verschilmaatregel (het combinatieproduct) is dat die de therapietrouw vergroot. Partijen zijn het er ook over eens dat diezelfde verschilmaatregel een negatief effect heeft. De keuze voor een combinatieproduct leidt tot een stabiliteitsprobleem. Zoals ook beschreven in het octrooischrift, was op de aanvraagdatum namelijk bekend dat calcipotriol en betamethason(dipropionaat) stabiel zijn bij verschillende pH’s (paragraaf [0005] van het octrooischrift). Daarom gebruikten de in het alternerende regime toegepaste monoproducten verschillende vehikels met een op de betreffende stof afgestemd pH (paragraaf [0006] van het octrooischrift). In het combinatieproduct moet worden gekozen voor één vehikel. Zonder nadere maatregelen zal de keuze voor een combinatieproduct dus leiden tot instabiliteit van tenminste één van de actieve stoffen.
4.6.
Ook niet in geschil is dat toepassing van de tweede verschilmaatregel, te weten het niet-waterig zijn van het geclaimde product, geen voordeel verschaft ten opzichte van het alternerende regime, maar wel een kort werkende oplossing biedt voor het stabiliteitsprobleem dat inherent is aan de keuze voor een combinatieproduct. Het niet-waterige karakter van het geclaimde product draagt dus bij aan het behoud van de stabiliteit van de actieve stoffen op de korte termijn. Partijen zijn het er echter over eens dat deze maatregel onvoldoende is om de stabiliteit van de actieve stoffen op de lange termijn te waarborgen. De maatregel die volgens het octrooi wel de stabiliteit van de actieve stoffen op de lange termijn waarborgt, te weten het oplosmiddel als bedoeld in conclusie 5, maakt geen onderdeel uit van de conclusies 1 en 2. Met de maatregelen van conclusies 1 en 2 wordt het stabiliteitsprobleem op de lange termijn derhalve niet opgelost.
4.7.
Leo heeft betoogd dat het geclaimde combinatieproduct nog een ander effect heeft, te weten – samengevat – een verbeterde behandeling van psoriasis. Zoals hierna zal worden toegelicht bij de bespreking van grief 3 (zie r.o. 4.14 e.v.), moet dat effect buiten beschouwing worden gelaten bij de beoordeling van inventiviteit omdat het niet plausibel is gemaakt. Daarom moet de objectieve probleemstelling uitsluitend worden gebaseerd op de hiervoor vastgestelde effecten van de verschilmaatregelen. Daarvan uitgaande moet het objectieve probleem dat het geclaimde product oplost naar voorlopig oordeel worden geformuleerd als: het verbeteren van de therapietrouw met behoud van de stabiliteit op de korte termijn. Bij die probleemstelling past dat de gemiddelde vakman bestaat uit een team bestaande uit een dermatoloog en een formuleringsdeskundige.
4.8.
Voorshands moet worden aangenomen dat een vakman die wordt geconfronteerd met het hiervoor geformuleerde probleem, uitgaande van het in Ortonne geopenbaarde alternerende regime, zou uitkomen op de geclaimde materie. Vast staat dat het algemene vakkennis was dat een combinatieproduct therapietrouw vergroot. Dat dit algemene vakkennis was heeft Sandoz uitdrukkelijk bepleit onder verwijzing naar verklaringen van haar deskundigen, de beslissing van de OD over EP 808 en het op deskundigenverklaringen gebaseerde oordeel van de Britse rechter. Leo heeft deze stelling ook niet, althans onvoldoende gemotiveerd bestreden. Daar komt bij dat, zoals Sandoz onbestreden heeft gesteld onder verwijzing naar onder meer de beschrijving van EP 083, therapietrouw een bijzonder groot probleem was bij de behandeling van psoriasis. Gelet daarop moet worden aangenomen dat de vakman bijzonder gemotiveerd was om een oplossing te vinden voor het objectieve probleem. Ten slotte heeft Sandoz niet, althans onvoldoende bestreden aangevoerd dat het tot de algemene vakkennis van de gemiddelde vakman behoorde dat het gebruik van een niet-waterig product een logische eerste stap is om stabiliteitsproblemen die samenhangen met een verschil in pH te voorkomen.
4.9.
De factoren die Leo heeft aangevoerd om te onderbouwen dat de geclaimde materie desondanks inventief is, kunnen niet leiden tot een ander oordeel. Leo heeft betoogd dat er, vooral vanwege het stabiliteitsprobleem op de lange termijn, een terughoudendheid bestond om calcipotriol en betamethason(dipropionaat) in één geneesmiddel samen te brengen. De oplossing van dat stabiliteitsprobleem maakt echter geen onderdeel uit van de hiervoor geformuleerde objectieve probleemstelling, omdat het geclaimde product dat probleem ook niet oplost. Met andere woorden, in het kader van de beoordeling van de inventiviteit van het geclaimde product moet worden aangenomen dat de gemiddelde vakman zich uitsluitend richt op verbetering van therapietrouw en behoud van stabiliteit op de korte termijn en dat hij eventuele stabiliteitsproblemen op de lange termijn dus negeert. Anders zou inventiviteit worden ontleend aan het niet-oplossen van een bekend probleem. Het hof is met Sandoz van oordeel dat dat geen recht zou doen aan de – in dit opzicht beperkte – bijdrage van het octrooi aan de stand van de techniek.
4.10.
Daarnaast heeft Leo aangevoerd dat de formulering van een combinatieproduct complex is omdat beide actieve stoffen zodanig oplosbaar moeten zijn in de gebruikte excipiënten dat de werkzame stof in voldoende mate wordt afgegeven door de huid. Ter onderbouwing heeft Leo een verklaring overgelegd van een formuleringsdeskundige, professor Brown. Ook hiervoor geldt dat de octrooiconclusies waarop Leo in deze zaak een beroep doet geen maatregelen bevatten die een oplossing bieden voor het gestelde probleem. Bovendien worden de bedenkingen van professor Brown weersproken door de deskundige van Sandoz, professor Crowley, die in zijn verklaring een aantal bekende topische combinatieproducten noemt. In het licht daarvan moet voorshands worden aangenomen dat de gestelde bedenkingen in ieder geval niet zodanig zijn dat ze de gemiddelde vakman ervan zouden weerhouden een combinatieproduct te ontwikkelen ter oplossing van het prangende probleem van gebrekkige therapietrouw.
4.11.
De stellingen van Leo dat calcipotriol en betamethason al zeven jaar alternerend werden toegediend en dat de gedachte om ze in één geneesmiddel te combineren zelfs nog nooit was geopperd, kunnen evenmin leiden tot een andere conclusie. Het uitblijven van (het idee van de ontwikkeling van) een combinatieproduct kan worden verklaard door het hiervoor genoemde stabiliteitsprobleem op de lange termijn. Zolang dat probleem niet was opgelost, was het weinig zinvol een combinatieproduct te maken, omdat het onpraktisch is een product steeds direct na bereiding toe te dienen (zie ook de tweede verklaring van professor Brown, productie 27 van Leo, paragraaf 16). Ten tweede heeft Sandoz aangevoerd dat de stand van de techniek wel een combinatieproduct van calcipotriol en betamethason openbaart, onder verwijzing naar voorbeeld 8 van Serup (productie 19 van Sandoz, p. 23). Dat dit product een waterige samenstelling is, niet specifiek betamethasondipropionaat bevat en niet wordt gebruikt voor de behandeling van psoriasis, is in dit verband niet relevant. Het gaat erom dat dit voorbeeld onderbouwt dat de gemiddelde vakman dacht aan de combinatie van calcipotriol en betamethason in één product.
4.12.
Ten slotte heeft Leo aangevoerd dat haar product een succes is en de standaardbehandeling is geworden. Dat alleen is in het licht van het voorgaande onvoldoende om inventiviteit aan te nemen. Bovendien zijn de ingeroepen conclusies niet beperkt tot het product dat Leo aanbiedt en is aannemelijk dat de ook onder bereik van de conclusies vallende producten waarin het stabiliteitsprobleem niet is opgelost, niet succesvol zouden zijn.
4.13.
Op grond van het voorgaande moet worden geconcludeerd dat de conclusies 1 en 2 in ieder geval niet over de gehele breedte van die conclusies inventief zijn. De grieven 2 en 5 van Leo over het gelijkluidende oordeel van de voorzieningenrechter moeten daarom worden verworpen.
grief 3: plausibiliteit synergetisch effect
4.14.
Leo heeft betoogd dat het geclaimde combinatieproduct ook los van de verbeterde therapietrouw leidt tot een verbeterde behandeling van psoriasis. Daarbij heeft zij in eerste aanleg uitdrukkelijk het standpunt ingenomen dat deze verbeterde behandeling wordt verklaard doordat bij het combinatieproduct de twee actieve stoffen synergetisch werken (inleidende dagvaarding, paragraaf 3.7). Dit houdt in dat de werkzaamheid van de actieve stoffen bij het combinatieproduct, in tegenstelling tot het alternerende regime, meer is dan een optelsom van de werkzaamheid van de stoffen los van elkaar (1+1=3). Het hof begrijpt dat Leo, anders dan Sandoz heeft gesuggereerd, dit standpunt niet heeft verlaten in hoger beroep. Ook in haar memorie van grieven stelt Leo namelijk uitdrukkelijk dat zich bij alternerende toediening van de twee actieve stoffen slechts een additief effect zou voordoen (1+1=2) en dat bij het geclaimde combinatieproduct sprake is van een meer dan additief effect (memorie van grieven, paragraaf 32) en ook bij pleidooi in hoger beroep is haar argumentatie gebaseerd op de stelling dat vervanging van het alternerende regime door het combinatieproduct ertoe leidt dat de actieve stoffen synergetisch werken (pleitnota in hoger beroep, onder meer paragrafen 16, 18, 32, 61 en 69).
4.15.
Partijen zijn het erover eens dat het hiervoor genoemde effect alleen mag meewegen bij de beoordeling van de inventiviteit van het octrooi als de gemiddelde vakman het effect plausibel zou hebben gevonden op basis van het octrooischrift. Partijen verschillen van mening over het antwoord op de vraag of in dit geval aan die voorwaarde is voldaan. Sandoz betoogt dat dat het geval is. Leo bestrijdt dat en klaagt met haar derde grief over het oordeel van de voorzieningenrechter over het gebrek aan plausibiliteit. Partijen strijden in dit verband ook over de bewijslast en de uitleg van het begrip plausibiliteit.
4.16.
Over de bewijslast heeft Leo naar het oordeel van het hof terecht aangevoerd dat op Sandoz de plicht rust te stellen en in kort geding voorshands aannemelijk te maken dat het bedoelde effect niet plausibel is. Sandoz beroept zich immers op de nietigheid van het octrooi wegens gebrek aan inventiviteit en moet daarom de feiten en omstandigheden aandragen die dat beroep kunnen onderbouwen. In het licht van het verweer van Leo dat Sandoz heeft nagelaten bij de formulering van het objectieve probleem het hiervoor beschreven effect mee te wegen, brengt dat mee dat Sandoz zal moeten stellen en in kort geding aannemelijk moeten maken dat dit effect niet hoeft te worden meegewogen omdat het niet plausibel is op basis van het octrooischrift. Het betoog van Sandoz dat de TKB uitgaat van een andere bewijslastverdeling kan niet leiden tot een ander oordeel, alleen al omdat het hof gebonden is aan de regels van het Nederlandse procesrecht in plaats van de procedureregels van de TKB.
4.17.
Wat betreft de uitleg van het plausibiliteitsvereiste staat voorop dat het een invulling vormt van het beginsel dat de omvang van het octrooimonopolie moet corresponderen met de bijdrage die het octrooi levert aan de stand van de techniek (vgl. TKB 12 september 1995, T-939/92, ECLI:EP:BA:1995:T093992.19950912, Agrevo, paragraaf 2.4.2). Dat beginsel brengt ten eerste mee dat (nagenoeg) alle producten die onder de reikwijdte van de octrooiconclusie vallen inventief moeten zijn en zich dus moeten onderscheiden van uit de stand van de techniek bekende producten doordat zij het aangevoerde technische effect vertonen (idem, paragraaf 2.5.3 en 2.5.4). Ten tweede is van belang dat de bijdrage aan de stand van de techniek en inventiviteit moeten worden beoordeeld vanuit het perspectief van de gemiddelde vakman op de aanvraagdatum. Dat brengt mee dat effecten die de gemiddelde vakman op de aanvraagdatum niet in het octrooi zou hebben gelezen of die hij niet plausibel zou hebben gevonden op basis van het octrooischrift, buiten beschouwing moeten worden gelaten bij de beoordeling van inventiviteit. De vereiste mate van aannemelijkheid van het effect is naar voorlopig oordeel niet in algemene termen aan te geven. Enerzijds is van belang dat van de uitvinder niet kan worden verwacht dat hij op de aanvraagdatum al volledig bewijs levert van een effect. Daarom wordt wel gesproken van een lage drempel. Anderzijds moet de drempel voldoende hoog zijn om te voorkomen dat inventiviteit wordt beoordeeld op basis van een uitvinding die pas na de aanvraagdatum is gedaan of geopenbaard, zoals wanneer de inventiviteit van het octrooi wordt ontleend aan stellingen over effecten die de gemiddelde vakman op de aanvraagdatum speculatief zou hebben gevonden. Daarbij moet er wel rekening mee worden gehouden dat de gemiddelde vakman het octrooi leest in het licht van zijn algemene vakkennis. Dat brengt enerzijds mee dat een effect en de onderbouwing daarvan niet uitdrukkelijk in het octrooischrift hoeven te worden vermeld als het effect en de plausibiliteit daarvan voor de gemiddelde vakman op de aanvraagdatum evident waren op basis van zijn algemene vakkennis. Zo staat het in deze zaak buiten kijf dat het voor de gemiddelde vakman op de aanvraagdatum zonder meer plausibel was dat het geclaimde combinatieproduct therapietrouw verbetert, ook al verschaft het octrooischrift geen onderbouwing voor dat effect. Anderzijds moeten strengere eisen worden gesteld aan de onderbouwing van een effect in het octrooischrift in het omgekeerde geval dat een effect voor de gemiddelde vakman juist niet voor de hand lag op basis van zijn algemene vakkennis op de aanvraagdatum.
4.18.
Sandoz heeft om de volgende redenen voorshands voldoende aannemelijk gemaakt dat de gemiddelde vakman op de aanvraagdatum niet in het octrooi zou hebben gelezen of op grond van zijn algemene vakkennis zou hebben aangenomen dat het combinatieproduct een synergetische werking van de twee actieve stoffen veroorzaakt en dat de gemiddelde vakman dat effect ook niet plausibel zou vinden op basis van het octrooischrift of zijn algemene vakkennis.
4.19.
Ten eerste staat het gestelde synergetische effect op gespannen voet met de gang van zaken in de oppositieprocedure. Zoals Sandoz heeft opgemerkt (memorie van antwoord, paragraaf 23), heeft de oppositiedivisie uitdrukkelijk geoordeeld dat ‘as indicated by the parties, no synergy can be attributed to the composition claimed over the combination known from D21 [Ortonne, hof]’. Het hof begrijpt uit die overweging dat Leo in de oppositieprocedure ook zelf heeft aangegeven dat een synergetisch effect niet kan worden toegeschreven aan het combinatieproduct, laat staan dat dit effect voor de gemiddelde vakman plausibel is op basis van het octrooischrift. Leo heeft niet duidelijk gemaakt waarom zij in deze procedure het tegengestelde standpunt inneemt en waarom het oordeel van de oppositieprocedure op dit punt niet kan worden gevolgd.
4.20.
Ten tweede is van belang dat tussen partijen vast staat dat het gestelde synergetisch effect een onverwacht effect is, dat wil zeggen een effect dat de gemiddelde vakman op de aanvraagdatum niet zou hebben verwacht op basis van de stand van de techniek. Leo zelf heeft bijvoorbeeld in de inleidende dagvaarding uitdrukkelijk bepleit dat er ‘geen enkele aanwijzing’ was dat met het combinatieproduct de effectiviteit van de formulering zou kunnen worden verhoogd (inleidende dagvaarding, paragraaf 6.5). Ook Sandoz gaat daarvan uit.
4.21.
Ten derde heeft Sandoz er naar voorlopig oordeel terecht op gewezen dat het octrooi niet benoemt dat calcipotriol en betamethason(dipropionaat) in het combinatieproduct synergetisch werken. De beschrijving vermeldt onder meer dat toepassing van het geclaimde combinatieproduct in vergelijking met de monoproducten resulteert in ‘higher efficacy’ (paragraaf [0009]), ‘a success of treatment of psoriasis hitherto unattainable’ (paragraaf [0012]), ‘therapeutic advantages’ (paragraaf [0020]), ‘faster onset of healing and a more effective healing of plaques’(paragraaf [0021]) en dat ‘satisfactory medical treatment of skin disorders, such as psoriasis, can be attained in a shorter period of time’ (paragraaf [0022]). De in deze passages genoemde verbeteringen kunnen echter ook duiden op een additieve werking en de door het combinatieproduct verkregen verbeterde therapietrouw. De enige keer dat het octrooi wel uitdrukkelijk melding maakt van ‘synergy’ (paragraaf [0022]), gaat het over de vermindering van bijwerkingen. Zoals ook Leo zelf benadrukt (pleitnota in hoger beroep, voetnoot 27), is de vermindering van bijwerkingen niet relevant voor de synergetische werkzaamheid van de actieve stoffen waar Leo op doelt.
4.22.
De opmerking van Leo dat op basis van de in het octrooi geopenbaarde gegevens over de werking van de monotherapieën een additief effect kan worden berekend dat kan worden vergeleken met de gegevens over de werking van het combinatieproduct, kan niet leiden tot een ander oordeel. Ook die berekening en vergelijking staan niet in het octrooischrift. Naar voorlopig oordeel zal de gemiddelde vakman geen berekeningen uitvoeren om vast stellen of een geclaimd product een onverwacht en niet in het octrooischrift benoemd effect heeft. Daarnaast wijzen de resultaten van de door Leo voorgestelde berekening ook niet eenduidig op een synergetisch effect van het combinatieproduct. Zo tonen de berekeningen aan dat het combinatieproduct op week 4 van de behandeling juist slechter scoort dan het berekende additieve effect van de monotherapieën, terwijl – zoals Sandoz niet, althans onvoldoende gemotiveerd bestreden heeft aangevoerd – in de literatuur veelvuldig op vier weken wordt gemeten om het effect van een behandeling vast te stellen.
4.23.
Bovendien volgt uit de stelling dat de twee actieve stoffen in het combinatieproduct synergetisch werken, niet zonder meer dat dit een effect is van de verschilmaatregel (het combineren van de twee actieve stoffen in één product). Om plausibel te achten dat het synergetisch effect wordt veroorzaakt door de vervanging van het alternerende regime door een combinatieproduct, zou de gemiddelde vakman ook plausibel moeten achten dat het synergetisch effect niet ook al optrad bij het bekende alternerende regime. Het octrooischrift openbaart echter geen gegevens over de werking van het alternerende regime. Dat de gemiddelde vakman wel een ‘theoretisch additief effect’ zou kunnen berekenen op basis van de in het octrooischrift vermelde gegevens over monotherapieën, is, anders dan Leo meent, niet relevant. Met die berekening wordt enkel vastgesteld wat de omvang van het effect van de therapie zou zijn als de stoffen in het alternerende regime additief zouden werken. Het gaat er echter om dat plausibel moet worden gemaakt dat de stoffen in het alternerende regime hooguit additief werken.
4.24.
Daarnaast heeft de deskundige van Sandoz, professor De Rie, voorshands overtuigend uiteengezet dat de gemiddelde vakman zou verwachten dat als een synergetisch effect optreedt bij toediening van het combinatieproduct, dat effect zich ook zal voordoen bij het alternerende regime (productie 27 van Sandoz, paragraaf 19), omdat een dermatoloog zou verwachten dat ook bij het alternerende regime de stoffen steeds in voldoende concentratie in de huid aanwezig zijn om de stoffen te laten interageren. Leo heeft dat niet steekhoudend bestreden. Leo heeft, onder verwijzing naar een verklaring van haar deskundige professor Segaert (productie 24 van Leo), betoogd dat calcipotriol en betamethason zodanig snel metaboliseren dat na een halve dag de concentratie van een stof onvoldoende hoog is om een synergetisch effect te realiseren. Die snelle metabolisatie wordt echter, zoals professor De Rie heeft opgemerkt, weersproken door de bijsluiter van Leo’s Dovobet product, dat juist vermeldt dat ‘vanwege de vorming van een depot in de huid de eliminatie na dermale applicatie in de orde van dagen [is]’ (bijlage 2, bij productie 27 van Sandoz; zie ook productie 36 van Sandoz, paragraaf 4). Leo heeft ook geen stukken in het geding gebracht die kunnen onderbouwen dat de gestelde snelle metabolisatie optreedt, laat staan dat de gemiddelde vakman daarvan op de hoogte was. Daarnaast is het betoog van Leo gebaseerd op de veronderstelling van professor Segaert dat een hoge gezamenlijke piekconcentratie nodig is voor het synergetisch effect. Gesteld noch gebleken is dat de gemiddelde vakman op de aanvraagdatum bekend was met de gestelde noodzaak van een hoge piekconcentratie.
4.25.
Ten slotte heeft Leo aangevoerd dat de op de aanvraagdatum beschikbare publicaties over het alternerende regime (Ortonne, Ruzicka en Kragballe) enkel spreken over een additief of complementair effect van het alternerende regime en niet over een synergetisch effect. Sandoz heeft echter terecht opgemerkt dat de bedoelde publicaties niet beoogden vast te stellen of de werking additief danwel synergetisch was en dat ze dat ook niet konden doen omdat ze geen gegevens over de werkzaamheid van beide monoproducten bevatten. Ruzicka en Ortonne hebben niet de werkzaamheid van het betamethason-monoproduct onderzocht. Kragballe bevat helemaal geen onderzoeksgegevens. De gemiddelde vakman zou uit die publicaties dus ook niet afleiden dat er bij het alternerende regime geen synergetisch effect zal optreden.
grief 3 en 6: plausibiliteit verbeterde behandeling over de volledige breedte
4.26.
Op sommige plaatsen lijkt Leo de inventiviteit van het octrooi niet te baseren op de gestelde synergetische werkzaamheid van de actieve stoffen bij toepassing van het combinatieproduct, maar op een verbeterde behandeling van psoriasis als zodanig, zich uitend in voordelen zoals een lagere PASI-score, het sneller aanslaan van de therapie, een grotere groep patiënten bij wie de therapie goed werkt en het nog sterker verminderen van bijwerkingen. Sandoz heeft het betoog van Leo ook zo opgevat. Het hof begrijpt dat dit standpunt over het effect van het combinatieproduct in die zin verschilt van het hiervoor besproken betoog, dat het focust op het resultaat (een verbeterd resultaat van de behandeling) in plaats van de specifieke manier waarop dat wordt bereikt (de synergetische werking van de twee actieve stoffen). Die andere focus wijzigt het debat over plausibiliteit in twee opzichten. Ten eerste is, zoals Sandoz heeft benadrukt, mogelijk dat de verbeterde behandeling wordt veroorzaakt door de betere therapietrouw die het combinatieproduct mogelijk maakt (zie hiervoor r.o. 4.5). In dat geval zou het door Leo bedoelde effect samenvallen met het hiervoor besproken effect van therapietrouw. Partijen zijn het erover eens dat daarom de verbeterde behandeling buiten beschouwing moet worden gelaten voor zover die een gevolg is van de verbeterde therapietrouw. Ten tweede brengt de focus op het resultaat mee dat kennis van omstandigheden die een negatief effect hebben op het bereiken van een verbeterde behandeling, zoals stabiliteitsproblemen, voor de gemiddelde vakman een reden kunnen zijn om dat effect niet of minder plausibel te vinden.
4.27.
Ook voor het gestelde, niet door verhoogde therapietrouw veroorzaakte, verbeterde behandelingsresultaat geldt dat niet in geschil is dat de gemiddelde vakman op de aanvraagdatum geen positieve aanwijzingen voor dit effect had. Bovendien staat tussen partijen vast dat onder het bereik van de conclusies ook samenstellingen vallen met stabiliteitsproblemen. Sandoz heeft erop gewezen dat instabiliteit inhoudt dat calcipotriol wordt afgebroken en dat het in het licht daarvan voor de gemiddelde vakman niet plausibel was dat toediening van die samenstellingen leidt tot een betere behandeling van psoriasis dan het alternerende regime (memorie van antwoord, paragraaf 161). Voor zover Leo dat heeft willen bestrijden met haar opmerking dat het soort oplosmiddel en de instabiliteit van de samenstelling niet van belang zijn voor het optreden van een verbeterde behandeling, kan die betwisting voorshands geen stand houden in het licht van de verklaring van haar eigen deskundige, professor Brown. Die bevestigt dat de keuze voor een combinatieproduct, vanwege de daardoor veroorzaakte stabiliteitsproblemen, ertoe kan leiden dat de absorptie van de actieve stof negatief wordt beïnvloed en de effectiviteit van het product verandert (productie 23 van Leo, paragraaf 32).
4.28.
Het verweer van Leo dat het er bij de beantwoording van de vraag of de conclusies over de gehele breedte inventief zijn om gaat of bij iedere uitvoeringsvorm van de geclaimde uitvinding het effect optreedt en niet of iedere uitvoeringsvorm beter werkt dan de concrete alternerende therapie van Ortonne, is naar voorlopig oordeel juist voor zover het gaat om het primaire standpunt van Leo dat het met de uitvinding bereikte effect is dat het combinatieproduct een synergetische werking veroorzaakt (zie r.o. 4.14). In dat geval volstaat het dat plausibel is dat de synergetische werking optreedt over de gehele breedte van de conclusies en hoeft niet te worden aangetoond dat elk product ook beter werkt. Als echter het effect wordt gedefinieerd als een betere behandelingsresulaat, zoals het hof het subsidiaire standpunt van Leo begrijpt, zal plausibel moeten zijn dat dàt effect over de gehele breedte van de conclusies optreedt en dus dat toepassing van de onder de conclusies 1 en 2 vallende producten resulteert in een betere behandeling van psoriasis dan realiseerbaar is met het alternerende regime van Ortonne. Omdat enerzijds onder die conclusies ook instabiele producten vallen, terwijl anderzijds vast staat dat dit instabiliteitsprobleem wordt geïntroduceerd door de keuze voor het combinatieproduct en zich dus niet voordeed in het alternerende regime van Ortonne (zie r.o. 4.5), is niet zonder meer plausibel dat vervanging van het alternerende regime door een van de onder de conclusies 1 en 2 vallende combinatieproducten leidt tot een verbeterde behandeling van psoriasis. Voor zover Leo met haar verwijzing naar paragraaf 6.4.2. van de beslissing van de oppositiedivisie heeft willen betogen dat een verbeterde behandeling wel plausibel is bij ‘immediate application of a fresh preparation’, kan dat niet leiden tot een andere uitkomst. De conclusies 1 en 2 zijn niet beperkt tot vers bereide producten die onmiddellijk moeten worden toegediend. De conclusies omvatten ook instabiele producten die langere tijd worden bewaard, waarbij – anders dan in het alternerende regime van Ortonne – het stabiliteitsprobleem dus daadwerkelijk leidt tot afbraak van de actieve stof.
4.29.
De gemiddelde vakman zal het in het licht van het voorgaande niet zonder meer plausibel hebben gevonden dat toediening van een combinatieproduct over de hele breedte van de conclusies 1 en 2 van het octrooi leidt tot een betere behandeling van psoriasis. De eventuele plausibiliteit van dit effect kan de vakman dus uitsluitend afleiden uit het octrooischrift. De verbeterde werking wordt voor de gemiddelde vakman echter niet plausibel gemaakt in het octrooischrift. De beschrijving stelt wel dat het geclaimde combinatieproduct therapeutische voordelen biedt ten opzichte van alternerende toediening (zie de hiervoor in r.o. 4.21 geciteerde paragrafen), maar het octrooischrift onderbouwt die stelling niet. Het octrooischrift openbaart bijvoorbeeld geen resultaten van onderzoek waarin de werking van het combinatieproduct wordt vergeleken met de werking van een alternerende toediening van calcipotriol en betamethason(dipropionaat). Evenmin openbaart het octrooischrift een mechanisme dat voor de gemiddelde vakman inzichtelijk maakt waarom het combinatieproduct beter zou werken dan alternerende toediening.
4.30.
De opmerking van Leo dat een ‘theoretisch additief effect’ van de alternerende therapie kan worden berekend en vergeleken met de gegevens over de werking van het combinatieproduct, kan niet leiden tot een ander oordeel. Zoals het hof hiervoor al heeft overwogen gaat deze redenering er ten onrechte van uit dat de gemiddelde vakman zou aannemen dat het effect van het alternerende regime niet meer dan additief kan zijn en toont de berekening ook niet eenduidig een verbetering aan.
4.31.
Daar komt bij dat de door Leo voorgestelde berekening ervan uitgaat dat het effect van het vehikel op de werkzaamheid van de behandeling volledig buiten beschouwing kan worden gelaten bij de vaststelling van de plausibiliteit van een door het combinatieproduct veroorzaakt verschil in de behandeling van psoriasis. Dat is niet terecht. Zoals hiervoor is vastgesteld, ging de vakman er op de aanvraagdatum van uit dat de toepassing van een combinatieproduct vanwege stabiliteitsproblemen een negatief effect kan hebben op de werkzaamheid. Dat negatieve effect is niet meegenomen in de onderzoeksresultaten die het octrooischrift openbaart. Bij dat onderzoek is bij de monoproducten hetzelfde vehikel toegepast als bij het combinatieproduct. De door Leo voorgestelde berekening geeft de gemiddelde vakman dus geen uitsluitsel over de vraag of een eventueel positief effect van de keuze voor het combinatieproduct volledig teniet wordt gedaan door het bekende negatieve effect daarvan.
4.32.
Het gebrek aan plausibiliteit geldt ook voor de vermindering van bijwerkingen die volgens Leo met het combinatieproduct kan worden gerealiseerd. Daarbij staat voorop dat Sandoz, onder verwijzing naar diverse publicaties uit de stand van de techniek (Ortonne, Kragballe, Ruzicka en Lebwohl) en paragraaf [0022] van het octrooischrift, heeft aangevoerd dat op de aanvraagdatum bekend was dat het alternerende regime resulteert in minder bijwerkingen dan de monotherapieën. Ook heeft Sandoz erop gewezen dat het octrooischrift leert dat een deel van de patiënten daarvan niet profiteert vanwege een gebrek aan therapietrouw (octrooischrift, paragraaf [0022]) en benadrukt dat een combinatieproduct gunstige effecten heeft op therapietrouw (octrooischrift, paragrafen [0006], [0007],[0025] en [0026]). In dat licht is voorshands niet aannemelijk dat de gemiddelde vakman in het octrooischrift leest dat toepassing van het geclaimde combinatieproduct los van het effect van therapietrouw leidt tot minder bijwerkingen dan het alternerende regime. Bovendien staan in het octrooischrift geen onderzoeksgegevens over bijwerkingen, ook niet over de bijwerkingen van het geclaimde product. Evemin openbaart het octrooischrift een mechanisme dat voor de vakman inzichtelijk maakt waarom het combinatieproduct zou resulteren in minder bijwerkingen.
4.33.
Op grond van het voorgaande moet worden geconcludeerd dat de door Leo bedoelde effecten voor de gemiddelde vakman niet over de hele breedte van de conclusies 1 en 2 plausibel waren op basis van het octrooischrift of zijn algemene vakkennis en dat de voorzieningenrechter die effecten daarom terecht buiten beschouwing heeft gelaten bij de beoordeling van inventiviteit.
4.34.
Omdat de inventiviteitsaanval slaagt, kan hetgeen Leo in grief 6 aanvoert over de nawerkbaarheid onbesproken blijven. Grieven 3 en 6 treffen dus geen doel.
grief 4: onderbouwing effect in post-published evidence
4.35.
Gegeven het feit dat de door Leo aangevoerde effecten op de aanvraagdatum niet plausibel waren voor de gemiddelde vakman, moeten die effecten buiten beschouwing blijven bij de beoordeling van inventiviteit, ook als uit bewijsmateriaal van na de aanvraagdatum zou blijken dat die effecten wel optreden. Daarom kan grief 4 van Leo tegen het oordeel van de voorzieningenrechter over dat post-published evidence niet leiden tot vernietiging van het bestreden vonnis en hoeft geen oordeel te worden gegeven over het betoog van Sandoz dat die effecten niet met voldoende mate van zekerheid blijken uit dat bewijsmateriaal.
grief 7: onderconclusies
4.36.
Leo heeft ook in hoger beroep niet bestreden dat als conclusies 1 en 2 niet inventief zijn, ook de onderconclusies 3, 4 en 9 waarop zij zich beroept, niet geldig zijn. De voorzieningenrechter heeft dus terecht geconcludeerd dat geen van de conclusies waarop Leo zich beroept een basis kunnen vormen voor een verbod. Grief 7, die gericht is tegen die conclusie, moet worden verworpen.
algemene grief: beslissing OD
4.37.
Leo heeft in haar ‘algemene grief’ terecht naar voren gebracht dat bij de beoordeling van de nietigheidsgronden die Sandoz heeft aangevoerd, rekening moet worden gehouden met het feit dat de OD bij beslissing van 6 oktober 2016 het octrooi ongewijzigd in stand heeft gehouden. Dat feit brengt mee dat een inbreukverbod alleen dan in verband met de kans op herroeping in oppositie of nietigverklaring in een bodemprocedure achterwege behoort te blijven als een gerede kans bestaat dat de Technische Kamer van Beroep (hierna: TKB), anders dan de OD, het octrooi in hoger beroep zal herroepen (HR 26 oktober 2001, ECLI:NL:HR:2001:AB2774, Tetra Laval/Meyn, r.o. 3.4.2 en HR 21 april 1995, ECLI:NL:HR:1995:ZC1705, Boehringer/Kirin Amgen, r.o. 3.4). Enerzijds houdt dat in dat het enkele herhalen van al door de OD beoordeelde en verworpen argumenten en de enkele mogelijkheid van een andere beoordeling van die argumenten door de TKB onvoldoende is. Het zal ten minste aannemelijk moeten zijn dat de TKB anders zal oordelen dan de OD (Boehringer/Kirin Amgen-arrest, r.o. 3.4). Anderzijds is voor het oordeel dat een gerede kans bestaat dat de TKB het octrooi zal herroepen niet slechts plaats in het geval dat Sandoz aannemelijk maakt dat de OD zodanige fouten heeft gemaakt dan wel op zulk belangrijk materiaal geen acht heeft geslagen (of heeft kunnen slaan) dat te verwachten is dat, waren die fouten niet gemaakt of het materiaal wel in de beschouwingen betrokken, het octrooi niet in stand was gebleven (Tetra Laval/Meyn-arrest, r.o. 3.4.2). Een kennelijke misslag of novum is dus niet vereist.
4.38.
Gelet op hetgeen hiervoor is overwogen over de inventiviteit van het octrooi, bestaat in dit geval een gerede kans dat de TKB, anders dan de OD, de conclusies van het octrooi waar Leo zich op beroept, zal herroepen. Ten eerste heeft Leo in de onderhavige procedure de inventiviteit van het octrooi primair gebaseerd op de stelling dat de twee actieve stoffen synergetisch werken. De OD onderschrijft in haar beslissing dat de verdediging van de inventiviteit van de ingeroepen conclusies geen stand kan houden op die grond. Ten tweede baseert de OD haar oordeel over de plausibiliteit van de verbeterde behandeling louter op de in het octrooischrift vermelde onderzoeksgegevens met betrekking tot de monotherapieën. Op basis van de argumenten en bewijsmiddelen die bij het hof naar voren zijn gebracht, is het aannemelijk dat de TKB daar anders over zal oordelen, mede gelet op het feit dat de OD in haar oordeel niet kenbaar rekening heeft gehouden met het ontbreken van gegevens over de werking van het alternerende regime. Evenmin acht het hof het aannemelijk dat de TKB de OD zal volgen in het oordeel dat het effect van de verbeterde behandeling optreedt over het gehele bereik van de conclusies, ongeacht stabiliteitsproblemen op de lange termijn. Ten vierde heeft de OD in de oppositieprocedure met betrekking EP 808 geoordeeld dat een combinatieproduct bestaande uit een Vitamine D analoog, zoals calcipotriol, en een corticosteroïde, zoals betamethason(dipropionaat), niet inventief was, zelfs niet in combinatie met een bepaald oplosmiddel. Ook met dat negatieve oordeel over de inventiviteit van een combinatieproduct van calcipotriol en betamethason(dipropionaat) moet rekening worden gehouden.
buitenlandse uitspraken
4.39.
De beslissingen van buitenlandse rechters over de buitenlandse delen van EP 083 brengen het hof ook niet tot een ander oordeel. In een door een derde aangespannen nietigheidsprocedure in Engeland heeft Leo het Engelse deel van EP 083 beperkt tot één van de oplosmiddelen die in conclusie 5 van EP 083 worden genoemd. Dat de Engelse rechter in beroep het octrooi met die beperking in stand heeft gelaten, botst niet met het oordeel van dit hof dat een gerede kans bestaat dat de bodemrechter of de TKB tot het oordeel zal komen dat het octrooi zonder die beperking niet inventief is.
4.40.
In Duitsland en Zweden is een voorlopig verbod opgelegd aan (een partij die gelieerd is aan) Sandoz . Daarbij is vanwege procesrechtelijke regels de geldigheid van EP 083 beperkt inhoudelijk beoordeeld. Bovendien hebben partijen de Duitse uitspraak niet overgelegd. Het hof kan dus niet beoordelen welke nietigheidsverweren naar voren zijn gebracht bij de Duitse rechter en hoe deze zijn beoordeeld. De Zweedse uitspraak is wel overgelegd (productie 16 van Leo). In die uitspraak overweegt de Zweedse rechter dat het niet ongefundeerd lijkt dat de geclaimde uitvinding resulteert in een betere behandeling dan het alternerende regime. Als die overweging betrekking heeft op de plausibiliteit van dat effect op basis van het octrooischrift, kan het hof die niet onderschrijven op basis van de argumenten en bewijsmiddelen die in de onderhavige procedure zijn aangevoerd.
4.41.
In Denemarken heeft Sandoz in een provisionele voorzieningsprocedure vrijwillig voldaan aan het gevorderde verbod en heeft de rechter dus niet hoeven oordelen over de geldigheid van EP 083.
in incidenteel beroep
4.42.
Het incidenteel beroep moet worden verworpen. De voorzieningenrechter heeft een bedrag van € 30.000,00 in mindering gebracht op de door Sandoz in eerste aanleg gevorderde kosten omdat Sandoz onvoldoende aannemelijk had gemaakt dat die kosten in het kader van onderhavige procedure waren gemaakt, gelet op het feit dat de kosten zagen op werkzaamheden met betrekking tot ‘pre-launch documents’ die ruim voor het aanbrengen van het kort geding waren uitgevoerd. In haar memorie van grieven in incidenteel appel heeft Sandoz naar voren gebracht dat het gaat om advieswerkzaamheden die Sandoz heeft laten verrichten voorafgaand aan de marktintroductie van haar product, onder meer in verband met de lopende oppositie tegen het moederoctrooi en het octrooi. Gesteld noch gebleken is dat er op het moment dat die werkzaamheden werden uitgevoerd, al sprake was van dreigend handhavend handelen door Leo, laat staan onrechtmatig (dreigen met) handhavend handelen. Integendeel, Leo heeft erop gewezen dat de advieswerkzaamheden zijn verricht voorafgaand aan haar sommatiebrief van 17 maart 2016. Een en ander bevestigt dat de werkzaamheden niet kunnen worden aangemerkt als (de voorbereiding van) een verweer tegen de in dit kort geding naar voren gebrachte vorderingen. Dat de werkzaamheden, nadat het kort geding aanhangig was gemaakt, ook nuttig bleken te zijn voor het verweer van Sandoz tegen die vorderingen, maakt – anders dan Sandoz meent – niet dat de kosten van kleur zijn verschoten en vanaf dat moment als in het kader van deze procedure gemaakte ‘inleeskosten’ kunnen worden gekwalificeerd.
in principaal en incidenteel beroep
4.43.
Op grond van het voorgaande moet worden geconcludeerd dat het principaal en incidenteel beroep moeten worden verworpen en dat het bestreden vonnis dus moet worden bekrachtigd.
4.44.
Leo zal als in het ongelijk gestelde partij worden veroordeeld in de kosten van het principaal beroep. Sandoz zal als in het ongelijk gestelde partij worden veroordeeld in de kosten van het incidenteel beroep. Partijen zijn overeengekomen dat de proceskosten kunnen worden begroot op € 200.000,- en dat dit bedrag volledig is toe te rekenen aan het principaal beroep. Het hof ziet in dit geval geen aanleiding af te wijken van die begroting.
5. De beslissing
Het hof
5.1.
bekrachtigt het tussen partijen gewezen vonnis van de voorzieningenrechter in de rechtbank Den Haag van 11 mei 2016;
5.2.
veroordeelt Leo in de kosten van het principaal beroep, tot op heden aan de zijde van Sandoz begroot op € 200.000,-, te vermeerderen met de wettelijke rente ex artikel 6:119 BW over dit bedrag vanaf 14 dagen na heden tot aan de dag der voldoening;
5.3.
veroordeelt Sandoz in de kosten van het incidenteel beroep, tot op heden begroot op nihil;
5.4.
verklaart de proceskostenveroordelingen uitvoerbaar bij voorraad.
Dit arrest is gewezen door mr. P.H. Blok, mr. R. Kalden en mr. C.J.J.C. van Nispen en is uitgesproken ter openbare terechtzitting van 7 november 2017 in aanwezigheid van de griffier.