Europees Octrooibureau
Rb. Den Haag, 01-03-2017, nr. C/09/526079 / KG ZA 17-129
ECLI:NL:RBDHA:2017:1907
- Instantie
Rechtbank Den Haag
- Datum
01-03-2017
- Zaaknummer
C/09/526079 / KG ZA 17-129
- Vakgebied(en)
Intellectuele-eigendomsrecht (V)
- Brondocumenten en formele relaties
ECLI:NL:RBDHA:2017:1907, Uitspraak, Rechtbank Den Haag, 01‑03‑2017; (Kort geding)
- Vindplaatsen
JGR 2018/7
Uitspraak 01‑03‑2017
Inhoudsindicatie
Octrooizaak combinatietherapie pemetrexed met vitamine B12. Inbreukverbod toegewezen. Onvoldoende kans dat octrooi nietig zal worden bevonden.
Partij(en)
vonnis
RECHTBANK DEN HAAG
Team handel
zaaknummer / rolnummer: C/09/526079 / KG ZA 17-129
Vonnis in kort geding van 1 maart 2017
in de zaak van
de vennootschap naar vreemd recht
ELI LILLY COMPANY,
gevestigd te Indianapolis, Verenigde Staten,
eiseres,
advocaat mr. L. Oosting te Amsterdam,
tegen
de besloten vennootschap met beperkte aansprakelijkheid
SANDOZ B.V.,
gevestigd te Almere,
gedaagde,
advocaat mr. D.F. de Lange te Amsterdam.
Partijen zullen hierna Lilly en Sandoz genoemd worden. De zaak is voor Lilly inhoudelijk behandeld door mr. Oosting voornoemd, mr. K.A.J. Bisschop en mr. H.J. Ridderinkhof, advocaten te Amsterdam, en voor Sandoz door mr. De Lange voornoemd en mr. A.D. de Leeuw, advocaat te Amsterdam.
1. De procedure
1.1.
Het verloop van de procedure blijkt uit:
- -
de dagvaarding van 30 januari 2017, met productie 1 tot en met 33;
- -
de akte houdende overlegging specificatie proceskosten van de zijde van Lilly ingekomen ter griffie op 31 januari 2017;
- -
de conclusie van antwoord ingekomen ter griffie op 3 februari 2017, met productie 1 tot en met 38;
- -
de mondelinge behandeling van 6 februari 2017 en de ter gelegenheid daarvan overgelegde pleitnotities van Lilly, alsmede de ter gelegenheid daarvan overgelegde pleitnota van Sandoz.
1.2.
Vonnis is bepaald op heden.
2. De feiten
2.1.
Lilly is onderdeel van het Lilly concern dat wereldwijd opereert en actief is op het gebied van onderzoek, ontwikkeling en verhandeling van nieuwe innovatieve geneesmiddelen.
2.2.
Lilly brengt onder meer het geneesmiddel ALIMTA op de markt. Dit geneesmiddel wordt toegepast bij de behandeling van bepaalde longkankers (tumorgroei). De actieve stof in Alimta is pemetrexed. Het antifolaat pemetrexed werd aanvankelijk beschermd door Europees octrooi EP 0 432 677 (hierna: EP 677), dat mede op naam van Lilly stond. EP 677 is het basisoctrooi voor Aanvullend Beschermingscertificaat 300181 voor ‘pemetrexed, desgewenst in de vorm van een farmaceutisch aanvaardbaar zout’ (hierna: het ABC). Het ABC was van kracht tot en met 9 december 2015.
2.3.
Daarnaast is Lilly houdster van het Europees octrooi EP (NL) 1 313 508 (hierna: EP 508 of het octrooi) voor een ‘Combination containing an antifolate and methylmalonic acid lowering agent’. De aanvraag voor EP 508 werd ingediend op 15 juni 2001 met beroep op de prioriteitsdata 30 juni 2000, 27 september 2000 en 18 april 2001 op basis van een drietal Amerikaanse octrooiaanvragen. De verlening van EP 508 is gepubliceerd op 18 april 2007. Het octrooi is van kracht tot en met 14 juni 2021.
2.4.
EP 508 is getiteld “Combination containing an antifolate and methylmalonic acid lowering agent” (waarvan de Nederlandse vertaling luidt: “Samenstelling welke een antifolaat en methylmalonzuur verlagend middel bevat”). De conclusies van het octrooi luiden in de authentieke Engelse versie:
“1. Use of pemetrexed disodium in the manufacture of a medicament for use in combination therapy for inhibiting tumor growth in mammals wherein said medicament is to be administered in combination with vitamin B12 or a pharmaceutical derivative thereof, said pharmaceutical derivative of vitamin B12 being hydroxocobalamin, cyano-10-chlorocobalamin, aquocobalamin perchlorate, aquo-10-chlorocobalamin perchlorate, azidocobalamin, chlorocobalamin or cobalamin.
2. Use according to claim 1 wherein said medicament is to be administered in combination with vitamin B12 or a pharmaceutical derivative thereof, said pharmaceutical derivative of vitamin B12 being hydroxocobalamin, cyano-10-chlorocobalamin, aquocobalamin perchlorate, aquo-10-chlorocobalamin perchlorate, azidocobalamin, chlorocobalamin or cobalamin, and a folic binding protein binding agent selected from folic acid, (6R)-5-methyl-5,6,7,8-tetrahydrofolic acid and (6R)-5-forinyl-5,6,7,8-tetrahydrofohc acid or a physiologically available salt or ester thereof.
3. Use according to claim 2 wherein the folic binding protein binding agent is folic acid.
4. Use according to any one of claims 1 to 3 wherein the vitamin B12 or pharmaceutical derivative thereof is vitamin B12, cobalamin or chlorocobalamin.
5. Use according to any one of claims 1 to 3 wherein the vitamin B 12 or pharmaceutical derivative thereof is selected from vitamin B12 or hydroxocobalamin.
6. Use according to any one of claims 1 to 5 wherein the medicament, the vitamin B12 or pharmaceutical derivative thereof and optionally the folic binding protein binding agent are to be administered simultaneously, separately or sequentially.
7. Use according to any one of claims 1 to 6 wherein the medicament is to be administered after administration of the vitamin B12 or pharmaceutical derivative thereof.
8. Use according to any one of claims 1 to 7 wherein the medicament is to be administered after the folic binding protein binding agent.
9. Use according to any one of claims 2 to 8 wherein the medicament is to be administered after pretreatment with the vitamin B12 or pharmaceutical derivative thereof followed by folic acid.
10. Use according to any one of claims 1 to 9 wherein vitamin B12 or pharmaceutical derivative thereof is to be administered as an intramuscular injection.
11. Use according to any one of claims 2 to 10 wherein the folic binding protein binding agent is to be administered orally as a tablet.
12. A product containing pemetrexed disodium, vitamin B12 or a pharmaceutical derivative thereof said pharmaceutical derivative of vitamin B12 being hydroxocobalamin, cyano-10-chlorocobalamin, aquocobalamin perchlorate, aquo-10-chlorocobalamin perchlorate, azidocobalamin, chlorocobalamin or cobalamin, and, optionally, a folic binding protein binding agent selected from the group consisting of folic acid, (6R)-5-methyl-5,6,7,8-tetrahydrofolic acid and (6R)-5-formyl-5,6,7,8-tetrahydrofolic acid, or a physiologically available salt or ester thereof, as a combined preparation for the simultaneous, separate or sequential use in inhibiting tumor growth.
13. A product according to claim 12 wherein the vitamin B12 or pharmaceutical derivative thereof is vitamin B12, cobalamin or chlorocobalamin and, if present, the folic binding protein binding agent is folic acid.
14. A product according to claim 12 wherein the vitamin B12 or pharmaceutical derivative thereof is vitamin B12 or hydroxocobalamin and, if present, the folic binding protein binding agent is folic acid.”
2.5.
In de onbestreden Nederlandse vertaling luiden de conclusies als volgt:
“1. Toepassing van pemetrexed dinatrium bij het bereiden van een geneesmiddel voor toepassing bij combinatietherapie voor het remmen van tumorgroei bij zoogdieren, waarbij het geneesmiddel dient te worden toegediend in combinatie met vitamine B12 of een farmaceutisch derivaat daarvan, waarbij het farmaceutisch derivaat van vitamine B12 hydroxocobalamine, cyaan-10-chloorcobalamine, aquocobalamine perchloraat, aquo-10-chloorcobalamine perchloraat, azidocobalamine, chloorcobalamine of cobalamine is.
2. Toepassing volgens conclusie 1, waarbij het geneesmiddel dient te worden toegediend in combinatie met vitamine B12 of een farmaceutisch derivaat daarvan, waarbij het farmaceutisch derivaat van vitamine B12 hydroxocobalamine, cyaan-10-chloorcobalamine, aquocobalamine perchloraat, aquo-10-chloorcobalamine perchloraat, azidocobalamine, chloorcobalamine of cobalamine is, en een foliumbindend eiwit bindend middel gekozen uit foliumzuur, (6R)-5-methyl-5,6,7,8-tetrahydrofoliumzuur en (6R)-5-formyl-5,6,7,8-tetrahydrofoliumzuur of een fysiologisch aanvaardbaar zout of ester daarvan.
3. Toepassing volgens conclusie 2, waarbij het foliumbindende eiwitbindende middel foliumzuur is.
4. Toepassing volgens een of meer van de conclusies 1-3, waarbij het vitamine B12 of het farmaceutische derivaat daarvan vitamine B12, cobalamine of chloorcobalamine is.
5. Toepassing volgens een of meer van de conclusies 1-3, waarbij het vitamine B12 of het farmaceutische derivaat daarvan is gekozen uit vitamine B12 of hydroxocobalamine.
6. Toepassing volgens een of meer van de conclusies 1-5, waarbij het geneesmiddel, het vitamine B12 of het farmaceutische derivaat daarvan en eventueel het foliumbindende eiwitbindende middel tegelijkertijd, afzonderlijk of achtereenvolgens dienen te worden toegediend.
7. Toepassing volgens een of meer van de conclusies 1-6, waarbij het geneesmiddel dient te worden toegediend na toediening van het vitamine B12 of het farmaceutische derivaat daarvan.
8. Toepassing volgens een of meer van de conclusies 1-7, waarbij het geneesmiddel na het foliumbindende eiwitbindende middel dient te worden toegediend.
9. Toepassing volgens een of meer van de conclusies 2-8, waarbij het geneesmiddel dient te worden toegediend na voorbehandeling met het vitamine B12 of het farmaceutische derivaat daarvan gevolgd door foliumzuur.
10. Toepassing volgens een of meer van de conclusies 1-9, waarbij het vitamine B12 of het farmaceutische derivaat daarvan als een intramusculaire inspuiting dient te worden toegediend.
11. Toepassing volgens een of meer van de conclusies 2-10, waarbij het foliumbindend eiwitbindend middel als een tablet oraal dient te worden toegediend.
12. Product dat pemetrexed dinatrium, vitamine B12 of een farmaceutisch derivaat daarvan, waarbij het farmaceutisch derivaat van vitamine B12 hydroxocobalamine, cyaan-10-chloorcobalamine, aquocobalamine perchloraat, aquo-10-chloorcobalamine perchloraat, azidocobalamine, chloorcobalamine of cobalamine is, en eventueel een foliumbindend eiwitbindend middel gekozen uit de groep bestaande uit foliumzuur, (6R)-5-methyl-5,6,7,8-tetrahydrofoliumzuur en (6R)-5-formyl-
5,6,7,8-tetrahydrofoliumzuur, of een fysiologisch aanvaardbaar zout of ester daarvan, als een gecombineerd preparaat voor gelijktijdige, afzonderlijk of achtereenvolgend gebruik bij remmen van tumorgroei, bevat.
13. Product volgens conclusie 12, waarbij het vitamine B12 of het farmaceutische derivaat daarvan vitamine B12, cobalamine of chloorcobalamine is en, indien aanwezig, het foliumbindende eiwitbindende middel foliumzuur is.
14. Product volgens conclusie 12, waarbij het vitamine B12 of farmaceutisch derivaat daarvan vitamine B12 of hydroxocobalamine is en, indien aanwezig, het foliumbindend eiwitbindend middel foliumzuur is.”
2.6.
In de authentieke Engelse versie van de beschrijving van het octrooi is voorts - voor zover hier van belang - het volgende opgenomen:
“[0001] Potentially, life-threatening toxicity remains a major limitation to the optimal administration of antifolates. (see, generally, Antifolate Drugs in Cancer Therapy, edited by Jackman, Ann L., Humana Press, Totowa, NJ, 1999.) In some cases, a supportive intervention is routinely used to permit safe, maximal dosing. For example, steroids, such as dexamethone, can be used to prevent the formation of skin rashes caused by the antifolate. (Antifolate, pg 197.)
[0002] Antifolates represent one of the most thoroughly studied classes of antineoplastic agents, with aminopterin initially demonstrating clinical activity approximately 50 years ago. Methotrexate was developed shortly thereafter, and today is a standard component of effective chemotherapeutic regimens for malignancies such as lymphoma, breast cancer, and head and neck cancer. (Bonnadonna G, Zambetti M, Valagussa P. Sequential or alternating doxorubicin and CMF regimens in breast cancer with more than three positive nodes: Ten year results. JAMA 1995;273(7):542-547; Bonnadonna G, Valagussa P, Moliterni A, Zambetti M, Brambilla C. Adjuvant cyclophosphamide, methotrexate, and fluorouracil in node-positive breast cancer: The results of 20 years of follow-up. N Engl J Med 1995;332(14):901-906; and Hong WK, Schaefer S, Issell B, et al A prospective randomized trial of methotrexate versus cisplatin in the treatment of recurrent squamous cell carcinoma of the head and neck. Cancer 1983;52:206-210.) Antifolates inhibit one or several key folate-requiring enzymes of the thymidine and purine biosynthetic pathways, in particular, thymidylate synthase (TS), dihydrofolate reductase (DHFR), and glycinamide ribonucleotide formyltransferase (GARFT), by competing with reduced folates for binding sites of these enzymes. (Shih C, Habeck LL, Mendelsohn LG, Chen VJ, Schultz RM. Multiple folate enzyme inhibition: Mechanism of a novel pytrolopyrimidine-based antifolate LY231514 (MTA). Advan Enzyme Regul, 1998; 38:135-152 and Shih C, Chen VJ, Gossett LS, et al. LY231514, a pyrrolo[2,3-d]pyrimidine-based antifolaten that inhibits multiple folate-requiring enzymes. Cancer Res 1997;57:1116-1123.) Several antifolate drugs are currently in development. Examples of antifolates that have thymidylate synthase inhibiting ("TSI") characteristics include 5-fluorouracil and Tomudex®. An example of an antifolate that has dihydrofolate reductase inhibiting ("DHFRI'') characteristic is Methotrexate®. An example of an antifolate that has glycinamide ribonucleotide formyltransferase inhibiting (''GARFTI") characteristics is Lometrexol. Many of these antifolate drugs inhibit more than one biosynthetic pathway.
For example Lometrexol is also an inhibitor of dihydrofolate reductase and pemetrexed disodium (Alimta®, Eli Lilly and Company, Indianapolis, IN) has demonstrated thymidylate synthase, dihydrofolate reductase, and glycinamide ribonucleotide formyltransferase inhibition.
[0003] A limitation to the development of these drugs is that the cytotoxic activity and subsequent effectiveness of antifolates may be associated with substantial toxicity for some patients. Additionally antifolates as a class are associated with sporadic severe mylosuppression with gastrointestinal toxicity which, though infrequent, carries a high risk of mortality. The inability to control these toxicities led to the abandonment of clinical development of some antifolates and has complicated the clinical development of others, such as Lometrexol and raltitrexed. (Jackman AL, Calvert AH Folate-
Based Thymidylate Synthase Inhibitors as Anticancer Drugs. Ann Oncol 1995;6(9):871-881; Laohavinij S, Wedge SR, Lind MJ, et al. A phase I clinical study of the antipurine antifolate Lometrexol (DDATHF) given with oral folic acid. Invest New Drugs 1996;14:325-335; and Maughan TS, James RD, Kerr D, et al., on behalf of the British MRC Colorectal Cancer Working Party. Preliminary results of a multicenter randomized trial comparing 3 chemotherapy regimens (deGramont, Lokich, and raltitrexed) in metastatic colorectal cancer. Proc ASCO 1999;18:Abst 1007.)
[0004] Initially, folic acid was used as a treatment for toxicities associated with GARFTI see, e.g. U.S. Pat. No. 5,217,974. Folic acid has been shown to lower homocysteine levels (see e.g. Homocysteine Lowering Trialist's Collaboration. Lowering blood homocysteine with folic acid based supplements: meta-analysis of randomized trials. (BMJ 1998; 316:894-898 and Naurath HJ, Joosten E, Riezler R, Stabler SP, Allen RH', Lindenbaum J). The role of folic acid in modulating the toxicity and efficacy of the multitargeted antifolate LY 231514 (pemetrexed) was discussed in Worzalla et al. (Anticancer Research 18: 3235-3240 (1998) Worzalla JF, Chuan S and Schultz RM). EP-A-0546870 relates to nutrient compositions which are intended to prevent and cure infectious diseases and which are intended to be administered to patients being administered with anticancer drugs to prevent and treat infectious diseases due to immunosuppression induced by the anticancer drug therapy. The compositions of EP-A-0546870 are characterized in that they comprise a certain amount of retinoid compound(s) such as vitamin A which is indicated as being responsible for the immunoreactivity. Effects of vitamin B12, folate and vitamin B6 supplements in elderly people with normal serum vitamin concentrations (Lancet 1995; 346:85-89), and homocysteine levels have been shown to be a predictor of cytotoxic events related to the use of GARFT inhibitors, see e.g. U.S. Pat. No. 5,217,974. However, even with this treatment, cytotoxic activity of GARFT inhibitors and antifolates as a class remains a serious concern in the development of antifolates as pharmaceutical drugs. The ability to lower cytotoxic activity would represent an important advance in the use of these agents.
[0005] Surprisingly and unexpectedly, we have now discovered that certain toxic effects such as mortality and nonhematologic events, such as skin rashes and fatigue, caused by antifolates, as a class, can be significantly reduced by the presence of a methylmalonic acid lowering agent as vitamin B12, without adverse adversely affecting therapeutic efficacy. The present invention thus generally relates to a use in the manufacture of a medicament for improving the therapeutic utility of antifolate drugs by administering to the host undergoing treatment with a methylmalonic acid lowering agent as vitamin B12. We have discovered that increased levels of methylmalonic acid is a predictor of toxic events in patients that receive an antifolate drug and that treatment for the increased methylmalonic acid, such as treatment with vitamin B12, reduces mortality and nonhematologic events, such as skin rashes and fatigue events previously associated with the antifolate drugs. Thus, the present invention generally relates to a use in the manufacture of a medicament for reducing the toxicity associated with the administration of an antifolate to a mammal by administering to said mammal an effective amount of said antifolate in combination with a methylmalonic acid lowering agent as vitamin B12.
[0006] Additionally, we have discovered that the combination of a methylmalonic acid lowering agent as vitamin B12 and folic acid synergistically reduces the toxic events associated with the administration of antifolate drugs. Although, the treatment and prevention of cardiovascular disease with folic acid in combination with vitamin B12 is known, the use of the combination for the treatment of toxicity associated with the administration of antifolate drugs was unknown heretofore.”
2.7.
Na de verlening van EP 508 is door Teva Pharmaceuticals Industry (hierna: Teva) oppositie ingesteld bij het EOB.1.De oppositieafdeling van het EOB (hierna: OD) heeft bij de mondelinge behandeling op 18 november 2010 de oppositie afgewezen en het octrooi in stand gelaten zoals verleend. In de schriftelijke beslissing van de OD ter zake (gedateerd 27 december 2010) is - voor zover in de onderhavige procedure relevant - opgenomen:
“1 SUMMARY OF FACTS AND SUBMISSIONS
(…)
Proprietor of the patent (P): Eli Lilly, Indianapolis (US)
Opponent 1 (O1) : Teva Pharmaceutical Industries Ltd., Petah Tqva (IL)
(…)
1.11
The following documents have been cited by the parties:
(…)
D8(a) and D8 (b): "Metabolism at a Glance", edited by Blackwell Science (1998 edition), pages 54-57.
D09: Niyikiza C et al.: "L Y231 514 (MTA): relationship of vitamin metabolite profile to toxicity", American Society of Clinical Oncology (ASCO) Meeting Abstract No.2139 (1998).
(…)
D12: Worzalla et al.: "Role of Folic acid in Modulating the Toxicity and Efficacy of the
Multitargeted Antifolate, L Y231 514", Anticancer Research (1998), 18: 3235 -3240.
D13: "Clinical Chemistry: principle, procedures, correlation", third edition (1996), published by Lippincott: pages 61 8-627.
(…)
D19: Barak, et al.: "Vitamin B12 as a Possible Adjunct in Prevention of Methotrexate Hepatotoxicity", Biochemical Archives (1985), vol. 1: 139 -142.
D20: Arsenyan, et al.: "Influence of Methylcobalamin on the Antineoplastic Activity of
Methotrexate", Pharmaceutical Chemistry Journal (1978), vol. 10: 1299 -1304.
D21: Maysishecheva, N.y., et al.: "Antitumor Activity of Methotrexate When Used in Combination with Cobalamine Derivatives", Eksperimentalnaya Onkologija (1982), vol. 4, no. 5: 29-33.
(…)
D22: Sofyina, Z.P., et al.: "Possibility of Potentiating the Antineoplastic Action of Folic Acid Antagonist by Methylcobalamine Analogs", Vestnik Akademli Medicinskich Nauk SSSR (1979), vol. 1: 72-78.
(…)
D23: McDonald, A.C., et al.: "Clinical Phase I Study of L Y231 514, a Multitargeted Antifolate, Administered by Daily x 5 q 21 Schedule", Annals of Oncology(1996), vol. 7: 85, Abstract No. 291.
(…)
D26: Abstract No.907, Zervos et al.: "Functional folate status as a prognostic indicator of toxicity in clinical trials of the multitargeted antifolate L Y231514", Proceedings of ASCO, Vol.16, 1997, page 256a.
(…)
D28: Calvert, Hilary: "An Overview of Folate Metabolism: Features Relevant to the Action of Toxicities of Antifolate Anticancer Agents", Seminars in Oncology, Vol.26, No.2, Suppl. 6 (1999), pages 3-10.
(…)
REASONS FOR THE DECISION
(…)
5 Inventive step(Article 100(a) in conjunction with Article 56 EPC)
5.1
Document D28, which constitutes the closest prior art, is a scientific article in which the action and toxicities of antifolate anticancer agents, including pemetrexed is discussed. D28 discloses the antitumor properties of pemetrexed (MTA) as well as its toxicity. This toxicity is correlated to an increase in homocysteine levels (page 9, left-hand column, paragraph 1). D28 further teaches that any functional deficiency either in B12 or folate will result in an increase in the plasma level of homocysteine (page 8, right-hand column).
5.2
The problem to be solved by the present invention is to reduce the toxicity associated with the administration of pemetrexed disodium in cancer patients.
The proposed solution is to use vitamin B12 alone or in association with folic acid.
5.3
The OD is convinced that the above-mentioned problem was solved in the light of the experimental data described on paragraphs [0034] to [0056] of the patent in suit (see point 3 above "insufficiency of disclosure").
5.4
During oral proceedings, O1 has argued lack of inventive step based on D28 taken alone or in combination with D9 in view of the general knowledge D13.
D28 teaches that the toxicity of pemetrexed is correlated to an increase in homocysteine plasma levels; said increase of homocysteine plasma level being known to be correlated with vitamin B12 deficiency. Consequently, the solution to the problem of the toxicity of pemetrexed, i.e. the administration of vitamin B12 was thus obvious in view of D28 based on the disclosure of pages 8-9 and Fig.8 (see point 5.1 above).
Alternatively, according to O1 D28 can be combined with D9 (reference 17 of D28).
D9 discloses a study concerning the problem of toxicity of pemetrexed. Neutropenia, thrombocytopenia, mucositis and diarrhea are mentioned as toxic side effects related to high level of homocysteine. The skilled person starting from D28/D9 and knowing that the pemetrexed toxicity is related to homocysteine would have been prompted by D13 to use vitamin B12 to lower the homocysteine blood level, and thus, the toxic effects thereof, since D13 teaches that an improved vitamin B12 status normalizes homocysteine levels in blood, which is in fact common general knowledge. According to O1, by administering vitamin B12 to correct homocysteine level and thereby the toxic effects of pemetrexed, the opposed patent did nothing more than apply standard knowledge.
5.5
The OD cannot follow this line of arguments.
D9 is an abstract which relates to pemetrexed (LY231514 or MTA) and the relationship of vitamin metabolite profile to toxicity. The abstract reports that three vitamin metabolites were measured: homocysteine, cystathioine and methyl malonic acid. D9 reports that there was a strong correlation between baseline homocysteine levels and the development of number toxicities such as neutropenia, thrombocytopenia, mucositis or diarrhea. Toxicity was seen in all patients with increased level of homocysteine. No correlation between those toxicities and the remaining pre-specified predictors, namely methylmalonic acid (MMA) and cystathionine was seen.
The strong correlation between homocysteine level and pemetrexed toxicity is also reported in other documents, for example in D10, D26 or D27. It was therefore well established, at the priority date of the patent, that the toxicity of pemetrexed is correlated to an increase in homocysteine plasma levels.
However, it appears that vitamin B12 is not the only marker of an increased level of homocysteine.
As can be appreciated from D8 and D13, homocysteine requires folate to convert to methionine. If no folate is present then homocysteine levels rise. Cystathionine is the deficiency marker for vitamin B6. If vitamin B6 is deficient then cystathioine levels rise.
Methyl malonic acid (MMA) is the deficiency marker for vitamin B12. However, vitamin B12 is also involved as a cofactor in the conversion of homocysteine to methionine. Thus, in some cases a vitamin B12 deficiency will also cause increased homocysteine as well as increased MMA.
This is in line with the teaching of D29 where it can be seen that folate deficiency is only associated to elevated serum level of homocysteine, whereas vitamin B12 deficiency is associated to elevation of serum level homocysteine and MMA (page 242, Table VII; page 244, left-hand column paragraphs 2-4).
The OD is therefore of the opinion that since D9 teaches that there is no correlation between pemetrexed toxicity and the marker for vitamin B12 deficiency (MMA), the skilled person would have concluded that vitamin B12 was not involved in the toxicity observed in pemetrexed treatment. He would thus have found no motivation to use vitamin B12 given that the known marker for its deficiency was uncorrelated.
Consequently, starting from D28, the skilled person faced with the problem of reducing pemetrexed toxicity would have ruled out the involvement of vitamin B12 in view of the teaching of D9 and therefore would not have used this vitamin to reduce said toxicity.
The OD considers that the skilled person would have rather used folic acid since in the absence of correlation between the pemetrexed toxicity and MMA as reported in D9, the elevated level of homocysteine described in said document would have been recognised as the marker for folate deficiency. In addition, the solution to the problem of pemetrexed toxicity has been already proposed in D12 and D26 as being the combined treatment of pemetrexed with folic acid.
5.6
During the procedure, additional arguments against inventive step were based on the combination of documents D19 with D23; D21 (or D20 or D22) in combination with the skilled person's common technical knowledge.
Documents D20-D22 describe the increase of the antitumor effect of the folic antagonist methotrexate when combined with vitamin B12. These documents however do not address the problem of the present invention, namely the toxicity of the antifolate drugs.
Document D19 relates to the use of vitamin B12 as a mean of protecting methotrexate hepatotoxicity. However, liver toxicity is generally not associated with pemetrexed treatment (see the opposed patent, Table 1 or D9). In the clinical phase I study of pemetrexed reported in D23, only one patient out of thirty two had hepatic toxicity.
5.7
In view of the foregoing, it is the OD's opinion that the subject-matter of the patent
in suit does involve an inventive step and thus fulfills the requirements of Article 56
EPC.
(…)”
2.8.
Teva heeft tegen de beslissing van de OD beroep aangetekend, maar heeft dit beroep vervolgens eenzijdig ingetrokken.
2.9.
De navolgende publicaties behoren voor het octrooi tot de stand van de techniek.
2.9.1.
Worzalla et al. (D12): "Role of Folic acid in Modulating the Toxicity and Efficacy of the Multitargeted Antifolate, L Y231 514", Anticancer Research (1998), 18: 3235 -3240. Daarin is - onder meer - opgenomen:“Abstract. We studied the effects of folic acid on modulating the toxicity and antitumor efficacy of LY231514
(pemetrexed, voorzieningenrechter). Using several human tumor cell lines adapted to growth in low folate medium, folic acid was shown to be 100- to 1000-fold less active than folinic acid at protecting cells from LY231514-induced cytotoxicity. The lethality of LY231514 was compared in mice maintained on standard diet or low folate diet. The LD50 occurred at 60- and 250-fold lower doses of LY231514 in DBA/2 and CD1 nu/nu mice, respectively, maintained on low folate diet compared to standard diet. The L5178Y/TK-/HX-murine lymphoma was much more sensitive to the antitumor action of LY231514 compared to wild type L5178Y-S tumors. For mice on low folate diet, LY231514 at 0.3 and 1 mg/kg (qd x 10, i.p.) produced 100% inhibition of L5178Y/TK-/HX-lymphoma growth, and significant lethality occurred at
≥ 3 mg/kg. For mice on standard diet, LY231514 produced > 95% inhibition of tumor growth at 30 to 300 mg/kg, but all mice died at 800 mg/kg. Folic acid supplementation was demonstrated to preserve the antitumor activity of LY231514 while reducing toxicity. The combination of folic acid with LY231514 may provide a mechanism for enhanced clinical antitumor selectivity.
(…)
Materials and Methods
(…)
Mice. (…) Mice were housed in temperature and humidity controlled rooms. Mice were fed either standard laboratory rodent chow (Purina Chow #5001) or folic acid-deficient diet containing 1% succinylsulfathiazole (Purina Chow #5831C-2); both diets were purchased from Ralston Purina Co. (St. Louis, MO, USA). The average content of folates from natural sources in both diets was found to be 0.03 ppm, whereas the standard diet was analyzed to contain 7.3 ppm of added folic acid. (…). ”
2.9.2.
A.L. Jackman (ed), Antifolate Drugs in Cancer Therapy, 1999, Humana Press. Totowa, NJ. In hoofdstuk 8 van deze uitgave, getiteld “Preclinical Pharmacology Studies and the Clinical Development of a Novel Multitargeted Antifolate, MTA (LY231514)” is - onder meer - opgenomen (pagina 190 en 191):
“2.6. The in Vivo Antitumor Effects and the Role of Folic Acid in Modulating the Efficacy and Toxicity of MTA
(…)
To evaluate the importance of dietary folate in modulating the toxicity of MTA (pemetrexed, voorzieningenrechter), LD50 values were determined in mice maintained on standard diet (SD) or on a special lowfolate diet (LFD) (35). MTA was administered ip daily for 10 d. It is estimated that mice on LFD consumed an average of approx 0.003 mg/kg/d of folic acid vs 0.75-1.5 mg/kg/d for mice on SD. Thus mice on SD had a daily intake of approx 250-500 times more folic acid than mice on LFD. MTA was more toxic to several different strains of mice maintained on LFD (Table 6), with the LD50 values being 30- to 250-fold lower than mice maintained on SD. A similar effect had been observed for antipurine antifolates such as lometrexol. The MTD of lometrexol on LFD was 1000- to 5000-fold lower than in mice maintained on SD (36). DHFR inhibitors such as methotrexate had a similar effect but to a lesser extent (50- to 100-fold, J.F. Worzalla, unpublished observation). The therapeutic index of MTA against the L5178Y/TK-/HX-tumor was greatly diminished when the mice were put on a LFD (2 wk) with no folate supplementation. Good antitumor activity was observed at 0.3 mg/kg and 1.0 mg/kg (ip daily X 10) doses only, and significant toxicity was observed for MTA at higher doses (Fig. 4). However, if daily folic acid supplementation (15 mg/d/mouse, po) was given in conjunction with MTA, excellent antitumor dose-response (10 mg/kg to 1000 mg/kg, with antitumor activity ranging from 80 to 100%) and no lethality were observed. This antitumor dose response (with folate supplementation) is identical to the dose response that was observed for MTA on mice fed with SD (Fig. 3). These data suggest that folate supplementation not only modulates the toxicity but also slightly enhances the antitumor response of MTA.”
In hoofdstuk 12 van deze uitgave, getiteld “Preclinical and Clinical Evaluation of the Glycinamide Ribonucleotide Formyltransferase Inhibitors Lometrexol and LY309887”, wordt - onder meer - vermeld (pagina 269, 270, 276 en 277):
“8. THE EFFECT OF LFD AND DIETARY FOLATE SUPPLEMENTATION ON THE EFFICACY AND TOXICITY OF LOMETREXOL AND LY309887
In mice on a LFD for 2 wk, the toxicity of lometrexol and LY309887 increased 300-1000-fold. Antitumor activity cannot be assessed because of the lethality of these agents. Oral supplementation with folic acid (0.6-600 mg/kg) restores sensitivity to the antitumor activity of both GARFT inhibitors. High doses of folic acid (>600 mg/kg) eliminated both toxicity and antitumor activity.
The therapeutic indexes (LD10/ED90) of LY309887 and lometrexol were determined over a range of supplemental folic acid doses in two antitumor models, the human xenograft GC3 colon and the murine mammary tumor C3H (Table 6). The data show that increasing folic acid supplementation doses from 0.0 to 6-15 mg/kg/d resulted in an enhanced therapeutic index ranging from 6 to 60 for LY309887 in both models. Furthermore, the ability to delay regrowth of the GC3 tumors over a broad dose range was only seen at the higher doses of folate supplementation. A small but modest increase in lometrexol's therapeutic index to 2-5 was also observed. Higher doses of folic acid supplementation resulted in less robust increases in the therapeutic index.
9. HUMAN FOLATE STATUS
The folate status of cancer patients has not been systematically evaluated. However, early studies reported decreased serum folic acid activity in patients with metastatic cancer (18-20). Other investigators have demonstrated decreased urinary clearance of a folic-acid load (21,22). Saleh et al. demonstrated that patients with metastatic disease incorporated more folic acid into their reduced folate pools, had decreased catabolism of folate and more rapid clearance of serum folate than controls even in the presence of maintained serum 5‑CH3‑THF concentrations (22). They concluded that patients were folate deficient and that there was an increased demand for folate in patients with malignant disease. In these patients, variability in the metabolism, pharmacokinetics, and toxicity of classical antifolates compared to humans with normal folate status would not be unexpected. Furthermore, dietary supplementation with folic acid may "normalize" the dose response for achieving antitumor activity and reduce toxicity to normal tissues by restoring folate pools in tissues having low folate requirements, without meeting the high folate demands of rapidly dividing tumor cells.
The biochemical pathways that utilize folate cofactors also require adequate amounts of vitamins B12 and B6. Thus, the status of all three vitamins in patients may significantly influence the severity of toxicity observed during chemotherapy. R. Allen and his colleagues have established that measuring specific amino acid metabolites, especially homocysteine, N-methyl glycine and others, from these metabolic pathways provides a more sensitive and reliable assessment of patient vitamin status (23). These surrogate indicators of functional folate status are more indicative of deficiencies and more responsive to dietary supplementation.
(…)
14. HOW DOES FOLIC ACID MODULATE TOXICITY?
There are a number of possible explanations for the preclinical and clinical observation that dietary folate levels modulate toxicity. As reviewed by Laohavinij and colleagues (43), these include:
1. A pharmacokinetic interaction,
2. Modulation of lometrexol transport.
3. An effect on lometrexol polyglutamation
4. An increase in intracellular folate pools in sensitive normal tissues.
There is no evidence to support a pharmacokinetic interaction in humans, although this may be species dependent (see Subheading 16). The only evidence to support a transport-mediated mechanism comes from studies in which mice were administered radiolabelled lometrexol and the disposition followed by whole-body autoradiography, (10). Under conditions of low folate status, there was an increase in hepatic retention of between 2.5- and 4.2-fold. Further studies are clearly needed to study both transport, polyglutamation, and folate pools in normal tissues.
(…)
17. CLINICAL DEVELOPMENT OF LY309887
The observations of severe cumulative toxicity in the absence of folic acid supplementation and the need to repeat studies with folic acid, meant that the phase I clinical development of lometrexol was very protracted. During the course of this clinical development, Eli Lilly and Company developed the second-generation compound LY309887. As has been reviewed earlier in this chapter, LY309887 has a different ratio of binding the different isoforms of the folate receptor, such that one would predict a greater distribution of the molecule into target tumor compared with the liver, and consequently, an improved therapeutic index. (…) Therefore, on completion of the preclinical toxicology for the compound, Eli Lilly decided to discontinue development of lometrexol in favor of developing LY309887. Hence, no phase II studies were conducted with lometrexol to assess efficacy.
(…)
18. CONCLUSION
In the absence of folic acid supplementation, patients treated with lometrexol in phase I clinical trials developed severe and cumulative myelosuppression and mucositis. The preclinical observations of the role of folic acid in preventing toxicity but preserving activity has been partially investigated in a clinical setting. We know that a 5 mg dose of folic acid given for 14 d around the dose of lometrexol allows at least 10 times more drug to be administered. Any effect on efficacy can of course not be evaluated except in the context of a phase II study. However it is encouraging to note that a number of partial responses were observed in the phase I clinical development in those patients who received folic acid supplementation. Similarly leucovorin given after dosing with lometrexol increases tolerance. Exactly how much folic acid needs to be given and for how long remains to be elucidated. We do know that an iv dose given 3 h before lometrexol is inadequate. These questions are being addressed in the clinical development of LY309887. The preclinical observations of an increasing therapeutic index at increased doses of folic acid are intriguing. It remains to be seen whether this translates into an effect clinically. However the preclinical profile of lometrexol and LY309887 are different and it would appear that the two molecules are also different clinically. (…)”
2.9.3.
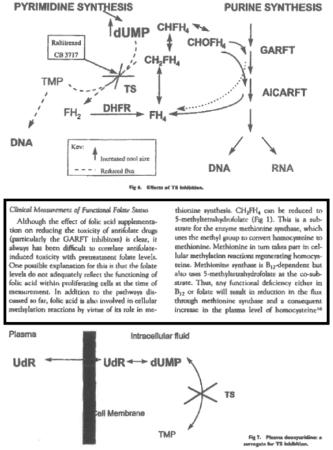
H. Calvert, An Overview of Folate Metabolism: Features Relevant to the Action of Toxicities of Antifolate Anticancer Agents, Seminars in Oncology, Vol.26, No.2, Suppl. 6 (1999), pages 3-10. In dit artikel is op de pagina’s 3 en 7 tot en met 10 opgenomen (markeringen toegevoegd door de voorzieningenrechter):




2.10.
Sandoz is eveneens actief op de geneesmiddelenmarkt en ontwikkelt, produceert, verhandelt en distribueert generieke geneesmiddelen. Sandoz behoort tot het Novartis concern.
2.11.
Ook Hexal AG (hierna: Hexal) is onderdeel van de Novartis-groep. Zij is leverancier in Duitsland van een generiek geneesmiddel met als actieve stof pemetrexed, welk middel wordt voorgeschreven in combinatie met een vitaminesupplement dat bestaat uit foliumzuur, oraal toegediend, en vitamine B12, toegediend via intramusculaire injectie (hierna: pemetrexed Sandoz). Het Landgericht München in Duitsland heeft op 10 december 2015 aan Lilly een ex parte verbod verleend jegens Hexal met betrekking tot pemetrexed Sandoz. Bij uitspraak van 20 mei 2016 heeft het Landgericht München in een inter partes procedure het door haar gegeven voorlopige verbod bekrachtigd.
2.12.
Lilly is in Duitsland een bodemprocedure gestart jegens Hexal wegens inbreuk op EP 508. De eerste zitting in deze zaak staat gepland voor 10 mei 2017.
2.13.
Op 5 februari 2016 heeft Hexal een nietigheidsprocedure aanhangig gemaakt tegen het Duitse deel van EP 508 bij het Bundespatentgericht. Vooralsnog is er geen zittingsdatum gepland.
2.14.
Op 5 januari 2017 heeft Sandoz bij de onderhavige rechtbank een bodemprocedure volgens het versneld regime voor Octrooizaken (hierna: de VRO-procedure) geëntameerd voor vernietiging van (het Nederlandse deel van) EP 508, tegen de eerst diendende dag van 14 juni 2017. Pleidooi in die zaak is bepaald op 27 januari 2018.
2.15.
Bij uitspraak van 12 januari 2017 heeft het United States Court of Appeals for the Federal Circuit het Amerikaanse octrooi 7,772,209 (een equivalent van EP 508) geldig bevonden en geoordeeld dat het generieke pemetrexed product van Teva Parenteral Medicines Inc. c.s. inbreuk maakt op dit octrooi. Daarmee heeft het de uitspraak in eerste aanleg van de District Court for the Southern District of Indiana bevestigd. Ook het Japanse Octrooibureau heeft op 10 november 2015 JP 5102928 (het Japanse equivalent van EP 508) geldig geacht in een aldaar aangespannen nietigheidsprocedure, welk oordeel op 2 februari 2017 door de Japanse rechtbank is bevestigd.
2.16.
Sandoz heeft bij brief van 13 januari 2017 aan Lilly gemeld dat zij voornemens is om na 16 februari 2017 pemetrexed Sandoz op de markt te brengen. Zij heeft pemetrexed Sandoz laten opnemen in de zogenaamde G-standaard van februari 2017, die op 17 januari 2017 is gepubliceerd.
2.17.
Naar aanleiding van de brief van 13 januari 2017 heeft Lilly onderhavig kort geding aanhangig gemaakt. Sandoz heeft toegezegd pemetrexed Sandoz niet te zullen uitleveren voordat in het onderhavige kort geding vonnis is gewezen.
3. Het geschil
3.1.
Lilly vordert samengevat en na vermindering van eis - dat de voorzieningenrechter bij vonnis uitvoerbaar bij voorraad:
1. Sandoz zal bevelen iedere directe en indirecte inbreuk op EP 508 en/of het gebruik maken van tussenpersonen die zulke handelingen verrichten en/of onrechtmatig handelen, te staken en gestaakt te houden, op straffe van verbeurte van een dwangsom van € 100.000,- voor iedere dag dat Sandoz het bevel niet nakomt of een dwangsom van € 100.000,- voor ieder product waarmee Sandoz het bevel niet nakomt;
2. Sandoz zal veroordelen in de volledige kosten van de procedure conform artikel 1019h Rv.
3.2.
Primair stelt Lilly zich op het standpunt dat Sandoz direct en/of indirect inbreuk maakt op alle conclusies van het octrooi wanneer zij pemetrexed Sandoz op de markt zou brengen. Subsidiair betoogt Lilly dat Sandoz in dat geval directe dan wel indirecte inbreuk maakt op conclusies 12-14 van EP 508.
3.3.
Sandoz betoogt ten verwere dat de door Lilly gevraagde voorziening moet worden geweigerd omdat een serieuze, niet te verwaarlozen kans bestaat dat het Nederlandse deel van EP 508 in een bodemprocedure zal worden vernietigd. Haar verweer houdt - zakelijk weergegeven - het navolgende in.
Nieuwheid
3.3.1.
Volgens Sandoz is Worzalla (vergelijk r.o. 2.9.1) nieuwheidschadelijk voor het onderhavige octrooi, nu Worzalla in zijn studie met muizen concludeert dat de toediening van foliumzuur de bijwerkingen van pemetrexed vermindert terwijl de werkzaamheid behouden blijft. Worzalla gebruikte daarbij de algemene vakkennis dat een adequaat vitamine B12 niveau nodig is om te beschikken over voldoende functioneel folaat voor een aantal biochemische processen in de cel. Hij zorgde er daarom voor dat het dieet van de muizen twee keer zoveel vitamine B12 bevatte dan gebruikelijk. Daarmee is in Worzalla de combinatietherapie nieuwheidsschadelijk geopenbaard.
Inventiviteit
3.3.2.
Sandoz baseert haar betoog dat het octrooi inventiviteit mist allereerst op de algemene vakkennis zoals verwoord in het handboek van Jackman (zie r.o. 2.9.2). Daaruit leert de vakman dat hij naast folaat ook vitamine B12 moet toedienen wanneer hij de bijwerkingen van pemetrexed wil verminderen, waarbij de vakman de onderzoeksresultaten met betrekking tot lometrexol in zijn afwegingen zal betrekken.
3.3.3.
Voorts volgt het gebrek aan inventiviteit uit Calvert (vergelijk r.o. 2.9.3). Calvert openbaart dat toediening van foliumzuur de bijwerkingen van antifolaten zoals pemetrexed vermindert en dat er een sterke correlatie bestaat tussen de bijwerkingen van pemetrexed en het homocysteïne niveau van de patiënt. Het homocysteïne gehalte wordt zowel beïnvloed door folaat als vitamine B12 en een functioneel tekort van deze beide zal derhalve leiden tot een stijging van het homocysteïne gehalte. Zonder inventieve denkarbeid zal de gemiddelde vakman uit Calvert distilleren dat bij de toediening van pemetrexed ook vitamine B12 moet worden toegediend, al dan niet in combinatie met de algemene vakkennis uit Jackman.
3.3.4.
Ten slotte is het octrooi in het licht van Worzalla niet inventief, als dit al niet nieuwheidsschadelijk is, op dezelfde gronden als genoemd in r.o. 3.3.1, al dan niet in combinatie met de algemene vakkennis uit Jackman of met Calvert.
3.4.
Op de stellingen van partijen wordt hierna, voor zover van belang, nader ingegaan.
4. De beoordeling
Bevoegdheid
4.1.
De rechtbank komt op grond van het bepaalde in artikel 4 jo. 24 lid 4 EEX II-Vo2.internationale (bodem)bevoegdheid toe om van de vorderingen van Lilly kennis te nemen. Gelet daarop is de voorzieningenrechter bevoegd voorlopige maatregelen te treffen. De relatieve bevoegdheid volgt uit artikel 80 lid 2 onder a Rijksoctrooiwet 1995. De bevoegdheid is overigens niet bestreden.
Spoedeisend belang
4.2.
Gezien de gestelde dreigende inbreuk op haar octrooi, heeft Lilly een spoedeisend belang bij het gevorderde. Dit spoedeisende belang is evenmin bestreden.
Kader
4.3.
Vooropgesteld wordt dat de in dit kort geding te hanteren maatstaf hierin bestaat dat dient te worden beoordeeld of er een gerede (dat is een serieuze, niet te verwaarlozen) kans aanwezig is dat het Nederlandse deel van EP 508 in de VRO-procedure nietig wordt bevonden.
4.4.
Bij de beoordeling daarvan wordt van belang geacht dat de OD bij mondelinge beslissing van 18 november 2010 (en schriftelijke beslissing van 27 december 2010, vergelijk r.o. 2.7) het octrooi in stand heeft gelaten. Het enkele herhalen van reeds door de OD beoordeelde (en verworpen) argumenten is daarom in beginsel onvoldoende.3.Het ligt op de weg van Sandoz om gemotiveerde argumenten naar voren te brengen waaruit zou kunnen worden afgeleid dat de beslissing van de OD niet in stand kan blijven. Dit kan zijn omdat de beslissing een (evidente) fout bevat of omdat er (nieuwe) argumenten zijn die de OD niet heeft meegewogen.
4.5.
Voorts wordt bij de beoordeling meegewogen dat Lilly een zeer aanzienlijk belang heeft bij handhaving van de status quo, nu sprake zal zijn van prijsbederf wanneer Sandoz zich met haar generieke pemetrexed (in de geclaimde combinatietherapie) op de markt zou begeven. In zoverre is de zaak dus te onderscheiden van het geval waarbij een product al enige tijd op de markt is, zodat prijsbederf reeds heeft plaatsgevonden en niet zozeer de octrooihouder als wel de vermeende inbreukmaker een aanzienlijk belang bij handhaving van de status quo heeft. Indien en voor zover er een derde partij, Fresenius Kabi, is die sinds kort een generiek pemetrexed geneesmiddel op de Nederlandse markt brengt, zoals Sandoz betoogt, maakt het voor de belangenafweging in de onderhavige procedure geen verschil, nu Lilly heeft gesteld dat zij die partij geen toestemming heeft gegeven en haar rechten met betrekking tot het octrooi zal handhaven tegen iedere generieke aanbieder van een pemetrexed product (in de geclaimde combinatietherapie).
4.6.
Hierbij is voorts van belang dat de Duitse rechter op 10 december 2015 al een ex parte heeft verleend jegens Hexal, waarmee ook voor zustervennootschap Sandoz (in ieder geval vanaf dat moment) duidelijk was dat zij indien zij pemetrexed (in de geclaimde combinatietherapie) in Nederland op de markt zou brengen, zeer waarschijnlijk Lilly tegenover zich zou vinden. Desalniettemin heeft Sandoz in Nederland geen actie ondernomen tot de dagvaarding in de VRO-procedure van 5 januari 2017, hoewel de Duitse nietigheidsprocedure pakweg een jaar eerder aanhangig was gemaakt. Desgevraagd heeft Sandoz geen deugdelijke reden voor die vertraging kunnen geven.
4.7.
Voormelde belangenafweging betekent dat in deze zaak voor Sandoz de lat hoger ligt dan in de situatie waarbij haar product al enige tijd op de markt zou zijn geweest.
Geldigheid octrooi
Technische inleiding
4.8.
Voor het technisch begrip van het octrooi is van hetgeen partijen naar voren hebben gebracht - onder meer - het volgende relevant.
Folaat is een vitamine uit het vitamine B-complex. Het is een essentiële vitamine. De mens kan derhalve geen folaat produceren en is voor de aanvoer ervan afhankelijk van externe bronnen (voeding of voedingssupplementen). Er zijn natuurlijke folaat-varianten (in voedsel als spinazie, spruitjes, broccoli en kool). Foliumzuur is de meest stabiele vorm van folaat en wordt als synthetische folaat-variant veel toegevoegd aan voedsel. Foliumzuur wordt in het lichaam omgezet in andere folaatvormen. Verschillende folaat-varianten fungeren als cofactoren van verschillende enzymen die nodig zijn voor de aanmaak van DNA en RNA. Tot de enzymen die folaat-varianten nodig hebben, behoren de enzymen Thymidylate Synthase (hierna: TS), GlycinAmide Ribonucleotide FormylTranferase (hierna: GARFT) en DriHydroFolate Reductase (hierna: DHFR).
Binnen het oncologische vakgebied zijn verschillende antifolaten als geneesmiddel ingezet c.q. op inzet als geneesmiddel onderzocht, vanwege hun celdodende capaciteiten. Dergelijke capaciteiten ontlenen de antifolaten aan het feit dat zij een analoog zijn van folaat en zich binden aan (één van) de drie voornoemde enzymen om zo de werking van dit enzym / deze enzymen remmen. Hierdoor wordt de DNA-vorming en daarmee de celdeling verstoord. Dit zou de groei van tumorcellen kunnen remmen. Het antifolaat methotrexaat (dat eind jaren ’40 van de vorige eeuw is ontwikkeld en op enig moment goedgekeurd is voor medisch gebruik) bindt zich aan DHFR. Eind jaren ’90 van de vorige eeuw is het antifolaat raltitrexed (merknaam: TOMUDEX) goedgekeurd voor medisch gebruik voor de behandeling van dikkedarmkanker. Raltitrexed bindt zich aan het enzym TS. Het antifolaat lometrexol bindt zich aan het enzym GARFT. Het onderzoek naar Lometrexol is tijdens de klinische fase I ontwikkeling afgebroken vanwege de ernstige toxiciteit. Het door Lilly ontwikkelde antifolaat pemetrexed (merknaam ALIMTA) onderscheidt zich van de voornoemde antifolaten doordat het zich zowel aan TS, GARFT als DHFR bindt.
Nieuwheid
4.9.
Om nieuwheidsschadelijk te zijn voor conclusie 1, dient Worzalla - kort gezegd - de combinatietherapie van het toedienen van vitamine B12 (en foliumzuur voor conclusie 2) met pemetrexed te openbaren.
4.10.
In het kader van de studie (vergelijk r.o. 2.9.1) is een groep muizen gehouden op een dieet met een laag foliumzuurgehalte en een andere groep muizen op een standaarddieet.
4.11.
Volgens Sandoz is in het onderzoek ook vitamine B12 aan de muizen toegediend omdat de muizen die op het standaarddieet zijn gehouden ‘Purina Chow #5001’ gevoerd hebben gekregen. Wanneer de samenstelling van ‘Laboratory Rodent Diet 5001’ (dat volgens Sandoz het door Worzalla bedoelde ‘Purina Chow #5001’ betreft) wordt bekeken, volgt daaruit dat dat dieet 22 μg/kg vitamine B12 bevatte. Dat is, in vergelijking met voedingsstandaarden voor laboratoriummuizen zoals volgt uit een artikel uit 1977, meer dan tweemaal zoveel vitamine B12 als gebruikelijk, waarmee vaststaat dat Worzalla extra vitamine B12 heeft toegediend, aldus Sandoz.
4.12.
De voorzieningenrechter stelt voorop dat het aan Sandoz is om onderbouwd te stellen dat Worzalla de toediening van vitamine B12 duidelijk en ondubbelzinnig openbaart. Hij is, met Lilly, voorshands van oordeel dat uit de door Sandoz overgelegde producties en haar uitleg niet zonder meer kan worden geconcludeerd dat het door Worzalla aan één van de muizengroepen gevoerde standaarddieet Purina Chow #5001, hetzelfde is als Laboratory Roden Diet 5001 (waarvan Sandoz de samenstelling heeft overgelegd als productie GP25). Op dit laatstgenoemde document is het logo ‘PMI Feeds Inc.’ opgenomen. Volgens Sandoz is dit de merknaam van het bedrijf Purina Mills, waaruit volgt dat Worzalla met de naam Purina Chow #5001 verwijst naar voornoemd Laboratory Roden Diet 5001. Lilly merkt echter terecht op dat Worzalla in zijn publicatie meldt dat Purina Chow #5001 een product is van Ralston Purina Co. en niet van Purina Mills (vergelijk r.o. 2.9.1, onder het kopje ‘Mice’). Daarnaast meldt Worzalla dat in het door hem gebruikte standaarddieet 7,3 ppm foliumzuur is opgenomen (vergelijk wederom r.o. 2.9.1, onder het kopje ‘Mice’), terwijl uit de samenstelling van Laboratory Roden Diet 5001 volgt dat daarin 5,9 ppm foliumzuur is opgenomen. Dat betekent dat in dit kort geding er voorshands niet van kan worden uitgegaan dat in Worzalla vitamine B12 aan het muizenvoer is toegevoegd, laat staan meer vitamine B12 dan gebruikelijk volgens de stand van de wetenschap.
4.13.
Gezien het voorgaande oordeelt de voorzieningenrechter vooralsnog dat Worzalla niet nieuwheidsschadelijk is voor (conclusies 1 en 2 van) het octrooi. Overigens is onbetwist gebleven dat Worzalla de nieuwheid niet wegneemt van de conclusies 10 en 11, waarop Sandoz volgens Lilly eveneens inbreuk maakt.
Inventiviteit
4.14.
Bij de beoordeling of de combinatietherapie van vitamine B12 (en foliumzuur) en pemetrexed ter vermindering van de toxiciteit van pemetrexed (bij gelijkblijvende werkzaamheid) voor de gemiddelde vakman op een voor de hand liggende wijze voortvloeit uit de stand van de techniek en EP 508 daardoor inventiviteit ontbeert, zoals Sandoz betoogt en Lilly heeft bestreden, gaat de voorzieningenrechter uit van de PSA4.-methode.
4.15.
De meest nabije stand van de techniek wordt gevormd door Jackman of Calvert (vergelijk r.o. 2.9). De gemiddelde vakman kan worden omschreven als een oncoloog die in het bijzonder ervaring heeft met patiënten met niet-opereerbare, kwaadaardige, lokaal vergevorderde of metastatische tumoren.
4.16.
Het verschil tussen het octrooi en de dichtstbijzijnde stand van de techniek is de toevoeging van vitamine B12 in de combinatietherapie met (foliumzuur en) pemetrexed. Met betrekking tot het technisch effect is de voorzieningenrechter - met Lilly - voorshands van oordeel dat met de combinatietherapie de pemetrexed-geïnduceerde toxiciteit wordt verminderd, zonder de werkzaamheid van pemetrexed te beïnvloeden. Dat het technisch effect slechts het verminderen van de bijwerkingen van pemetrexed zou zijn, los van de werkzaamheid van pemetrexed, zoals Sandoz betoogt, acht de voorzieningenrechter niet juist. Uit de eerste zin van paragraaf [0005] van het octrooi (vergelijk r.o. 2.6) blijkt immers dat door de uitvinders is gevonden dat bij toediening van vitamine B12 de toxische effecten gereduceerd kunnen worden, zonder dat de therapeutische werking van het antifolaat (d.w.z. pemetrexed) wordt aangetast. Sandoz heeft niet onderbouwd gesteld dat dit aldus omschreven effect zich niet zou voordoen. Bovendien, als naast de toxiciteit eveneens de werkzaamheid van pemetrexed zou worden verminderd, wordt het doel van de toediening van pemetrexed, te weten inperking van tumorgroei bij bepaalde vormen van longkanker - kort gezegd - ondermijnd.
4.17.
Het door de vakman op te lossen technische probleem, is gelijk te stellen aan het technisch effect, te weten vermindering van de pemetrexed-geïnduceerde toxiciteit zonder de werkzaamheid van pemetrexed te beïnvloeden.
4.18.
De voorzieningenrechter oordeelt voorshands dat redenerend vanuit Calvert (zie r.o. 2.9.3) de oplossing voor de gemiddelde vakman niet voor de hand lag. Afgezien van de rol van foliumzuur, zal de vakman uit Calvert niet afleiden dat het toedienen van vitamine B12 in combinatietherapie met pemetrexed de oplossing biedt voor het verminderen van de toxiciteit. Calvert beschrijft dat het lastig is om antifolaat geïnduceerde toxiciteit te correleren aan het folaatniveau gemeten vóór de behandeling met het antifolaat (p. 8 linker kolom). De antifolaat geïnduceerde toxiciteit van pemetrexed kan volgens Calvert beter voorspeld worden door vóór de behandeling het homocysteïne-gehalte in het plasma te meten (p. 9, linksboven). Een verhoogd homocysteïne-gehalte duidt erop dat er ofwel een tekort is geweest aan een folaat-variant, ofwel specifiek een tekort aan vitamine B12 dan wel vitamine B6 (vergelijk Jackman, § 9, r.o. 2.9.2). Homocysteïne wordt namelijk door methionine synthase (met vitamine B12) omgezet in methionine en door cystathionine synthase (met vitamine B6) in cystathionine. Dat een verhoogd homocysteïne-gehalte toxiciteit voorspelt, wil echter niet zeggen dat de oplossing voor de vermindering van toxiciteit zonder meer gelegen is in verlaging van dit gehalte door vitamine B12 en/of foliumzuur (en/of vitamine B6) aan patiënten toe te dienen, zoals Sandoz betoogt. Daarvoor spelen er naar voorlopig oordeel op celniveau teveel processen mee die in ogenschouw genomen moeten worden (Calvert schrijft in zijn conclusie dat folaten “complex metabolic pathways” hebben en heeft het over “the very complexity of the processes involved”). Calvert legt bovendien het verband ook niet. Voor zover de vakman al door Calvert getriggerd zou worden om te onderzoeken of het verlagen van het homocysteïne-gehalte (door eventuele toevoeging van foliumzuur, vitamine B12 en/of vitamine B6) vermindering van toxiciteit zou opleveren, dan zou voetnoot 17 (vergelijk r.o. 2.9.3) de vakman naar het abstract van Niyikiza et al (hierna: Niyikiza 2) hebben geleid. In het abstract is opgenomen dat uit een door Niyikiza uitgevoerde statistische multivariate analyse volgt dat hij op zich inderdaad een correlatie heeft gevonden tussen een verhoogd homocysteïne-gehalte en de toxiciteit van pemetrexed, maar geen correlatie tussen een verhoogd methylmalonzuur-gehalte en toxiciteit. Aangezien methylmalonzuur (hierna: MMA) de specifieke marker is voor vitamine B12 (specifieker dan homocysteïne, want die is aan meerdere processen gecorreleerd zoals hiervoor aangegeven) zou die bevinding de vakman juist wegleiden van de oplossing tot toediening van vitamine B12. Vergelijk in dit kader de gelijkluidende beslissing van de OD (zie r.o. 2.7).
4.19.
Naar voorlopig oordeel is in dit kader tekenend dat Calvert zelf kennelijk geen heil zag in de in het octrooi (door uitvinder Niyikiza) voorgedragen oplossing om vitamine B12 toe te dienen. Calvert had namelijk zitting in de Antifolaat Adviescommissie van Lilly, welke adviescommissie de oplossing om vitamine B12 toe te dienen consistent afwees (vergelijk de uitspraak van het US District Court for the Southern District of Indiana, productie E8, p. 25).
4.20.
Sandoz heeft erop gewezen dat in Niyikiza 2 niet met zoveel woorden staat dat er geen correlatie is tussen de toxiciteit van pemetrexed en MMA maar enkel dat er voor homocysteïne een correlatie is en voor de “remaining pre-specified predictors” geen correlatie werd gevonden. Een gemiddelde vakman die Niyikiza 2 leest, zal echter zonder meer afleiden dat met die laatste term werd gedoeld op onder meer MMA en dat het onderzoek van Niyikiza onder 246 patiënten kennelijk geen verband had opgeleverd. Het is juist dat het ontbreken van een verband daarmee voor de gemiddelde vakman nog niet zal vaststaan, ook omdat Sandoz er terecht op wijst dat dit geen peer-reviewed artikel is, maar die vakman zal minst genomen uit de publicatie een duidelijke suggestie afleiden dat het verband er niet is. Omdat het MMA-gehalte een specifiekere marker voor vitamine B12 tekort is dan het homocysteïne-gehalte, zal een gemiddelde vakman daaruit afleiden dat het probleem juist niet bij vitamine B12 ligt maar bij één van de andere processen/stoffen die verband houden met een hoog homocysteïne-niveau. De gedachte van Sandoz dat een gemiddelde vakman deze informatie links zou laten liggen en toch toediening van vitamine B12 zou onderzoeken, is niet aannemelijk (vgl. overweging 5.5 uitspraak OD, zie r.o. 2.7 en de inter partes beslissing van het Landgericht München, r.o. 2.11). Zo dit al in hem opkomt dan zou deze gedachte er hoogstens een zijn van “obvious to try” dan dat de gemiddelde vakman ertoe zou worden gebracht. Evenmin is juist het betoog van Sandoz dat Niyikiza 2 hooguit een “pointer away” is en omdat het geen vooroordeel schept, geen inventiviteit kan verlenen. Zoals hiervoor is overwogen is de leer van Calvert niet dat vitamine B12 moet worden toegediend maar dat een hoog homocysteïne-gehalte een goede indicator is voor toxiciteit van pemetrexed en dat dit homocysteïne-gehalte door diverse factoren (waarvan vitamine B12 er één is) beïnvloed wordt. Voor de onderbouwing van de observatie dat het homocysteïne gehalte een goede indicator is, wordt verwezen naar Niyikiza 2. De leer van Calvert kan naar voorlopig oordeel zodoende op dit punt niet los worden gezien van wat er in Niyikiza 2 daadwerkelijk staat. Dat Calvert in zijn artikel niet tevens heeft opgenomen dat uit Niyikiza 2 kan worden afgeleid dat er geen correlatie is gevonden met het MMA-gehalte en derhalve niet met vitamine B12, doet aan het voorgaande onvoldoende af.
4.21.
Sandoz heeft opgeworpen dat het opvallend voorkomt dat mede-uitvinder Niyikiza in 1998 nog rapporteert dat hij geen correlatie heeft gevonden met MMA (Niyikiza 2), maar in 2000 het tegengestelde vindt en doet octrooieren. Omdat de verklaring van Niyikiza (overgelegd als productie E29) niet ingaat op die ogenschijnlijke tegenstrijdigheid, heeft de voorzieningenrechter daarover ter zitting vragen gesteld aan Lilly. Voorshands tot genoegen heeft Lilly toegelicht dat dit geenszins is gebaseerd op onzorgvuldigheid of “foul play” maar op de omstandigheid dat Niyikiza naar aanleiding van een alarmerende toename van het aantal overleden patiënten als gevolg van pemetrexed naar 7% eind 1999 zijn analyse nogmaals heeft uitgevoerd op de data van een veel grotere patiëntenpopulatie (zie ook p. 7 van de beslissing van de US District Court for the Southern District of Indiana, productie E8). Hij vond toen wel een statistisch significant verband. De voorzieningenrechter voegt hier nog aan toe dat als de speculatie van Sandoz juist zou zijn dat Niyikiza (kennelijk bewust) onzorgvuldige resultaten in het abstract publiceerde “in de hoop een nieuw octrooi op pemetrexed te kunnen krijgen”, de man daarmee zeer elementaire wetenschappelijke waarden zou hebben geschonden en mogelijk dode patiënten op zijn geweten zou hebben.5.Daarvoor is in dit kort geding bepaald onvoldoende bewijs bijgebracht.
4.22.
De deskundigenverklaringen die Lilly heeft ingebracht, ondersteunen het standpunt dat toentertijd toedienen van vitamine B12 voor de vakman niet in de rede lag.
Chabner (productie E13), expert met meer dan 45 jaar ervaring op het gebied van oncologie en hoogleraar op de Harvard Medical School, verklaart dat de vakman zou verwachten dat door het toedienen van vitamine B12 en foliumzuur de werkzaamheid van pemetrexed zou verminderen. Dit omdat folaten en antifolaten elkaar in het lichaam beconcurreren en de balans bij toediening van foliumzuur en vitamine B12 in het nadeel van het antifolaat zou verschuiven. Daarbij verwijst Chabner naar de oorsprong van het idee om antifolaten in te zetten bij bestrijding van kanker in 1947. Dat idee werd geboren uit de observatie van het effect van toediening van foliumzuur aan leukemiepatiëntjes, te weten verhoogde tumorgroei. Met betrekking tot lancering van het idee van Lilly om patiënten voor te behandelen met vitaminepreparaten (foliumzuur en/of vitamine B12), memoreert Chabner zijn eerste reactie in de Wall Street Journal (D87): "When I first heard about it, I thought it was crazy".
O'Dwyer (productie E18), expert met meer dan 30 jaar ervaring op het gebied van oncologie en hoogleraar op de Universiteit van Pennsylvania, verklaart eveneens sceptisch te zijn geweest vanwege de verwachting dat toediening van vitaminepreparaten met vitamine B12 en/of foliumzuur de werkzaamheid van pemetrexed zou verminderen. Volgens hem was de gebruikelijke redressering van toxiciteit het aanpassen van de dosering.
Ook Jackman heeft in haar deskundigenverklaring (productie E20) bevestigd dat de vakman niet zou hebben bedacht vitamine B12 toe te dienen, omdat hij/zij geen positief therapeutisch effect daarvan zou verwachten en bovendien zou verwachten dat het de werkzaamheid van pemetrexed zou verminderen.
Tegenover de deskundigenverklaringen van Lilly heeft Sandoz geen verklaringen ingebracht die het tegendeel aantonen.
4.23.
Het betoog van Sandoz ter zitting dat foliumzuur en vitamine B12 een soort “peper-en-zout combinatie” betreffen, waardoor de vakman deze combinatie vrij automatisch zou toedienen bij een antifolaat of bij pemetrexed om de toxiciteit te verminderen, wordt weersproken door voornoemde deskundigenverklaringen.
4.24.
De voorzieningenrechter is voorshands van oordeel dat de oplossing voor de vakman vanuit Jackman (vergelijk 2.9.2) - al dan niet in combinatie met Calvert - evenmin voor de hand lag. Hoofdstuk 8 van Jackman wijst de vakman erop dat het voordelen kan hebben foliumzuur toe te dienen bij de behandeling met pemetrexed. Maar daarbij blijft hetzelfde probleem bestaan dat bij Calvert is opgeworpen, te weten hoe de toxiciteit verder verminderd kan worden. Het betoog van Sandoz dat de vakman door lezing van hoofdstuk 12 over lometrexol op het spoor gezet zou worden om vitamine B12 toe te dienen, verwerpt de voorzieningenrechter. In de conclusie onder dit hoofdstuk wordt expliciet overwogen dat nader onderzoek noodzakelijk is en dat resultaten met lometrexol niet zonder meer geëxtrapoleerd kunnen worden naar het antifolaat LY309887 nu deze beide antifolaten een andere molecuulstructuur hebben. Pemetrexed heeft weer een andere molecuulstructuur en grijpt bovendien aan op drie enzymen (TS, GARFT en DHFR), terwijl lometrexol alleen GARFT remt. Evenzo is in paragraaf 14 van hoofdstuk 12 opgenomen onder de vraagstelling hoe foliumzuur de toxiciteit (van lometrexol) moduleert, dat er verscheidene oplossingen denkbaar zijn, waarvan een “increase in intracellular folate pools in sensitive normal tissues” er slechts een is. Bovendien sluit de paragraaf af met de opmerking dat “Further studies are clearly needed to study both transport, polyglutamation, and folate pools in normal tissues.”
Voor zover hoofdstuk 12 van Jackman voor de vakman al een pointer zou opleveren richting toediening van foliumzuur en/of vitamine B12, waren er andere pointers die daartegen pleitten. In het medisch woordenboek van Vidal uit 1999 (productie E25) is met betrekking tot de contra-indicaties van vitamine B12 opgenomen: “Malignant tumor: due to the action of vitamin B12 on tissue growth at high cell multiplication rates, the risk of progressive growth must be taken into account”. Daarnaast was in de SmPC van TOMUDEX (raltitrexed, een ander folaat dat wordt ingezet bij de behandeling van “advanced colorectal cancer”, vgl. r.o. 4.8.) opgenomen (productie E28): “Leucovorin (folinic acid), folic acid or vitamin preparations containing these agents must not be given immediately prior to or during administration of Tomudex', since they may interfere with its action.” Ook voor wat betreft wellicht het bekendste antifolaat methotrexaat werd gewaarschuwd dat vitamine preparaten (met foliumzuur) de werking kunnen verminderen (verklaring Jackman onder 15 met verwijzing naar de Physicians’ Desk Reference D40). Voorts verwijst de voorzieningenrechter naar de in r.o. 4.23 aangehaalde deskundigenverklaringen.
4.25.
Dat het octrooi inventiviteit zou ontberen redenerend vanuit Worzalla, verwerpt de voorzieningenrechter met verwijzing naar r.o. 4.12. Er is geen (impliciete) openbaarmaking van de toediening van vitamine B12. Zoals blijkt uit het voorgaande lag die toediening evenmin voor de hand.
4.26.
In zijn algemeenheid hecht de voorzieningenrechter bij zijn voorlopig oordeel nog waarde aan het gegeven dat de toediening van vitamine B12 blijkbaar niet zo voor de hand lag dat het door oncologen al eerder is toegepast bij pemetrexed of andere antifolaten noch dat zij het zagen als een gebruikelijke maatregel bij bestrijding van de toxiciteit van een antifolaat. Conclusie 1 van EP 508 is daarom voorshands inventief te achten. Dit geldt ook voor de overige (ingeroepen) conclusies.
Conclusie
4.27.
Gelet op al het voorgaande acht de voorzieningenrechter de kans dat het gevorderde verbod in de bodemprocedure zou worden afgewezen op de grondslag dat het octrooi niet nieuw en/of niet inventief is, onvoldoende groot om het gevorderde verbod in deze kortgedingprocedure te weigeren.
Inbreuk op het octrooi
4.28.
Tussen partijen staat vast dat zoals Sandoz haar generieke pemetrexed (al dan niet met gebruikmaking van tussenpersonen) op de markt wil brengen binnen het bereik van de door Lilly ingeroepen conclusies van EP 508 valt en dat Sandoz door het opnemen van haar generieke product in de G-standaard en de voorgenomen verhandeling ervan direct en indirect inbreuk maakt op EP 508. Dat betekent dat de voorzieningenrechter het door Lilly gevorderde verbod met betrekking tot de directe en indirecte inbreuk op het octrooi zal toewijzen, waarbij de dwangsommen zullen worden gematigd en gemaximeerd op € 5.000.000,-. De voorzieningenrechter merkt op dat voor zover het verbod ziet op de vermelding in de G-standaard, er met Sandoz kan worden aangenomen dat verwijdering niet onmiddellijk kan worden uitgevoerd, hetgeen door Lilly overigens ook niet bestreden is. Het verbod dient in zoverre te worden verstaan dat Sandoz die verwijdering op de eerst mogelijke gelegenheid (na betekening) dient te bewerkstelligen. Er zal aan Sandoz een termijn van twee dagen worden gegund tot nakoming.
Slotsom en proceskosten
4.29.
Sandoz zal als de in het ongelijk gestelde partij worden veroordeeld in de proceskosten. Conform de tussen partijen gemaakte afspraak zullen deze kosten aan de zijde van Lilly worden begroot op € 50.000,-.
4.30.
De termijn in de zin van artikel 1019i Rv zal worden bepaald op zes maanden na heden.
5. De beslissing
De voorzieningenrechter
5.1.
beveelt Sandoz binnen twee dagen na betekening iedere directe en indirecte inbreuk op Europees octrooi EP 1 313 508 en/of het gebruik maken van tussenpersonen die zulke handelingen verrichten, te staken en gestaakt te houden, zulks op straffe van verbeurte
van een dwangsom van € 100.000,- voor iedere dag dat Sandoz het bevel niet nakomt of - ter vrije keuze van Lilly - een dwangsom van € 10.000,- voor ieder product waarmee Sandoz het bevel niet nakomt, met een maximum van € 5.000.000,-;
5.2.
veroordeelt Sandoz in de proceskosten tot aan dit vonnis aan de zijde van Lilly begroot op € 50.000,-;
5.3.
verklaart dit vonnis tot zover uitvoerbaar bij voorraad;
5.4.
wijst af het meer of anders gevorderde;
5.5.
stelt de termijn als bedoeld in artikel 1019i Rv op zes maanden na heden.
Dit vonnis is gewezen door mr. E.F. Brinkman en in het openbaar uitgesproken op 1 maart 2017 in tegenwoordigheid van de griffier.
Voetnoten
Voetnoten Uitspraak 01‑03‑2017
Verordening (EU) 1215/2012 van het Europees Parlement en de Raad van 12 december 2012 betreffende de rechterlijke bevoegdheid, de erkenning en de tenuitvoerlegging van beslissingen in burgerlijke en handelszaken, inwerkingtreding: 9-1-2013, PB EU 2012, L 351/1
HR 21 april 1995, NJ 1995, 437, ECLI:NL:HR:1995:ZC1705 (Boehringer v. Kirin Amgen)
Problem and Solution Approach, Case Law EPO 2016, p. 161 e.v.
Waarvoor Lilly als werkgever zonder twijfel aansprakelijk zou zijn onder het behoorlijk punitieve karakter van het Amerikaanse schadevergoedingsrecht.