De dagvaarding in deze zaak is uitgebracht vóór 10 januari 2015 zodat de (herschikte) Verordening (EU) 1215/2012 van het Europees Parlement en de Raad van 12 december 2012 betreffende de rechterlijke bevoegdheid, de erkenning en de tenuitvoerlegging van beslissingen in burgerlijke en handelszaken nog niet van toepassing is.
Rb. Den Haag, 15-07-2015, nr. C/09/468395 / HA ZA 14-738
ECLI:NL:RBDHA:2015:8197
- Instantie
Rechtbank Den Haag
- Datum
15-07-2015
- Zaaknummer
C/09/468395 / HA ZA 14-738
- Vakgebied(en)
Civiel recht algemeen (V)
Intellectuele-eigendomsrecht (V)
- Brondocumenten en formele relaties
ECLI:NL:RBDHA:2015:8197, Uitspraak, Rechtbank Den Haag, 15‑07‑2015
Uitspraak 15‑07‑2015
Inhoudsindicatie
Europees octrooi. Beschermingscertificaat. Beschermingsomvang. Equivalentie. Afstand van een gedeelte van de bescherming waarop het octrooi aanspraak geeft (‘afstandsleer’).
Partij(en)
vonnis
RECHTBANK DEN HAAG
Team handel – sectie IE
zaaknummer / rolnummer: C/09/468395 / HA ZA 14-738
Vonnis van 15 juli 2015
in de zaak van
de rechtspersoon naar vreemd recht
RESOLUTION CHEMICALS LIMITED,
gevestigd te Stevenage, Verenigd Koninkrijk,
eiseres,
advocaat: mr. D. Knottenbelt te Rotterdam,
tegen
1. de besloten vennootschap met beperkte aansprakelijkheid
ASTRAZENECA B.V.,
gevestigd te Zoetermeer,
2. de rechtspersoon naar vreemd recht
SHIONOGI SEIYAKU KABUSHIKI KAISHA,
gevestigd te Osaka, Japan,
gedaagden,
advocaat: mr. L.Ph.J. baron van Utenhove te Den Haag.
Partijen zullen hierna Resolution en Shionogi c.s. genoemd worden. Waar nodig zullen gedaagden sub 1 en 2 afzonderlijk worden aangeduid als Shionogi en Astrazeneca. Resolution is bijgestaan door mrs. M.G.R. van Gardingen en H.J. Pot, advocaten te Amsterdam en drs. K.M.L. Bijvank, LLM, Europees octrooigemachtigde. Voor Shionogi c.s. is de zaak inhoudelijk behandeld door mrs. W.A. Hoyng en J.M.J.A. Krens, advocaten te Amsterdam, met bijstand van dr. J.H.J. den Hartog, Europees octrooigemachtigde.
1. De procedure
1.1.
Het verloop van de procedure blijkt uit:
- de beschikking van de voorzieningenrechter van deze rechtbank van 14 april 2014 waarbij verlof is verleend te dagvaarden volgens de regeling omtrent de versnelde bodemprocedure in octrooizaken;
- de dagvaarding van 17 april 2014;
- de akte houdende overlegging van producties van 25 juni 2014 met producties 1 t/m 10;
- de conclusie van antwoord tevens akte houdende overlegging van producties van 3 september 2014 met producties 1 t/m 7;
- de akte houdende overlegging van aanvullende producties zijdens Resolution van 10 december 2014 met producties 11 t/m 14;
- de akte houdende overlegging van reactieve producties zijdens Shionogi c.s. van 9 januari 2015 met producties 8 t/m 12;
- de e-mail van mr. Krens van 22 januari 2015 waarin zij de rechtbank mede namens mr. Van Gardingen bericht dat partijen een afspraak hebben gemaakt over het bedrag van de redelijke en evenredige kosten van de procedure;
- de door beide partijen ter zitting gehanteerde pleitnotities; in de pleitnotities van mr. Hoyng zijn de paragrafen 1 t/m 11 en 108 t/m 122 doorgehaald nu die niet zijn gepleit.
1.2.
Ten slotte is vonnis nader bepaald op heden.
2. De feiten
2.1.
Resolution maakt haar bedrijf van het ontwikkelen en produceren van actieve farmaceutische bestanddelen.
2.2.
Shionogi is een Japanse farmaceutische onderneming die houdster is van het aanvullende beschermingscertificaat 300125 (hierna ook: ABC) voor Nederland, verleend voor het product ‘Rosuvastatinum, desgewenst in de vorm van een niet-toxisch farmaceutisch aanvaardbaar zout, in het bijzonder het calciumzout’. Het ABC, dat is gebaseerd op Europees octrooi 0 521 471 (hierna: EP 471 of het (basis)octrooi), is in exclusieve licentie gegeven aan Astrazeneca, zoals Shionogi c.s. ter zitting desgevraagd heeft verklaard. Astrazeneca verhandelt in Nederland rosuvastatine calcium onder de merknaam Crestor®. Astrazeneca is ook houdster van de marktvergunning voor Crestor® in Nederland. Het ABC expireert op 29 juni 2017, tenzij de aanvraag voor pediatrische verlenging van het ABC wordt verleend. In dat geval zal de duur van het ABC worden verlengd tot 29 december 2017.
2.3.
Shionogi was houdster van EP 471 dat betrekking had op ‘Pyrimidine derivatives as HMG-CoA reductase inhibitors’ (in de niet-bestreden Nederlandse vertaling: ‘Pyrimidinederivaten als HMG-CoA-reductase-inhibitoren’). Het octrooi is verleend op 25 oktober 2000 op een aanvrage daartoe van 30 juni 1992, onder inroeping van prioriteit van 1 juli 1991 op basis van JP 18801591. Het octrooi, dat op 29 juni 2012 expireerde, was gedesigneerd voor onder meer Nederland. Voor zover de rechtbank bekend is tegen de verlening van het octrooi geen oppositie ingesteld.
2.4.
Het octrooi kende 16 (hierna volledig weergegeven) conclusies, die als volgt kunnen worden samengevat. Onafhankelijke conclusie 1 zag op de verbinding rosuvastatine-zuur of een niet-toxisch farmaceutisch zout daarvan. Conclusie 2 zag alleen op het rosuvastatine-zuur. Conclusies 3 en 4 hadden betrekking op respectievelijk het calciumzout en het natriumzout van de verbinding volgens conclusie 1. Conclusies 5 en 6 waren gericht op farmaceutische samenstellingen die de verbindingen van conclusies 1 en 4 als een actief bestanddeel bevatten. Conclusie 6 voegde de beperking ‘which is useful as an HMG-CoA reductase inhibitor’ toe. Conclusie 7 was gericht op een werkwijze voor de bereiding van de verbindingen van conclusies 1 tot en met 4 en bevatte een reactieschema. Conclusie 8 had betrekking op een werkwijze voor de bereiding van de samenstellingen van conclusies 5 en 6 vermengd met een farmaceutische drager. Conclusie 9 had als onderwerp de verbinding volgens conclusie 1 tot en met 4 voor het gebruik als een actief farmaceutisch bestanddeel. Conclusies 10, 12 en 13 hadden betrekking op werkwijzen voor de bereiding van zouten van het zuur van conclusie 1 en conclusie 11 voor de bereiding van het zuur van conclusie 1. Conclusie 14 zag op de bereiding van een farmaceutische samenstelling van het calciumzout van de verbinding volgens conclusie 1. Conclusies 15 en 16 betroffen zogenaamde use-claims gericht op het gebruik van de verbindingen van conclusies 1 tot en met 4 voor de vervaardiging van een farmaceutische samenstelling, waarbij conclusie 16 beperkt was tot farmaceutische samenstellingen voor de behandeling van hypercholesterolemie, hyperlipoproteïnemie en atherosclerose.
2.5.
De (oorspronkelijke) Engelse tekst van de conclusies luidde als volgt:
1. The compound (+)-7-[4-(4-fluorophenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino)pyrimidin-5-yl]-(3R,5S)-dihydroxy-(E)-6-heptenoic acid or a non-toxic pharmaceutically acceptable salt thereof.
2. A compound as claimed in claim 1 which is (+)-7-[4-(4-fluorophenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino)pyrimidin-5-yl]-(3R,5S)-dihydroxy-(E)-6-heptenoic acid
3. A compound as claimed in claim 1 which is the calcium salt of (+)-7-[4-(4-fluorophenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino)pyrimidin-5-yl]-(3R,5S)-dihydroxy-(E)-6-heptenoic acid.
4. A compound as claimed in claim 1 which is the sodium salt of (+)-7-[4-(4-fluorophenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino)pyrimidin-5-yl]-(3R,5S)-dihydroxy-(E)-6-heptenoic acid.
5. A pharmaceutical composition which comprises a compound as claimed in any one of claims 1 to 4 as an active ingredient.
6. A pharmaceutical composition as claimed in claim 5 which is useful as an HMG-CoA reductase inhibitor.
7. A process for the preparation of a compound as claimed in any one of claims 1-4 which comprises
(1) subjecting compound a
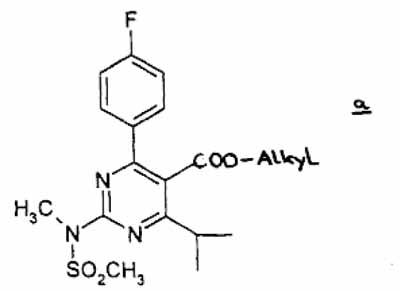
wherein Alkyl means straight, branched or cyclic C1 to C6 alkyl to a reduction in an appropriate inactive solvent in the presence of a reductant to give the alcohol compound,
(2) subjecting the thus obtained alcohol compound to an oxidation in an appropriate solvent in the presence of an oxidizing agent to give aldehyde compound b
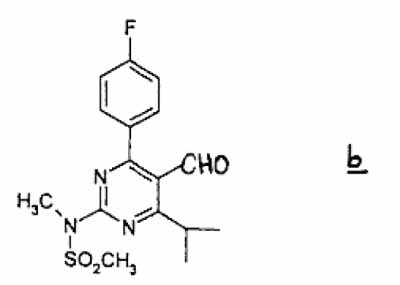
(3) which is reacted with 3-(tert-butyldimethylsilyloxy)-5-oxo-6-triphenylphosphoranylidene hexanoic acid derivatives in an appropriate solvent to give compound c
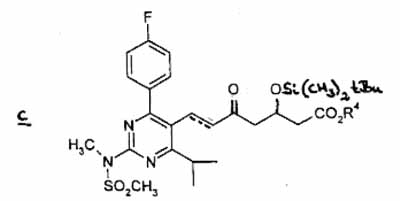
wherein the dotted line denotes the presence of a double bond, and R4 is a straight, branched or cyclic C1 to C6 alkyl
(4) which is subjected to elimination of the tert-butyldimethylsilyl group in an appropriate organic solvent in the presence of a hydrogen halogenide to give compound d
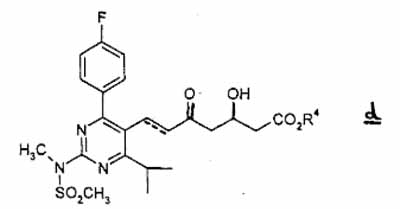
wherein the doffed [kennelijk is bedoeld ‘dotted’, Rb] line and R4 have the same meaning as defined above
(5) which is reacted with diethylmethoxyborane and NaBH4, in an alcohol-organic solvent mixture and subjected to column chromatography on silica gel and the obtained product is subjected to saponification in a polar solvent with a solution of metallic hydroxide (in the case where the desired product is a non-toxic pharmaceutically acceptable salt of (+)-7-[4-(4-fluorophenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino)pyrimidin-5-yl]-(3R,5S)-dihydroxy-(E)-6-heptenoic acid or after the saponification, it is neutralized with an inorganic acid (in the case where the desired product is (+)-7-[4-(4-fluorophenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino)pyrimidin-5-yl]-(3R,5S)-dihydroxy-(E)-6-heptenoic acid.
8. A process for the preparation of a pharmaceutical composition as defined in claims 5 or 6 which comprises admixing a compound as defined in any one of claims 1 to 4 with a pharmaceutically acceptable carrier.
9. A compound as claimed in any one of claims 1 to 4 for use as an active pharmaceutical substance.
10. A process for preparing a non-toxic pharmaceutically acceptable salt of the compound (+)-7-[4-(4-fluorophenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino)pyrimidin-5-yl]-(3R,5S)-dihydroxy-(E)-6-heptenoic acid which comprises saponification of
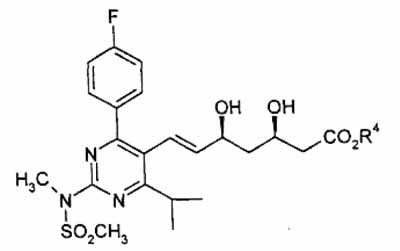
wherein R4 is a straight, branched or cyclic C1 to C6 alkyl, in a polar solvent with a solution of a metallic hydroxide.
11. A process as claimed in claim 10, followed by neutralisation with an inorganic acid to give (+)-7-[4-(4-fluorophenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino)pyrimidin-5-yl]-(3R,5S)-dihydroxy-(E)-6-heptenoic acid.
12. A process for the preparation of the calcium salt of (+)-7-[4-(4-fluorophenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino)pyrimidin-5-yl]-(3R,5S)-dihydroxy-(E)-6-heptenoic acid which comprises reaction of the sodium salt of (+)-7-[4-(4-fluorophenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino)pyrimidin-5-yl]-(3R,5S)-dihydroxy-(E)-6-heptenoic acid with a water soluble calcium salt under aqueous conditions.
13. A process as claimed in claim 12, wherein the water soluble calcium salt is calcium chloride.
14. A process for the preparation of a pharmaceutical composition which comprises admixing the calcium salt of (+)-7-[4-(4-fluorophenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino)pyrimidin-5-yl]-(3R,5S)-dihydroxy-(E)-6-heptenoic acid with a pharmaceutically acceptable carrier.
15. Use of a compound as claimed in any one of claims 1 to 4 for the manufacture of a pharmaceutical composition.
16. Use according to claim 15, wherein the pharmaceutical composition is for treating hypercholesterolemia, hyperlipoproteinemia and athereosclerosis.
2.6.
De onbestreden Nederlandse vertaling van de conclusies van EP 471 luidt als volgt:
1. Verbinding (+)-7-[4-(4-fluorfenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino)pyrimidin-5-yl]-(3R,5S)-dihydroxi-(E)-6-hepteenzuur of een niet-toxisch farmaceutisch aanvaardbaar zout daarvan.
2. Verbinding volgens conclusie 1, die (+)-7-[4-(4-fluorfenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino)pyrimidin-5-yl]-(3R,5S)-dihydroxi-(E)-6-hepteenzuur is.
3. Verbinding volgens conclusie 1, die het calciumzout van (+)-7-[4-(4-fluorfenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino)pyrimidin-5-yl]-(3R,5S)-dihydroxi-(E)-6-hepteenzuur is.
4. Verbinding volgens conclusie 1, die het natriumzout van (+)-7-[4-(4-fluorfenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino)pyrimidin-5-yl]-(3R,5S)-dihydroxi-(E)-6-hepteenzuur is.
5. Farmaceutische samenstelling die een verbinding volgens een der conclusies 1 tot 4 als actief bestanddeel bevat.
6. Farmaceutische samenstelling volgens conclusie 5, die kan worden toegepast als een HMB-CoA-reductase-inhibitor.
7. Werkwijze voor het bereiden van een verbinding volgens één der conclusies 1-4, die het volgende omvat:
(1) onderwerpen van een verbinding a
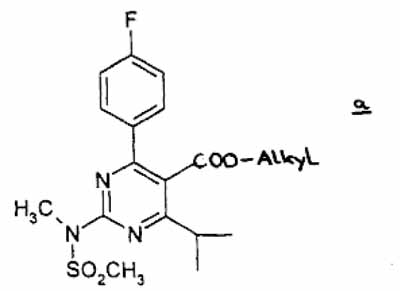
waarbij alkyl een rechte, vertakte of cyclische C1- tot C6-alkylgroep voorstelt, aan een reductie in een geschikt inactief oplosmiddel, in aanwezigheid van een reduceermiddel, om de alcoholverbinding te verkrijgen,
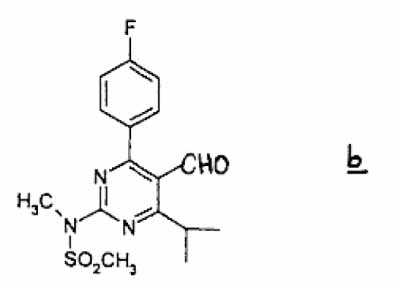
(2) onderwerpen van de aldus verkregen alcoholverbinding aan een oxidatie, in een geschikt oplosmiddel, in aanwezigheid van een oxideermiddel, om aldehydeverbinding b te verkrijgen
(3) die in reactie wordt gebracht met 3-(tert-butyldimethylsilyloxi)-5-oxo-6-trifenylfosforanylideenhexaanzure derivaten, in een geschikt oplosmiddel, om verbinding c te verkrijgen
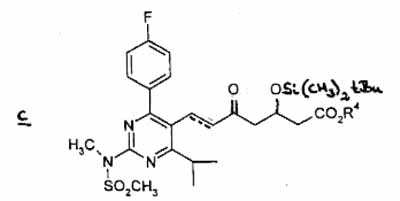
waarbij de stippellijn de aanwezigheid van een dubbele binding voorstelt, en R4 een rechte, vertakte of cyclische C1- tot C6-alkylgroep voorstelt,
(4) die wordt onderworpen aan eliminatie van de tert-butyldimethylsilylgroep, in een geschikt organisch oplosmiddel, in aanwezigheid van een waterstofhalogenide, om verbinding d te verkrijgen
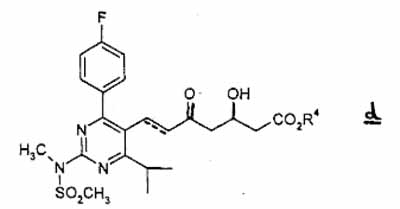
waarbij de stippellijn en R4 dezelfde betekenis hebben als hierboven gedefinieerd
(5) die in reactie wordt gebracht met diëthylmethoxiboraan en NaBH4, in een alcohol-organisch oplosmiddelmengsel en wordt onderworpen aan kolomchromatografie over silicagel, waarbij het verkregen product wordt onderworpen aan verzeping in een polair oplosmiddel met een oplosmiddel van metallisch hydroxide (in het geval waarbij het gewenste product een niet-toxisch farmaceutisch aanvaardbaar zout van (+)-7-[4-(4-fluorfenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino)pyrimidin-5-yl]-(3R,5S)-dihydroxi-(E)-6-hepteenzuur is) of na de verzeping wordt geneutraliseerd met een anorganisch zuur (in het geval waarbij het gewenste product (+)-7-[4-(4-fluorfenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino)pyrimidin-5-yl]-(3R,5S)-dihydroxi-(E)-6-hepteenzuur is).
8. Werkwijze voor het bereiden van een farmaceutische samenstelling zoals gedefinieerd in conclusie 5 of conclusie 6, die het mengen van een verbinding zoals gedefinieerd in één der conclusies 1 tot 4 met een farmaceutisch aanvaardbare drager omvat.
9. Werkwijze [kennelijk is bedoeld: verbinding, Rb] volgens één der conclusies 1 tot 4, om te worden toegepast als een actieve farmaceutische stof.
10. Werkwijze voor het bereiden van een niet-toxisch farmaceutisch aanvaardbaar zout van de verbinding (+)-7-[4-(4-fluorfenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino)pyrimidin-5-yl]-(3R,5S)-dihydroxi-(E)-6-hepteenzuur, die het verzepen van
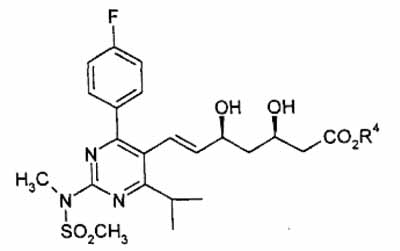
waarbij R4 een rechte, vertakte of cyclische C1- tot C6-alkylgroep voorstelt, in een polair oplosmiddel, met een oplossing van een metallisch hydroxide, omvat.
11. Werkwijze volgens conclusie 10, gevolgd door neutraliseren met een anorganisch zuur, om (+)-7-[4-(4-fluorfenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino)pyrimidin-5-yl]-(3R,5S)-dihydroxi-(E)-6-hepteenzuur te verkrijgen.
12. Werkwijze voor het bereiden van het calciumzout van (+)-7-[4-(4-fluorfenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino)pyrimidin-5-yl]-(3R,5S)-dihydroxi-(E)-6-hepteenzuur, die het reageren van het natriumzout van (+)-7-[4-(4-fluorfenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino)pyrimidin-5-yl]-(3R,5S)-dihydroxi-(E)-6-hepteenzuur met een in water oplosbaar calciumzout, onder waterige omstandigheden, omvat.
13. Werkwijze volgens conclusie 12, waarbij het in water oplosbare calciumzout calciumchloride is.
14. Werkwijze voor het bereiden van een farmaceutische samenstelling, die het mengen van het calciumzout van (+)-7-[4-(4-fluorfenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino)pyrimidin-5-yl]-(3R,5S)-dihydroxi-(E)-6-hepteenzuur met een farmaceutisch aanvaardbare drager omvat.
15. Toepassing van een verbinding volgens één der conclusies 1 tot 4, voor het bereiden van een farmaceutische samenstelling.
16. Toepassing volgens conclusie 15, waarbij de farmaceutische samenstelling is bedoeld voor het behandelen van hypercholesterolemie, hyperlipoproteïnemie en atherosclerose.
2.7.
De beschrijving van EP 471 bevatte onder meer de volgende passages:
[0001] The present invention relates to 3-hydroxy-3-methylglutaryl coenzyme A (HMG-CoA) reductase inhibitors.
[0002] The first generation of drags [bedoeld zal zijn: drugs, Rb] for the treatment of atherosclerosis by inhibiting the activity of HMG-CoA reductase, are mevinolin (…), pravastatin sodium (…), and simvastatin (…), which are fungal metabolites or chemical derivatives thereof. Recently, synthetic inhibitors of HMG-CoA reductase such as fluvastatin (…) were developed as the second generation drags [idem, Rb].
[0003] The compounds of the present invention inhibit the HMG-CoA reductase, which plays a major role in the synthesis of cholesterol, and thus they suppress the biosynthesis of cholesterol. Therefore, they are useful in the treatment of hypercholesterolemia, hyperlipoproteinemia and atherosclerosis.
(…)
[0006] In the specification, the term “lower alkyl” refers to a straight, branched, or cyclic C1 to C6 alkyl, including methyl, ethyl, n-propyl, isopropyl, cyclopropyl, n-butyl, isobutyl, sec-butyl, tert-butyl, cyclobutyl, n-pentyl, isopentyl, neopentyl, tert-pentyl, cyclopentyl, n-hexyl, and isohexyl and the like. Further, the lower alkyl may be substituted by 1 to 3 substituents independently selected from the group consisting of halogen, amino, and cyano. Halogen means fluorine, chlorine, bromine and iodine.
[0007] The term “a non-toxic pharmaceutically acceptable salt” refers to a salt in which the cation is an alkali metal ion, an alkaline earth metal ion, or an ammonium ion. Examples of alkali metals are lithium, sodium, potassium, and cesium, and examples of alkaline earth metals are beryllium, magnesium, and calcium. Sodium and calcium are preferred.
(…)
[0029] The present invention is illustrated by the following examples and reference examples, which are not to be considered as limiting.
(…)
2.8.
Conclusie 1 zoals neergelegd in de oorspronkelijke aanvrage van EP 471 luidt als volgt:
1. A compound represented by the formula (I):
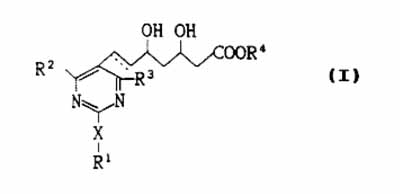
wherein R1 is lower alkyl, aryl of aralkyl, each of which may have one or more substituents; R2 and R3 each is independently hydrogen, lower alkyl or aryl, and each of said lower alkyl and aryl may have one or more substituents; R4 is hydrogen, lower alkyl, or a cation capable of forming a non-toxic pharmaceutically acceptable salt; X is sulfur, oxygen, or sulfonyl, or imino which may have a substituent; the dotted line represents the presence or absence of a double bond, or the corresponding ring-closed lactone.
2.9.
In de beschrijving van de oorspronkelijke aanvrage zijn onder meer de volgende passages opgenomen:
(pagina 2, regels 1 en 2)
The present invention relates to 3-hydroxy-3-methylglutaryl coenzyme A (HMG-CoA) reductase inhibitors.
(pagina 2, regels 9 t/m 29)
The compounds of the present invention inhibit the HMG-CoA reductase, which plays a major role in the synthesis of cholesterol, and thus they suppress the biosynthesis of cholesterol. Therefore, they are useful in the treatment of hypercholesterolemia, hyperlipoproteinemia and atherosclerosis.
The present invention relates to compounds of the formula (I):
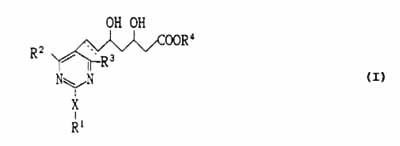
wherein R1 is lower alkyl, aryl of aralkyl, each of which may have one or more substituents; R2 and R3 each is independently hydrogen, lower alkyl or aryl, and each of said lower alkyl and aryl may have one or more substituents; R4 is hydrogen, lower alkyl, or a cation capable of forming a non-toxic pharmaceutically acceptable salt; X is sulfur, oxygen, or sulfonyl, or imino which may have a substituent; the dotted line represents the presence or absence of a double bond, or the corresponding ring-closed lactone. This invention also provides a pharmaceutical composition comprising the same.
(pagina 2, regels 42 t/m 45)
The term “a cation capable of forming a non-toxic pharmaceutically acceptable salt” refers to an alkali metal ion, an alkaline earth metal ion, or an ammonium ion. Examples of alkali metals are lithium, sodium, potassium, and cesium, and examples of alkaline earth metals are beryllium, magnesium, and calcium. Sodium and calcium are preferred.
(pagina 4, regels 29 en 30)
The present invention is illustrated by the following examples and reference examples, which are not to be considered as limiting.
(pagina 8, regels 43 t/m 47)
Example 1
Sodium (+)-7-[4-(4-fluorophenyl)-6-isopropyl-2(N-methyl-N-methylsulfonylaminopyrimidin)-5-yl]-(3R,5S)-dihydroxy-(E)-6-heptenate (Ia-1)
[…]
(pagina 13, regels 16 t/m 58 en pagina 14 regels 1 t/m 22)
Example 7
Calcium salt of the compound (Ia-1)
The compound (Ia-1) (sodium salt) 1.50 g (3.00 mmol) is dissolved in 15 ml of water and stirred at room temperature under a nitrogen atmosphere. Successively 3.00 ml (3.00 mmol) of 1 mol/L calcium chloride 3.00 ml (3.00 mmol) is added dropwise thereto over 3 minutes. The reaction mixture is stirred at the same temperature for 2 hours, and the resulting precipitate is collected, washed with water and dried to give 1.32 g of calcium salt as powder. This compound started to melt at a temperature of 155 ° C, but the definitive melting point is ambiguous. [α]D = +6.3±0.2° (C = 2.011, 25.0 ° C, MeOH)
Anal Calcd. (%) for C22H27N3O4SF·0.5Ca·0.5H2O | ||||||
|---|---|---|---|---|---|---|
: | C,51.85; | H,5.53; | N,8.25; | F,3.73; | Ca,3.93 | |
Found | : | C,51.65; | H,5.51; | N,8.47; | F,3.74; | Ca,4.07 |
Biological Activity
Experiment
The HMG-CoA reductase inhibitory effect
(1) Preparation of rat liver microsomes
Sprague-Dawley rats, which were in free access to ordinary dietes containing 2% cholestyramine and water for 2 weeks, were used for the preparation of rat liver microsomes. The thus obtained microsomes were then purified according to the manner described by Kuroda et al., Biochem. Biophys. Act, 486, 70 (1977). The microsomal fraction obtained by centrifugation at 105000 x g was washed once with a buffered solution containing 15 mM nicotinamide and 2 mM magnesium chloride (in a 100 mM potassium phosphate buffer, pH 7.4). It was homogenized with a buffer containing nicotinamide and magnesium chloride at the same weight as the liver employed. The thus obtained homogenate was cooled down and kept at -80 ° C.
(2) Measurement of the HMG-CoA reductase inhibitory activities
The rat liver microsome sample (100 µ l), which was preserved at -80 ° C, was fused at 0 ° C and diluted with 0.7 ml of a cold potassium phosphate buffer (100 mM pH7.4). This was mixed with 0.8 ml of 50 mM EDTA (buffered with the aforementioned potassium phosphate buffer) and 0.4 ml of 100 mM dithiothreitol solution (buffered with the aforementioned potassium phosphate buffer), and the mixture was kept at 0 ° C. The microsome solution (1.675 ml) was mixed with 670 µ l of 25 mM NADPH (buffered with the aforementioned potassium phosphate buffer), and the solution was added to the solution of 0.5mM [3-14C]HMG-CoA (3mCi/mmol). A solution (5 µ l) of sodium salt of the test compound dissolved in potassium phosphate buffer was added to 45 µ l of the mixture. The resulting mixture was incubated at 37 ° C for 30 minutes and cooled. After termination of the reaction by addition of 10 µ l of 2N-HCL, the mixture was incubated again at 37 ° C for 15 minutes and then 30 µ l of this mixture was applied to thin-layer chromatography on silica gel of 0.5 mm in thickness (Merck AG, Art 5744). The chromatograms were developed in toluene/acetone (1/1) and the spot, whose Rf value was between 0.45 to 0.60, were scraped. The obtained products were put into a vial containing 10 ml of scintillator to measure specific radio-activity with a scintillation counter. The activities of the present compounds are shown in Table 4 as comparative data, based on the assumption that the activity of mevinolin (sodium salt) as the reference drug is 100.
Test Compound | HMG-CoA reductase inhibitory activities |
|---|---|
I a-I | 442 |
I a-3 | 385 |
I a-5 | 279 |
I a-7 | 260 |
Mevinolin Na | 100 |
The test data demonstrates that the compounds of the present invention exhibit HMG-CoA reductase inhibition activities superior to mevinolin.
2.10.
Resolution heeft voor de verhandeling van rosuvastatine zink een marktvergunning gekregen en is voornemens dat product in Nederland op de markt te brengen. Daarvan heeft zij Shionogi c.s. bij brief van 26 maart 2014 in kennis gesteld. Op 4 april 2014 heeft mr. Hoyng namens Shionogi c.s. te kennen gegeven dat Shionogi c.s. niet bereid is te bevestigen dat ABC 300125 niet wordt ingeroepen jegens Resolution, haar afnemers en hun afnemers indien zij rosuvastatine zink zullen gaan verhandelen op de Nederlandse markt.
3. Het geschil
3.1.
Resolution vordert dat de rechtbank bij vonnis, zo veel mogelijk uitvoerbaar bij voorraad, conclusies 1 en 2 van het Nederlandse deel van EP 471 en de daarvan afhankelijke conclusies vernietigt voor zover de materie daarvan betrekking heeft op een andere verbinding dan rosuvastatine calcium en/of rosuvastatine natrium, en voorts ABC 300125 nietig verklaart voor zover het meer omvat dan rosuvastatine calcium en/of rosuvastatine natrium, alsmede voor recht verklaart dat Resolution (en/of haar klanten) geen directe of indirecte inbreuk maakt/maken op de rechten van Shionogi c.s. onder ABC 300125 door rosuvastatine zink in Nederland te vervaardigen, te gebruiken, in het verkeer te brengen of (verder) te verkopen, te verhuren, af te leveren of anderszins te verhandelen, dan wel voor een of ander aan te bieden, in te voeren of in voorraad te hebben, met hoofdelijke veroordeling van Shionogi c.s. in de kosten van de procedure te begroten op de voet van artikel 1019h Rv, vermeerderd met de wettelijke rente.
3.2.
Aan haar vorderingen legt Resolution ten grondslag - kort gezegd - dat de conclusies 1 en 2 van het Nederlandse deel van EP 471, alsmede de daarvan afhankelijke conclusies, op grond van artikel 75 lid 1 sub c Rijksoctrooiwet 1995 (hierna: ROW) niet verleend hadden mogen worden voor zover deze meer omvatten dan rosuvastatine calcium en/of rosuvastatine natrium vanwege toegevoegde materie, zodat het ABC op grond van artikel 15 lid 1 sub c Verordening EG nr. 469/2009 van het Europees Parlement en de Raad van 6 mei 2009 betreffende het aanvullende beschermingscertificaat voor geneesmiddelen (hierna: beschermingscertificaatVo) partieel nietig is nu na verval van het basisoctrooi nietigheidsgronden bestaan die een beperking gerechtvaardigd zouden hebben. Voorts legt Resolution aan haar vorderingen ten grondslag dat zij met de voorgenomen verhandeling van rosuvastatine zink in Nederland - ook indien het ABC (geheel) geldig wordt geacht - geen inbreuk zal maken op het ABC.
3.3.
Shionogi c.s. voert gemotiveerd verweer.
3.4.
Op de stellingen van partijen wordt hierna, voor zover van belang, nader ingegaan.
4. De beoordeling
bevoegdheid
4.1.
De rechtbank is, daargelaten andere gronden, internationaal bevoegd om van de vorderingen tegen Shionogi kennis te nemen op grond van artikel 4 van Verordening (EG) nr. 44/2001 betreffende de rechterlijke bevoegdheid, de erkenning en de tenuitvoerlegging van beslissingen in burgerlijke en handelszaken (verder: EEX-Vo (oud))1.jo. artikel 9 sub a Rv, nu Shionogi gevestigd is buiten de Europese Unie en is verschenen zonder de bevoegdheid te bestrijden. Voor zover de geldigheid van het Nederlandse deel van EP 471 ter discussie wordt gesteld, bestaat bevoegdheid op grond van artikel 22 lid 4 EEX-Vo (oud). Op die laatste grond en nu Astrazeneca in Nederland is gevestigd bestaat ook bevoegdheid om van de vorderingen jegens Astrazeneca kennis te nemen.
4.2.
De relatieve bevoegdheid volgt uit artikel 80 lid 1 sub a respectievelijk artikel 80 lid 2 sub b ROW en is overigens ook niet bestreden.
technische achtergrond
4.3.
Voordat aan de beoordeling wordt toegekomen, zal eerst kort worden ingegaan op de technische achtergrond van het octrooi, welke is ontleend aan de onbestreden stellingen van partijen.
4.4.
Cholesterol is een vettige substantie die door het menselijk lichaam voornamelijk wordt gebruikt als bouwstof voor celmembranen en om galzuur aan te maken. Aangezien cholesterol niet oplosbaar is, wordt het door het bloed getransporteerd als een complex in bepaalde, verschillende soorten, eiwitten. Men onderscheidt twee hoofdtypen cholesterol, namelijk LDL-cholesterol (LDL staat voor ‘low density lipoprotein’) en HDL-cholesterol (HDL staat voor ‘high density lipoprotein’). Het betreft echter hetzelfde cholesterol maar ‘verpakt’ in andere eiwitten.
4.5.
LDL en HDL oefenen verschillende functies uit. LDL transporteert cholesterol vanuit de lever door het lichaam, terwijl HDL (een overschot aan) cholesterol weer terugbrengt naar de lever zodat het daar afgebroken en verder geëlimineerd kan worden. Als het LDL-cholesterol gehalte in het bloed relatief hoog is, zal het aan de binnenkant van de slagaderen blijven plakken. Dit is met name het geval wanneer het geoxideerd is. De slagaderen raken hierdoor verstopt en dit verhoogt de kans op cardiovasculaire aandoeningen zoals hartaanvallen en beroertes. HDL heeft zulke effecten niet.
4.6.
Ongeveer 1/3 van het cholesterol dat aanwezig is in het menselijk lichaam is geconsumeerd. De overige 2/3 wordt voornamelijk in de lever aangemaakt. Het in de lever aangemaakte cholesterol wordt voornamelijk in LDL ‘pakketjes’ getransporteerd. Het biologische proces van de aanmaak van cholesterol is zeer complex en bestaat uit een groot aantal stappen waaronder verschillende enzymatische omzettingen. Dit is schematisch weergegeven in de onderstaande figuur:
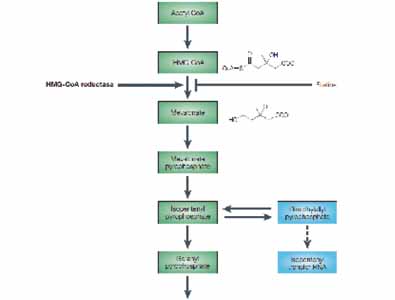
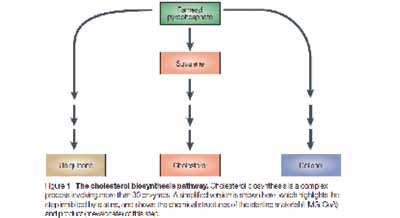
4.7.
De snelheidsbepalende stap in de aanmaak van cholesterol is de omzetting van HMG-CoA in mevolonaat door het enzym HMG-CoA reductase. Statines (ook wel HMG-CoA reductase remmers genoemd) zijn een klasse van geneesmiddelen die gebruikt worden om de cholesterol niveaus (als LDL complex) te verlagen door het enzym HMG-CoA reductase, dat in de lever een centrale rol speelt bij de aanmaak van cholesterol, af te remmen. Door de verminderde aanmaak van cholesterol in de lever, wordt ook de hoeveelheid LDL cholesterol die in het bloed door het lichaam wordt getransporteerd afgeremd.
4.8.
Eén van de hiervoor bedoelde statines, is rosuvastatine. De farmaceutisch actieve vorm is het rosuvastatine-anion, een negatief geladen deeltje. Dit anion bindt aan het enzym HMG-CoA reductase. Als HMG-CoA reductase bindt aan het rosuvastatine-anion en niet aan HMG-CoA, dan is het reductase geblokkeerd (geïnhibeerd) en wordt de aanmaak van cholesterol in de lever geremd. Hieronder is de structuurformule van het rosuvastatine-anion weergegeven:
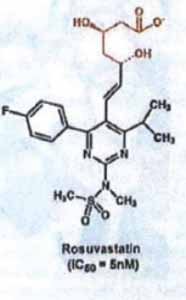
4.9.
Het anion ontstaat/bestaat alleen in oplossing en wordt gevormd in het lichaam. Het is niet mogelijk een tablet te maken met als actieve stof het anion; men kan alleen neutrale stoffen hanteren en dat impliceert de aanwezigheid van een kation (een positief geladen deeltje, zout) of een waterstofatoom (zuur).
4.10.
De zoutvorm is van invloed op de eigenschappen van de farmaceutische samenstelling. De geschiktheid van een zoutvorm wordt vastgesteld door een zoutenonderzoek (‘salt screening’). In een artikel van S.M. Berge e.a. in Journal of Pharmaceutical Sciences (januari 1977, overgelegd door Resolution als productie EP11) wordt daarover opgemerkt:
The chemical, biological, physical, and economic characteristics of medicinal agents can be manipulated and, hence, often optimized by conversion to a salt form. Choosing the appropriate salt, however, can be a very difficult task, since each salt imparts unique properties to the parent compound. Salt-forming agents are often chosen empirically. Of the many salts synthesized, the preferred form is selected by pharmaceutical chemists primarily on a practical basis: cost of raw materials, ease of crystallization, and percent yield. Other basic considerations include stability, hygroscopicity, and flowability of the resulting bulk drug. Unfortunately, there is no reliable way of predicting the influence of a particular salt species on the behavior of the parent compound. Furthermore, even after many salts of the same basic agent have been prepared, no efficient screening techniques exist to facilitate selection of the salt most likely to exhibit the desired pharmacokinetic, solubility, and formulation profiles.
het basisoctrooi
4.11.
EP 471 heeft, anders dan de oorspronkelijke aanvrage waarin door middel van een zogenaamde Markush-formule een klasse van verbindingen werd geclaimd, slechts betrekking op rosuvastatine. EP 471 claimt het zuur van rosuvastatine, zie de onderstaande structuurformule (welke is ontleend aan de door Shionogi c.s. overgelegde verklaring van prof. dr. J.W. Jukema, productie GP3). De in conclusie 1 van de oorspronkelijke aanvrage weergegeven R4-groep (zie 2.8.) is dan H, hieronder rood omcirkeld, en ook voor R1, R2, R3 en X-groepen zijn keuzen gemaakt.
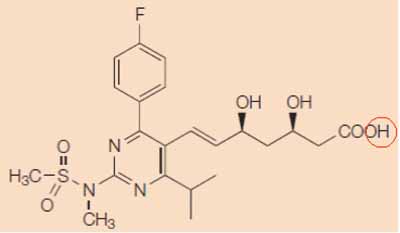
4.12.
EP 471 claimt ook non-toxische farmaceutische zouten van rosuvastatine, waaronder het natriumzout en het calciumzout. Bij deze zouten van rosuvastatine is deR4-positie natrium (Na) respectievelijk calcium (Ca).Het anion wordt in EP 471 niet geclaimd.
beschermingsomvang EP 471 / ABC
4.13.
In het kader van de vraag naar de beschermingsomvang van EP 471 en het daarop gebaseerde ABC, houdt partijen verdeeld wat onder het in conclusie 1 genoemde kenmerk “a non-toxic pharmaceutically acceptable salt thereof” moet worden begrepen.
4.14.
Vooropgesteld wordt dat Shionogi c.s. een verkeerde toets aanlegt waar zij kennelijk betoogt2.dat de conclusies de beschermingsomvang van een octrooi bepalen en dat alleen als de woorden van de conclusies onduidelijk zijn, uitleg is geboden en dan de beschrijving mag worden geraadpleegd. Het arrest van de Hoge Raad van 4 april 20143.benadrukt immers dat - volgens artikel 69 EOV (Europees Octrooiverdrag) en het daarbij behorende protocol van uitleg - de beschermingsomvang wordt bepaald door de conclusies van het octrooischrift, waarbij de beschrijving en de tekeningen dienen tot uitleg van die conclusies en waarbij die uitleg zowel een redelijke bescherming aan de aanvrager als een redelijke rechtszekerheid aan derden dient te bieden. De Hoge Raad heeft er daarbij op gewezen dat de beschrijving en de tekeningen in dat kader een belangrijke bron vormen. Het in die zaak gevoerde betoog dat de letterlijke tekst van de conclusies in het kader van het bepalen van de beschermingsomvang van een octrooi steeds behoort te prevaleren, althans dat nimmer tot een uitleg kan worden gekomen die beperkter is dan waartoe de letterlijke tekst van de conclusie ruimte laat, is expliciet verworpen. Verwezen wordt voorts naar de in r.o. 3.4.2. en 3.4.3. en 3.5.2. van aangehaald arrest verwoorde uitgangspunten.
4.15.
Zoals eerder verwoord4., begrijpt de rechtbank het arrest van de Hoge Raad aldus dat de beschermingsomvang van een Europees octrooi wordt vastgesteld aan de hand van het perspectief van de vakman op de aanvraag- of prioriteitsdatum (de eerste datum) in het licht van de in het arrest genoemde uitgangspunten (ook wel ‘context-gebonden’ uitleg genoemd).
4.16.
De rechtbank is van oordeel dat de gemiddelde vakman op de eerste datum, indachtig de hiervoor gegeven maatstaf en gelet op de bewoordingen van de conclusie in de context van de beschrijving en met diens kennis van de stand van de techniek, het kenmerk ‘a non-toxic pharmaceutically acceptable salt thereof [i.e. van rosuvastatine]’ van conclusie 1 van EP 471 zou lezen in verbinding met de definitie die de uitvinder in paragraaf [0007] van de beschrijving eerder openbaart (en die ook al in de oorspronkelijke aanvrage voorkwam). In die paragraaf wordt immers gezegd dat ‘the term “a non-toxic pharmaceutically acceptable salt” refers to a salt in which the cation is an alkali metal ion, an alkaline earth metal ion, or an ammonium ion’. Daarbij worden voorbeelden gegeven van alkalimetalen en aardalkalimetalen en wordt aangegeven dat natrium en calcium ‘preferred’ zijn. De vakman zou dit opvatten als een beperkende definitie en begrijpen dat de octrooihouder slechts die zouten onder bescherming heeft willen stellen voor gebruik met rosuvastatine.
4.17.
Het standpunt van Shionogi c.s. dat paragraaf [0007] geen definitie zou bevatten maar gezien moet worden als een niet-limitatieve opsomming, wordt niet gevolgd. Zoals Resolution terecht heeft aangevoerd, geeft de eerste zin van bedoelde paragraaf met de woorden ‘refer to’ aan wat de in de conclusie 1 van het octrooi gebruikte term ‘a non-toxic pharmaceutically acceptable salt’ betekent, namelijk dat die betrekking heeft op een zout waarvan het kation bestaat uit een alkalimetaal, een aardalkalimetaal of ammonium. Het gebruik van de woorden ‘The term’ en de aanhalingstekens voor en na de gebruikte term, maken duidelijk dat het om een definitie gaat. Pas in de tweede en derde zin van de paragraaf volgt een niet-limitatieve opsomming van voorbeelden van zouten die binnen de aangewezen categorieën van zouten vallen. Dat, als een beperkende definitie was bedoeld, de octrooihouder wel gekozen zou hebben voor het - volgens Shionogi c.s. - meer limitatieve ‘means’ overtuigt niet. ‘Refers to’ en ‘means’ zijn ongeveer gelijke aanduidingen. Als de octrooihouder tot uitdrukking had willen brengen dat het in paragraaf [0007] van de beschrijving om een niet-limitatieve opsomming gaat, was de definitie überhaupt niet opgenomen of was gekozen voor termen als ‘and the like’, zoals die elders in het octrooischrift, zelfs op dezelfde pagina, wel worden gebruikt.
4.18.
Shionogi c.s. heeft, onder verwijzing naar het AGA/Occlutech-5., het Van Bentum/Kool-6.en het Meyn/Stork-arrest7.van de Hoge Raad, verder nog het verweer gevoerd dat er geen goede grond bestaat om aan te nemen dat de octrooihouder afstand heeft gedaan van andere zouten dan die geopenbaard in paragraaf [0007] van de beschrijving. Vooropgesteld wordt dat de rechtbank met Shionogi c.s. constateert dat de Hoge Raad blijkens zijn arrest in de AGA/Occlutech-zaak kennelijk niet is teruggekomen op de in Meyn/Stork en nadien in Van Bentum/Kool gegeven beslissing dat de gemiddelde vakman slechts dan mag aannemen dat afstand is gedaan van een gedeelte van de bescherming waarop het octrooi (met daarbij destijds de toevoeging: ‘naar het wezen van de uitvinding’) aanspraak geeft indien daartoe, gelet op de inhoud van het octrooischrift in het licht van eventuele andere bekende gegevens, waaronder de openbare gegevens uit het octrooiverleningsdossier, goede grond bestaat. In r.o. 4.3.2. van het AGA/Occlutech-arrest, welk arrest dateert van na het arrest Lely/Delaval8.(waarin - kort gezegd - ‘het wezen van de uitvinding’ niet langer als uitgangspunt dient, maar als ‘gezichtspunt’ wordt geplaatst tegenover de letterlijke tekst van de conclusies), haalt de Hoge Raad immers de hiervoor genoemde uit Meyn/Stork bekende passage aan.
4.19.
Hoe dit ook zij, deze constatering maakt niet dat het beroep van Shionogi c.s. slaagt. Daartoe geldt dat Shionogi c.s. niet heeft weersproken dat het op de prioriteitsdatum tot de algemene vakkennis behoorde dat de keuze voor een bepaalde zoutvorm voor een geneesmiddel uitmaakt in termen van therapeutische activiteit zoals biobeschikbaarheid, absorptie, alsook ten aanzien van chemische- en opslagstabiliteit en dat vooraf niet te voorspellen valt welke zouten van een bepaalde stof uiteindelijk wel of niet bruikbaar zijn, reden waarom routinematig een zoutenonderzoek (‘salt screening’) wordt gedaan. Resolution heeft dit ook onderbouwd aan de hand van onder meer het hiervoor genoemde artikel van Berge e.a. en het eveneens overgelegde Handbook of Pharmaceutical Salts (productie EP12). Dat de vakman zich geen zorgen zou maken om de keuze van het zout nu het werkzame bestanddeel bij rosuvastatine het anion betreft en niet het kation, valt in dit verband niet in te zien. Nu er in het octrooischrift een specifieke definitie wordt gegeven voor de in conclusie 1 van EP 471 gebruikte ‘term’ niet-toxisch farmaceutisch aanvaardbare zouten en gelet op de wetenschap van de gemiddelde vakman van het belang van salt screening, moet bij afweging van een redelijke bescherming van de octrooihouder en de rechtszekerheid van derden worden geoordeeld dat de vakman er gerechtvaardigd van uit mag gaan dat die definitie niet zomaar zal zijn opgenomen en arbitrair en onbetekenend is, maar dat het een zinvolle specificatie betreft. De vakman mag aannemen dat de keuze voor de in paragraaf [0007] geopenbaarde zouten een bewuste keuze is geweest van de octrooihouder, bijvoorbeeld vanwege de uitkomsten van een zoutenonderzoek, en dat de octrooihouder in zoverre dus afstand heeft gedaan van andere zouten die mogelijk zouden kunnen worden toegepast. Andere zouten zal hij om deze reden dan ook niet aanmerken als (geschikte) equivalenten die onder de beschermingsomvang van de geclaimde uitvinding vallen, ook al ziet hij in dat het rosuvastatine-anion uiteindelijk verantwoordelijk is voor het blokkeren van de HMG-CoA reductase.
4.20.
De beschermingsomvang van conclusie 1 van EP 471, zo zou de vakman op de eerste datum op grond van de conclusies, de beschrijving en de tekeningen en met inachtneming van zijn kennis van de stand van de techniek begrijpen, strekt zich mitsdien niet uit tot andere zouten dan die waarin het kation bestaat uit een alkalimetaalion, een aardalkalimetaalion of ammoniumion.
toegevoegde materie
4.21.
Resolution stelt dat de oorspronkelijke aanvrage alleen basis biedt voor het claimen van het calcium- en/of natriumzout van rosuvastatine, en niet voor enige andere zouten of het zuur van rosuvastatine. Zij vindt het niet toelaatbaar om de openbaarmaking van deze twee specifieke zouten in de uitvoeringsvoorbeelden uit te breiden naar het zuur en andere zouten van rosuvastatine. Conclusie 1 van EP 471 als verleend en, naar de rechtbank begrijpt, conclusie 2 alsmede de van conclusies 1 en 2 afhankelijke conclusies zijn om die reden niet toelaatbaar op grond van artikel 75 lid 1 onder c ROW.
4.22.
De rechtbank oordeelt daarover als volgt. Van verboden toegevoegde materie als bedoeld in artikel 123 lid 2 EOV, hetgeen een grond voor nietigheid oplevert ingevolge artikel 75 lid 1 sub c ROW, is sprake wanneer het onderwerp van het octrooi niet wordt gedekt door de inhoud van de aanvrage. Bij de beoordeling daarvan moeten niet alleen de conclusies van de oorspronkelijke aanvrage in ogenschouw worden genomen, maar de aanvrage als geheel. Doorslaggevend is of de gemiddelde vakman de materie van het octrooi direct en ondubbelzinnig, met gebruikmaking van zijn algemene vakkennis, uit de oorspronkelijke aanvrage kan afleiden.
4.23.
Niet in geschil is dat er basis is in de oorspronkelijke aanvrage voor het in het octrooi geclaimde natrium- en calciumzout van rosuvastatine. Anders dan Resolution betoogt, meent de rechtbank dat er ook basis is in de oorspronkelijke aanvrage voor de andere, in paragraaf [0007] van de beschrijving van het octrooi genoemde zouten, waartoe het volgende redengevend is.
4.24.
De aanvrage leert de vakman dat ‘the compounds of the present invention inhibit the HMG-CoA reductase, which plays a major role in the synthesis of cholesterol, and thus they suppress the biosynthesis of cholesterol’ en dat zij om die reden nuttig zijn ‘in the treatment of hypercholesterolemia, hyperlipoproteinemia and atherosclerosis’. De genoemde compounds, zijn als een Markush-formule weergegeven in conclusie 1 van de oorspronkelijke aanvrage, waarbij de R4-positie onder meer kan bestaan uit een ‘cation capable of forming a non-toxic pharmaceutically acceptable salt’.
4.25.
In de voorbeelden 1 en 7 van de oorspronkelijke aanvrage wordt de bereiding van rosuvastatinezouten beschreven. Meer in het bijzonder wordt daar het natrium- en calciumzout van rosuvastatine geopenbaard, in welke uitvoeringsvormen voor de R1-, R2-, R3-, R4- en X-posities een specifieke keuze is gemaakt. In deze voorbeelden, waarvan op pagina 4, regels 29 t/m 30 gezegd wordt dat zij niet als ‘limiting’ moeten worden beschouwd, zou de gemiddelde vakman zonder meer meelezen een combinatie van de specifieke R1-, R2-, R3- en X-posities van de stof rosuvastatine met ieder ander kation ‘capable of forming a non-toxic pharmaceutically acceptable salt’. Welke kationen geschikte zouten vormen begrijpt hij uit de definitie die is weergegeven op pagina 2, regels 42 t/m 45 van de beschrijving, waaruit volgt dat een geschikt kation een alkalimetaal-ion9.is, een aardalkalimetaal-ion10.of een ammonium-ion (NH4+).
4.26.
Het voorgaande wordt bevestigd door verdere lezing van het op pagina 13 en 14 van de oorspronkelijke aanvrage beschreven experiment. In het experiment wordt onder meer rosuvastatine natrium in oplossing gebracht. De gemiddelde vakman begrijpt dat deze stof uiteenvalt in het rosuvastatine-anion en het kation (Na+) en zal, zoals Shionogi c.s. onweersproken heeft gesteld (vgl. paragraaf 15 pleitnota mr. Hoyng), op basis van zijn algemene vakkennis voorts begrijpen dat het actieve bestanddeel van de stof wordt gevormd door het anion en dat het kation verder niet werkzaam is. De vakman die uit de beschrijving (p. 2, regels 42 t/m 45) leert welke zouten geschikt zijn, zou de resultaten van het experiment extrapoleren naar andere in de aanvrage genoemde zouten, in de veronderstelling dat de uitvinder heeft onderzocht (‘salt screening’) dat deze in oplossing (in ieder geval in zekere mate) uiteenvallen in het anion en het kation, zoals Resolution zelf ook wel lijkt aan te nemen (zie paragraaf 42 pleitnota mrs. Van Gardingen en Pot).
4.27.
Gelet op het vorenstaande zijn conclusie 1 van EP 471 en de daarvan afhankelijke conclusies geldig voor zover de zouten betrekking hebben op de in paragraaf [0007] van de beschrijving gedefinieerde categorie.
4.28.
Dat is anders voor het in conclusies 1 en 2 van EP 471 en de daarvan afhankelijke conclusies ook geclaimde zuur van rosuvastatine. Een combinatie van specifieke R1-, R2-, R3- en X-posities van rosuvastatine met een waterstof-ion (H+) op de R4--positie is in de aanvrage niet direct en ondubbelzinnig te lezen. Dit is door Shionogi c.s. ook niet gemotiveerd aangevoerd. Ook is niet zonder meer aannemelijk dat de gemiddelde vakman een dergelijke combinatie op grond van zijn vakkennis zou meelezen. In dit verband heeft Resolution onder verwijzing naar het artikel van Berge (productie EP11) betoogd dat geneesmiddelen gebaseerd op een organisch zuur doorgaans in de vorm van een zout op de markt worden gebracht omdat de zuurvorm slecht oplosbaar is. Zonder een duidelijke aanwijzing daarvoor in de oorspronkelijke aanvrage, die ontbreekt, weet de vakman niet of, en zo ja in welke mate, het zuur uiteen zou vallen in het anion en het waterstof ion. Shionogi c.s. heeft niet uitgelegd waarom de vakman een en ander op basis van de oorspronkelijke aanvrage voor het rosuvastatine-zuur wel zou begrijpen.
4.29.
De conclusie van het bovenstaande is dat het ABC op grond van artikel 15 lid 1 sub c BeschermingscertificaatVo partieel nietig is, namelijk voor zover het meer omvat dan de in paragraaf [0007] van EP 471 genoemde niet-toxische farmaceutisch acceptabele zouten van rosuvastatine, te weten die waarin het kation bestaat uit een alkalimetaalion, een aardalkalimetaalion of een ammoniumion, nu na verval van het basisoctrooi nietigheidsgronden bestaan die een beperking gerechtvaardigd zouden hebben.
‘letterlijke’ inbreuk?
4.30.
Uitgaande van de hiervoor bepaalde beschermingsomvang op de prioriteitsdatum valt het zinkzout van rosuvastatine daar buiten. Dat is immers niet een zout dat voldoet aan de in paragraaf [0007] van het octrooischrift van EP 471 gegeven definitie. Het is niet een alkalimetaal, aardalkalimetaal of ammonium maar is een overgangsmetaal (de twaalfde kolom van het periodiek systeem). Rosuvastatine zinkzout is derhalve niet ‘letterlijk’ door conclusie 1 van het octrooi of de daarvan afhankelijke conclusies beschermd geweest.
4.31.
De stelling van Shionogi c.s. dat er ook bij beperkte lezing van conclusie 1 van EP 471 nog steeds sprake is van ‘letterlijke’ inbreuk omdat Resolution ‘in feite het zuur dreigt aan te bieden’ (het zuur ‘in disguise’, vgl. paragraaf 103 conclusie van antwoord en pleitnota randnummer 69 e.v.), wat daarvan ook zij, wordt reeds verworpen nu het rosuvastatine-zuur vanwege het gedeeltelijk slagen van het toegevoegde materie-argument niet onder de beschermingsomvang van conclusies 1 en 2 of de daarvan afhankelijke conclusies van EP 471 geacht kan worden te hebben gevallen.
inbreuk in het equivalentiebereik?
4.32.
Nu het in deze zaak gaat om een beroep op een op de prioriteitsdatum voor de vakman kenbaar equivalent, welk beroep reeds bij de context-gebonden uitleg is betrokken en is verworpen, bestaat voor aanvullende bescherming in het equivalentiebereik bij beoordeling van de gestelde inbreuk eveneens geen plaats. Aan de vraag of het zinkzout ‘technisch’ equivalent is aan calcium- of natriumzout van rosuvastatine (of één van de andere gedefinieerde zouten), wordt derhalve niet toegekomen.
‘indirecte inbreuk’
4.33.
Hiervoor is reeds vastgesteld dat het zuur van rosuvastatine niet onder de beschermingsomvang valt van EP 471, zodat bespreking van het indirecte inbreukbetoog, wat daarvan in het kader van een beschermingscertificaat ook zij, achterwege kan blijven nu dit betoog is gebaseerd op de onjuist geoordeelde aanname dat de beschermingsomvang van conclusies 1 en 2 van EP 471 en de daarvan afhankelijke conclusies zich ook uitstrekte tot rosuvastatine-zuur. Shionogi c.s. heeft nog aangevoerd dat bovendien sprake is van indirecte inbreuk omdat de in oplossing zijnde rosuvastatine-anionen associëren met de in de gastric fluid in grote hoeveelheid aanwezige natrium kationen. Aan dit betoog dient voorbijgegaan te worden omdat dit nieuwe verweer in strijd met de eisen van de goede procesorde van het versneld regime pas bij pleidooi is aangevoerd.
slotsom
4.34.
Uit het vorenstaande volgt dat rosuvastatine-zinkzout niet onder conclusie 1 van EP 471 en de daarvan afhankelijke conclusies kan worden geacht te hebben gevallen. Ingevolge artikel 4 BeschermingscertificaatVo geldt dit derhalve ook voor het op grond van het basisoctrooi verleende ABC. Van (dreigende) inbreuk op het ABC is dan ook geen sprake.
vorderingen
4.35.
De sub b) van het petitum gevorderde nietigverklaring van het ABC zal worden toegewezen voor zover het ABC meer omvat dan de in paragraaf [0007] van EP 471 genoemde niet-toxische farmaceutisch aanvaardbare zouten van rosuvastatine, te weten die waarin het kation bestaat uit een alkalimetaalion, een aardalkalimetaalion of ammoniumion, nu na verval van het basisoctrooi nietigheidsgronden bestaan die een beperking gerechtvaardigd zouden hebben.
4.36.
De sub a) van het petitum ook gevorderde vernietiging van conclusies 1 en 2 van EP 471 alsmede van de daarvan afhankelijke conclusies wordt afgewezen nu Resolution daarvoor geen afzonderlijk belang heeft gesteld.
4.37.
Nu niet weersproken is dat Resolution belang kan hebben bij de gevorderde verklaring voor recht, ook jegens Astrazeneca met het oog op een mogelijke vordering tot schadevergoeding, zal de sub c) van het petitum gevorderde verklaring voor recht worden toegewezen als na te melden, ook jegens Astrazeneca.
proceskosten
4.38.
Shionogi c.s. zal als de hoofdzakelijk in het ongelijk gestelde partij worden veroordeeld in de proceskosten, welke aan de zijde van Resolution op de voet van artikel 1019h Rv zijn te begroten op € 240.000,00, bij niet-tijdige betaling te vermeerderen met de wettelijke rente. Partijen hebben de rechtbank laten weten over dit bedrag overeenstemming te hebben bereikt. Voor de sub d) van het petitum gevorderde hoofdelijke veroordeling is geen grondslag aanwezig.
uitvoerbaarheid bij voorraad
4.39.
De proceskostenveroordeling zal uitvoerbaar bij voorraad worden verklaaard. De gevorderde nietigverklaring van het ABC alsook de gevorderde verklaring voor recht kunnen naar hun aard niet uitvoerbaar bij voorraad worden verklaard.
5. De beslissing
De rechtbank
5.1.
verklaart nietig het beschermingscertificaat met nummer 300125 voor zover de bescherming ervan zich uitstrekt over andere producten dan de in paragraaf [0007] van EP 471 genoemde niet-toxische farmaceutisch aanvaardbare zouten van rosuvastatine, te weten die waarin het kation bestaat uit een alkalimetaalion, een aardalkalimetaalion of een ammoniumion;
5.2.
verklaart voor recht dat Resolution (en/of haar klanten) geen inbreuk maakt/maken op de rechten van Shionogi onder beschermingscertificaat met nummer 300125 door rosuvastatine zink in Nederland te vervaardigen, te gebruiken, in het verkeer te brengen of (verder) te verkopen, te verhuren, af te leveren of anderszins te verhandelen, dan wel voor een of ander aan te bieden, in te voeren of in voorraad te hebben;
5.3.
veroordeelt Shionogi c.s. in de kosten van de procedure, tot zover aan de zijde van Rosolution begroot op € 240.000,00, te vermeerderen met de wettelijke rente over dat bedrag vanaf veertien dagen na betekening van dit vonnis tot aan de dag van volledige voldoening;
5.4.
verklaart de kostenveroordeling uitvoerbaar bij voorraad;
5.5.
wijst het meer of anders gevorderde af.
Dit vonnis is gewezen door mr. P.G.J. de Heij, mr. J.Th. van Walderveen en mr. C.T. Aalbers en in het openbaar uitgesproken op 15 juli 2015.
Voetnoten
Voetnoten Uitspraak 15‑07‑2015
conclusie van antwoord onder randnummer 67
HR 4 april 2014, ECLI:NL:HR:2014:816 (Medinol v. Abbott c.s.)
Vgl. Rb. Den Haag 18 juni 2014, BIE 2014, nr. 41, p. 173, r.o. 4.10. t/m 4.15. (MBI v. Shimano c.s.); Rb. Den Haag 23 juli 2014, ECLI:RBDHA:2014:9417, r.o. 4.7. t/m 4.12. (Bayer Pharma v. Sandoz).
HR 25 februari 2012, ECLI:NL:HR:2012:BV3680 (AGA/Occlutech).
HR 22 maart 2002, NJ 2002, 530 (Van Bentum/Kool).
HR 27 januari 1989, NJ 1989, 506 (Meyn/Stork), r.o. 3.3.
HR 7 september 2007, ECLI:NL:HR:2007:BA3522 (Lely/Delaval); zie over dit arrest Rb. ‘s-Gravenhage 14 november 2007, IEF 5087, (Exodus/Joyincare), r.o. 4.12.
Alkalimetalen zijn lithium (Li), natrium (Na), kalium (K), rubidium (Rb), cesium (Cs) en francium (Fr) uit groep 1 (de linker kolom) van het periodiek systeem.
Aardalkalimetalen zijn beryllium (Be), magnesium (Mg), calcium (Ca), strontium (Sr), barium (Ba) en radium (Ra) uit groep 2 (de tweede kolom van links) van het periodiek systeem.