Deze tekst is dezelfde in de aanvrage voor EP 511, zie p. 18, r. 1 t/m 22.
Rb. Den Haag, 02-10-2013, nr. C/09/428871 / HA ZA 12-1209
ECLI:NL:RBDHA:2013:15067
- Instantie
Rechtbank Den Haag
- Datum
02-10-2013
- Zaaknummer
C/09/428871 / HA ZA 12-1209
- Roepnaam
TEVA Pharmaceuticals Europe/SANOFI S.A.
- Vakgebied(en)
Intellectuele-eigendomsrecht (V)
- Brondocumenten en formele relaties
ECLI:NL:RBDHA:2013:15067, Uitspraak, Rechtbank Den Haag, 02‑10‑2013
Uitspraak 02‑10‑2013
Partij(en)
Vonnis van 2 oktober 2013
in de zaak van
de besloten vennootschap met beperkte aansprakelijkheid
TEVA PHARMACEUTICALS EUROPE B.V.,
gevestigd te Utrecht,
eiseres,
advocaat: mr. D. Knottenbelt te Rotterdam,
tegen
de vennootschap naar vreemd recht
SANOFI S.A.,
gevestigd te Parijs, Frankrijk,
gedaagde,
advocaat: mr. B.J.H. Crans te Amsterdam.
Partijen zullen hierna Teva en Sanofi genoemd worden. Voor Teva zijn de zaken behandeld door mr. Swens en mr. A.A.M. Reijns. advocaten te Amsterdam. Voor Sanofi zijn de zaken behandeld door S.C. Dack, barrister en geregistreerd EU-advocaat te Amsterdam, mr. J.M.J.A. Krens en mr. P. van Schijndel, advocaten, eveneens te Amsterdam.
1. De procedure
1.1.
Het verloop van de procedure blijkt uit:
- —
de beschikking voor een versneld regime in octrooizaken van 31 augustus 2012,
- —
de dagvaarding van 7 september 2012 (Teva).
- —
de akte houdende overlegging producties producties 1–30 tevens verdere toelichting van de feiten en stellingen van 10 oktober 2012 (Teva),
- —
de conclusie van antwoord van 19 december 2012 met producties 1–11 (Sanofi),
- —
de akte houdende overlegging producties 31–32 van 27 maart 2013 (Teva),
- —
de akte houdende overlegging aanvullende producties 12–15 van 24 mei 2013 (Sanofi),
- —
de akte houdende overlegging aanvullende producties 16–18 van 24 mei 2013 (Sanofi),
- —
de email van 10 mei 2013 van mr. Krens waarin mede namens Mr Swens is bericht ‘dat partijen overeenstemming hebben bereikt met betrekking tot de redelijke en evenredige kosten van bovengenoemd geding: EUR 100.000’,
- —
de pleidooien van 24 mei 2013 en de ter gelegenheid daarvan overgelegde pleitnotities, met in de pleitnota van Sanofi geschrapt de randnummers 147 t/m 159 welke niet zijn gepleit en de randnummers 194, 196 en 197 waartegen Teva bezwaar heeft gemaakt omdat daarin nieuwe, niet eerder ingenomen stellingen worden betrokken, welk bezwaar — zoals hierna zal blijken — wordt gehonoreerd.
1.2.
Ten slotte is vonnis nader bepaald op heden.
2. De feiten
2.1.
Sanofi is een wereldwijd opererende farmaceutische onderneming. Zij is rechthebbende met betrekking tot het Aanvullend Beschermingscertificaat met het nummer 990006 (hierna: het combinatie-ABC). Het combinatie-ABC ziet op irbesartan, desgewenst in de vorm van een zout en/of een hydraat, en hydrochloorthiazide (ook wel aangeduid als HCTZ) en is van kracht tot en met 14 oktober 2013.
2.2.
Het combinatie-ABC is verleend met als basisoctrooi het Europees octrooi EP 0 454 511 (hierna: EP 511), voor ‘Dérivés hétérocycliques N-substitués, leur préparation, les compositions pharmaceutiques en contenant’, in het Nederlands: ‘N-gesubstitueerde heterocyclische derivaten, de bereiding hiervan, farmaceutische preparaten die deze bevatten’. EP 511 is verleend op 17 juni 1998 op een aanvrage van 20 maart 1991 en is vervallen op 20 maart 2011 wegens afloop van de maximale duur.
2.3.
EP 511 is eveneens aangemerkt als basisoctrooi voor het Aanvullend Beschermingscertificaat met het nummer 980039 (hierna: het mono-ABC) dat ziet op irbesartan, desgewenst in de vorm van een zout en/of een hydraat. Het mono-ABC is op 27 augustus 2012 vervallen wegens afloop van de maximale duur.
2.4.
De voor het onderhavige geding relevante conclusies van EP 511 zijn genummerd 1 t/m 7 en 20. Conclusie 7 betreft irbesartan en conclusie 20 de combinatie van irbesartan met een diureticum. Genoemde conclusies luiden voor alle gedesigneerde landen (behalve Spanje en Griekenland — voor deze landen bestaat een afzonderlijke conclusieset) in de oorspronkelijke Franse taal als volgt:

2.5.
In de — onbestreden — Nederlandse vertaling luiden deze conclusies als volgt.


2.6.
De beschrijving van EP 511 bevat de volgende passage1.:
‘L'affinité des produits selon l'invention pour les récepteurs de l'angiotensine II a été étudiée sur un test de liaison de l'angiotensine II marquée à l'iode 125 à des récepteurs membranaires de foie de rats. La méthode utilisée est celle décrite par S. KEPPENS et al. dans Biochem. J., 1982, 208, 809–817.
On mesure la Cl50: concentration qui donne 50 % de déplacement de l'angiotensine II marquée, liée spécifiquement au récepteur. La Cl50 des composés selon l'invention est inférieure à 10-6 M.
De plus l'effet antagoniste de l'angiotensine II des produits selon l'invention a été constaté sur différentes espèces animales dans lesquelles le système rénine-angiotensine a été préalablement activé (C. LACOUR et al., J. Hypertension, 1989.7 (suppl.2), S33-S35).
Les composés selon l'invention sont actifs après administration par différentes voies, notamment par voie orale. Aucun signe de toxicité n'est observé avec ces composés aux doses pharmacologiquement actives. Ainsi les composés selon l'invention peuvent être utilisés dans le traitement de différentes affections cardiovasculaires, notamment l'hypertension, la défaillance cardiaque, l'insuffisance veineuse, ainsi que dans le traitement du glaucome, des rétinopathies diabétiques, et de différentes affections du système nerveux central, l'anxiété, la dépression, les déficits mnésiques ou la maladie d'Alzheimer par exemple.’
(p. 12, r. 39 t/m 52)
Of in de onbestreden Nederlandse vertaling:
‘De affiniteit van de producten volgens de uitvinding voor de receptoren van angiotensine II werd bestudeerd in een test op het binden van met jodium 125 gelabeld angiotensine II aan membraan receptoren van de rattelever. De gebruikte methode wordt door S. KEPPENS et al. beschreven in Biochem. J., 1982, 208, 809–817.
Men meet de Cl50: de concentratie die 50 % verplaatsing geeft van het gelabelde angiotensine II, dat specifiek aan de receptor is gebonden. De Cl50 van de verbindingen volgens de uitvinding is lager dan 10-6M.
Bovendien werd het antagonistische effect op angiotensine II van de verbindingen volgens de uitvinding waargenomen bij verschillende diersoorten waarin het renine-angiotensine systeem van tevoren werd geactiveerd (C. LACOUR et al., J. Hypertension, l989.7(suppl. 2),S833-S35).
De verbindingen volgens de uitvinding zijn werkzaam na verschillende wijzen van toediening, bij voorbeeld oraal.
Er werd bij de farmacologisch actieve doseringen geen enkel teken van toxiciteit voor deze verbindingen waargenomen.
De verbindingen volgens de uitvinding kunnen derhalve worden gebruikt bij de behandeling van verschillende cardiovasculaire aandoeningen, bij voorbeeld hypertensie, hartzwakte, aderinsufficiëntie, evenals bij de behandeling van glaucoom, diabetische retinopathieën en verschillende aandoeningen van het centrale zenuwstelsel, angst, depressie, geheugenverlies of de ziekte van Alzheimer hij voorbeeld.
(p. 20, r. 7 t/m 36, Nederlandse vertaling)
2.7.
Voorafgaand aan de prioriteitsdatum is gepubliceerd een artikel van Chiu et al. (Nonpeptide Angiotensin II Receptor Antagonists. VII. Cellular and Biochemical Pharmacology of DuP 753, an Orally Active Antihypertensive Agent, The Journal of Pharmacology and Experimental Therapeutics, Vol. 252. No. 2. 1990, p. 711–718 (productie 13 Teva), waarin onder meer de volgende passages voorkomen:

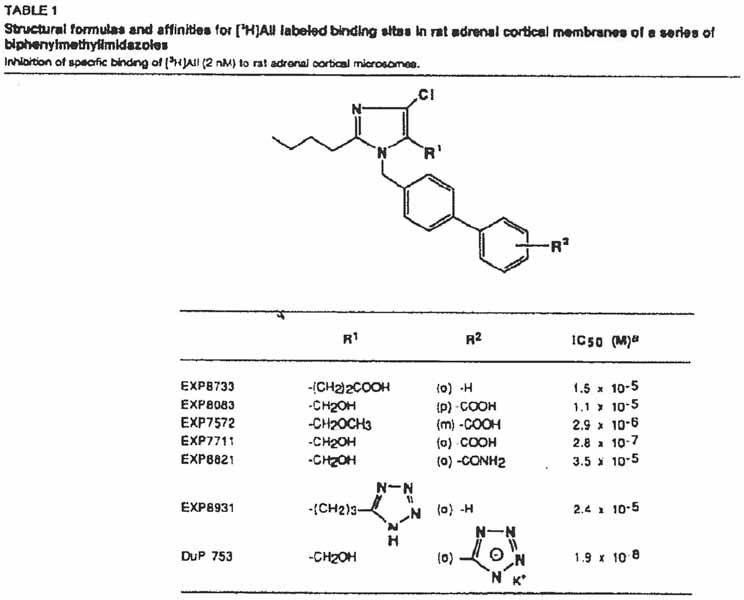

2.8.
Voorts zijn er van de hand van de uitvinders van DuP 753 ook nog twee octrooiaanvragen op naam van Dupont de Nemours ingediend, te weten EP 0 253 310 A2 (hierna ook EP 310) and EP 0 324 377 A2 (hierna ook EP 377). Door de deskundige prof.
Haemers aan de zijde van Teva is de informatie die deze octrooiaanvragen2. leveren als volgt (in het Engels) samengevat (Teva productie 11 annex 2):
‘Data relevant for Structure Activity Relationship in EP 310 and EP 377 concerning position 4 and 5 of the imidazole ring
The following tables summarize the activity data of compounds disclosed in EP 0253310 AI (EP 310) and EP 0324377 Al (EP 377), which have the biphenylylmethyl group (substituted by carboxyl or tetrazolyl at the 2' position).
These data show that the (2'-tetrazolyl)-biphenylylmethyl group is vital for a high activity, as is the choice of the substituent at the 2 position is very important for high activity, the choice of the substituent at the 4 position of the imidazole group is not very critical for high activity, and that the substituent at the 5 position can be varied without loss of activity as long as it contains a hydrogen-bridge forming group, in particular a hydrogen-bridging oxygen atom.’
Table 1: A-II receptor antagonistic active compounds of EP 253310 and EP 324377.
Example | R | R2 | R4 | R5 | IC50x 10-9 | inlravenous activity | Oral activity |
|---|---|---|---|---|---|---|---|
310-89 = DuP 753 | CN4H | nBu | Cl | CH2OH | 39 | 1 | 1 |
310-90 | CN4H | nBu | Cl | CH2OCH3 | 20 | 1 | 1 |
377-92B | CN4H | nBu | CF3 | CH2OH | 12 | 1 | nt |
310-94 | CO2H | nBu | Cl | CH2OH | 280 | 1 | 1 |
Example | R | R2 | R4 | R5 | IC50x 10 10-9 | intravenous activity | Oral activity |
|---|---|---|---|---|---|---|---|
310-98 | CO2H | nBu | Cl | CH2OCH3 | 99 | 1 | 1 |
310-100 | CO2H | nBu | Br | CH2OH | 90 | 1 | 1 |
310-102 | CO2H | nBu | I | CH2OH | 61 | 1 | 1 |
310-107 | CO2H | Ethyl | Cl | CH2OH | 1700 | 1 | 1 |
310-108 | CO2H | nProp | Cl | CH2OH | 160 | 1 | 1 |
310-109 | CO2H | nPent | Cl | CH2OH | 980 | 1 | 1 |
310-113 | CN4H | nProp | Cl | CH2OH | 20 | nt | nt |
310-114 | CN4H | nProp | Cl | CHO | 50 | 1 | 1 |
310-118 | CN4H | nBu | CH2OH | Cl | 89 | 1 | 1 |
377-124A | CO2H | nProp | CF3 | CH2OH | 130 | 1 | 1 |
377-124B | CO2H | nProp | CF2CF3 | CH2OH | 50 | 1 | 1 |
377-124C | CN4H | nBu | Br | CH2OH | 20 | 1 | 1 |
377-124D | CN4H | nProp | CF3 | CH2OH | 6 | 1 | 1 |
377-124E | CN4H | nBu | CF2CF3 | CH2OH | 7 | 1 | 1 |
377-124F | CN4H | nProp | CF2CF3 | CH2OH | 1 | nt | nt |
377-124L | CN4H | nBu | I | CH2OH | 20 | 1 | 1 |
310-132 | CN4H | nBu | Cl | CHO | 20 | 1 | 1 |
377-133 | CN4H | nBu | CF3 | CHO | 36 | 1 | 1 |
377-140C | CN4H | nProp | CF3 | CHO | 20 | 1 | 1 |
377-140E | CN4H | nBu | Br | CHO | 33 | 1 | 1 |
377-140I | CN4H | nBu | CF3 | CO2CH2CH3 | 52 | 1 | 1 |
377-140J | CN4H | nBu | CF3 | CONH2 | 27 | 1 | 1 |
377-140K | CN4H | nBu | I | CHO | 38 | 1 | 1 |
310-150 | CO2H | nBu | Cl | CH2NHCOCH3 | 200 | 1 | 1 |
310-156 | CN4H | nBu | Cl | CH2NHCOCH3 | 60 | 1 | 1 |
377-240 | CO2H | nBu | Cl | CO2H | 92 | 1 | 1 |
377-251A | CN4H | nProp | Cl | CO2H | 45 | 1 | 1 |
377-252 | CN4H | nBu | Cl | CO2H | 11 | 1 | 1 |
377-314A | CN4H | nBu | CF3 | CO2CH2O | 52 | 1 | 1 |
377-342 | CN4H | nBu | CN | CONH2 | 37 | ||
377-344 | CN4H | nBu | Cl | CN4H | 160 | 1 | 1 |
Table 1 further the finding of Chin et al. that compounds having the tetrazolvl group (R = CN4H) at the 2' position of the biphenyl group consistently have higher activities (lower IC50 values) than the same compounds having the carboxyl group (R = CO2H) at the same position. Compare 89 with 94, 90–98, 113-108, 124C-100, 124D-124A, 124F-124B, 124L-102, 156-150, 252-240.
Table 1 also confirms that the butyl and propyl groups at the 2 position of the imidazole group (R2) are about equally effective: Compare 89–113, 92B-124D, 124E-124F, 132-114, 252-251A. The longer pentyl group and the shorter ethyl group make the compounds less active (compare 109 and to 94 and 108).
Tables 2 and 3 below are extracts from Table 1 showing the effects of variation at the 4 and 5 positions of the imidazole group of DuP 753.
Table 2. Effect of exchange at 4 position
Example | R | R2 | R4 | R5 | IC50X 10-9M | intravenous activity | Oral activity |
|---|---|---|---|---|---|---|---|
310-89 = Dup 753 | CN4H | nBu | Cl | CH2OH | 39 | 1 | 1 |
377-124c | CN4H | nBu | Br | CH2OH | 20 | 1 | 1 |
377-124L | CN4H | nBu | 1 | CH2OH | 20 | 1 | 1 |
377-92B | CN4H | nBu | CF3 | CH2OH | 12 | Nt | Nt |
377-124E | CN4H | nBu | CF2CF3 | CH2OH | 7 | 1 | 1 |
310-94 | CO2H | nBu | Cl | CH2OH | 280 | 1 | 1 |
310-100 | CO2H | nBu | Br | CH2OH | 90 | 1 | 1 |
310-102 | CO2H | nBu | I | CH2OH | 61 | 1 | 1 |
310-125 | CO2H | nBu | Cl | CHO | 650 | 1 | 1 |
310-130 | CO2H | nBu | H | CHO | 470 | 1 | 1 |
377-140D | CO2H | nBu | Br | CHO | 400 | 1 | 1 |
The analogues of DuP 753 (R = CN4H) wherein chlorine at position 4 is exchanged by other groups, such as bromine or perfluoroalkyl groups, give a similar or even a slightly better activity (as summarised in Table 2).
Also, removal of the chlorine in 310-125 (which differs from DuP 753 in that the 2'-substituent is carboxyl instead of tetrazolvl) did not negatively affect the activity thereof. Thus the medicinal chemist knows from the prior art that chlorine is not critical to the binding affinity and replacement of chlorine would be feasible.
Table 3. Effect of exchange at 5 position
Example | R | R2 R4 | R5 | IC50X 10-9 | intravenous activity | Oral activity | |
|---|---|---|---|---|---|---|---|
310-89 = Dup 753 | CN4H | nBu | Cl | CH2OH | 1 | 1 | |
310-90 | CN4H | nBu | Cl | CH2OCH3 | 20 | 1 | 1 |
310-132 | CN4H | nBu | Cl | CHO | 20 | 1 | 1 |
310-156 | CN4H | nBu | Cl | CH2NHCOCH3 | 60 | 1 | 1 |
377-252 | CN4H | nBu | Cl | CO2H | 11 | 1 | 1 |
377-342 | CN4H | nBu | CN | CONH2 | 37 | ||
377-344 | CN4H | nBu | Cl | CN4H | 160 | 1 | 1 |
310-94 | CO2H | nBu | Cl | CH2OH | 280 | 1 | 1 |
Example | R | R2 | R4 | R5 | IC50x 10-9 | intravenous activity | oral activity |
|---|---|---|---|---|---|---|---|
310-229 | CO2H | nBu | Cl | CH=CH-CH(CH3)OH | 2100 | 1 | 1 |
310-314 | CO2H | nBu | Cl | CH=CH-CH2OH | 630 | 1 | 0 |
310-115 | CO2H | nBu | Cl | CH2CO2H | 430 | 1 | 1 |
377-240 | CO2H | nBu | Cl | CO2H | 92 | 1 | |
310-264 | CO2H | nBu | Cl | CH2CH2CO2H | 250 | 1 | 1 |
310-265 | CO2H | nBu | Cl | CH2CH2CH2CO2H | 270 | 1 | 1 |
Table 3 shows the effect of substitution of the 5 position. This effect appears to be limited for the compounds related to DuP 753 (R = CN4H), at least as long oxygen-containing groups are present (as was also known Chiu et al.2 Thus the medicinal chemist will expect no significant change in activity when introducing another oxygen-containing group at position 5. From comparing compounds 229 and 314 with 94, the medicinal chemist would derive that the shorter group at the 5 position could be more active.
2.9.
Het door het combinatie-ABC beschermde product, kort gezegd irbesartan en HCTZ, wordt gebruikt voor de behandeling van hypertensie (hoge bloeddruk), een veel voorkomende aandoening die de stroming van het bloed door het lichaam verstoort. Dit kan leiden tot ernstige vaatziekten.
2.10.
Hypertensie kan worden bestreden door toediening van zogeheten vasodilatoren, geneesmiddelen die de gladde spieren in de bloedvaten ontspannen, waardoor de bloedvaten zich verwijden.
2.11.
Sinds de jaren vijftig van de vorige eeuw is bekend dat voor de behandeling van hypertensie gebruikt gemaakt kan worden van diuretica, stoffen die de uitscheiding van water door de nieren bevorderen, zodat water aan het lichaam wordt onttrokken. Hierdoor ontspannen de wanden van de bloedvaten, wat resulteert in bloeddrukverlaging. HCTZ, een zogeheten thiazide-diureticum, is ontwikkeld in 1958 en wordt veel voorgeschreven voor de behandeling van hypertensie.
2.12.
Naast diuretica zijn andere vasodilatoire geneesmiddelen ontwikkeld. Een deel daarvan richt zich op het voorkomen van interactie tussen het hormoon angiotensine Il en zijn receptor. De binding van angiotensine Il aan zijn receptor veroorzaakt een hogere bloeddruk. Een van deze angiotensine-receptorblokkers, of ARB's, is irbesartan. De eerste ARB was losartan (aanvankelijk bekend als DuP 753), ontwikkeld door DuPont.
2.13.
Sanofi brengt onder de naam Aprovel een geneesmiddel op de markt met als werkzaam bestanddeel irbesartan. Onder de naam CoAprovel verhandelt zij een geneesmiddel met als werkzame bestanddelen irbesartan en HCTZ.
2.14.
Gedaagden maken deel uit van het Teva-concern en houden zich bezig met de verhandeling van generieke geneesmiddelen. Op 26 november 2009 heeft Teva Pharma een handelsvergunning verkregen voor een geneesmiddel met als werkzame bestanddelen irbesartan en HCTZ.
2.15.
Op 14 september 2012 heeft de voorzieningenrechter van deze rechtbank het onder meer Teva verboden inbreuk te maken op het combinatie-ABC. Door Teva is beroep ingesteld en daarin is inmiddels arrest gewezen op 27 augustus jl. — derhalve na het pleidooi in deze zaak — zodat de rechtbank hiervan ambtshalve kennis heeft genomen.
2.16.
In vele landen in Europa is geprocedeerd over het onderhavige combinatie-ABC. De Engelse High Court (Arnold J.) heeft bij beslissing van 20 september 2012 vragen van uitleg gesteld aan het Europese Hof van Justitie aangaande de uitleg van artikel 3 onder a van de ABC-verordening.
3. Het geschil
3.1.
Teva vordert vernietiging van het combinatie-ABC, met veroordeling van Sanofi in de redelijke proceskosten conform 1019h Rv. Zij stelt daartoe dat het combinatie-ABC nietig is omdat het in strijd met artikel 3 onder a en c van de ABC-verordening is verleend. Daarnaast stelt Teva dat er nietigheidsgronden bestaan die nietigverklaring van EP 511 gerechtvaardigd zouden hebben, te weten een gebrek aan inventiviteit.
3.2.
Sanofi voert verweer.
3.3.
Op de stellingen van partijen wordt hierna, voor zover van belang, nader ingegaan.
4. De beoordeling
4.1.
Partijen hebben de diverse buitenlandse beslissingen over de geldigheid van het combinatie-ABC en de mogelijke betekenis daarvan voor deze Nederlandse procedure uitgebreid besproken. Ook hebben zij aandacht besteed aan de vraag of de onderhavige procedure zou moeten worden aangehouden tot het Europese Hof van Justitie verschillende vragen van uitleg over de ABC-verordening heeft beantwoord. De rechtbank vindt echter aanleiding om ten eerste de inventiviteit van het onderliggende octrooi te beoordelen.
4.2.
Partijen zijn het erover eens dat de publicatie van Chiu et al. (zie 2.7.) de meest nabij gelegen stand van de techniek is, waarin DuP 753/losartan als meest veelbelovende stof wordt beschreven (zie Table 1, onderaan alsmede de laatste twee alinea's van 2.7.). Sanofi heeft onvoldoende inhoudelijk bestreden de volgende gemotiveerde stellingen van Teva bij dagvaarding (nrs 80–82):
- ‘80.
Chiu et al. laten dus zien dat een bifenylgroep met een zure functionaliteit en met name een tetrazoolgroep3. in de ortho-positie van de terminale fenylgroep van wezenlijk belang is voor affiniteit. Daarnaast leren Chui et al. dat er keuzevrijheid is voor de substituent op positie 5 van het imidazool4. zolang deze maar een waterstofbrugvormende groep bevat.
- 81.
Chiu et al. leren de vakman dut DuP 753 een veelbelovend vertrekpunt is in de zoektocht naar andere analogen. Door analyse van de structnur-activiteits-relatie wijst Chiu et al. de vakman er ook op welke delen van DuP 753 belangrijk zijn voor de activiteit en welke delen minder belangrijk zijn. Chiu et al geeft daarmee de koers aan voor de ontwikkeling van alternatieve verbindingen.
- 82.
Kortom, Chiu et al openbaren dat DuP 753 een krachtige, oraal werkzame, bijzonder selectieve All-antagonist is en veelbelovend voor de verdere ontwikkeling als therapeutisch middel. Daarnaast openbaren Chiu et al de volgende essentiële onderdelen van DuP753:
- a.
een extra fenylring op de para-positie van de benzylgroep aan een N-atoom van de imidazoolkern;
- b.
een zure functionaliteit, met name een tetrazolylgroep, op de orthopositie van die extra fenylring;
- c.
een alkylzijketen van drie of vier koolstofatomen op positie 2 van het imidazool 2;5.
- d.
een groep op positie 5 van het imidazool 5 positie die in staat is een waterstofbrug te vormen;’
4.3.
De volgende stap is te beoordelen wat het verschil is tussen DuP 753, met bovengenoemde uitgangspunten in het achterhoofd, en het octrooi. Uitgaande van Chiu et al. (in feite DuP 753 met kennis over welke onderdelen relevant zijn en welke niet) wordt conclusie 7 in EP 511 gekenmerkt door de aanwezigheid van de 4-spirocyclopentaan- en de 5-oxo-structuur in plaats van de 4-chloor- en 5-hydroxymethyl-structuur, zoals uit de volgende formules afgeleid kan worden.
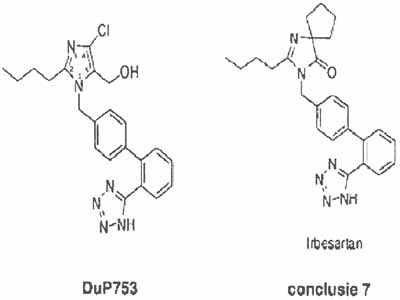
4.4.
Anders gezegd, de volgende (met elkaar verband houdende) verschillen in de DuP 753 imidazool structuur kunnen worden onderscheiden:
- a.
vervanging van de hydroxymethylgroep op positie 5 door een oxogroep;
- b.
vervanging van het chlooratoom op positie 4 door een spirocyclopentaan; en
- c.
vervanging van de dubbele binding tussen posities 4 en 5 door een enkelvoudige binding.
4.5.
Het technische effect van het verschil is het voorzien in een andere verbinding met een (vergelijkbare) angiotensine II-receptor blokkerende werking. Niet kan worden aanvaard de stelling die Sanofi eerst bij pleidooi naar voren heeft gebracht dat hierbij ook een verbeterde activiteit van irbesartan ten opzichte van DuP 753 mag worden meegenomen. Die verbeterde werking is immers niet in de oorspronkelijke aanvrage terug te lezen. Integendeel, er wordt slechts genoemd een werking met IC50 waarden lager dan 10-6 (zie passage opgenomen in 2.6., die in de oorspronkelijke aanvrage gelijkluidend is). Het zal de gemiddelde vakman duidelijk zijn dat daaronder waarden vallen die tot 50 keer hoger zijn dan de IC50 van 1,9 × 10-8 M van DuP 753 (zie Table 1 van Chiu et al., r.o. 2.7.; door Haemers wordt een IC50 van 39 × 10-9 gerapporteerd, r.o. 2.8.). Hoe lager echter de IC50 waarde, hoe beter de werking naar verwachting. Dat betekent dat de gemiddelde vakman uit de in de oorspronkelijke aanvraag (en het octrooi) gerapporteerde IC50-waarde geen betere werking verwachtte en zelfs rekening hield met een minder grote affiniteit.
4.6.
Naar vaste jurisprudentie van deze rechtbank en de kamers van beroep van het EOB, kunnen later ingediende onderzoeksgegevens niet meetellen voor inventiviteit indien het geclaimde effect niet reeds aannemelijk is gemaakt in de oorspronkelijke aanvrage.6. Dat in de aanvrage wel al iets over angiotensine-II-blokkerende werking van de verbindingen van conclusie 1 wordt gezegd, betekent niet dat een verbeterde werking is geopenbaard noch dat in feite al op de verbeterde werking is gehint of dat verbetering op de al gestelde werking zou voortborduren, zoals Sanofi nog ter zitting heeft gesteld onder verwijzing naar Guideline G-VII, 11. Indien de stelling van Sanofi zou worden gevolgd, zou dit immers betekenen dat eerst na aanvraag gebleken voordelen alsnog inventiviteit zouden kunnen verlenen aan het octrooi, hetgeen de octrooiaanvrager een ongerechtvaardigde voordeel zou geven.
4.7.
In het licht van het bovenstaande en uitgaande van Chiu et al. kan het objectieve technische probleem dat de uitvinding volgens conclusie 7 van het octrooi oplost in overeenstemming met het door Teva gestelde worden geformuleerd als het ‘voorzien in een alternatieve angiotensine-II-blokkerende stof voor DuP 753’.
4.8.
In de inventiviteitsanalyse is dan te beoordelen de vraag of de in conclusie 7 gegeven oplossing, die bestaat uit:
- a.
plaatsing van een oxo-groep op positie 5;
- b.
plaatsing van een spiropentaangroep op positie 4; en
- c.
voorzien in een enkelvoudige binding tussen posities 4 en 5, door de vakman zou zijn gekozen met de redelijke verwachting een aan DuP 753 vergelijkbare activiteit te bereiken.
4.9.
Door Teva is onder verwijzing naar twee deskundige opinies (van prof. Haemers, farmacochemicus, en dr. Fuhrer, organisch chemicus met vele jaren ervaring in geneesmiddelonderzoek; Teva producties 11 en 10 respectievelijk) bij dagvaarding uitgebreid aangegeven dat de gemiddelde vakman daarbij de hiervoor onder a-c genoemde wijzigingen in overweging zou nemen, dat deze met conventionele methoden zonder ‘undue burden’ door te voeren zijn en dat hij geredelijk zou verwachten dat de verkregen verbindingen nog angiotensine-II-blokkerende werking zouden vertonen vergelijkbaar met DuP 753. De door Sanofi opgeworpen omstandigheid dat Fuhrer niet als een gemiddelde vakman is te kenschetsen (maar eerder als uitvinder) maakt niet dat zijn verklaring reeds om die reden ter zijde is te laten. De gemiddelde vakman is immers een octrooirechtelijke fictie. Deskundigen in een octrooirechtelijke procedure vallen doorgaans niet volledig samen met die fictie. Waar deskundigen echter wel (enige) duidelijkheid in kunnen verschaffen is hoe een gemiddelde collega (die fictieve persoon derhalve) op een bepaald moment over bepaalde zaken zou hebben gedacht. Dit hebben prof. Hamers en dr. Fuhrer gedaan en daartegen heeft, zoals hierna is te overwegen, Sanofi onvoldoende ingebracht.
4.10.
Kort gezegd, houdt de verklaring van Haemers in dat de gemiddelde vakman op zoek naar een alternatieve verbinding ten tijde van de prioriteitsdatum
- i)
een analyse van de beschikbare informatie betreffende de structuur-activiteitsrelatie (SAR) zou maken, waarbij wordt beoordeeld wat de essentiële groepen zijn van de uitgangsstof voor receptorbinding en welke niet en
- ii)
bij die SAR-analyse alle voorhanden literatuur over de stof in kwestie zal raadplegen (waaronder naast Chiu et al. ook EP 310 en EP 377).
Dit een en ander is door Sanofi (bij antwoord) niet betwist. Eerst bij pleidooi heeft Sanofi gesteld dat een gemiddelde vakman ten tijde van de prioriteitsdatum in het geheel geen SAR-analyse zou uitvoeren.
Niet alleen moet dit als tardief worden gepasseerd, Sanofi heeft deze stelling ook op geen enkele wijze onderbouwd (bijvoorbeeld door overlegging van een deskundige opinie, tegenover de deskundige opinies van Haemers en Fuhrer). In het vervolg van dit vonnis is ervan uit te gaan dat de SAR-analyse als voormeld onderdeel vormde van de standaard stappen die een gemiddelde vakman zou uitvoeren.
4.11.
Evenmin juist is Sanofi's stelling dat de gemiddelde vakman DuP 753 als eindpunt zou zien en niet als startpunt (van een SAR-analyse). Die stelling gaat er immers ten onrechte vanuit dat een gemiddelde vakman uit de stand van de techniek zou begrijpen dat alle structureel verwante alternatieve stoffen reeds door DuPont zouden zijn geprobeerd. Dat is geenszins het geval, zoals Haemers laat zien met de (routinematige) SAR-analyse. Evenmin heeft Sanofi bijvoorbeeld gewezen op enige passage in de stand van de techniek waaruit zou blijken dat verdere ontwikkeling in deze richting een doodlopende weg zou zijn. De enkele opmerking in Chiu et al. dat DuP 753 een ‘useful therapeutic for the management of chronic All dependent types of disease’ is, kan niet als een indicatie gelden dat DuP 753 volgens Chiu et al. een eindpunt was. In hun studie was het de meest veelbelovende verbinding. Maar dat er geen structurele analogen zouden zijn met vergelijkbare of zelfs betere werking, valt daarin geenszins te lezen.
4.12.
In r.o. 2.8. is weergegeven wat een SAR-analyse zou opleveren volgens professor Haemers, in het kort in zijn rapport onder 20 samengevat, welke resultaten als zodanig door Sanofi niet betwist zijn:
All in all, on the basis of Chiu et al and the information present in the patent applications, the medicinal chemist come to the following conclusions relevant for the development of analogues of DuP 753:
- —
The degree of freedom within the hiphenyl group is limited by the absorptive process, required for activity after oral application.
- —
The presence of the tetrazole group at the ortho position of the terminal phenyl group was required for sufficient receptor affinity.
- —
A central imidazole group was always present, but, apart from the fact that it formed the centerpiece bearing the various groups indispensable for activity, the role of this imidazole group per se in receptor binding had not been described.
- —
The alkyl (especially butyl) group at position 2 of the imidazole was important for sufficient receptor affinity: replacement of this substituent with shorter (ethyl) or longer (pentyl, hexyl) substituents resulted in significant loss of activity
- —
The hydrogen-bridging oxygen in the substituent at position 5 of the imidazole was an important feature for sufficient receptor affinity. Extensive variations were made by Du Pont wherein the length of the substituent at the 5-position had been varied and the lowest IC50 values were reported for the variants with the shortest group, i.e. hydroxymethyl, methoxymethyl, carbonyl and carboxyl, having the oxygen separated from the imidazole by just one carbon atom.
- —
the chlorine at position 4 of the imidazole ring was not critical for the binding affinity.
4.13.
Vervolgens legt professor Haemers uit dat een gemiddelde vakman met deze wetenschap de wijzigingen als geclaimd in conclusie 7 zonder meer zou proberen en dat dergelijke stoffen volgens gangbare methoden te synthetiseren zijn. Ook die bevindingen zijn als zodanig niet door Sanofi betwist. Wat Sanofi wel betwist is dat de gemiddelde vakman daarbij een redelijke verwachting van succes zou hebben. Op dit punt wreekt zich echter evenzeer dat Sanofi geen tegenrapport heeft ingebracht ter ontkrachting van de conclusies van Haemers en Fuhrer, namelijk dat een gemiddelde vakman die verwachting wel zou hebben. Zij heeft bovendien die conclusies te laat, namelijk pas ter zitting weersproken. Aldus heeft de rechtbank ervan uit te gaan dat de gemiddelde vakman redelijkerwijs zou verwachten dat de stoffen van conclusie 7 de angiotensine II-blokkerende werking van DuP 753 zullen hebben behouden (of althans dat die werking daarmee vergelijkbaar is).
4.14.
Hieraan doet onvoldoende af, waarop Sanofi eerst ter zitting — en derhalve tardief — wijst (nr. 194–197 pleitnota Dack), dat Haemers in zijn rapport al een zeker verlies aan aromaticiteit7. bespreekt (paragraaf 37). Niet alleen stelt Haemers in zijn rapport al dat de gemiddelde vakman niet op basis van enige informatie zou concluderen dat dit tot verlies aan werkzaamheid zou leiden, ook Fuhrer verklaart dat dit in zijn ogen geen reden was om deze aanpak te verlaten (paragraaf 48 van zijn rapport). De rechtbank is er daarom — zonder deskundige voorlichting die Sanofi niet tegenover de rapportages van Haemers en Fuhrer heeft gesteld — niet van overtuigd dat de gemiddelde vakman op basis van een (beperkt) verlies aan aromaticiteit zou verwachten dat de verbinding niet meer zou werken. De verschillende polariteit van DuP 753 en irbesartan is eerst ter zitting door Sanofi aan de orde gesteld en mitsdien tardief, daargelaten dat (deskundige) onderbouwing ontbreekt dat dit de vakman zou weerhouden. De verwijzing naar een artikel van Bernhart gaat niet op nu dit artikel dateert van na de prioriteitsdatum. Bovendien is de niet onderbouwde en eerst bij pleidooi ingenomen stelling van Sanofi dat de gemiddelde vakman zou twijfelen aan de werkzaamheid van irbesartan in directe tegenspraak met haar eigen stellingen in de verleningsprocedure bij het Japanse octrooibureau (productie 19B Teva). In het kader van aldaar gerezen bezwaren dat de werkzaamheid van de geclaimde uitvinding onvoldoende uit de aanvrage zou blijken, heeft Sanofi immers aangevoerd dat de gemiddelde vakman de goede werkzaamheid op basis van de structuur van de geclaimde verbindingen bij vergelijking met die van DuP 753 (zelfs op basis van zijn algemene vakkennis) kon voorspellen (productie 19B Teva, p. 3, onder 2).
4.15.
Sanofi heeft tot slot aangevoerd dat hiermee de uitvinding nog niet voor de hand ligt omdat er geen sprake is van een ‘pointer’ naar de stoffen van conclusie 7 (irbesartan). Sanofi noemt de aanpak van inventiviteit door Teva daarom een ‘schoolvoorbeeld’ van een verboden ex post facto-analyse. Zij wijst daarbij op Guidelines G-VII 5.3:
‘whether there is any teaching in the prior art as a whole that would (not simply could, but would) have prompted the skilled person, faced with the objective technical problem, to modify or adapt the closest prior art while taking account of that teaching, thereby arriving at something falling within the terms of the claims, and thus achieving what the invention achieves (see G-VII. 4).’
4.16.
De rechtbank overweegt als volgt. Op zich is juist, zoals Sanofi stelt, dat in de regel een ‘pointer’ of motivatie nodig is om de gemiddelde vakman de richting naar de uitvinding te wijzen wil inventiviteit ontbreken. Ten onrechte echter trekt Sanofi daaruit de conclusie dat die ‘pointer’ of motivatie bij het enkel vinden van een alternatief voor de dichtstbijzijnde stand van de techniek, specifiek en eenduidig naar (uitsluitend) de geclaimde oplossing dient te wijzen. Alle alternatieven moeten immers als een oplossing van het gestelde probleem worden gezien, zolang van die alternatieven redelijkerwijs kan worden verwacht dat ze werkzaamheid behouden, een gemiddelde vakman deze in overweging zou nemen en hij ze op conventionele wijze kan synthetiseren zonder ‘undue burden’. Dat betekent evenzeer dat alle alternatieven die aan die voorwaarden voldoen, niet inventief zijn. Zie de volgende uitspraken van de Technische Kamers van beroep van het EOB: T0821/97, r.o. 6.4; T0852/91, r.o. 8.2; T0892/08, r.o. 1.7; T0964/92, r.o. 2.10, T0879/05. r.o. 5.3, T0631/06, r.o. 2.3.10.
4.17.
Anders gezegd, bij gebreke aan een reden (zoals een onverwacht, verbeterd effect, hetgeen bij irbesartan niet aan de orde is zoals hiervoor onder 4.5. en 4.6. overwogen), is een keuze van één alternatief dat naar verwachting werkzaamheid behoudt uit vele (die na SAR-analyse van DuP 753 beschikbaar zijn) willekeurig en aldus niet inventief te achten. Zie een lange lijn van uitspraken van de Technische Kamers van beroep van het EOB: T0892/08, r.o. 1.7; T0964/92, r.o. 2.10, T0879/05, r.o. 5.3, T0631/06, r.o. 2.3.10, T0345/07, r.o. 4.7.3, T0012/07, r.o. 4,1,6, T0423/08, r.o. 2.3.5, T0931/04, r.o. 4.11.1.
4.18.
Aldus kan er geen andere conclusie zijn dan dat conclusie 7 niet inventief is. Dat Du Pont irbesartan niet ook heeft gevonden en geclaimd in haar octrooiaanvragen maakt dit oordeel niet anders. Sanofi heeft de gemotiveerde stelling van Teva dat alsdan ook conclusie 20, irbesartan in combinatie met een diureticum, voor de hand ligt, niet bestreden zodat ook die conclusie moet sneuvelen. Evenmin heeft Sanofi betwist dat bij die stand van zaken de grondslag voor het combinatie ABC is weggevallen en het ABC op basis van artikel 15 van de ABC-verordening moet worden vernietigd. De overige argumenten van Teva behoeven gelet hierop geen nadere bespreking meer.
4.19.
Sanofi zal als de in het ongelijk gestelde partij in de proceskosten worden veroordeeld. Partijen zijn overeengekomen dat die kosten € 100.000,- bedragen zodat daarvan is uit te gaan.
5. De beslissing
De rechtbank
5.1.
vernietigt ABC 990006;
5.2.
veroordeelt Sanofi in de proceskosten, aan de zijde van Teva tot op heden begroot op € 100.000,00;
5.3.
verklaart dit vonnis voor wat betreft de proceskostenveroordeling uitvoerbaar bij voorraad;
5.4.
wijst het meer of anders gevorderde af.
Dit vonnis is gewezen door mr. J.Th. van Walderveen, mr. E.F. Brinkman en mr. C.S.M. Morel en in het openbaar uitgesproken op 2 oktober 2013.
Voetnoten
Voetnoten Uitspraak 02‑10‑2013
In zijn (annex bij het) rapport noemt prof. Haemers de A1 -publicaties van EP 310 en EP 377. Gezien het feit dat de A2-publicaties in de verleningsprocedures als Dl en D4 waren betrokken, houdt de rechtbank het ervoor dat Haemers deze laatste publicaties bedoelt aan te halen.
Dit is de ringstructuur met vijf stikstofatomen weergegeven geheel onderaan in de structuurformule van DuP 753 (opgenomen in 4.3. hierna), in Chiu et al. in Table 1 aangeduid met R2.
Dit is de ringstructuur met twee stikstofatomen bovenin weergegeven in de structuurformule van DuP 753 opgenomen in 4.3. hierna (met nummering van de posities).
Ter zitting heeft Teva desgevraagd aangegeven dat onderdeel c) niet als zodanig in Chiu et al is terug te vinden, maar wel is geopenbaard in EP 377 en EP 310. Ook prof. Ilaemers zegt in paragraaf 19 van zijn rapport en op p. 2 van zijn bij het rapport behorende annex 2 dat hij dit onderdeel afleidt uit EP 310 en EP 377 (vgl. 2.8.).
Zie bijvoorbeeld T1329/04 en r.o. 4.26.–4.30. van Sandoz/Glaxo, rechtbank Den Haag, 26 januari 2011, te vinden op http www te forum nl index php?//Evenals de buitenlandse rechters //27750/
De imidazole ring van DuP 753 is aromatischer van aard dan de imidazoline ring van irbesartan, omdat — in de woorden van prof. Ilaemers ter zitting — deze bij de imidazoline iets buiten de ringstructuur ligt (de rechtbank begrijpt: vanwege het dubbel gebonden zuurstofatoom dat in de aromatische electronenverdeling meedoet).